
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
31 марта 2021
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
- 5528
- 2
- 7
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.


Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
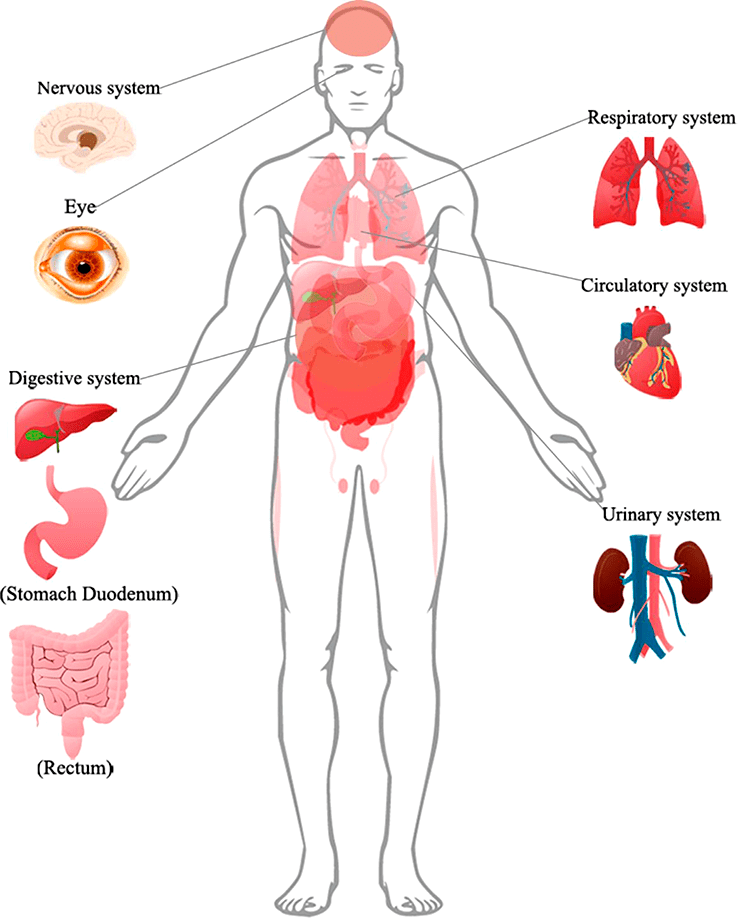
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
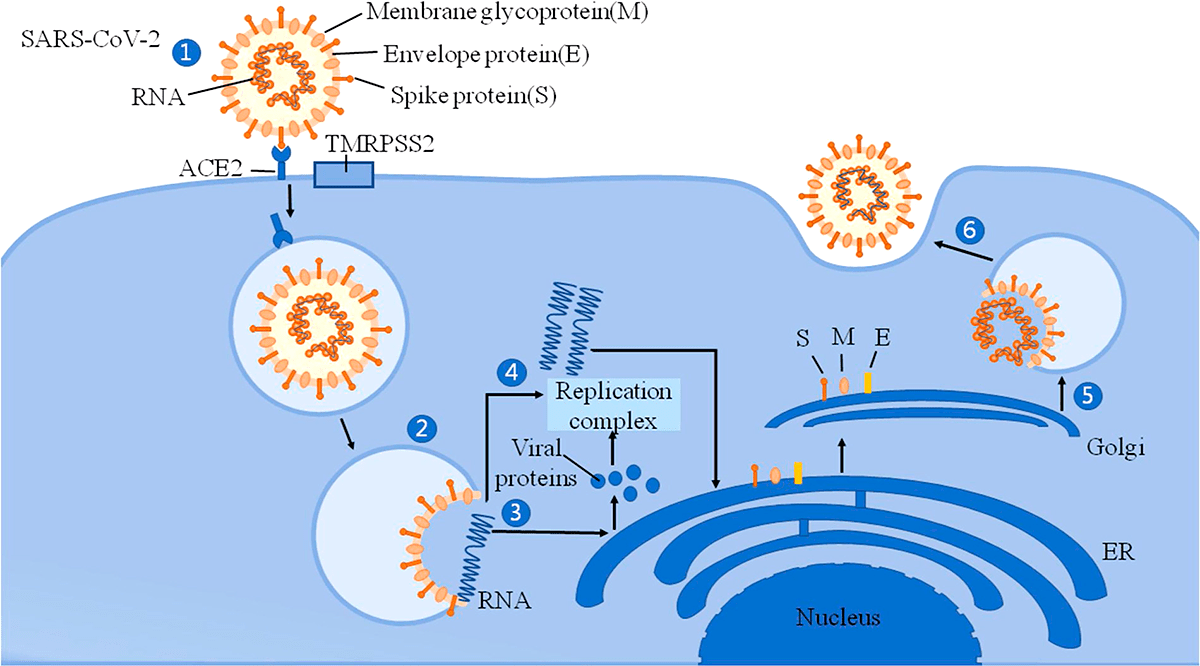
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
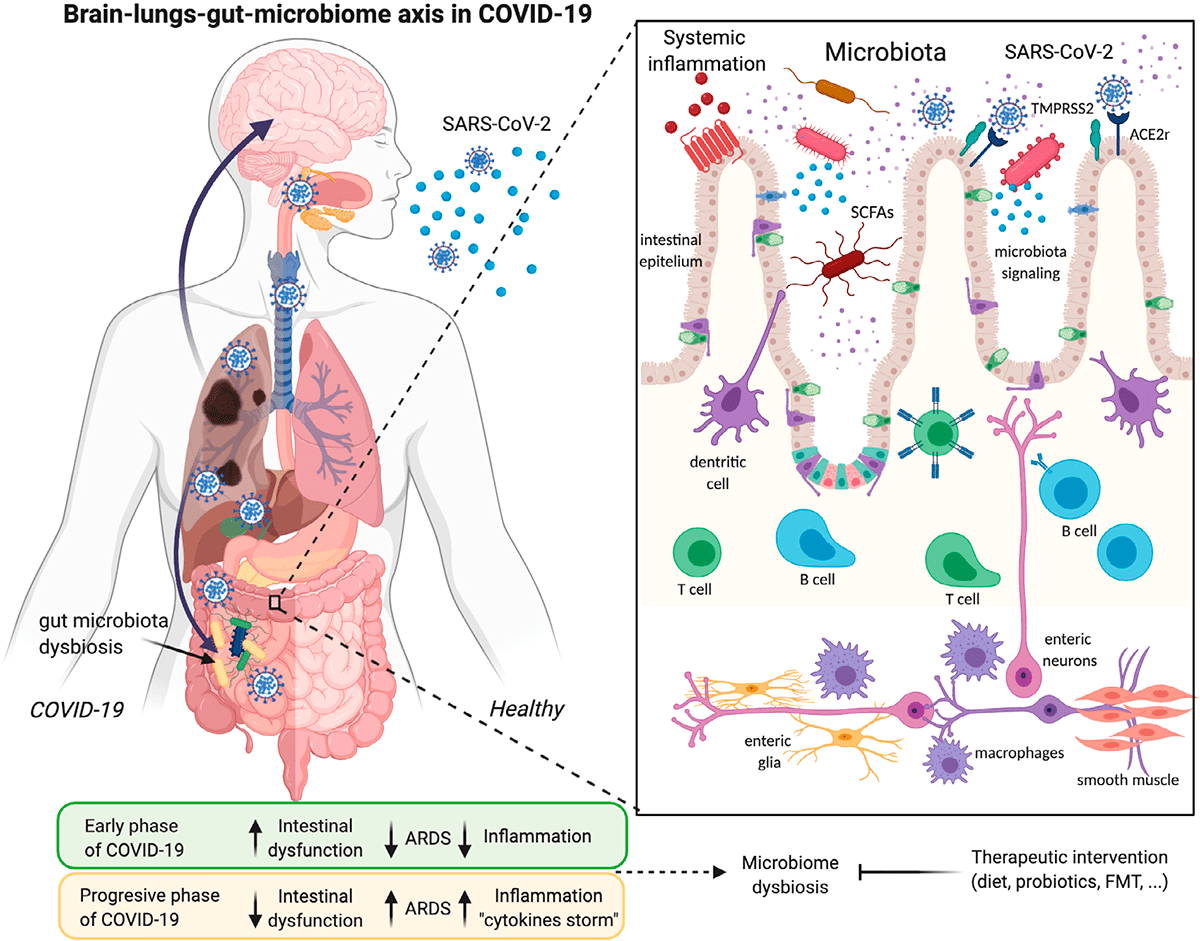
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.

Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
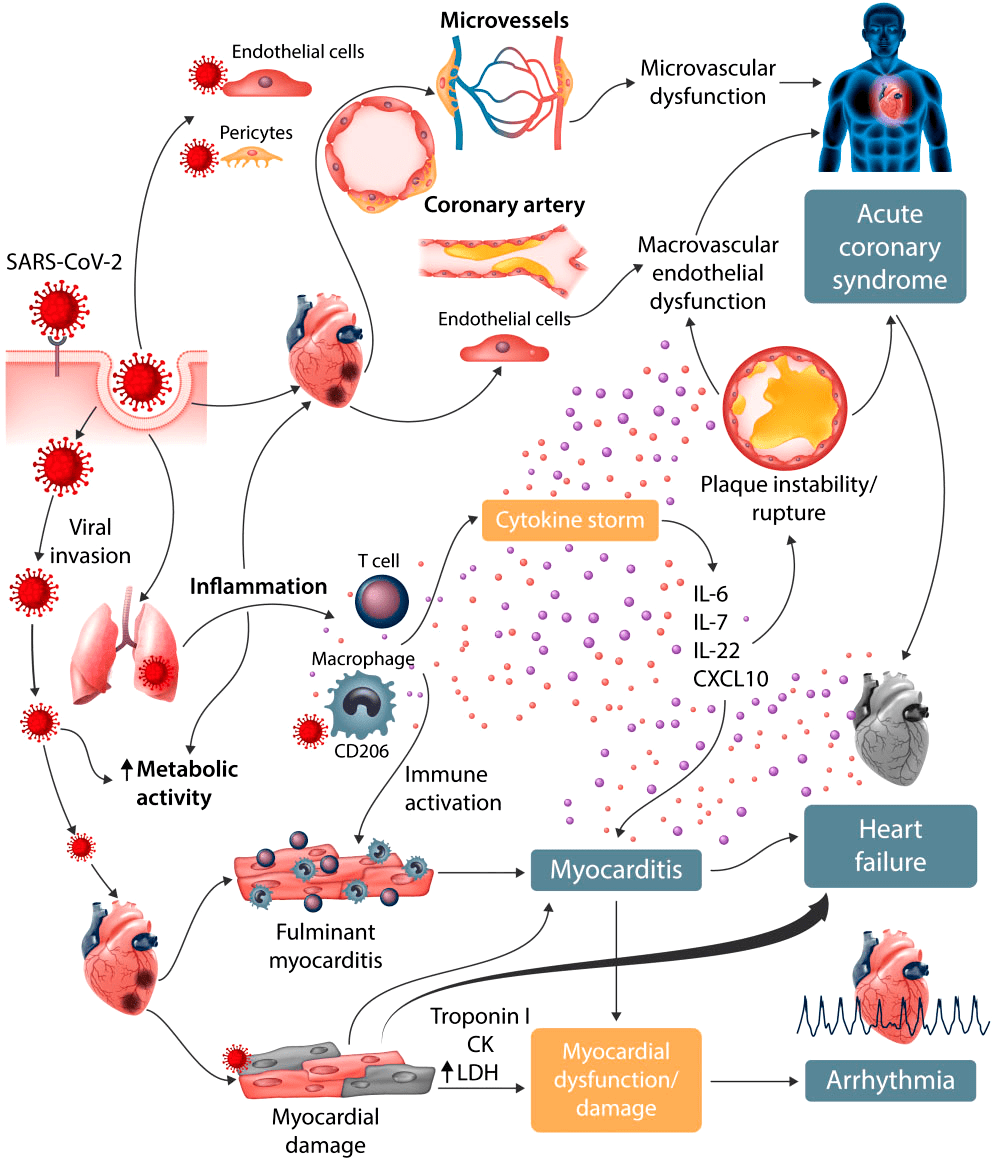
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
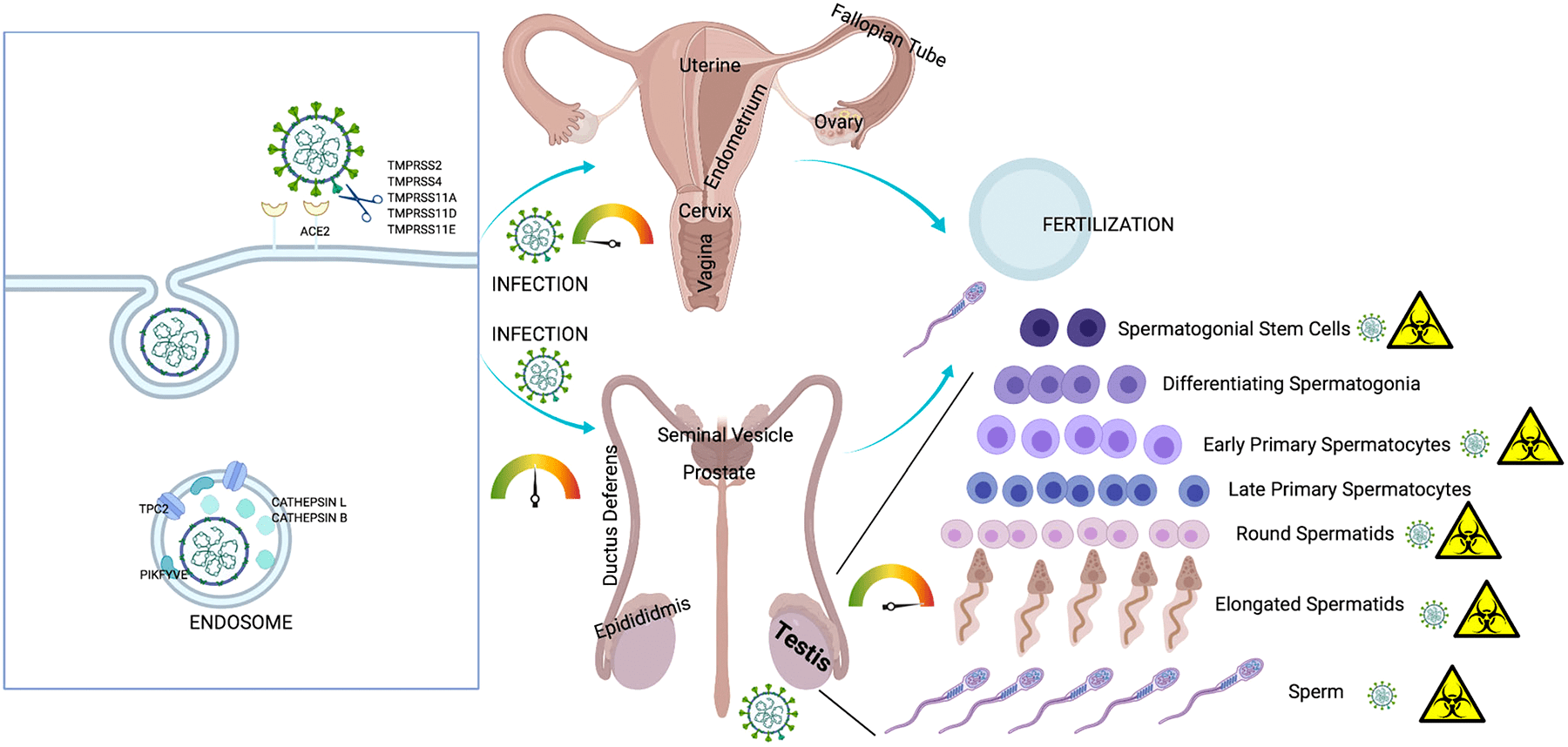
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Литература
- Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder, Nadine Krüger, Tanja Herrler, et. al.. (2020). SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell;
- I Hamming, W Timens, MLC Bulthuis, AT Lely, GJ Navis, H van Goor. (2004). Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J. Pathol.. 203, 631-637;
- Ferdinando D’Amico, Daniel C. Baumgart, Silvio Danese, Laurent Peyrin-Biroulet. (2020). Diarrhea During COVID-19 Infection: Pathogenesis, Epidemiology, Prevention, and Management. Clinical Gastroenterology and Hepatology. 18, 1663-1672;
- Colleen T. Cole-Jeffrey, Meng Liu, Michael J. Katovich, Mohan K. Raizada, Vinayak Shenoy. (2015). ACE2 and Microbiota. Journal of Cardiovascular Pharmacology. 66, 540-550;
- Tanya Yatsunenko, Federico E. Rey, Mark J. Manary, Indi Trehan, Maria Gloria Dominguez-Bello, et. al.. (2012). Human gut microbiome viewed across age and geography. Nature;
- M. J. Claesson, S. Cusack, O. O'Sullivan, R. Greene-Diniz, H. de Weerd, et. al.. (2011). Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proceedings of the National Academy of Sciences. 108, 4586-4591;
- N. C. Wiley, T. G. Dinan, R. P. Ross, C. Stanton, G. Clarke, J. F. Cryan. (2017). The microbiota-gut-brain axis as a key regulator of neural function and the stress response: Implications for human and animal health1,2. Journal of Animal Science. 95, 3225-3246;
- Yolanda Sanz, Angela Moya-Pérez. (2014). Microbiota, Inflammation and Obesity. Advances in Experimental Medicine and Biology. 291-317;
- Claudia Sanmiguel, Arpana Gupta, Emeran A. Mayer. (2015). Gut Microbiome and Obesity: A Plausible Explanation for Obesity. Curr Obes Rep. 4, 250-261;
- Alexis Elias Malavazos, Massimiliano Marco Corsi Romanelli, Francesco Bandera, Gianluca Iacobellis. (2020). Targeting the Adipose Tissue in COVID‐19. Obesity. 28, 1178-1179;
- Thomas C Fung, Christine A Olson, Elaine Y Hsiao. (2017). Interactions between the microbiota, immune and nervous systems in health and disease. Nat Neurosci. 20, 145-155;
- Akililu Alemu Ashuro, Tekle Airgecho Lobie, Dong-Qing Ye, Rui-Xue Leng, Bao-Zhu Li, et. al.. (2020). Review on the Alteration of Gut Microbiota: The Role of HIV Infection and Old Age. AIDS Research and Human Retroviruses. 36, 556-565;
- Tao Zuo, Hui Zhan, Fen Zhang, Qin Liu, Eugene Y.K. Tso, et. al.. (2020). Alterations in Fecal Fungal Microbiome of Patients With COVID-19 During Time of Hospitalization until Discharge. Gastroenterology. 159, 1302-1310.e5;
- Tao Zuo, Fen Zhang, Grace C.Y. Lui, Yun Kit Yeoh, Amy Y.L. Li, et. al.. (2020). Alterations in Gut Microbiota of Patients With COVID-19 During Time of Hospitalization. Gastroenterology. 159, 944-955.e8;
- Ibrahim Elmadfa, Alexa L. Meyer. (2019). The Role of the Status of Selected Micronutrients in Shaping the Immune Function. EMIDDT. 19, 1100-1115;
- Schofield C. and Ashworth A. (1997). Severe malnutrition in children: high case-fatality rates can be reduced. Africa health. 6, 17–18;
- Giorgi P.L., Catassi C., Guerrieri A. (1984). Zinco ed enteropatie croniche [Zinc and chronic enteropathies]. Pediatr. Med. Chir. 6, 625–636;
- David J. Allison, Kayleigh M. Beaudry, Aysha M. Thomas, Andrea R. Josse, David S. Ditor. (2019). Changes in nutrient intake and inflammation following an anti-inflammatory diet in spinal cord injury. The Journal of Spinal Cord Medicine. 42, 768-777;
- Katherine L Tucker. (2014). Vegetarian diets and bone status. The American Journal of Clinical Nutrition. 100, 329S-335S;
- Alison J. McAfee, Emeir M. McSorley, Geraldine J. Cuskelly, Bruce W. Moss, Julie M.W. Wallace, et. al.. (2010). Red meat consumption: An overview of the risks and benefits. Meat Science. 84, 1-13;
- G. Keyßer. (2001). Gibt es sinnvolle Diätvorschläge für Patienten mit rheumatoider Arthritis?. Zeitschrift für Rheumatologie. 60, 17-27;
- Jasper Fuk-Woo Chan, Kin-Hang Kok, Zheng Zhu, Hin Chu, Kelvin Kai-Wang To, et. al.. (2020). Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerging Microbes & Infections. 9, 221-236;
- Lirong Zou, Feng Ruan, Mingxing Huang, Lijun Liang, Huitao Huang, et. al.. (2020). SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med. 382, 1177-1179;
- Igor J. Koralnik, Kenneth L. Tyler. (2020). COVID ‐19: A Global Threat to the Nervous System. Ann Neurol. 88, 1-11;
- Peter P. Liu, Alice Blet, David Smyth, Hongliang Li. (2020). The Science Underlying COVID-19. Circulation. 142, 68-78;
- Wim P. Krijnen. (2006). Some Results on Mean Square Error for Factor Score Prediction. Psychometrika. 71, 395-409;
- Kate E. Stanley, Elizabeth Thomas, Megan Leaver, Dagan Wells. (2020). Coronavirus disease-19 and fertility: viral host entry protein expression in male and female reproductive tissues. Fertility and Sterility. 114, 33-43;
- Saguna Verma, Sarini Saksena, Hooman Sadri-Ardekani. (2020). ACE2 receptor expression in testes: implications in coronavirus disease 2019 pathogenesis†. Biology of Reproduction. 103, 449-451;
- Zhengpin Wang, Xiaojiang Xu. (2020). scRNA-seq Profiling of Human Testes Reveals the Presence of the ACE2 Receptor, A Target for SARS-CoV-2 Infection in Spermatogonia, Leydig and Sertoli Cells. Cells. 9, 920;
- Qiaoyan Shen, Xia Xiao, Aili Aierken, Wei Yue, Xiaojie Wu, et. al.. (2020). The ACE2 expression in Sertoli cells and germ cells may cause male reproductive disorder after SARS‐CoV‐2 infection. J Cell Mol Med. 24, 9472-9477;
- Pallav Sengupta, Sulagna Dutta. (2020). Does SARS-CoV-2 infection cause sperm DNA fragmentation? Possible link with oxidative stress. The European Journal of Contraception & Reproductive Health Care. 25, 405-406;
- Livan Delgado-Roche, Fernando Mesta. (2020). Oxidative Stress as Key Player in Severe Acute Respiratory Syndrome Coronavirus (SARS-CoV) Infection. Archives of Medical Research. 51, 384-387;
- Rong Li, Tailang Yin, Fang Fang, Qin Li, Jiao Chen, et. al.. (2020). Potential risks of SARS-CoV-2 infection on reproductive health. Reproductive BioMedicine Online. 41, 89-95;
- Yan Jing, Li Run-Qian, Wang Hao-Ran, Chen Hao-Ran, Liu Ya-Bin, et. al.. (2020). Potential influence of COVID-19/ACE2 on the female reproductive system. Molecular Human Reproduction. 26, 367-373;
- Xie Xudong, Chen Junzhu, Wang Xingxiang, Zhang Furong, Liu Yanrong. (2006). Age- and gender-related difference of ACE2 expression in rat lung. Life Sciences. 78, 2166-2171;
- Alexandre J. Vivanti, Christelle Vauloup-Fellous, Sophie Prevot, Veronique Zupan, Cecile Suffee, et. al.. (2020). Transplacental transmission of SARS-CoV-2 infection. Nat Commun. 11;
- Huaping Zhu, Lin Wang, Chengzhi Fang, Sicong Peng, Lianhong Zhang, et. al.. (2020). Clinical analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl Pediatr. 9, 51-60;
- Lisheng Wang, Yiru Wang, Dawei Ye, Qingquan Liu. (2020). Review of the 2019 novel coronavirus (SARS-CoV-2) based on current evidence. International Journal of Antimicrobial Agents. 55, 105948;
- Yuhao Zhang, Xiuchao Geng, Yanli Tan, Qiang Li, Can Xu, et. al.. (2020). New understanding of the damage of SARS-CoV-2 infection outside the respiratory system. Biomedicine & Pharmacotherapy. 127, 110195;
- Sonia Villapol. (2020). Gastrointestinal symptoms associated with COVID-19: impact on the gut microbiome. Translational Research. 226, 57-69;
- Yassine Yachou, Abdeslem El Idrissi, Vladimir Belapasov, Said Ait Benali. (2020). Neuroinvasion, neurotropic, and neuroinflammatory events of SARS-CoV-2: understanding the neurological manifestations in COVID-19 patients. Neurol Sci. 41, 2657-2669;
- Tomasz J Guzik, Saidi A Mohiddin, Anthony Dimarco, Vimal Patel, Kostas Savvatis, et. al.. (2020). COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovascular Research. 116, 1666-1687;
- Luisa Zupin, Lorella Pascolo, Gabriella Zito, Giuseppe Ricci, Sergio Crovella. (2020). SARS-CoV-2 and the next generations: which impact on reproductive tissues?. J Assist Reprod Genet. 37, 2399-2403.







