От встряхивания до лапароскопии, или история эндометриоза
26 марта 2025
От встряхивания до лапароскопии, или история эндометриоза
- 1162
- 0
- 2
Эндометриоз — это хроническое заболевание женской репродуктивной системы, при котором ткань, похожая на слизистую оболочку матки, разрастается за пределами матки. Это может привести к болям, нарушениям менструального цикла, бесплодию и другим проблемам со здоровьем. Ранняя диагностика и лечение эндометриоза очень важны для предотвращения осложнений и улучшения качества жизни женщин, столкнувшихся с этим заболеванием.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Острая боль, обильное кровотечение, тревога — нет, это не типичный фильм ужасов, а всего лишь симптомы эндометриоза. Статистика заболевания говорит о распространении болезни, а последние исследования — о повышении риска рака и бесплодия. В этой статье мы рассмотрим наиболее важные аспекты течения болезни, почему она «прячется» от врачей, а также обсудим новые методы терапии.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного цифр

Рисунок 1. Процедура встряхивания — пациенток привязывали к лестнице, переворачивали вверх ногами и энергично трясли.
Эндометриоз — заболевание, при котором ткань, подобная слою, выстилающему матку, разрастается за ее пределами. На основе последних исследований принято разделять эндометриоз полости малого таза на три подтипа: поверхностный перитонеальный (около 80% всех случаев болезни), яичниковый и глубокий [1]. Разница между первым и третьим случаях заключается в том, что при глубоком эндометриозе происходит прорастание тканей под поверхность перитонеума (оболочка, выстилающая стенки полости живота). Это может являться причиной более выраженных болевых симптомов и тяжелых осложнений. Яичниковый эндометриоз в основном характеризуется наличием кист, называемых эндометриоидными или шоколадными. Такое сладкое название они получили за счет своего темно-коричневого цвета. Также эндометрий может выходить за область малого таза — экстрагенитальный эндометриоз, при котором происходит поражение органов, не относящихся к репродуктивной системе, например, в прямой кишке, мочевом пузыре, мочеточниках, почках, легких и так далее.
Вопрос лечения эндометриоза становится все актуальнее: по данным мировой статистики эндометриоз продолжает оставаться одним из распространенных гинекологических заболеваний, а цифры, приведенные Федеральной службой государственной статистики, показывают, что частота встречаемости эндометриоза в России за последние 10 лет возросла на 72,9%. Мало того, что он значительно снижает качество жизни человека, эндометриоз может вызывать ряд тяжелых заболеваний, например рак яичников и молочной железы, меланомы и даже бесплодие. Сложность лечения может быть связана и с тем, что часто диагноз ставится с большим опозданием: средний промежуток постановки диагноза составляет 9 лет (если считать от момента появления болевых симптомов). Несмотря на наличие лекарств (в том числе симптоматических: анальгетики, спазмолитики) и стратегий лечения, существуют пробелы в лечении и диагностике, которые современная медицина стремится устранить. В этой статье мы рассмотрим современный взгляд на причины появления эндометриоза, а также новые способы диагностики и лечения заболевания.
Несмотря на нынешнюю высокую распространенность, эндометриоз нельзя назвать «болезнью цивилизации», так как патологические изменения, характерные для этого заболевания, встречаются еще в древних египетских папирусах Эберса (около 1600 лет до н.э.). Однако первый отчет в научной литературе принадлежит Карлу фон Рокитанскому и датируется 1860 годом [2]. Однако сильно отличались взгляды на причины возникновения болезни и ее последствия, взять, к примеру, теории знаменитой «блуждающей» матки, одержимости демонами и истерию. Очевидно, в XXI веке такие изречения покажутся забавными и необъективными. Больше могли поразить только методы лечения данных заболеваний, например, встряхивание вверх ногами (для возвращения матки на ее законное место) (рис. 1) или удушье [3]. Изумленный читатель может выдохнуть — благодаря развитию науки и медицины врачи имеют намного более четкое представление как о самой болезни, так и методах ее лечения.
Первые теории
Как мы уже выяснили, эндометриоз — болезнь достаточно древняя. Рассмотрим же ее с точки зрения современного врача. Существует несколько теорий происхождения эндометриоза. Несмотря на то, что теория имплантации Сэмпсона (1927 г.) является самой старой (его первые публикации, посвященные эндометриозу и данной теории, датируются 1921–1922 гг.), в настоящее время она считается наиболее широко принятой в патогенезе эндометриоза. Эта теория рассматривает ретроградную менструацию, а именно сокращение мышечного слоя матки в обратном направлении от шейки матки, вследствие которой части эндометрия проходят цервикальный канал и через маточные трубы попадают в брюшную полость. Затем следует процесс адгезии (прикрепление клеток эндометрия к тканям). В результате в месте расположения эндометриоидных очагов возникает воспаление с дальнейшим формированием рубцовой ткани и спаек [4]. Все достаточно просто и логично, однако есть пара важных нюансов: во-первых, теория Сэмпсона не может объяснить появление тканей эндометрия вне области малого таза, например, в кишечнике, легких, слезных желез и других местах; во-вторых, она также не объясняет наличие заболевания у женщин с синдромом Майера—Рокитански—Кюстера—Хаузера — врожденного порока, приводящего к отсутствию матки, у подростков до или вскоре после первой менструации и у мужчин [5]. (Вообще, эндометриоз у мужчин встречается крайне редко, за все время было описано лишь несколько случаев, причем чаще всего он встречался в мочевом пузыре [6]). В-третьих, более поздние исследования доказывают, что около 90% женщин страдают от ретроградной менструации, однако только у 15% процентов это перерастает в эндометриоидную болезнь [7]. Более того, современная медицина утверждает, что клетки эндометриоидных кист и просто пересаженный нормальный эндометрий — не одно и то же.
Также весьма важным выводом Сэмпсона считается доказательство того, что геморрагические кисты яичников на самом деле являются тем же заболеванием, что и эндометриоз. Его открытие было сделано на основе большого количества микроскопических анализов и подтверждало ранее выявленную косвенную связь между катамениальным гематоцеле (скопление крови в полости тела во время менструаций) и эндометриозом [3].
Теория целомической метаплазии также считается правдоподобной концепцией возникновения эндометриоза. Она была подробно изучена и описана Мейером (1924). Суть теории заключается в том, что клетки, выстилающие висцеральную и абдоминальную брюшину, трансформируются в клетки эндометрия. Это происходит не спонтанно, стимулом могут служить гормональные, инфекционные или экологические факторы, что вызывает метапластические изменения в слизистой оболочке брюшины, приводящие к имплантации эндометрия [8], [9]. Эту теорию подтверждают случаи экстрагенитального эндометриоза, поскольку клетки могут проникать в отдаленные органы и ткани лимфогенным или гематогенным путем; а также наличие эндометриоза у женщин с синдромом Майера—Рокитански—Кюстера—Хаузера [10], [11]. Все выглядит вполне гармонично, но есть нюанс: метастазирование является феноменом, вероятность которого увеличивается с возрастом, а значит, чем старше пациентка, тем выше вероятность возникновения эндометриоза. Однако, по статистике, после менопаузы у пожилых женщин происходит резкое снижение частоты эндометриоза, что не укладывается в данную теорию [12].
Подводя итог двум теориям, мы видим, что у каждой есть и плюсы, и минусы, и их можно считать во многом состоятельными. Но есть один нюанс, который не учитывается ни в одной, ни во второй теории. Еще в 1882 году Илья Мечников открыл фагоциты — те самые клетки иммунной системы, которые поглощают чужеродные частицы, а также мертвые или погибающие клетки. Раз во время эндометриоза возникает очаг воспаления, то почему мы не видим никакого иммунного ответа? Ведь, как говорилось ранее, эндометриоз не равен пересаженному эндометрию. Увы, здесь обе теории молчат.
В то же время, хирургическая медицина не стоит на месте. К 1970 году для лечения эндометриоза и спаек активно начинает использоваться метод лапароскопии, который вытеснил лапаротомию из-за минимальной травматизации тканей и меньшего количества послеоперационных осложнений.
В традиционном варианте лапаротомия подразумевает, что хирург делает разрез на животе по вертикали, в обход, выше или ниже пупочной области и проводится под местной спинальной анестезией или под общим наркозом, а срок реабилитации занимает до 6 недель. Во время лапароскопической операции делается 2–3 небольших разреза в брюшной стенке. Через разрезы в брюшную полость вводят специальные инструменты (скальпели, зажимы, сшивающие аппараты, помещенные в защитные полые трубки), проводится под общим наркозом пациента. Восстановление после лапароскопии занимает от 2 до 4 недель.
Операцию значительно упрощало использование системы линз, разработанной доктором Хопкинсом еще в 1960-х годах, которая повышается разрешающая способность прибора. Единственным недостатком было обязательное использование общей анестезии [13]. Чуть ранее, в 1940-х гг. Джон Херст предложил использование инъекции пропионата тестостерона как способ медикаментозного лечения эндометриоза [14]. Поскольку определенные типы клеток эндометрия экспрессируют рецептор андрогена, это потенциально могло стать решением проблемы [15]. Результат оказался положительным, лечение привело к уменьшению отека и облегчению боли, и он рекомендовал использовать эту форму лечения, когда радикальное хирургическое удаление было противопоказано. Это был прорыв, поскольку использование синтетических гормонов не только позволило бороться с симптомами болезни, но и с позиции фундаментальной науки подготовить почву для новой теории происхождения эндометриоза.
Углубимся в механизмы
Гормональная теория происхождения эндометриоза предполагает, что болезнь связана с гормональными изменениями в организме. В нормальном слое эндометрия сигналы гормонов эстрогена и прогестерона взаимосвязаны и скоординированы так, чтобы обеспечить нормальный менструальный цикл и создать подходящую среду для имплантации эмбриона и поддержания беременности. Соотношение гормонов может меняться в течение менструального цикла [16]. Эстроген способен взаимодействовать со своими рецепторами в эндометрии (рис. 2), например, для стимуляции пролиферации слизистой оболочки или же для последующего синтеза рецепторов прогестерона, которые затем подготовят эндометрий к секреторной фазе. Именно неправильная экспрессия рецептора эстрогена может вызывать не только эндометриоз, но и гиперплазию или рак эндометрия [17]. Одним из эстрогенов, действующих на эндометрий, является 17β- эстрадиол. Известно, что его высокий уровень активирует эстрогеновый рецептор, что влечет за собой рост эндометрия. Повышенная активность рецептора эстрогена β в эндометриозе также может быть причиной болезни, поскольку он ингибирует индуцированный фактором некроза опухоли апоптоз [18]. После появления очага поражения в эндометрий мигрируют макрофаги. Оказалось, что они секретируют белки Sema3A, NGF и VEGF с нейропротекторными свойствами, которые стимулируют рост нервных волокон. Как макрофаги, так и нервные волокна могут вызывать воспалительную реакцию путем высвобождения провоспалительных пептидов (например, нейропептид SP, который впоследствии вызывает высвобождение провоспалительных цитокинов, таких как TNF-α, IL-6 и IL-8). Взаимодействие между ними при эндометриозе считается основной причиной нейровоспаления, поскольку из-за этого снижается активность симпатических нервов и повышается активность сенсорных нервов, способствуя провоспалительным эффектам. Это позволяет предположить наличие нейрогенного воспалительного процесса в очаге эндометриоза, это приводит к гиперчувствительности [19].
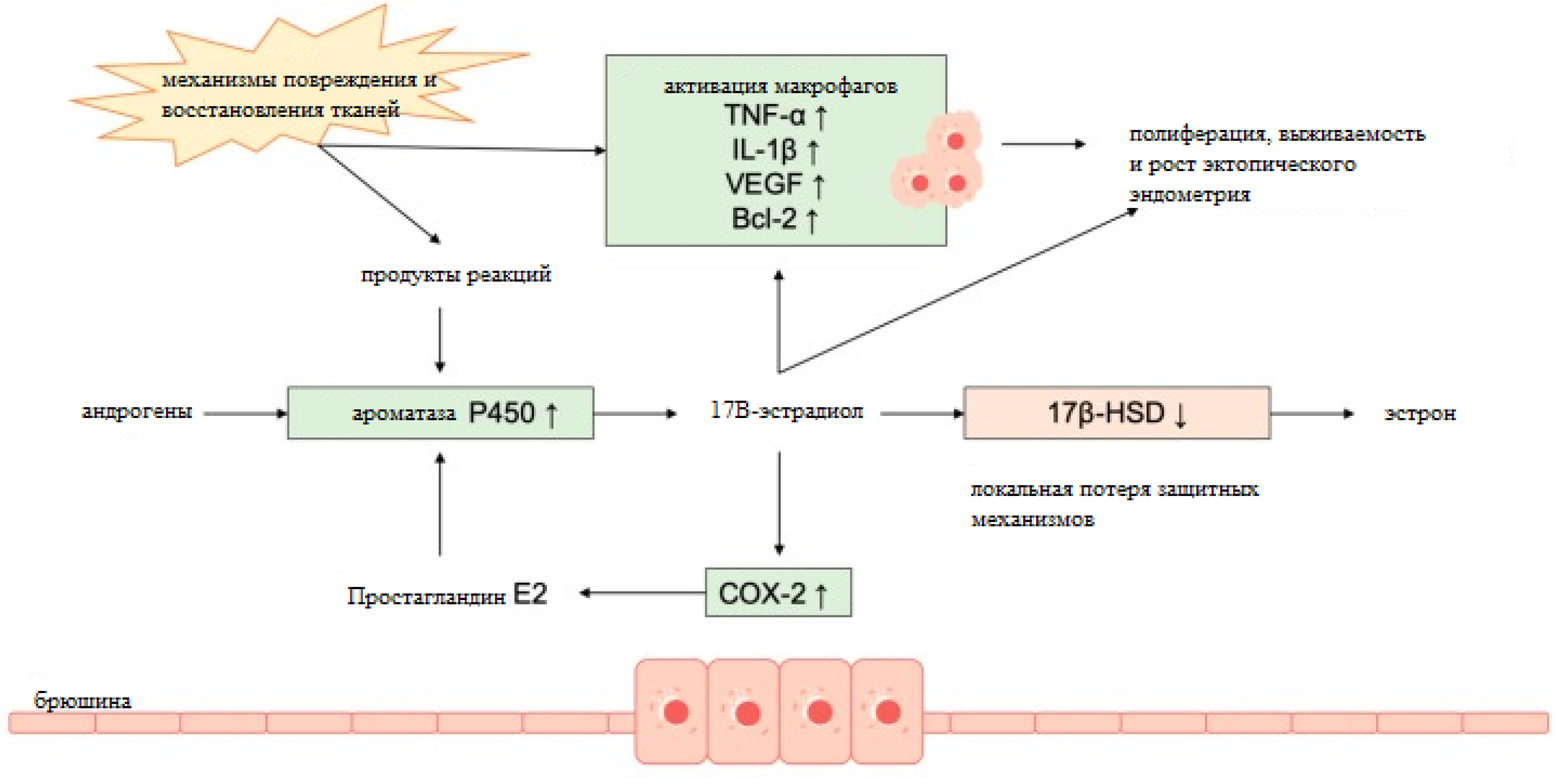
Рисунок 2. Описание механизмов, объясняющих ключевую роль эстрогенов в патогенезе эндометриоза. TNF — фактор некроза опухоли; IL — интерлейкины; VEGF — фактор роста эндотелия сосудов; 2 Bcl-2 — антиапоптотический белок B-клеточной лимфомы; 17β-HSD — 17β-гидроксистероиддегидрогеназа.
из [3], с изменениями
С развитием технологий, включая методы секвенирования ДНК, ученым удалось глубже понять генетические основы эндометриоза.
Генетическая теория эндометриоза предполагает, что некоторые микроскопические и поверхностные очаги эктопического эндометрия содержат в себе как «нормальные» клетки, которые спонтанно регрессируют, так и другие — прогрессирующие до более тяжелого заболевания за счет генетических и эпигенетических механизмов. Ведь, как оговаривалось ранее, микроскопические или поверхностные очаги эндометриоза возникают периодически у всех женщин, однако не у всех женщин развивается эндометриоз. В исследовании 2019 г. были выявлены дифференциально экспрессирующиеся гены, информацию о которых использовали в дальнейшем для получения более полной картины заболевания с точки зрения генетики. Транскриптомный анализ различных эндометриоидных клеток показал, что в пораженных эндометриозом клетках нарушены регуляция провоспалительных путей и сверхэкспрессия факторов комплемента. Кроме того, мутации в эндометриоидных эпителиальных клетках двух «генов-драйверов» онкологического профиля приводят к их обильному делению. Следовательно, изучение генетических особенностей очагов эндометриоза открывает двери для разработки новых методов лечения [20]. Например, было установлено, что ингибирование теломеразы способствовало снижению пролиферации эндометриоидных клеток [21]. Также была выявлена аберрантная экспрессия генов DNMT1, DNMT3A и DNMT3B, которые кодируют ферменты, отвечающие за метилирование ДНК [22]. Все это может служить доказательством того, что эндометриоз — эпигенетическое заболевание. Более полный эпигенетический механизм развития приведен на рис. 3.
Эта теория является самой молодой, а из-за того, что геномные исследования являются дорогостоящими и трудоемкими, сейчас идет период накопления информации и данных. Скорее всего, в будущем будет наблюдаться развитие этой концепции и следом за ней — появление новых препаратов или методов диагностики. Остается только ждать.
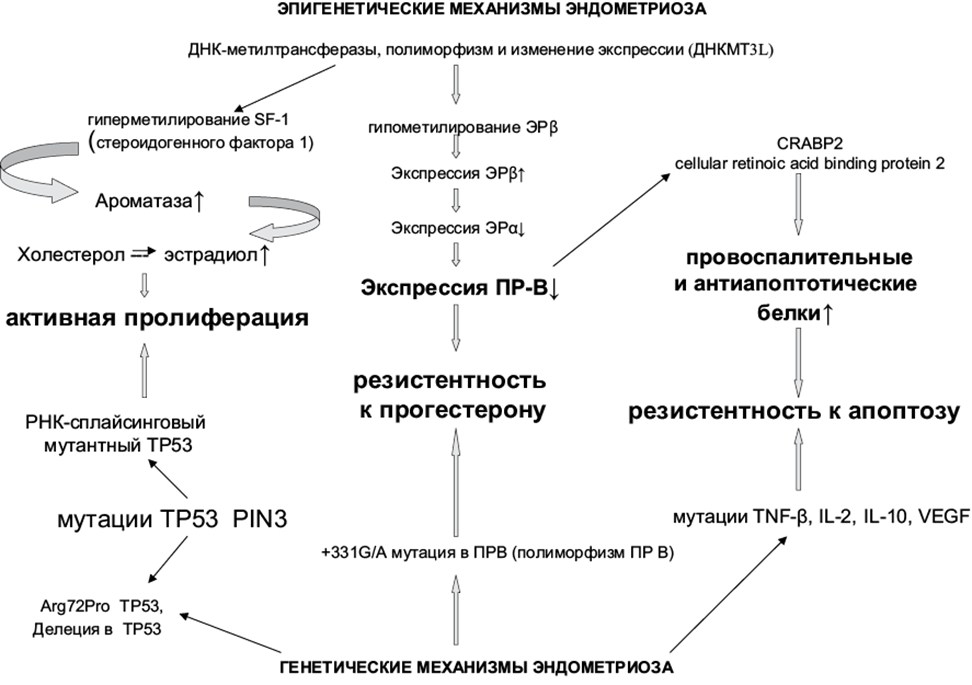
Рисунок 3. Генетические и эпигенетические факторы развития эндометриоза. К эпигенетическим механизмам относятся полиморфизм и изменение экспрессии ДНК-метилтрансфераз, к генетическим — мутации гена, кодирующего белок ТР53.
Так ли все просто?
Однако банально предполагать, что даже несколько, пусть даже общепринятых и хорошо обоснованных теорий, могут учитывать все клинические случаи появления эндометриоза. Например, японские ученые установили, что одной из причин эндометриоза может являться фузобактерия. Эта концепция не укладывается в предыдущие гипотезы. На основе мышиной модели был проанализирован механизм действия бактерии. Известно, что большая часть бактерий во влагалище — это лактобациллы, которые препятствуют инвазии патогенов путем предотвращения увеличения их популяции. В ходе исследования было выявлено присутствие и других типов бактерий, таких как Fusobacterium nucleatum. Очевидно, что при нарушении этой экосистемы возможен чрезмерный рост возбудителей инфекций, которые могут вызывать такие тяжелые заболевания, как бактериальный вагиноз [18]. Тем не менее, вернемся к эндометриозу. В группе девушек с эндометриозом частота встречаемости фузобактерий внутри тканей эндометрия была выше, чем в контрольной группе без эндометриоза. Эксперимент по пересадке разных тканей матки мышам показал идентичный результат, поскольку инфицированная бактерией ткань матки приводила к образованию множества очагов поражения эндометриозом, тогда как неинфицированная ткань подобного свойства не имела, даже при дополнительной стимуляции эстрогеном. Для лечения были использованы антибиотики метронидазол и хлорамфеникол, поскольку фузобактерии чувствительны к ним. Как и ожидалось, вскоре после лечения бактерии больше не присутствовали, а количество очагов эндометриоза уменьшилось.
Это исследование подтвердило, что эндометриоз является многофакторным заболеванием и что его патогенез трудно объяснить какой-либо одной концепцией, а лечение антибиотиками может ускорить выздоровление [25].
Благодаря появлению гормональной и генетической теорий, а также глубокому изучению гормонального статуса пациенток с эндометриозом стало возможным осуществлять более осознанный выбор медикаментозной терапии. Хотя лапароскопия и решала большую часть проблемы с минимальными послеоперационными последствиями, вероятность рецидива остается весьма высока: через один-два года после хирургического вмешательств повторное развитие эндометриоза отмечается у 15–21% пациенток, в течение двух-пяти лет при адекватном удалении очагов — 12–30%, спустя пять лет —36—47%, а через пять-семь лет — 50–55%. Понятно, что приемом простых анальгетиков тут не отделаться [26]. Нужно было что-то помасштабней. Этим «помасштабней» оказались прогестины.
Методы борьбы
Прогестины — это вещества, действующие на гипоталамо-гипофизарную связь, метаболические процессы, направленные на выработку других эндогенных стероидов, в том числе половых гормонов и кортикостероидов, ткани молочной железы и половые органы. Это синтетические молекулы, которые имитируют действие прогестерона (рис. 4). Сам же прогестерон является стероидным гормоном, вырабатываемый в яичниках, надпочечниках и плаценте. В эндометриотических клетках прогестины провоцируют апоптоз, а также атрофию и регрессию поражений эндометрия. Эти чудо-соединения также снижают активность металлопротеиназ, что снижает способность эндометриотических имплантатов проникать вглубь организма [27], поскольку именно матриксные металлопротеиназы играют роль в физиологическом функционировании эндометрия, активируя процессы миграции эндометриоидных клеток и формировании очагов воспаления. Однако все еще неизвестно, является ли это первичным механизмом появления заболевания или это просто реакция на другие иммунологические факторы [28]. Также прогестин значительно подавляет экспрессию фактора некроза опухоли и эстрадиола [29]. Это, в свою очередь, ингибирует разрастание эндометриотических клеток. Еще немаловажен тот факт, что прогестин снижает плотность нервных волокон и рецептора фактора роста нервов, тем самым устраняя боль.
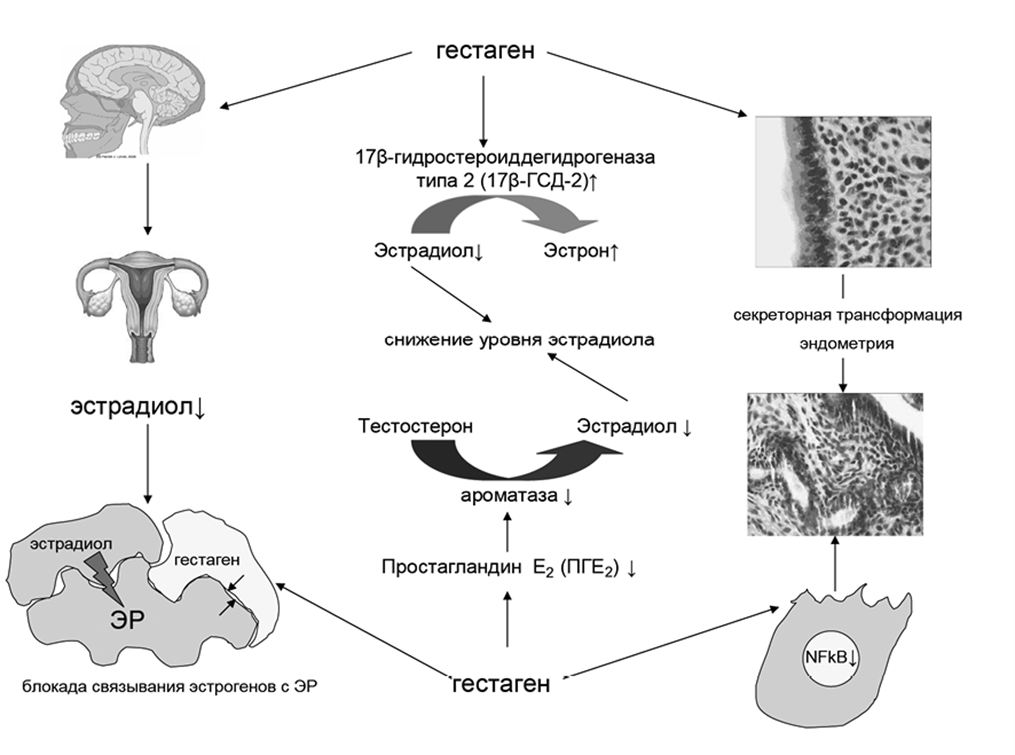
Рисунок 4. Участие гестагенов в патогенезе эндометриоза. Гестагены оказывают центральное действие, блокируя гипоталамо-гипофизарно-яичниковую ось и тем самым уменьшая секрецию эстрогенов яичниками (слева). Они стимулируют дифференцировку стромальных клеток и секреторную трансформацию эпителиальных клеток эндометрия, что приводит к его атрофии (справа). Гестагены активируют 17β-гидростероиддегидрогеназу типа 2 (17β-ГСД-2), преобразующую эстрадиол в менее активный эстрон, оказывают ингибирующее влияние на синтез простагландина E2 (ПГE2), играющего ключевую роль в патогенезе эндометриоза и способствующего повышению синтеза эстрогенов за счет модулирующего влияния на экспрессию ароматазы.
Сейчас мы имеем достаточно много лекарств от эндометриоза с различными действующими веществами. Постараемся разобраться, чем они отличаются друг от друга и какой препарат наиболее эффективен. Среди пероральных средств первым в списке идет ацетат норэтиндрона (ацетат норэтистерона, или НЭТА) (рис. 5). Изначально вещество увидело свет в составе противозачаточных таблеток под торговой маркой Эновид, которые содержали аж 10 мг вещества. Попадая в организм, вещество, вследствие расщепления сложноэфирных связей, быстро превращается в норэтистерон, который обладает сильным прогестагенным эффектом и слабыми андрогенными свойствами [30]. Это подавляет эстроген-индуцированную пролиферацию эндометрия, и очаги эндометриоза перестают распространяться и расти [31]. По итогам контролируемых исследований можно сказать, что низкие дозы норэтиндрона ацетата можно рассматривать как весьма эффективное, переносимое и недорогое лечение симптоматических поражений ректовагинального эндометриоза у пациенток, особенно при повторном хирургическом вмешательстве. Что интересно, вещество также, пусть и незначительно, повышало минеральную плотность костной ткани и предотвращало остеопороз, а комбинированная терапия 1 мг эстрадиола и 0,5 мг НЕТА значительно лучше устраняла приливы жара, особенно у женщин в постменопаузе [31]. Однако есть и недостатки: помимо тошноты, периферических отеков и увеличении массы тела, при длительном приеме препарата значительно повышается риск тромбоза и тромбоэмболии.
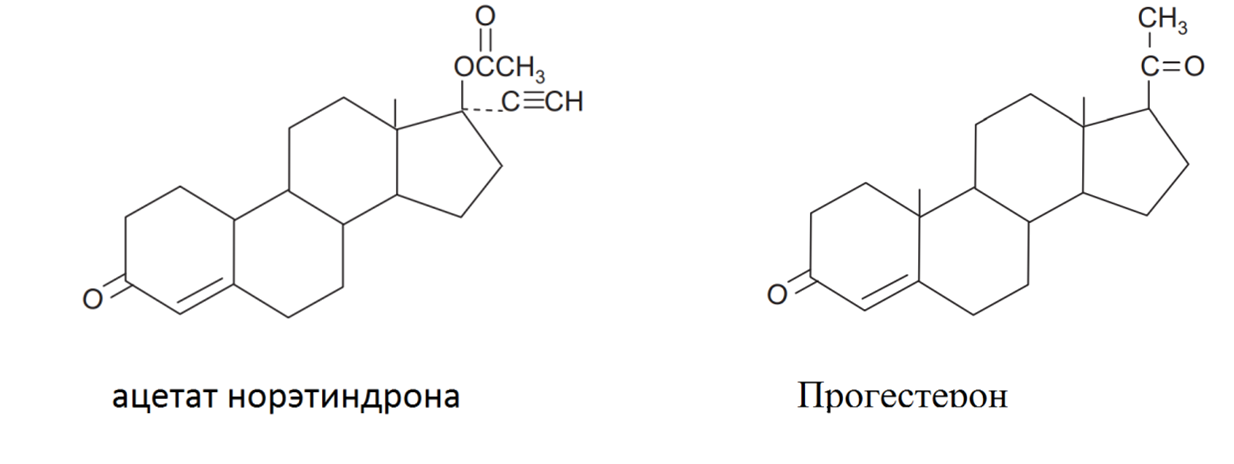
Рисунок 5. Сравнение молекул прогестерона и ацетата норэтидрона.
Следующим на очереди идет дидрогестерон (рис. 6). Если норэтидрон тяжело сейчас найти на прилавках аптеки, то дидрогестерон, который появился на рынках в 1961 году, можно легко отыскать, ведь он хорошо известен как Дюфастон. Если мы внимательно посмотрим на его молекулу и сравним ее с прогестероном, то мы... не обнаружим отличий. Но это только на первый взгляд: в молекуле притаилась двойная связь, а в остальном дидрогестерон можно считать оптическим изомером прогестерона. Возможно, именно это делает препарат эффективным и безопасным. Он является высокоселективным прогестагеном и используется при широком спектре гинекологических заболеваний, а также для предупреждения угрожающего аборта и преждевременных родов. Из всех стероидных рецепторов дидрогестерон взаимодействует только с рецепторами прогестерона. Это весьма важно учитывать, поскольку другие препараты прогестинов взаимодействуют и с другими рецепторами и, как следствие, приводят к нежелательным побочным эффектам (например, активация андрогеновых рецепторов ведет к развитию вторичных мужских признаков) [32]. Дидрогестерон вызывает атрофию эктопического эндометрия, не подавляя нормальный эндометрий, и одновременно подавляет развитие новых эндометриотических поражений [19]. Вещество обладает благоприятным профилем безопасности, поскольку дидрогестерон, отличается от прогестерона лишь наличием двойной связи у атома. Он также не подавляет овуляцию (а значит, его можно использовать при беременности) и регулярные менструации, не вызывает увеличения веса и отеков, в отличие от ацетата норэтиндрона.
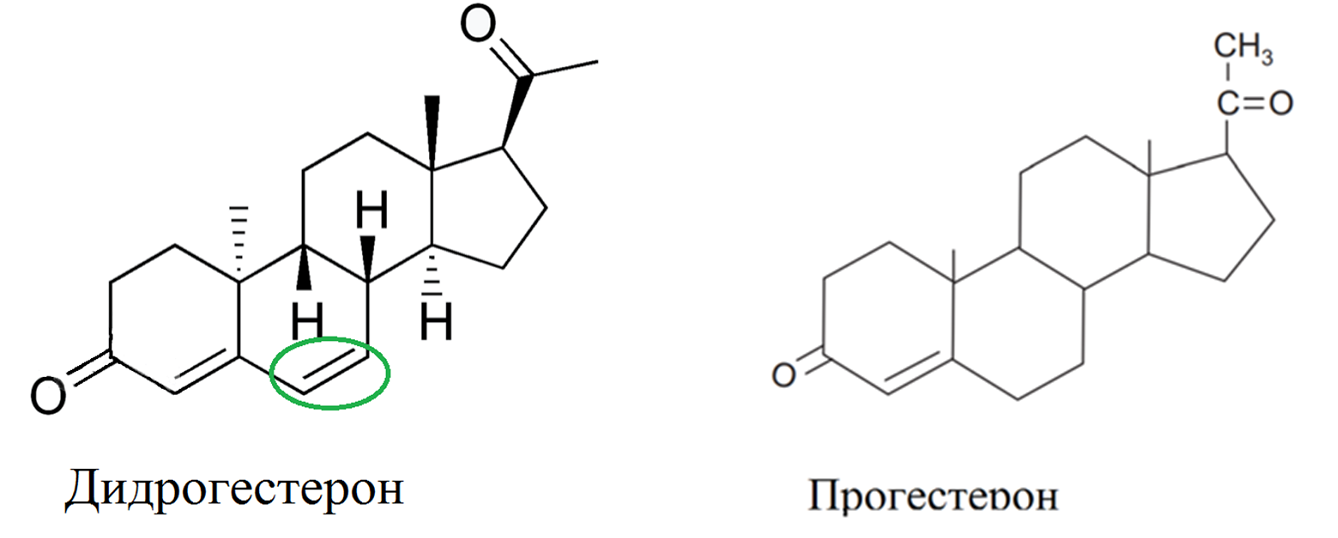
Рисунок 6. Молекула дидрогестерона в сравнении с прогестероном.
Ровно через десять лет после открытия дидрогестерона, в 1971 году, Эндрю Шалли и Роже Гиймен открыли, а затем и синтезировали гонадотропный-ризлинг-гормон (ГнРГ), за что в 1977 получили Нобелевскую премию по медицине. Однако нас будет интересовать не сам гормон, а его антагонист.
Как известно, в художественной литературе антагонист мешает главному герою достичь своей цели. Здесь то же самое, только главный герой — не принц на белом коне, а гормон. Достигая рецептора, антагонист связывается с ним, заставляя рецептор принимать неактивную конформацию, тем самым лишая его биохимической активности.
В результате конкурентного связывания синтетических аналогов ГнРГ с рецепторами в гипофизе секреция лютеинизирующего и фоликулостимулирующих гормонов увеличивается. Данный эффект сейчас широко используется в циклах контролируемой суперовуляции при использовании вспомогательных репродуктивных технологий. Значит, при применении агонистов гонадотропного-ризлинг-гормона (далее ГнРГ), особенно пролонгированного действия, чувствительность гипофиза уменьшится, равно как и число его гонадотропных рецепторов. Как итог, это ведет к постепенному снижению синтеза эндогенного гонадотропина, а также к низкому уровню секреции лютеинизирующего и фолликулостимулирующего гормона. Следующим этапом подавляется рост фолликулов яичников, овуляция и нарушает стероидогенез. Таким образом, будто по эффекту домино, агонисты ГнРГ блокируют деятельность всей гипоталамо-гипофизарно-яичниковой оси, снижая концентрацию эстрадиола в крови до уровня при менопаузе. Это ведь то, что нужно! Значит, ГнРГ оказывают прямое воздействие на эндометрий, в котором также содержатся рецепторы к ГнРГ, и подавляют в нем любую пролиферативную активность. Более того, так как матка искусственно переводится в состояние менопаузы, препараты с антагонистами ГнРГ помогают справиться с анемией (часто сопровождающая эндометриоз из-за обильных менструаций), особенно при дополнительном применении железосодержащих препаратов [33]. Получается, что мы убиваем двух зайцев одним выстрелом.
Также для лечения эндометриоза принимались агонисты ГнРГ, однако на основе полученных результатов нельзя четко говорить о преимуществах перед антагонистами. Сейчас оба этих препарата нашли применение в сфере вспомогательных репродуктивных технологий, как раз из-за того, что они оба действуют на эндометрий и участвуют в его подготовке к беременности (например, препараты Ганиреликс-Рихтер Оргалутран, действующее вещество — Ганиреликс) (рис. 7), а также как для лечения рака предстательной железы (действующее вещество — Дегареликс). Помимо привычных побочных реакций (головная боль и тошнота, которые идут рука об руку с гормональными препаратами), в редких случаях возможны также эктопическая беременность и самопроизвольный аборт.
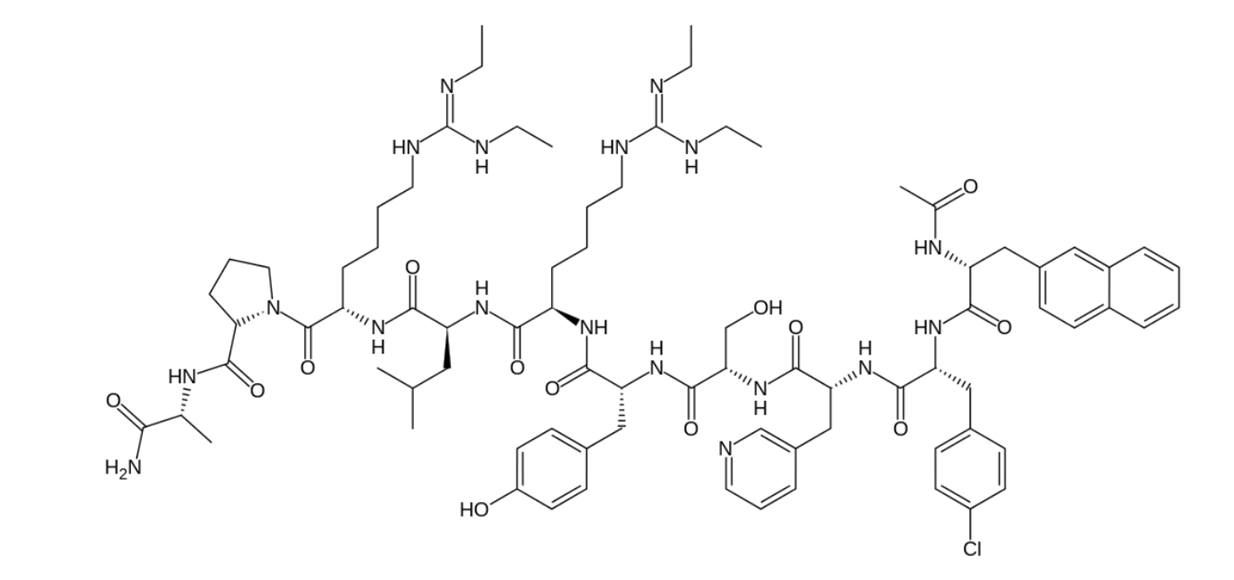
Рисунок 7. Пример молекулы антагониста ГнРГ — Ганиреликс (действующее вещество одноименного препарата).
Примерно в это же время был открыт диеногест (рис. 8). Диеногест — гестаген четвертого поколения, представляет собой производное 19-нортестостерона с цианометильной группой вместо этинильной в положении С-17. Поэтому диеногест, как и нортестостерон, изначально использовался как противозачаточное средство. Например, препарат «Валетт» (диеногест 2,0 мг и этинилэстрадиол 0,03 мг) показывал высокую эффективность и хорошую переносимость [34]. Но раз предыдущий контрацептив весьма неплохо боролся с эндометриозом, почему бы не попробовать интегрировать диеногест и повторить опыт?
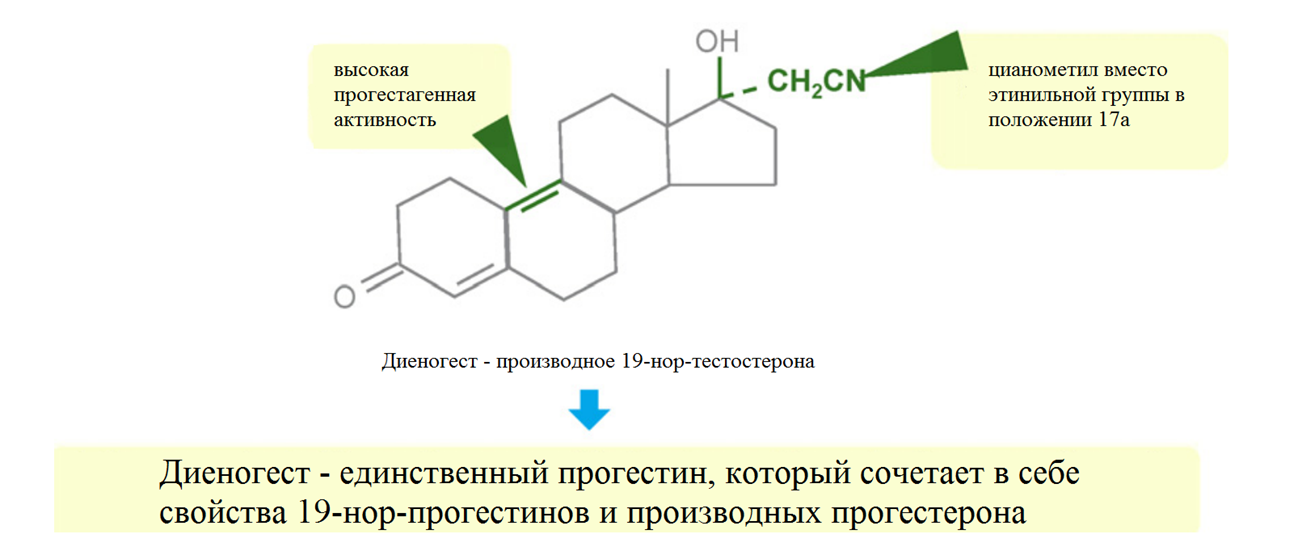
Рисунок 8. Химическая структура диеногеста.
из [35], с изменениями
В сравнении с НЭТА, диеногест не уступает в биодоступности (она составляет более 90%), во времени достижения максимальной концентрации после однократного и повторного приема и в периоде полураспада в плазме крови (около 10 часов). Значит в стабильном состоянии не происходит накопления диеногеста, что может быть связано с его плохим сродством к глобулину, связывающему половые гормоны. За счет этого вещество также не может вытеснить тестостерон, связанный с транспортным белком, да и в принципе не обладает ни эстрогенной, ни андрогенной активностью. Также отмечено отсутствие глюкокортикоидной активности, а значит, и риск возникновения тромбов ниже (1:0 в пользу диеногеста) [35].
Исследование японских ученых показало, что диеногест обладает противораковым действием, причем оно очень сильно отличается от других прогестинов, причем такая уникальная активность проявляется при дозах, меньших, чем те, которые оказывают прогестагенный эффект [36].
Для исследования были выбраны клетки, полученные из карциномы эндометрия (причем использовались как клетки, экспрессирующие только эстроген, так и эстроген и прогестаген), а также из карциномы молочной железы. Диеногест успешно подавлял рост опухолевых клеток, не проявляя цитотоксичности, однако его действие не затрагивает гетерогенные опухолевые клетки из-за отсутствия прогестиновых рецепторов. Очередным плюсом является то, что для подавления опухолей доза препарата была намного ниже, чем у других прогестинов, что должно способствовать уменьшению побочных эффектов при клиническом применении [36].
Но что же насчет самого эндометриоза? По данным объединенного анализа европейской программы клинических исследований, диеногест продемонстрировал значительную эффективность в уменьшении очагов поражения, оцениваемых при лапароскопии и в снижении интенсивности боли. Препарат значительно превзошел плацебо и была эквивалентна аналогу гонадотропин-рилизинг-гормона при регулярном приеме в течение 12–65 недель. По статистике, наиболее частыми побочными реакциями стали: головная боль (30 из 332 пациентов), дискомфорт в груди (18) и подавленное настроение (17). Длительный прием диеногеста также не повлиял на среднюю концентрацию липидов в крови (то есть общего холестерина, триглицеридов, холестерина липопротеинов низкой плотности и холестерина липопротеинов высокой плотности). Это же касается и уровня гликированного гемоглобина и уровня эстрадиола. Однако минимально изменились показатели костного обмена и характер кровотечений. Подводя итоги, можно сказать, что диеногест является оптимальным препаратом для лечения эндометриоза [37].
Несмотря на эволюцию хирургических и медикаментозных методов лечения эндометриоза, вопрос появления заболевания все еще остается открытым. С появлением и признанием генетики как науки появилась возможность более детального изучения многих болезней и патологий.
Заключение
Эндометриоз — серьезное заболевание, требующее своевременного и квалифицированного лечения. Регулярные визиты к гинекологу и внимание к симптомам могут значительно снизить риск развития заболевания. Несмотря на весьма продолжительный период изучения, все еще невозможно прийти к единой концепции появления и развития болезни, а также к способам ее полного устранения. Однако развитие медицины и науки уже сейчас помогает бороться с симптомами и значительно повышать качество жизни больных. Сейчас многие врачи говорят о более частых случаях эндометриоза, особенно у девушек в возрасте от 20 лет и даже младше. Связано ли это с изменением образа жизни человека? Или это следствие более продвинутых методов медицинской диагностики? Чтобы ответить на эти вопросы, потребуется не мало времени, статистических данных и лабораторных анализов.
Возможно, в будущем ученые смогут не только отыскать больше информации об этой загадочной болезни, но также открыть новые методы диагностики и лечения.
Литература
- Philippa T.K. Saunders, Andrew W. Horne. (2021). Endometriosis: Etiology, pathobiology, and therapeutic prospects. Cell. 184, 2807-2824;
- V. E. Balan, S. A. Orlova, A. S. Zhuravel, V. V. Ovchinnikova, Yu. P. Titchenko, et. al.. (2016). From the history of studies of endometriosis to current treatments. Ross. vestn. akush.-ginekol.. 16, 102;
- Camran Nezhat, Farr Nezhat, Ceana Nezhat. (2012). Endometriosis: ancient disease, ancient treatments. Fertility and Sterility. 98, S1-S62;
- P.R. Koninckx, D. Barlow, S. Kennedy. (1999). Implantation versus Infiltration: The Sampson versus the Endometriotic Disease Theory. Gynecol Obstet Invest. 47, 3-10;
- Antonio Simone Laganà, Simone Garzon, Martin Götte, Paola Viganò, Massimo Franchi, et. al.. (2019). The Pathogenesis of Endometriosis: Molecular and Cell Biology Insights. IJMS. 20, 5615;
- Khaleel I. Al-Obaidy, Muhammad T. Idrees. (2019). Endometriosis With Cystic Degeneration: A Rare Disease of Males. Int J Surg Pathol. 27, 311-314;
- Halme J., Hammond M., Hulka J., Raj S., Talbert L. (1984). Retrograde menstruation in healthy women and in patients with endometriosis. Obstet Gynecol. 64, 151–154;
- Isaac E. Sasson, Hugh S. Taylor. (2008). Stem Cells and the Pathogenesis of Endometriosis. Annals of the New York Academy of Sciences. 1127, 106-115;
- Kohei Matsuura, Hideyuki Ohtake, Hidetaka Katabuchi, Hitoshi Okamura. (1999). Coelomic Metaplasia Theory of Endometriosis: Evidence from in vivo Studies and an in vitro Experimental Model. Gynecol Obstet Invest. 47, 18-22;
- Evelyn Y. Mok-Lin, Adam Wolfberg, Heidi Hollinquist, Marc R. Laufer. (2010). Endometriosis in a Patient with Mayer-Rokitansky-Küster-Hauser Syndrome and Complete Uterine Agenesis: Evidence to Support the Theory of Coelomic Metaplasia. Journal of Pediatric and Adolescent Gynecology. 23, e35-e37;
- Moon Kyoung Cho, Cheol Hong Kim, Sung Tack Oh. (2009). Endometriosis in a patient with Rokitansky‐Kuster‐Hauser syndrome. J of Obstet and Gynaecol. 35, 994-996;
- Adamyan L., Arslanyan K., Loginova O., Manukyan L., Kharchenko E. (2020). Immunological aspects of endometriosis: review of the literature;
- Mais V., Ajossa S., Guerriero S., Paoletti A., Palmas M., Mascia M., Melis G. (1994). The role of laparoscopy in the treatment of endometriosis. Clin Exp Obstet Gynecol. 21, 225–227;
- John C. Hirst. (1943). Favorable Response of Advanced Endometriosis to Testosterone Propionate Therapy**Read at a meeting of the Philadelphia Obstetrical Society, December 3, 1942.. American Journal of Obstetrics and Gynecology. 46, 97-102;
- Ioannis Simitsidellis, Philippa T.K. Saunders, Douglas A. Gibson. (2018). Androgens and endometrium: New insights and new targets. Molecular and Cellular Endocrinology. 465, 48-60;
- Jin-xiang Wu, Shu Lin, Shuang-bo Kong. (2021). Psychological Stress and Functional Endometrial Disorders: Update of Mechanism Insights. Front. Endocrinol.. 12;
- Kun Yu, Zheng-Yuan Huang, Xue-Ling Xu, Jun Li, Xiang-Wei Fu, Shou-Long Deng. (2022). Estrogen Receptor Function: Impact on the Human Endometrium. Front. Endocrinol.. 13;
- Zi-Run Tang, Rui Zhang, Zheng-Xing Lian, Shou-Long Deng, Kun Yu. (2019). Estrogen-Receptor Expression and Function in Female Reproductive Disease. Cells. 8, 1123;
- Jinjie Wu, Hongyu Xie, Shuzhong Yao, Yanchun Liang. (2017). Macrophage and nerve interaction in endometriosis. J Neuroinflammation. 14;
- L.V. Adamyan, M.V. Kuznetsova, L.G. Pivazyan, Yu.D. Davydova, D.Yu. Trofimov. (2023). Genetic aspects of endometriosis and adenomyosis: a modern view on the problem. Probl. reprod.. 29, 14;
- A.J. Valentijn, G. Saretzki, N. Tempest, H.O.D. Critchley, D.K. Hapangama. (2015). Human endometrial epithelial telomerase is important for epithelial proliferation and glandular formation with potential implications in endometriosis. Hum. Reprod.. dev267;
- Yan Wu, Estil Strawn, Zainab Basir, Gloria Halverson, Sun-Wei Guo. (2007). Aberrant expression of deoxyribonucleic acid methyltransferases DNMT1, DNMT3A, and DNMT3B in women with endometriosis. Fertility and Sterility. 87, 24-32;
- Федотчева Т.А., Шимановский Н.Л. (2018). Роль гестагенов в лечении эндометриоза. Проблемы Эндокринологии. 64, 54–61;
- Wallace Jeng Yang Chee, Shu Yih Chew, Leslie Thian Lung Than. (2020). Vaginal microbiota and the potential of Lactobacillus derivatives in maintaining vaginal health. Microb Cell Fact. 19;
- Ayako Muraoka, Miho Suzuki, Tomonari Hamaguchi, Shinya Watanabe, Kenta Iijima, et. al.. (2023). Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts. Sci. Transl. Med.. 15;
- Качалина Т.С., Зиновьев А.Н., Зяблова М.Е. Рецидивы эндометриоидных кист: факторы риска и профилактика. Эффективная фармакотерапия. Акушерство и гинекология. 1;
- Laura Buggio, Edgardo Somigliana, Giussy Barbara, Maria Pina Frattaruolo, Paolo Vercellini. (2017). Oral and depot progestin therapy for endometriosis: towards a personalized medicine. Expert Opinion on Pharmacotherapy. 18, 1569-1581;
- L.V. Adamyan, L.M. Manukyan, O.N. Loginova, K.N. Arslanyan, V.O. Zayratyants. (2020). The role of matrix metalloproteinases in the pathogenesis of endometriosis(literature review). Probl. reprod.. 26, 95;
- Sayako Horie, Tasuku Harada, Masahiro Mitsunari, Fuminori Taniguchi, Tomio Iwabe, Naoki Terakawa. (2005). Progesterone and progestational compounds attenuate tumor necrosis factor alpha–induced interleukin-8 production via nuclear factor kappaB inactivation in endometriotic stromal cells. Fertility and Sterility. 83, 1530-1535;
- Kristof Chwalisz, Eric Surrey, Frank Z. Stanczyk. (2012). The Hormonal Profile of Norethindrone Acetate: Rationale for Add-Back Therapy With Gonadotropin-Releasing Hormone Agonists in Women With Endometriosis. Reprod. Sci.. 19, 563-571;
- H Kuhl. (2005). Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric. 8, 3-63;
- Torshin I.Y., Gromova O.A., Sukhikh G.T., Galitskaya S.A., Yurgel' I.S. (2009). Molekulyarnye mekhanizmy didrogesterona (Dyufaston®). Polnogenomnoe issledovanie transkriptsionnykh effektov retseptorov progesterona, androgenov i estrogenov. Gynecology. 11, 9–15;
- O.A. Pustotina. (2023). Agonists of gonadotropin-releasing-hormone and add-back-therapy. Ross. vestn. akush.-ginekol.. 23, 63;
- Zimmermann T., Dietrich H., Wisser K., Hoffmann H. (1999). The efficacy and tolerability of Valette: a postmarketing surveillance study. Eur J Contracept Reprod Health Care. 4, 155–164;
- Xiangyan Ruan, H. Seeger, A.O. Mueck. (2012). The pharmacology of dienogest. Maturitas. 71, 337-344;
- Katsuki Y., Shibutani Y., Aoki D., Nozawa S. (1997). Dienogest, a novel synthetic steroid, overcomes hormone-dependent cancer in a different manner than progestins. Cancer. 79, 169–176.