
Паразит-виртуоз: раковая опухоль способна расти за счет активности мозга
09 января 2024
Паразит-виртуоз: раковая опухоль способна расти за счет активности мозга
- 1128
- 0
- 10
Паразит в мозге больного глиобластомой, диффузионная МРТ.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вы наверняка слышали о том, что люди, постоянно занимающиеся умственным трудом, живут дольше и менее подвержены таким нейродегенеративным заболеваниям, как болезнь Альцгеймера. Но может ли активность нервных клеток быть обращена во вред организму? Последние исследования в области нейроонкологии показали, что глиобластома, злокачественная опухоль мозга, способна «паразитировать» на нейронах, выживать и расти за счет их работы. Эта статья посвящена обзору адаптаций новообразования к такому «образу жизни».
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Глиома
Глиомы — раковые опухоли, возникающие в центральной нервной системе, чаще всего в головном мозге, из глиальных и стволовых клеток. Несмотря на то, что стволовые клетки нервной ткани способны давать начало как астроцитам и олигодендроцитам, так и нейронам, образование последних — гораздо более редкое явление. Чаще возникает потребность в новых глиальных клетках, особенно в активных зонах, где образуются новые синаптические контакты, прорастают нервные волокна и строятся миелиновые оболочки.
Глиальные клетки ЦНС, к которым относятся астроциты, олигодендроциты и микроглия — неутомимые работники, кормильцы нейронов, участвующие также в построении и разборке синапсов. Они регулируют работу контактов и защищают нервную ткань от ядов и патогенов. Коммуникация глиальных клеток между собой и с нейронами необходима для выполнения этих задач и осуществляется с помощью химических и электрических сигналов. Раковые клетки, которые появляются из стволовых клеток нервной ткани, сохраняют способность распознавать и даже генерировать эти сигналы, усиливая за счет такой коммуникации свою устойчивость.
Существует множество типов глиом, отличающихся клеточным составом, генетическими маркерами и агрессивностью. В этой статье будут рассмотрены так называемые глиомы высокой степени злокачественности: астроцитомы и олигодендроглиомы. Свое название эти новообразования получили благодаря гистологическому сходству их клеток с астроглией и олигодендроглией соответственно. Особенно много будет сказано о глиобластоме, наиболее агрессивной астроцитоме, практически неизлечимой и обладающей удивительным набором «навыков», позволяющим ей противостоять терапии, активно регенерировать после операций, манипулировать сосудами и иммунными клетками, а также «паразитировать» на активности мозга. Эта уникальная опухоль подчиняет себе нейроны, перестраивая связи и перехватывая электрические сигналы, делая работу нервной ткани — а в частности умственную деятельность — стимулятором своего роста.
Глиобластома — один из наиболее опасных видов рака и самый частый рак мозга человека. Опухоль может появляться в любом возрасте, однако наиболее подвержены заболеванию мужчины 74–85 лет, причем лишь 2% пациентов живут дольше 5 лет после диагноза [1].
Современные методы терапии не справляются с быстрым прогрессированием глиобластомы: хирургическое удаление основной массы опухоли — лишь отсрочка, ее клетки мигрируют вдоль сосудов и пучков белого вещества глубоко в ткань мозга, часто образуя симметричные поражения, по форме напоминающие крылья бабочки [2]. Опухоль образует единую клеточную сеть, на которую практически не действует радиационная и химическая терапия. Глиобластома эффективно встраивается в нервные сети и изменяет их возбудимость, «питаясь» за счет их работы. Механизмы, лежащие в основе этих процессов, сложные, многогранные и по-своему элегантные, будут разобраны ниже, а сперва — выясним чему обязана опухоль своим уникальным «паразитическим» потенциалом.
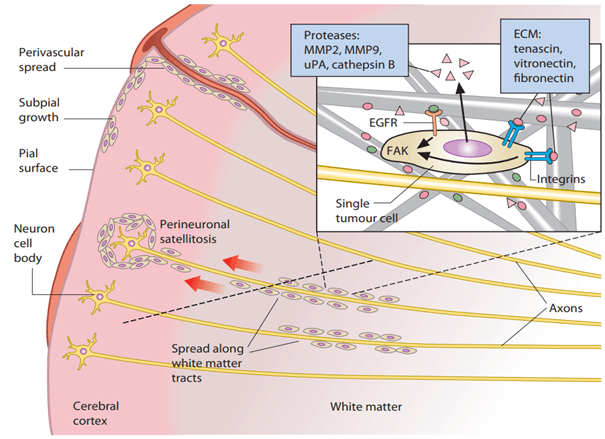
Рисунок 1. Миграция клеток глиомы. Раковые клетки внедряются в ткань мозга, путешествуют по трактам белого вещества и вдоль кровеносных сосудов и часто локализуются у тел нейронов и под мягкой оболочкой мозга. Клетки ориентируются по сигнальным молекулам внеклеточного матрикса и активно его перестраивают.
Стволовые клетки нервной ткани — обратная сторона медали
Удивительной пластичностью, способностью коммуницировать с нейронами и глией и другим уникальным свойствам глиобластома обязана своим происхождением из стволовых клеток нервной ткани (NPC, neural progenitor cells). Эти мультипотентные стволовые клетки, сохраняющиеся в мозгу взрослого человека, дают начало астроцитам, олигодендроцитам, нейронам [3]. С одной стороны стволовые клетки являются важными участниками процессов нейропластичности, придают нервной ткани способность восстанавливаться и регенерировать. С другой — как активно делящиеся клетки они подвержены риску раковой трансформации. Таким образом нейральные стволовые клетки несут в себе как большую надежду для науки и медицины, так и скрытую угрозу. Глиобластома может быть также и вторичной, то есть развиваться из менее агрессивных опухолей мозга, таких как олигодендроглиома (происходит из OPC, клеток-предшественников олигодендроцитов) [2].
Данная опухоль — сложный комплекс раковых и здоровых клеток, отличающихся строением, происхождением и функцией. В составе опухоли обнаруживаются четыре злокачественных фенотипа:
- подобный нейральным стволовым клеткам (NPC-подобный)
- подобный предшественникам олигодендроцитов (OPC-подобный)
- астроцит-подобный (AC-подобный)
- мезенхимальный (MES-подобный) [4].
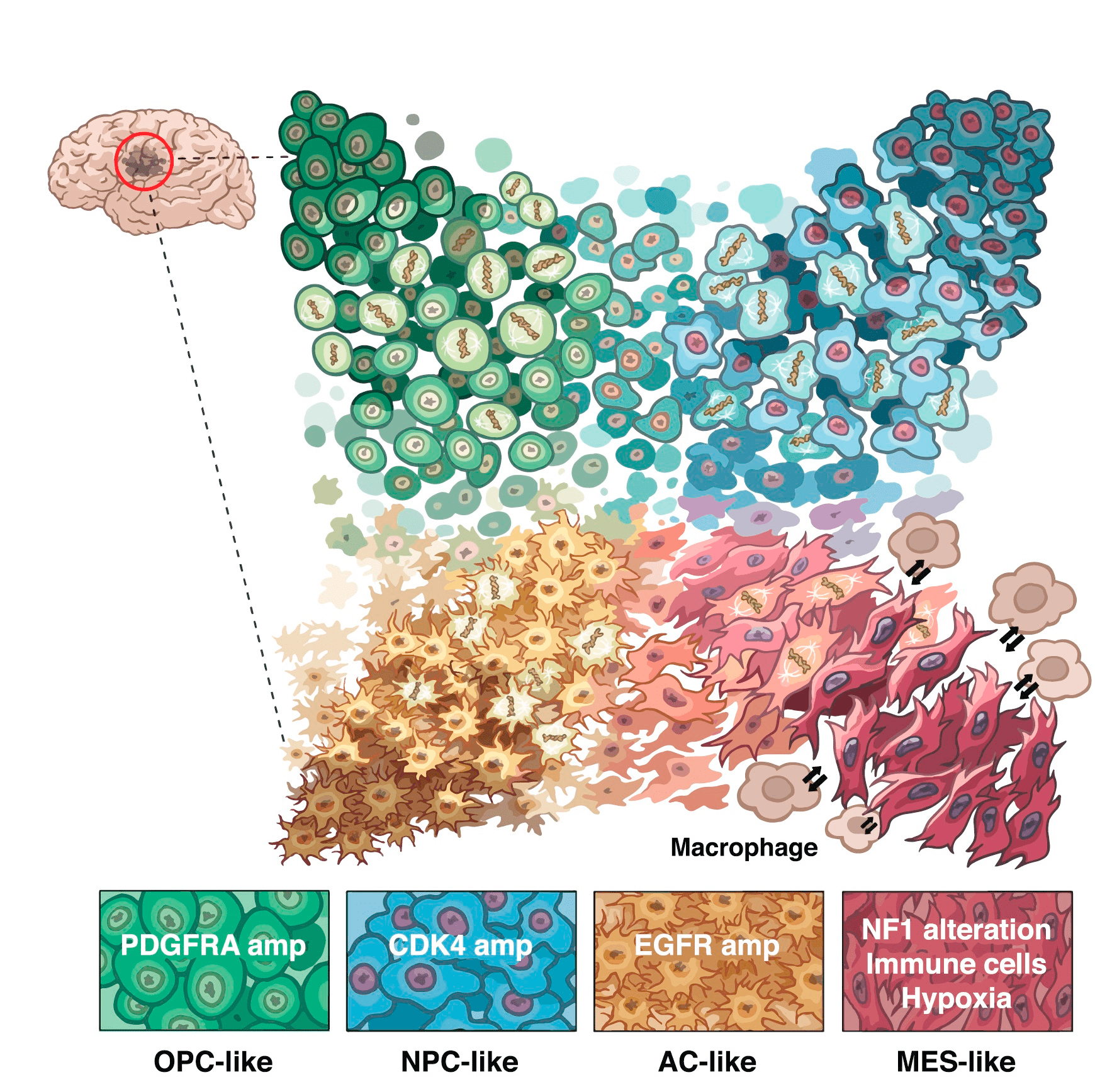
Рисунок 2. Клеточные фенотипы глиобластомы. Четыре фенотипа отличаются модификациями генома, уровнем экспрессии определенных генов и занимают свои ниши в системе опухоли. Модель клеточной гетерогенности показывает, что OPC-, NPC, AC- и MES-подобные фенотипы обладают уникальными маркерами экспрессии и способны переходить друг в друга. Выраженность фенотипа показана на рисунке его расстоянием от центра.
Как мы увидим позже, эти клеточные фенотипы, отличающиеся уникальными мутациями, профилем экспрессии белков и морфологией, не только внешне схожи со своими «здоровыми» собратьями, но и выполняют примерно те же функции, но уже не в нервной ткани, а в ткани опухоли. Можно сказать, что глиобластома «знает» слабые места мозга благодаря своему стволовому «прошлому».
Искусный манипулятор
Глиобластома практически непобедима. В ее пользу играет расположение, ее оплотом служит головной мозг, защищенный черепом от механических воздействий и гематоэнцефалическим барьером от действия ядов (а также лекарственных препаратов). Но все же самым опасным «приспособлением» этого рака является его способность манипулировать клетками хозяина при помощи широкого спектра сигнальных веществ, выделяемых различными клеточными фенотипами опухоли. Несмотря на то, что на такие манипуляции способны в той или иной степени все виды рака, глиобластома на этом поприще идет дальше всех, посягая на святая святых организма — нервную систему. Однако процессы, не затрагивающие напрямую нейроны, также чрезвычайно важны и интересны. С них мы начнем разбирать нелегкий путь опухоли к вершинам паразитизма.
Глиобластома изменяет ток крови и переманивает иммунные клетки
Первым ресурсом, в котором нуждается любая живая ткань, является артериальная кровь, богатая кислородом и питательными веществами. Агрессивные опухоли, и глиобластома в том числе, способны «заставить» организм снабжать себя кровью, подчиняя себе рост сосудов в результате процесса, называемого васкуляризацией. Разрастаясь, опухоль начинает испытывать гипоксию, в ответ на что она выделяет ангиогенные (стимулирующие рост сосудов) факторы, такие как VEGF (фактор роста эндотелия), PDGF (тромбоцитарный фактор роста) и IL-8 (интерлейкин 8). Этот процесс запускает васкулярную пролиферацию — образование клубочков капилляров (гломерул) в районе опухоли, за счет которых та «крадет» артериальную кровь у нервной ткани [2].
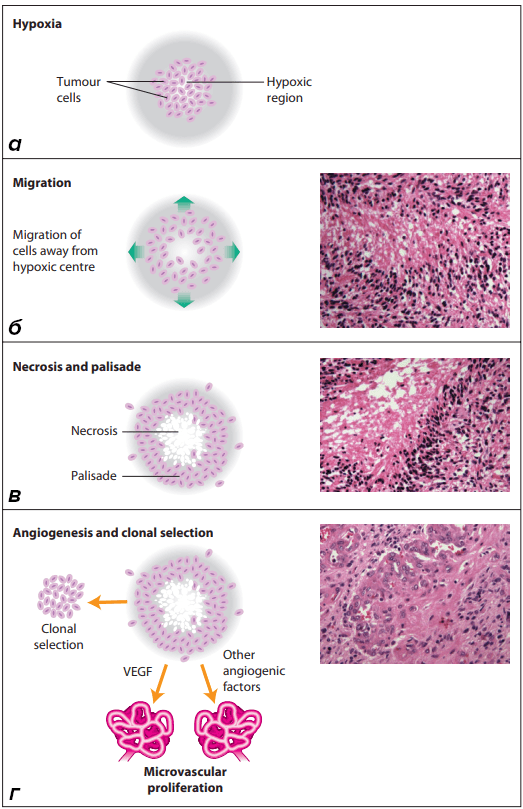
Рисунок 3. Развитие васкулярной пролиферации. По мере роста опухоли центральная часть начинает испытывать гипоксию (а), что запускает миграцию клеток (б) и образование центральной некротической области и палисада (каймы из живых раковых клеток) по периферии (в). Клетки палисада выделяют VEGF и другие ангиогенные факторы, вызывающие формирование гломерул (г).
Кроме обеспечения себя питанием и кислородом глиобластома нуждается в безопасных условиях существования, чего она не сможет добиться, пока защитные системы организма будут продолжать атаковать ее, убивая раковые клетки и тормозя развитие опухоли. В норме при появлении неопластических клеток система «иммунного надзора» (immune surveillance) отслеживает и уничтожает их, подавляя новообразование в зачатке. Клетки системы иммунного надзора, такие как естественные киллеры, NK T-лимфоциты и CD8+ клетки, распознают специфические антигены опухолей (TSA, tumor-specific antigens) и другие злокачественные маркеры на поверхности молодых опухолевых клеток, и убивают их или подавляют их деление. Если раковые клетки делятся достаточно быстро, они какое-то время могут сопротивляться уничтожению, и борьба переходит в так называемую стадию равновесия (equilibrium). В стадию равновесия, которая является самой долгой из трех, в результате естественного отбора опухолевых клонов выживают клетки, способные активно противостоять иммунной системе. Эти раковые клетки избегают иммунного ответа благодаря пониженной экспрессии антигенов опухолей, выделению молекул, нарушающих работу анти-опухолевых Т-клеток, а также привлечению иммуносупрессорных клеток (Treg-лимфоциты, опухолевые макрофаги, MDSC и ингибирующие дендритные клетки). Последние позволяют опухоли избежать иммунного ответа путем выделения хемокинов, подавляющих активацию противоопухолевых лимфоцитов. Итогом является стадия бегства (escape), когда в результате давления со стороны иммунной системы появляются раковые клетки, способные напрямую или косвенно подавлять иммунный ответ [5], [6].
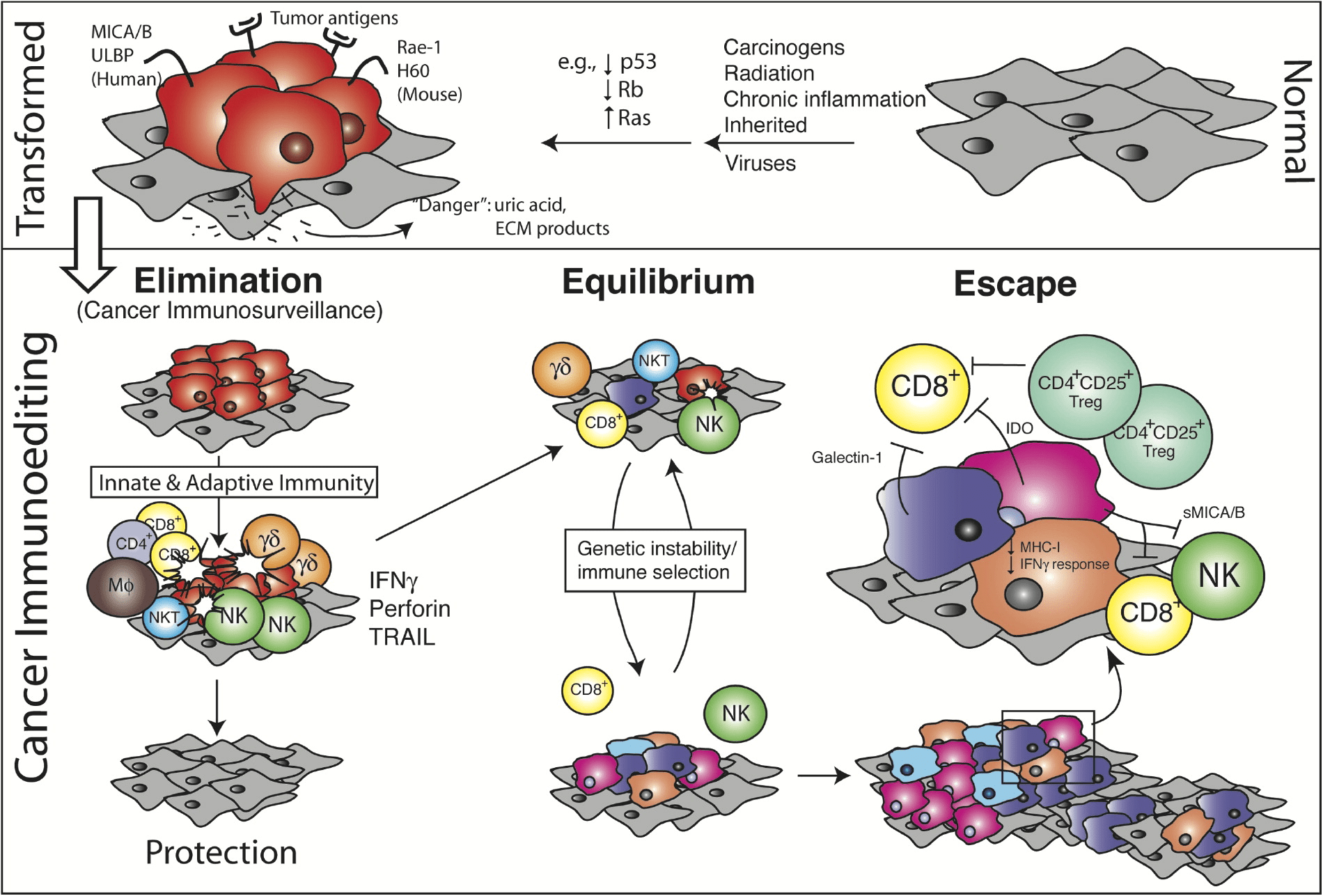
Рисунок 4. Борьба иммунной системы с опухолью. На схеме изображены три стадии взаимодействия: уничтожение (elimination), равновесие (equilibrium) и бегство (escape). В течение стадии равновесия происходит отбор опухолевых клонов, способных противостоять давлению иммунной системы. В результате происходит приобретение опухолью иммуносупрессорных свойств (подавление активности антиопухолевых агентов иммунной системы раковыми клетками напрямую и с помощью «завербованных» клеток).
Онкологи полагают, что перенаправлением кровяного русла и иммунной защитой опухолевой ткани «занимается» клеточный фенотип MES (mesenchymal, мезенхимальный). В составе клеток опухоли этого фенотипа обнаруживаются миелоидные (иммунные) клетки, а также перициты сосудов. Последнее очень интересно, так как перициты входят в систему гематоэнцефалического барьера, который на пути в мозг проходят антигены и лекарственные препараты. Выходит, что глиобластома обзаводится не только личной иммунной «охраной», но и внедряет своих агентов в ГЭБ — главный «КПП» мозга [7].
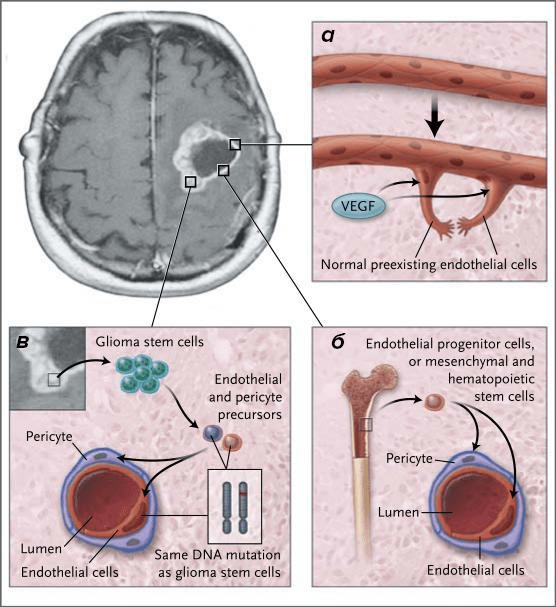
Рисунок 5. Модификация сосудов мозга глиобластомой. На схеме изображены механизмы васкуляризации глиобластомы. а — выделяющийся при гипоксии фактор роста эндотелия (VEGF) стимулирует формирование новых капилляров из существующих эндотелиальных клеток. б — выделяемые опухолью ангиогенные факторы мобилизуют из кровотока стволовые клетки костного мозга, участвующие в построении сосудов. в — глиобластома способна самостоятельно строить новые капилляры, при этом эндотелиоциты и перициты дифференцируются из клеток опухоли. В последнем случае в клетках капилляров микроокружения опухоли обнаруживаются генетические маркеры глиобластомы.
Рука товарища — клетки глиомы объединены в сеть мембранными трубками
Описанные выше процессы безусловно важны для выживания опухоли, хоть и не уникальны для нее. Одно из ключевых приспособлений, отличающее агрессивные глиомы — особый тип клеток, способных объединяться в единую сеть с помощью тонких выростов, получивших название опухолевых мембранных трубок (в англоязычной литературе — tumour microtubes, «опухолевые микротрубки»). Объединенные мембранными трубками клетки — локомотив инвазии и функциональная основа устойчивости опухоли. Эти выросты имеют сходство с отростками нейронов и являются, по сути, их гомологами.
Мембранные трубки опухолевых клеток напоминают зачатки аксонов и регулируются тем же геном, а именно GAP-43, экспрессия которого аномально повышена в клетках раковой сети. Отростки раковых клеток подобно аксонам имеют конус роста, который нащупывает дорогу в дебрях нервной ткани, направляя фронт инвазии и помогая раковым клеткам объединяться в сеть.
Если выжечь тонким лазерным пучком ядро отдельной клетки опухоли, к ней протянется рука помощи — «товарищеская» мембранная трубка, по которой от соседней раковой клетки в поврежденную придет новое ядро. Этот простой эксперимент показывает буквально нечеловеческую способность глиобластомы к регенерации. Более того, подобно предшественникам нервной ткани, радиальным глиоцитам, вытягивающим свои отростки-тракты для миграции по ним будущих нейронов, раковые клетки способны запускать трубки глубоко в толщу мозга, прокладывая магистрали инвазии опухоли.
Эффективная регенерация и диффузное проникновение в нервную ткань позволяет опухоли восстанавливаться после хирургического удаления 99% ее массы, однако мембранные трубки играют еще одну, не менее важную роль в выживании глиобластомы.
Интеграция в единую сеть открывает клеткам возможность коммуницировать и реагировать на изменения микроокружения слаженно. Похожий принцип используют астроциты — глиальные клетки, выполняющие структурную функцию, поддерживающие гомеостаз нервной ткани и регулирующие работу синапсов.
Если сравнить наш мозг с офисным зданием крупной фирмы, то астроцитами будут как перегородки между залами этого здания и мебель, так и обслуживающий персонал. Эти клетки создают оптимальное «рабочее пространство» для нейронов, снабжая их питанием, ограждая от ядов, поддерживая архитектуру мозга. Также астроциты следят за состоянием синапсов и их работой, контролируют образование контактов, работу медиаторов и активность нейронов. Для нормального выполнения этих задач глиальным клеткам необходимо эффективно общаться между собой, для чего служит кальциевая сигнализация в их обширной сети, объединенной щелевыми контактами — нексусами.
Выяснилось, что мембранные трубки астроцитом, к которым относится глиобластома, соединяются щелевыми контактами, образованными тем же типом коннексинов (Сх43), что и астроцитарные.
Как вы могли догадаться, кальциевая сигнализация в сетях глиом тоже есть. При радиотерапии в отдельных раковых клетках происходит повышение концентрации ионов Са2+, которое пускает под откос сигнальные программы клетки и вызывает апоптоз (программированную клеточную гибель). Такое драматическое изменение количества кальция в цитоплазме было бы фатально для одиночной раковой клетки, однако если клетки соединены нексусами, кальций сможет перераспределиться по всей сети, не достигая критических концентраций. Такая «амортизация» — еще один залог стойкости глиобластомы. Феномен тока и перераспределения кальция по опухолевой сети получил название кальциевых волн [8].
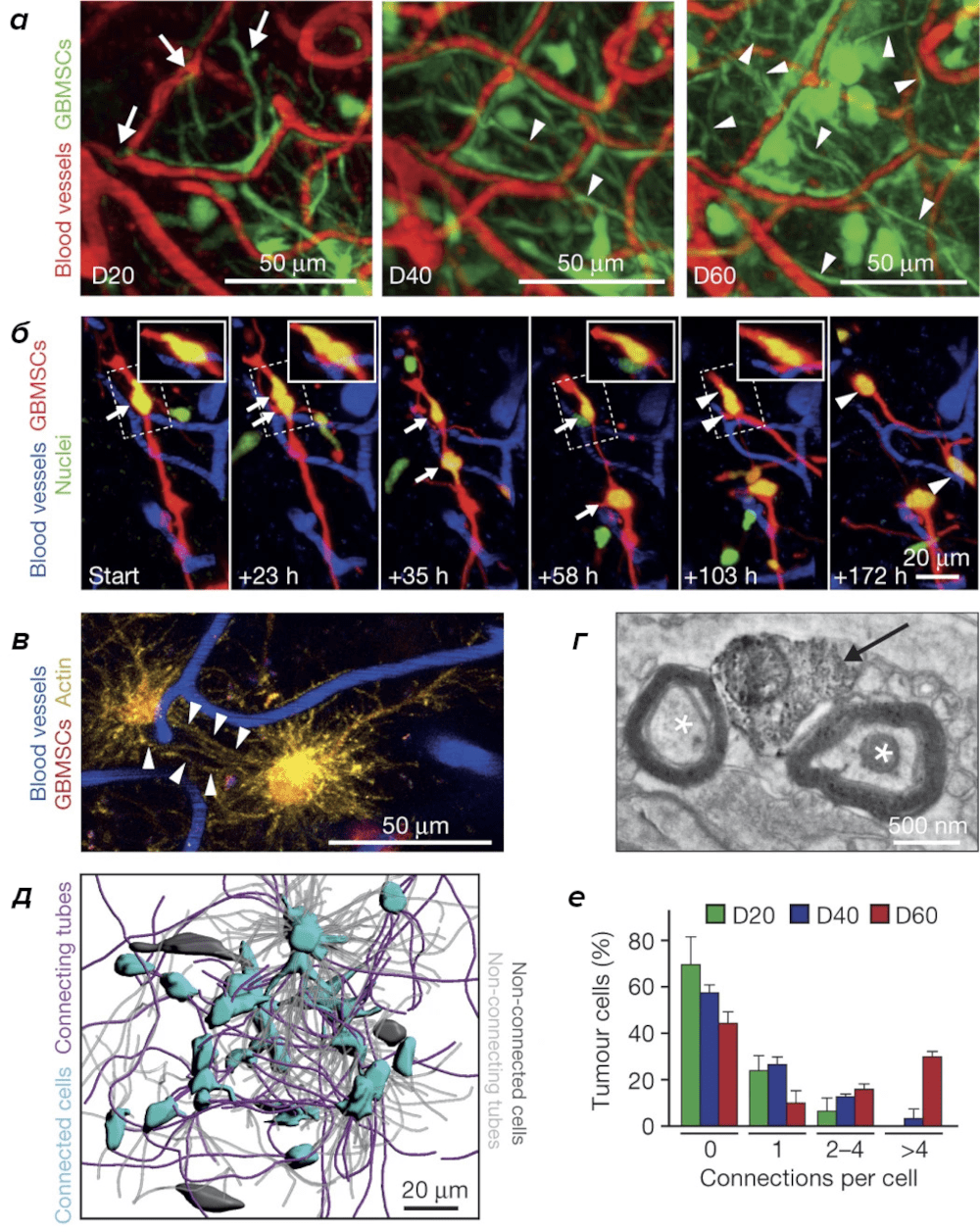
Рисунок 6. Объединение раковых клеток мембранными трубками. Трансплантированные в мозг мышей раковые клетки быстро делятся и объединяются в сеть мембранными трубками.
а — раковые клетки на 20-е, 40-е и 60-е сутки после трансплантации, видно увеличение числа трубок (зеленый цвет).
б — миграция ядер (желтый цвет) по трубкам (красный цвет).
в — мембранные трубки богаты актином (желтый цвет).
г — электронная микрофотография мембранной трубки (стрелка), лежащей рядом с двумя аксонами (отмечены звездой).
д — сеть глиобластомы (связанные клетки — лазурный цвет, соединяющие трубки — фиолетовый).
е — опухолевая сеть формируется за короткий промежуток времени (по вертикали — процент объединенных клеток, по горизонтали — число связей на одну клетку).
Святая святых — опухоль паразитирует на активности нейронов
Как уже упоминалось, для нейрона работать — значит жить, а работа у нейронов — коммуницировать друг с другом через синапсы и обрабатывать информацию. Это поприще требует постоянной помощи глиальных клеток, чутко «прослушивающих» и тонко контролирующих активность нейронов. Интенсивно работающие синапсы, сигналы в виде факторов роста и деполяризация запускают программы выживания в нервной клетке, а также сигнализируют глии о том, что необходимо запускать процессы построения новых миелиновых оболочек и других структур. В процессе онтогенеза все эти сигналы также важны для молодых клеток мозга и их предшественников — дифференцирующихся стволовых клеток нервной ткани. Способность раковых клеток «слышать» и распознавать эти сигналы не приобретается ими заново. Выходцы из стволовых клеток, глиомы сохраняют необходимые рецепторы и регуляторные каскады своих предшественников: ОРС и NPC, что позволяет им «использовать» пластичность и работу нервной ткани, но отнюдь не для помощи нейронам. Активность захваченной части мозга положительно влияет на рост опухоли, делает ее более устойчивой к терапии и ускоряет ее внедрение в ткань мозга. Более того, раковые клетки способны заставить нейроны на оккупированной территории работать интенсивнее и сильнее стимулировать развитие опухоли.
Гуморальные маркеры активности — глиома вслушивается в переговоры клеток мозга
Злокачественные глиомы могут возникать в любом возрасте, причем у детей чаще встречаются поражения ствола мозга, в подростковом возрасте и у молодых людей опухоли появляются в коре больших полушарий, а у старшей части больных по большей части в лобно-височной области коры. Может ли это значить, что части мозга, где усиленно развиваются нервные сети, более предрасположены к раку?
Активная зона мозга, в которой модифицируются нейронные связи, образуются и разбираются синапсы подобна большой стройке. Поставляются необходимые материалы (усиливается кровоток), суетятся рабочие (глия и нейроны обмениваются сигналами), на месте работ остаются на какое-то время леса и мешки с цементом (структурные молекулы синапсов, также играющие роль сигнальных). Такие изменения микроокружения не остаются незамеченными клетками, в том числе стволовыми. К примеру, в области, где повышена пластичность, необходимо строить миелиновые оболочки, что запускает пролиферацию ОРС (клеток-предшественников олигодендроцитов).
Там, где клетки активно делятся, всегда есть риск злокачественной трансформации, а если в мозгу уже есть глиома, она чутко вслушивается в гомон переговоров в ожидании сигналов активности.
Один из таких гуморальных сигналов — мембранный синаптический белок нейролигин-3 (NLGN3). Нейролигины и их партнеры — β-нейрексины участвуют в формировании синапсов, соединяя пресинаптическую (на которой сидят β-нейрексины) и постсинаптическую (на которой ожидают контакта нейролигины) мембраны. Эти белки определяют структуру синапса, обеспечивают правильное расположение рецепторов нейромедиатора. При этом рецепторы выстраиваются на постсинаптической мембране четко напротив мест выброса нейромедиатора на пресинапсе. В зоне повышенной активности нейролигин-3 секретируется во внеклеточное пространство и запускает сигнальные каскады в клетках окружения, регулируя их участие в «стройке».
Однако помимо полезных работников сигнал доходит и до клеток глиомы, в которых запускается сигнальный путь PI3K-mTOR, который ингибирует апоптоз и стимулирует деление раковых клеток и рост опухоли. Нормальные стволовые клетки, для которых предназначен этот сигнальный путь при запуске PI3K-mTOR делятся хоть и быстро, но недолго, предоставляя ограниченное число новых клеток глии. В клетках же глиобластомы PI3K-mTOR «зацикливается»: он повышает экспрессию нейролигина-3, который снова действует на раковые клетки, вызывая бурное и бесконтрольное их деление.
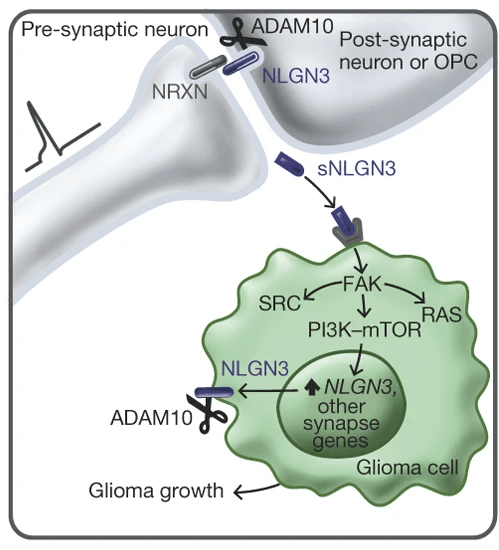
Рисунок 7. Нейролигин-3 заставляет клетки глиобластомы делиться активнее. На рисунке изображен синапс, в котором работает комплекс нейролигина-3 (NLGN) и нейрексина (NRXN). Внешний домен нейролигина-3 выделяется в межклеточную жидкость при перестройках синапсов и запускает сигнальный путь PI3K-mTOR в раковых клетках, что заставляет их активнее делиться и повышает в них экспрессию гена нейролигина-3.
Существуют и другие вещества, которые позволяют раковым клеткам детектировать повышение активности в мозгу. К примеру BDNF, трофический фактор, регулирующий выживание нервных клеток и формирование отростков, выделяясь в активных нервных окончаниях, также побуждает раковые клетки к делению. Помимо специфических сигнальных молекул агрессивность опухоли может повышать глутамат, главный возбуждающий нейромедиатор мозга, внеклеточная концентрация которого повышается при усиленной работе нейронов [9].
Глиома не дремлет, пассивно ожидая сигналов активности окружающей ее нервной ткани, готовая ответить пролиферацией и инвазией. Она способна самостостоятельно повышать возбудимость нейронов, выделяя сигнальные вещества.
Раковые клетки отличаются повышенной экспрессией гена SLC7A11, кодирующего цистин-глутаматный обменник (SXC), белок, транспортирующий в клетку глии аминокислоту цистин в обмен на выброс в межклеточную жидкость молекулы глутамата. Глутамат, являясь основным возбуждающим нейромедиатором мозга, повышает активность близлежащих синапсов [10].
В работе мозга важную роль играет равновесие, при котором возбуждение и торможение находятся в балансе. Множественные регуляторные процессы нервной ткани не допускают смещения этого равновесия в любую из сторон. Глиома, как выяснилось, подрывает баланс с обеих полюсов. Помимо подстегивания возбуждения нейронов глутаматом опухоль подавляет ингибиторную активность, уменьшая число тормозных нейронов по соседству с собой и мешая им работать. Считается, что обильно выделяемый раковыми клетками глутамат вызывает гибель ГАМК-ергических тормозных нейронов микроокружения опухоли и повышает общую возбудимость. Вторым механизмом снятия торможения является нарушение экспрессии калий-хлорного обменника КСС2 в нейронах, из-за чего их становится сложнее ингибировать. В конечном итоге в области инфильтрации создается повышенный фон возбудимости, что благоприятно влияет на опухоль и, в частности, служит причиной таких симптомов, как эпилепсия [11].
Двойники — роли NPC, ОРС и АС-подобных клеточных фенотипов
Ограничивается ли глиома химическими сигналами активности? Безусловно, сигнальные вещества играют важную роль в работе нервных сетей и передаче информации, но все же главным каналом коммуникации, центральным игроком нервной деятельности является синапс. Способна ли опухоль идти на прямой синаптический контакт с нейронами? Ответ скрыт в ее безгрешном прошлом.
Клетки-предшественники нервной ткани, такие как нейральные стволовые клетки, в процессе эмбриогенеза путешествуют по развивающемуся мозгу, ориентируясь по химическим сигналам: растворенным в межклеточной жидкости молекулам, белкам матрикса и мембран клеток. Кроме того, на своем пути они останавливаются и переговариваются со встречными клетками, формируя короткоживущие глутаматные синапсы. Клетки-предшественники олигодендроцитов, которые активизируются при необходимости миелинизировать новые волокна при повреждении нервной ткани или ее перестройке, также получают глутаматные синаптические входы от нейронов. Они являются единственными не-нейрональными клетками зрелого мозга, способными к формированию синапсов. Наконец, астроциты, клетки-няньки мозга, хоть и лишены такой способности, все же электроактивны и отвечают на интенсивную работу соседних нейронов медленным изменением мембранного потенциала за счет калиевых токов.
Вернемся к глиобластоме. Как вы могли заметить, у всех упомянутых типов клеток, способных к электрической активности, есть двойники в составе опухоли. NPC-подобные, OPC-подобные, астроцит-подобные раковые клетки, за которыми проследили ученые, регистрируя их потенциалы, не отличаются по способностям от своих нормальных прототипов и могут обеспечивать подключение глиомы к нейросетям мозга.
Налаживая связи — как глиома перехватывает активность
Гены, регулирующие формирование синапсов, а также гены, направляющие отростки, структурные гены синаптических контактов эффективно функционируют в клетках глиомы. Сеть раковых клеток, объединенных мембранными трубками, отвечает на стимуляцию прилежащей нервной ткани понижением мембранного потенциала (но не генерацией потенциала действия). Все это позволяет предположить существование синаптических контактов раковых клеток с нейронами, что было доказано недавно.
Флуоресцентная и электронная микроскопия позволяет увидеть нейроглиомальные глутаматные синапсы, в которых мембрана опухолевых трубок играет роль постсинаптической. В формировании такого контакта «инициатива» может исходить как от нейрона, когда его окончание «приземляется» на отросток или тело раковой клетки, так и от нее самой, когда мембранная трубка подходит к уже существующему синапсу «нейрон-нейрон» и встраивается в него [12].
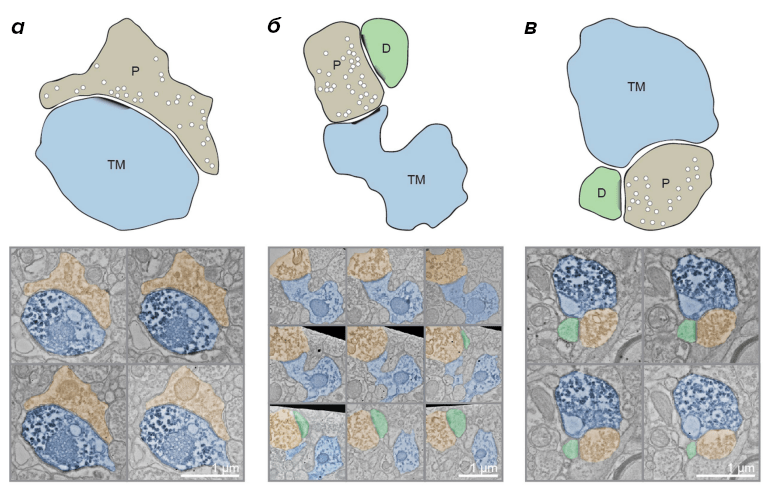
Рисунок 8. Виды нейроглиомальных контактов. Верхний ряд — схематическое изображение, нижний ряд — электронные микрофотографии контактов. а — пресинаптическое окончание (Р) контактирует с трубкой (tumor microtube, ТМ). б — мембранная трубка встраивается в существующий синапс (D — дендрит). в — трубка подходит к существующему синапсу без образования истинного.
В классических глутаматных синапсах глии передача сигнала осуществляется через AMPAR (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor), ионотропные рецепторы глутамата, пропускающие в клетку ионы натрия и выпускающие ионы калия. Глиома тоже использует AMPAR, способный, однако, дополнительно пропускать в клетку ионы кальция. Это отличие глиомальных рецепторов обусловлено нарушением работы регуляторной субъединицы канала GluA2. В норме GluA2 делает прохождение ионов кальция через канал невозможным, однако в глиомальных AMPA-рецепторах GluA2 отсутствует, либо в мРНК субъединицы не происходит конвертации аденозина в инозин. Эти нарушения играют роль в появлении пресловутых кальциевых волн, распространяющихся вместе с деполяризацией мембраны по сети опухолевых клеток и стимулирующих их деление, рост трубок и захват новых областей мозга. При работе «захваченных» глиомой участков та в ответ генерирует быстрые возбуждающие постсинаптические потенциалы (EPSC, excitatory postsynaptic potential) и медленные входящие токи (SIC, slow inward current). Первые — результат открытия каналов AMPAR, а вторые — пассивного тока ионов калия в клетку. Как уже упоминалось, медленные входящие токи обнаруживаются в нормальных астроцитах и, судя по всему, служат им для сетевой регуляции активности синапсов [13].
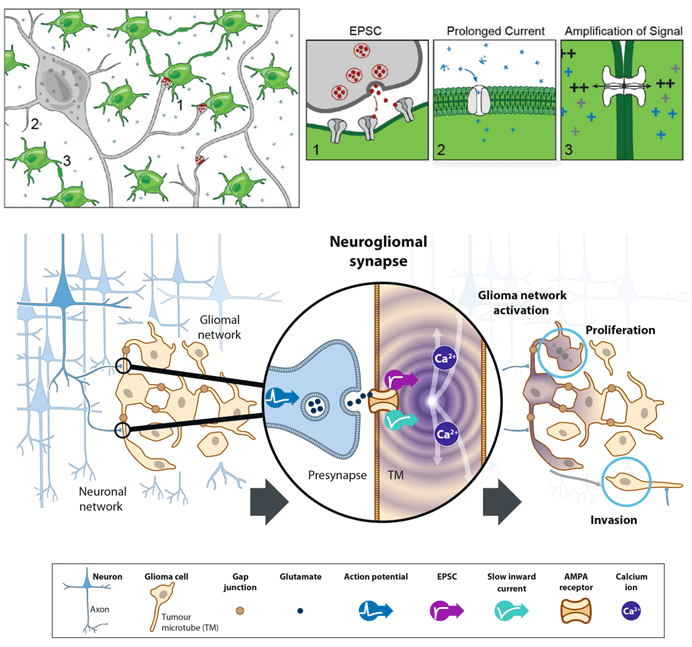
Рисунок 9. Глиобластома электроактивна. Верхняя панель — глиобластома получает электрические сигналы от нейронов в виде быстрых (EPSC) и медленных (SIC) входящих токов. Нижняя панель — деполяризация и кальциевый сигнал распространяются по сети раковых клеток, стимулируя их деление и рост опухоли.
Синаптогенные клетки: начало обратного отсчета
Объединение в сеть, способность формировать синапсы с нейронами и влиять на их активность — триада успеха глиобластомы. Обладая такими инструментами опухоль не оставляет выбора организму, он оказывается в замкнутом круге, вынужденный повышать активность нейронов и стимулировать рост опухоли, пока та не приведет к фатальному разрушению ткани мозга. Козырь в рукаве неизлечимого рака — синаптогенные клетки (HFC, high functional connectivity). Так обозначается опухолевый фенотип, способный, в отличие от несинаптогенных (LFC, low functional connectivity) к активному паразитизму на активности с использованием всех трех механизмов одновременно.
Функционально объединенные клетки были описаны в этом году нейроонкологом Калифорнийского университета Саритой Кришной с соавторами. Эксперименты с культурами раковых клеток, ксенотрансплантатами (пересаженными в мышиный мозг участками человеческой опухоли) и пациентами раскрыли ключевое значение синаптогенных клеток опухоли в патогенезе глиобластомы.
При совместном культивировании синаптогенных и несинаптогенных раковых клеток с нейронами гиппокампа мыши пролиферация синаптогенных клеток повышалась в пять раз по сравнению с контрольной группой (культурой без нейронов). В культурах клеток, неспособных формировать синапсы такого изменения не наблюдалось. Именно синаптогенные раковые клетки позволяют выстраивать сети, используя мембранные трубки, формировать синаптические контакты и перепрошивать целые отделы мозга, изменяя их работу и нарушая такие процессы, как мышление. Помимо этого группой ученых под руководством Кришны было показано, что появление синаптогенных клеток глиобластомы почти вдвое снижало выживаемость пациента.
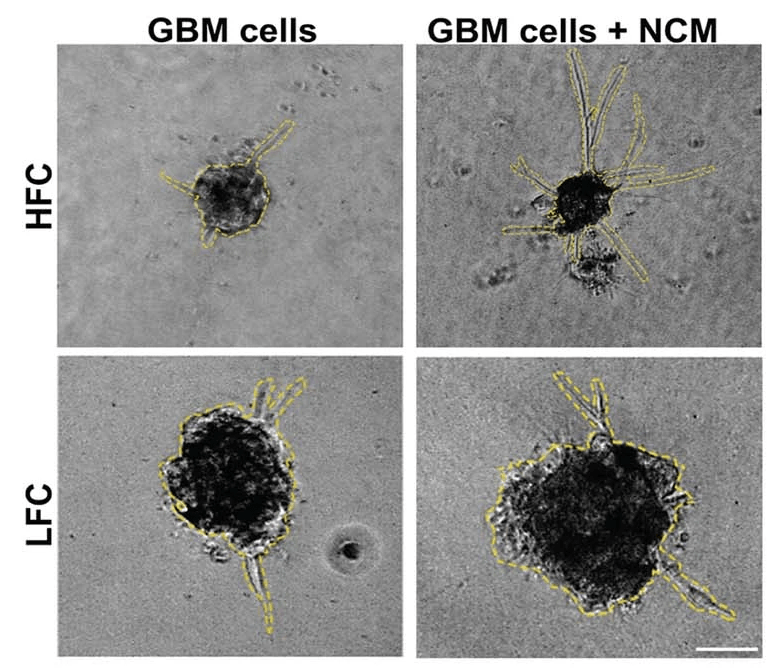
Рисунок 10. HFC обладают высоким инвазивным потенциалом. На изображении показаны раковые сфероиды (особый вид культуры) синаптогенных (HFC) и несинаптогенных (LFC) раковых клеток, выращенные без добавления (GBM cells) и с добавлением нейрональных сигнальных веществ (GBM cells + NCM, супернатант нейронов гиппокампа мыши). На верхней правой панели видно, что синаптогенные клетки формируют более многочисленные и длинные трубки, чем несинаптогенные.
Одним из главных приспособлений синаптогенных раковых клеток является тромбоспондин-1 (THBS1), в норме — адгезионный белок астроцитов и нейральных стволовых клеток, регулирующий синаптогенез и миграцию молодых нервных клеток. Семикратно превышающая норму экспрессия гена THBS1 наделяет синаптогенные клетки способностью формировать мембранные трубки [14], объединяться в сети и образовывать синапсы с нейронами. Помимо синаптогенных клеток опухоли тромбоспондин-1 выделяется астроцитами и иммунными клетками, что усиливает влияние глиобластомы на пластичность захваченного участка нервной ткани. Уже упоминавшийся синаптический белок нейролигин-3, повышающий пролиферацию опухоли в ответ на активность нейронов, как оказалось, работает параллельно с тромбоспондином, увеличивая плотность нейроглиомальных синапсов [15].
Связь опухоль — мозг
Глиобластома чаще встречается у пожилых людей, и поражает конечный мозг, что логично, ведь в этом возрасте именно там интенсивнее всего идет перестройка нейронных связей, неизбежно влекущая за собой активное деление клеток и риск раковой трансформации. Двусторонняя связь, в которой мозг стимулирует рост опухоли, а та перестраивает связи нейронов и нарушает его работу, проявляется в виде эпилепсии и нарушений высшей нервной деятельности. Рассмотрим два этих феномена.
Эпилепсия и нарушение высших функций мозга
Опухоль берет на себя контроль над пластичностью нервной ткани в области поражения, повышая активность нейронов и встраиваясь в их сети. В нервной ткани появляется структура, участвующая в активности, подпитывающаяся от нее, проводящая электрические сигналы, что явно должно негативно влиять на работу мозга. Самое заметное проявление этого влияния — эпилепсия. Представьте себе тонко настроенную систему сопряженных нейронных систем мозга, множественные уровни регуляции которой не позволяют ей выйти из-под контроля. Активация и торможение этой системы находятся в динамическом равновесии, которое может смещаться при необходимости, но тем не менее никогда не нарушается. Электроактивная, способная к ритмической пульсации система глиомы подобна неконтролируемому маятнику, встроенному в сложный механизм мозга. Получая толчок от захваченных нейросетей этот маятник начинает колебаться, приводя всю систему в резонанс, что проявляется синхронной ритмической активацией нейронов обширных областей мозга, то есть, судорожным припадком.
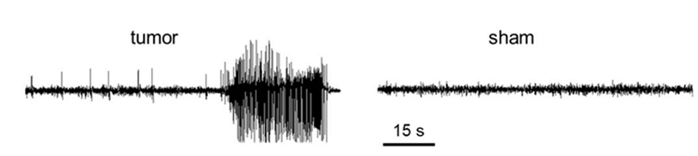
Рисунок 11. Эпилепсия — частый симптом глиобластомы. Записи электроэнцефалограммы мыши с трансплантированной тканью глиобластомы человека (tumor) и ложнооперированного животного (sham).
Нарушение когнитивных функций при глиобластоме сложнее заметить, однако это проявление патологических процессов не менее значимо. Поражение коры больших полушарий влечет изменение функций центров высшей нервной деятельности, таких как восприятие, мышление, управление движением. В своем исследовании Кришна и ее коллеги демонстрируют, насколько сильно опухоль перестраивает связи коры больших полушарий и как она она «ведет себя» при работе пораженной части мозга.
Часть экспериментов проводилась с использованием метода электрокортикографии, при котором пластина с электродами размещалась на поверхности мозга для регистрации электрических сигналов, возникающих при работе нейронов пораженной области [16]. Испытуемым предлагалось назвать объект, который им показывали или описывали устно, в то время как регистрировалась активность латеральной префронтальной коры больших полушарий. У пациентов с пораженной латеральной префронтальной корой, как и ожидалось, была повышена общая возбудимость этой зоны. Также было замечено, что «химера» мозг-опухоль дает физиологически организованный ответ на возбуждение. Оказалось, что опухоль не создает бессмысленный «шум», а включается в активность и эхом повторяет электрические вспышки сетей пораженного участка мозга. Более того, было обнаружено, что другие зоны мозга, к которым «подключена» сеть глиобластомы, которые в норме не участвуют в планировании речи, активизируются синхронно с латеральной префронтальной корой.
Тем не менее при всей организованности сопряжения опухоль-мозг, глиобластома — лишь паразит, не участвующий в работе коры. Поэтому при инфильтрации опухолью область не функционирует полностью эффективно. Это стало заметно при выполнении сложных задач, то есть произнесении редко встречающихся слов: пораженная латеральная префронтальная кора оказалась не способна отличать простые артикуляционные конструкции от сложных, требующих тонкой регуляции мышц речевого аппарата.
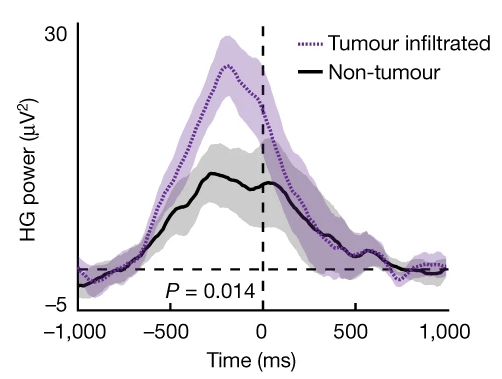
Рисунок 12. Электрическая активность участка мозга, пораженного глиобластомой. Возбудимость пораженной латеральной префронтальной коры (LPFC, lateral prefrontal cortex, пунктирная линия) значительно выше, чем у здоровой (сплошная линия). На графике видно, что активность повышается именно в момент выполнения задачи. По вертикали отложена интенсивность гамма-волн, по горизонтали — время (ноль — момент начала говорения).
Электрическая активность пораженной зоны мозга сокращает срок жизни людей с глиобластомой
Не менее интересна обратная сторона взаимодействия мозга и глиомы, а именно влияние активности коры на опухоль. Очевидно, что нейропластичность и электрическое возбуждение нейронов должно оказывать влияние на «самочувствие» глиобластомы. Но что конкретно происходит в захваченной раком коре? Зная стратегию выживания глиобластомы, ее тесную связь с работой мозга, можно прийти к поразительному заключению: активность нейронов коры больших полушарий, в частности процессы мышления, стимулируют рост и повышают устойчивость глиобластомы к терапии. Другими словами, людям с глиобластомой буквально опасно думать. В опубликованной этой весной статье Кришны и коллег приведено экспериментальное доказательство этого феномена.
Исследования с участием пациентов с диагностированной глиобластомой, результаты которых были опубликованы в мае этого года, показали, что высокая степень синаптической интеграции опухоли изменяет коммуникацию нейросетей коры, нарушает их работу и понижает выживаемость пациентов. В исследуемой группе участники, у которых в мозгу были обнаружены синаптогенные раковые клетки, позволяющие опухоли максимально эффективно «питаться» активностью, жили в среднем в два раза меньше остальных при прочих равных условиях.
Такие результаты несложно объяснить, ведь кора больших полушарий ничем не отличается от любой другой части мозга, где может возникнуть опухоль — синаптогенные клетки не брезгуют паразитизмом на высшей нервной деятельности, подчиняя себе структуру нервной ткани и заставляя ее работать на себя [15]. Тем не менее, виртуозность, с которой функционирует опухоль и такой необычный механизм выживания не могут не поражать.
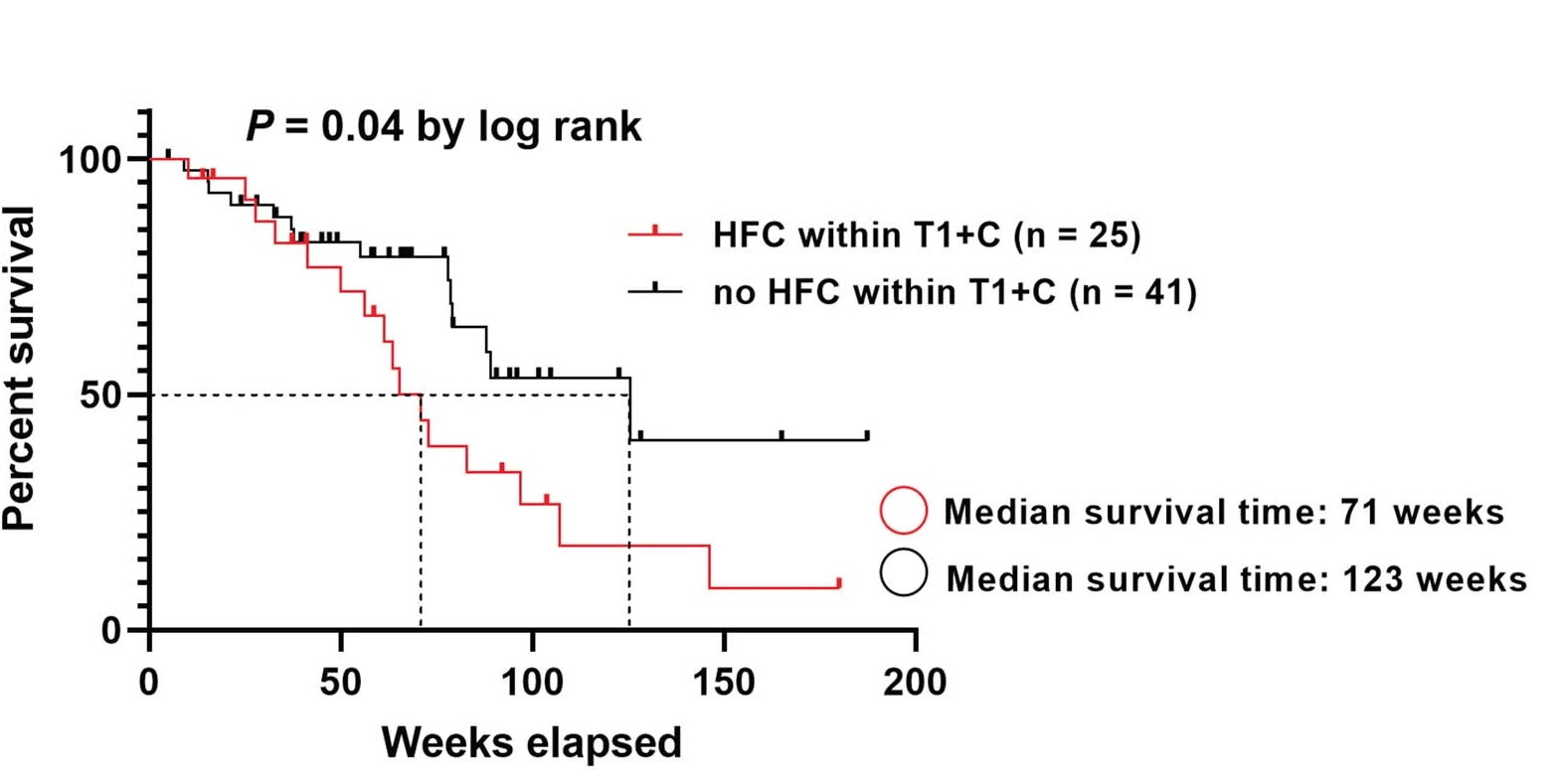
Рисунок 13. Наличие синаптогенных клеток снижает выживаемость пациентов почти вдвое. На графике представлена кривая выживаемости пациентов после диагноза. По вертикали отложен процент выживших участников, по горизонтали — время (недели). Красная кривая — пациенты, имевшие синаптогенные клетки в составе опухоли, черная кривая — пациенты без синаптогенных клеток.
Заключение
Изучение патологий часто лежит в основе фундаментальных знаний о физиологии организма. Причем в центре любой, даже самой сложной патологии лежит нарушение работы клетки. Мы, как многоклеточные организмы, своим существованием обязаны сложной системе межклеточных коммуникаций, без которой функционирование систем нашего сложного тела невозможно. Поэтому в изучении патологий ключевую роль играют знания о взаимодействии клеток, их взаимной модуляции, совместном функционировании. Онкология является важнейшим источником этих знаний, так как в развитии рака нарушение клеточной коммуникации играет центральную роль.
Среди многочисленных типов рака глиобластома вызывает особый интерес тем, что ее развитие происходит в головном мозге, где связи клеток определяют личность человека, его восприятие себя и мира. Именно эти связи опухоль способна использовать на благо себе, повышая устойчивость к терапии и агрессивность, внедряясь в толщу нервной ткани и захватывая все новые отделы мозга.
Строго говоря, раковую опухоль нельзя назвать паразитом. Это сравнение можно использовать только в переносном смысле, для того чтобы подчеркнуть ее «эгоизм» и неподчинение правилам организма, в котором она возникает. Однако тонкая игра этого не обладающего поведением не-существа и драматизм процессов, сценой для которых служит мозг, поражают воображение.
Изучение глиобластомы, безусловно, ценно как для фундаментального понимания физиологии мозга, так и для разработки эффективных способов борьбы с раком. Коммуникация раковых и здоровых клеток, приспособления, применяемые опухолью, ее происхождение могут оказаться ключом к разгадке тайн развития, функционирования и пластичности центральной нервной системы.
Литература
- Hans-Georg Wirsching, Evanthia Galanis, Michael Weller. (2016). Glioblastoma. Handbook of Clinical Neurology. 381-397;
- Raymond A. Sobel. (2015). Greenfield's Neuropathology, Ninth Edition: 2-Volume Set. J Neuropathol Exp Neurol. 74, 1185-1185;
- Xinyu Zhao, Darcie L. Moore. (2018). Neural stem cells: developmental mechanisms and disease modeling. Cell Tissue Res. 371, 1-6;
- Cyril Neftel, Julie Laffy, Mariella G. Filbin, Toshiro Hara, Marni E. Shore, et. al.. (2019). An Integrative Model of Cellular States, Plasticity, and Genetics for Glioblastoma. Cell. 178, 835-849.e21;
- Gavin P. Dunn, Lloyd J. Old, Robert D. Schreiber. (2004). The Immunobiology of Cancer Immunosurveillance and Immunoediting. Immunity. 21, 137-148;
- 10.3389/fimmu.2022.1003651. PMID: 36466873; PMCID: PMC9712217;
- Sunit Das, Philip A. Marsden. (2013). Angiogenesis in Glioblastoma. N Engl J Med. 369, 1561-1563;
- Matthias Osswald, Erik Jung, Felix Sahm, Gergely Solecki, Varun Venkataramani, et. al.. (2015). Brain tumour cells interconnect to a functional and resistant network. Nature. 528, 93-98;
- Humsa S. Venkatesh, Tessa B. Johung, Viola Caretti, Alyssa Noll, Yujie Tang, et. al.. (2015). Neuronal Activity Promotes Glioma Growth through Neuroligin-3 Secretion. Cell. 161, 803-816;
- Niyatee Samudra, Tresa Zacharias, Aaron Plitt, Bradley Lega, Edward Pan. (2019). Seizures in glioma patients: An overview of incidence, etiology, and therapies. Journal of the Neurological Sciences. 404, 80-85;
- Susan L. Campbell, Stefanie Robel, Vishnu A. Cuddapah, Stephanie Robert, Susan C. Buckingham, et. al.. (2015). GABAergic disinhibition and impaired KCC2 cotransporter activity underlie tumor-associated epilepsy. Glia. 63, 23-36;
- Humsa S. Venkatesh, Wade Morishita, Anna C. Geraghty, Dana Silverbush, Shawn M. Gillespie, et. al.. (2019). Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545;
- Varun Venkataramani, Dimitar Ivanov Tanev, Christopher Strahle, Alexander Studier-Fischer, Laura Fankhauser, et. al.. (2019). Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538;
- Justin V Joseph, Capucine R Magaut, Simon Storevik, Luiz H Geraldo, Thomas Mathivet, et. al.. (2022). TGF-β promotes microtube formation in glioblastoma through thrombospondin 1. Neuro-Oncology. 24, 541-553;
- Saritha Krishna, Abrar Choudhury, Michael B. Keough, Kyounghee Seo, Lijun Ni, et. al.. (2023). Glioblastoma remodelling of human neural circuits decreases survival. Nature. 617, 599-607;
- Электрокортикография. (2020). CMI Brain Research.







