Перезагрузка жизни: история Виктории Грей и генной терапии, победившей боль
16 февраля 2026
Перезагрузка жизни: история Виктории Грей и генной терапии, победившей боль
- 156
- 0
- 4
Схематичное изображение процесса активации фетального гемоглобина (HbF) с помощью Casgevy.
Рисунок в полном размере.
адаптировано из Genomics Education Programme
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Генная терапия Casgevy стала событием, которое еще недавно казалось научной фантастикой. Впервые технология CRISPR/Cas9 вышла за пределы лабораторий и доказала свою способность менять судьбы людей с тяжелыми наследственными заболеваниями. В центре статьи — история Виктории Грей, чья жизнь десятилетиями была подчинена боли, и научный прорыв, позволивший «перезагрузить» работу крови на генетическом уровне. Материал объясняет, как активация фетального гемоглобина позволяет остановить разрушительное действие серповидноклеточной болезни, приводит ключевые результаты клинических исследований и поднимает неизбежные вопросы о цене прогресса, доступности высоких технологий и будущем медицины. Casgevy здесь — не просто препарат, а символ новой эры, в которой генетические ошибки перестают быть приговором.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Наследство, приносящее боль
Представьте, что каждый вдох может стать причиной невыносимой, сковывающей жизнь боли. Для людей с серповидноклеточной анемией (SCD) это не фигура речи, а жестокая реальность. Именно такой была жизнь Виктории Грей, которая в 18 лет стала лицом медицинской революции. Ее жизнь с самого детства — это бесконечная череда госпитализаций и мучительных приступов, когда кажется, что все тело горит изнутри. Каждый такой кризис, словно шторм, обрушивался на ее организм, оставляя за собой лишь изнеможение и страх перед следующим [1].
Причина этих страданий — крошечная ошибка в геноме, мутация всего одного нуклеотида. Из-за этого дефекта гемоглобин, белок-переносчик кислорода, становится нестабильным. Эритроциты, в норме гибкие диски, превращаются в жесткие и липкие «серпы». Эти деформированные клетки закупоривают мелкие сосуды, блокируя кровоток и вызывая приступы невыносимой боли — вазоокклюзивные кризы. До недавнего времени арсенал врачей был крайне ограничен. Лечение сводилось к поддерживающей терапии, такой как переливания крови и препараты вроде гидроксимочевины. Этот препарат снижает частоту болевых кризов, стимулируя организм к производству фетального гемоглобина и предотвращая слипание эритроцитов, однако он не устраняет основную генетическую причину заболевания. Единственным шансом на исцеление была трансплантация костного мозга от донора — сложная и рискованная процедура, сопряженная с высокой опасностью смертельной реакции «трансплантат против хозяина».
История Виктории была историей выживания, а не жизни. Но что, если можно не просто бороться с симптомами, а «выключить» саму болезнь на генетическом уровне? Ее случай стал наглядной демонстрацией того, как научный прорыв под названием Casgevy превратил фантастику в реальность [1].
Как «включить» детское здоровье: научное чудо Casgevy
Чтобы понять, как работает Casgevy, не нужно быть генетиком. Принцип терапии элегантен и основан на пробуждении скрытого потенциала нашего собственного организма. В основе серповидноклеточной анемии лежит дефектный взрослый гемоглобин (HbS). Именно он заставляет эритроциты деформироваться и причинять боль. У каждого человека при рождении есть естественная защита — фетальный гемоглобин (HbF) [2].
Этот «детский» гемоглобин прекрасно переносит кислород и, что самое главное, не подвержен серповидной деформации. Однако вскоре после рождения организм «выключает» его производство, заменяя взрослым гемоглобином. За это «выключение» отвечает ген BCL11A. Он работает как строгий «молекулярный контролер» или «тормоз», который останавливает синтез защитного HbF. Технология генного редактирования CRISPR/Cas9 (читайте: «Просто о сложном: CRISPR/Cas» [3]) действует подобно сверхточным «молекулярным ножницам». Они находят ген BCL11A в ДНК и делают в нем точный разрез. После этого клетка пытается «починить» разрыв с помощью своего естественного, но неидеального механизма — негомологичного соединения концов (NHEJ). Технология генного редактирования CRISPR/Cas9 действует подобно сверхточным «молекулярным ножницам». Она вносит целевой разрыв в регуляторную область гена BCL11A, снимая «молекулярный тормоз» и реактивируя синтез фетального гемоглобина (HbF) (рис. 1). В результате такого ремонта ген-контролер оказывается «сломанным», тормоз снимается, и производство фетального гемоглобина возобновляется, навсегда защищая клетки от деформации.
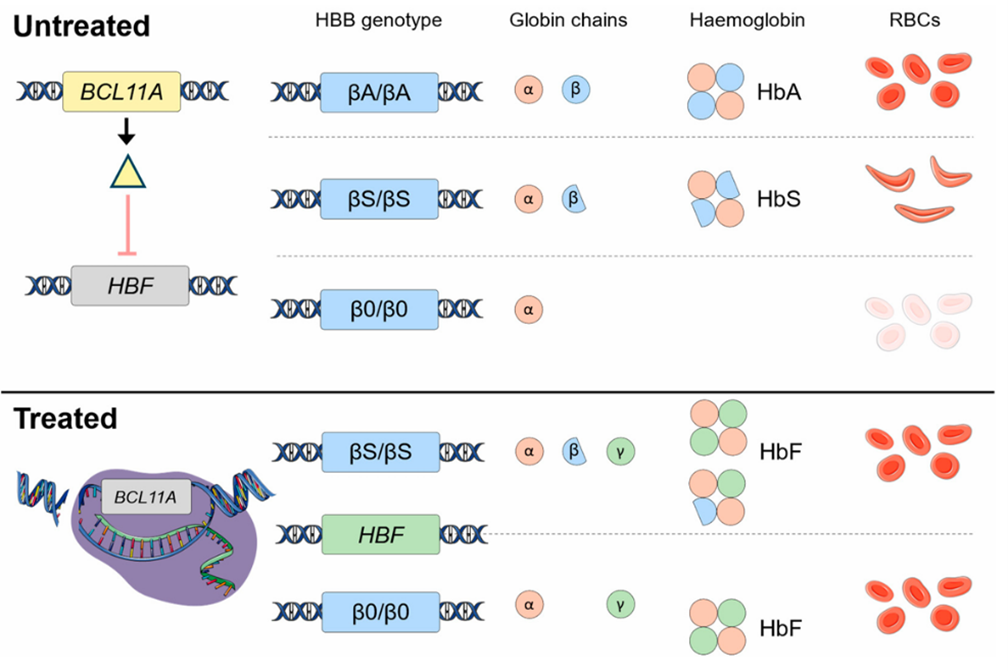
Рисунок 1. Молекулярный механизм действия Casgevy. Система CRISPR/Cas9 вносит точечный разрыв в регуляторную область гена BCL11A, что нарушает его функцию как «молекулярного тормоза» и приводит к реактивации синтеза фетального гемоглобина (HbF).
адаптировано из [2]
Casgevy не «чинит» исходную мутацию, а включает естественный защитный механизм, который без лечения остается «выключенным» после рождения. Этот уникальный подход — не просто теория. Он стал основой сложного, но четко выстроенного пути, который проходят пациенты, чтобы навсегда изменить свою жизнь [2].
Путь к исцелению: год, меняющий все
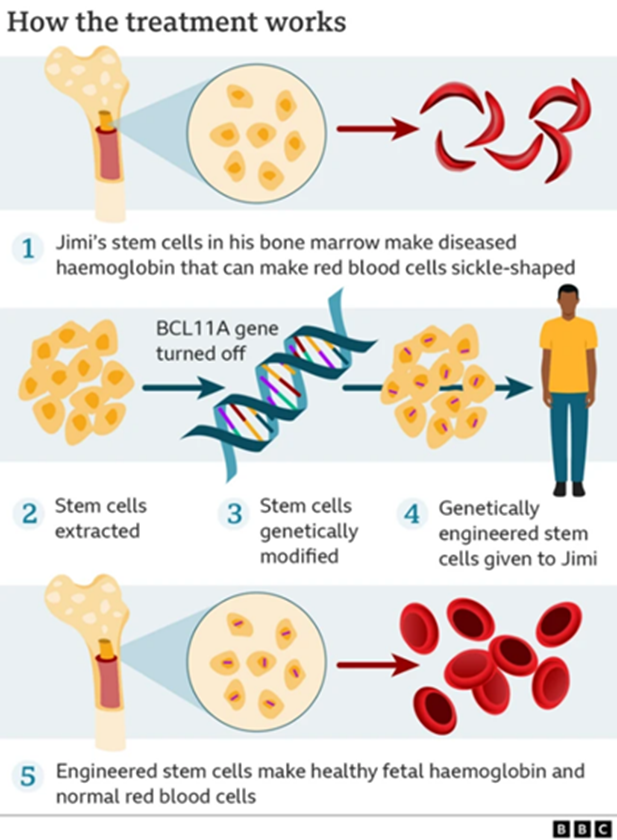
Рисунок 2. Этапы терапевтического процесса Casgevy, от сбора стволовых клеток пациента (аферез) до обратной трансплантации отредактированных клеток после миелоаблативной химиотерапии.
адаптировано из BBC News
Терапия Casgevy — это однократная процедура, которая занимает около года и похожа на тщательно спланированное путешествие. Она состоит из четырех ключевых этапов (рис. 2) [2].
- Шаг 1: сбор урожая. Сначала пациенту вводят препарат плериксафор, который стимулирует выход стволовых клеток из костного мозга в кровь. Затем эти драгоценные клетки, являющиеся «фабрикой» по производству всех клеток крови, собирают с помощью процедуры под названием аферез.
- Шаг 2: редактирование стволовых клеток вне тела (ex vivo). Собранные стволовые клетки отправляются в высокотехнологичную лабораторию. Здесь «молекулярные ножницы» CRISPR/Cas9 вносят тот самый спасительный разрыв в ген-контролер BCL11A. Важно понимать, что вся «операция» на генах происходит вне организма пациента, в строго контролируемых условиях [2].
- Шаг 3: подготовка «почвы». Это самый тяжелый этап для пациента. Пока клетки редактируются, он проходит курс высокодозной химиотерапии. Ее цель — полностью уничтожить старый костный мозг, освободив место для новых, здоровых клеток. Этот период — настоящее испытание на прочность. Пациенты сталкиваются с мучительными побочными эффектами: мукозитом (воспалением слизистых оболочек), падением уровня тромбоцитов и лейкоцитов, что открывает ворота для инфекций, и опасным состоянием под названием фебрильная нейтропения — лихорадкой на фоне практически полного отсутствия иммунитета. Именно в этот момент, проходя через самое суровое испытание, пациент держится за надежду на отредактированные клетки, которые уже ждут своего возвращения.
- Шаг 4: возвращение домой. Наконец, отредактированные и проверенные клетки вводят обратно в организм пациента через обычную капельницу. Они сами находят путь в костный мозг, приживаются там и начинают производить новую, здоровую кровь, обогащенную фетальным гемоглобином. Больше никаких «серпов» — только здоровые эритроциты.
Но насколько эффективен этот сложный и долгий путь? Клинические исследования дали на этот вопрос ошеломляюще позитивный ответ.
Рассвет новой жизни: результаты, превзошедшие ожидания
История Виктории Грей — это не единичное чудо, а яркий пример успеха, подтвержденного строгими научными данными. Сегодня она живет без кризов, может работать и строить планы на будущее, которого у нее раньше просто не было. Ее личный триумф отражает общие результаты клинического исследования CLIMB-111, которые легли в основу одобрения Casgevy по всему миру [2].
- 93,5% пациентов (29 из 31) полностью избавились от тяжелых вазоокклюзивных кризов на срок не менее 12 месяцев.
- Приживление отредактированных клеток прошло успешно у всех участников исследования.
- Пациенты в среднем оставались свободными от приступов боли до 35 месяцев после терапии [4].
Эти цифры означают не просто улучшение состояния — они означают новую жизнь. Успех Casgevy ознаменовал наступление новой эры в медицине. Однако, хотя результаты революционны, ученые сохраняют осторожный оптимизм. Для полной оценки долгосрочной эффективности необходимо дальнейшее наблюдение. Именно для этого были запущены 15-летние исследования, такие как CLIMB-121, чтобы подтвердить, что исцеление будет длиться всю жизнь [2].
Надежда, у которой есть цена
Одобрение Casgevy стало историческим событием, технология CRISPR/Cas9 впервые перешла из лабораторий в реальную клиническую практику, дав надежду миллионам пациентов с серповидноклеточной анемией.
Однако между громким одобрением и реальным внедрением технологии пролегает куда более сложный путь. За два года, прошедшие с момента регистрации Casgevy, терапию получили лишь около 39 пациентов. К сентябрю 2025 года примерно 165 завершили первичную процедуру сбора клеток, а почти 300 человек были направлены в авторизованные центры для начала лечения. Медленное внедрение объясняется как высокой стоимостью лечения, так и его технологической сложностью. Страховые компании неохотно покрывают многомиллионную процедуру, эффективность которой в долгосрочной перспективе пока ограниченно подтверждена, а экономический эффект проявляется лишь спустя годы.
Осторожность проявляют и сами пациенты. Casgevy — это процедура необратимая, связанная с агрессивной химиотерапией и уничтожением клеток костного мозга. Поэтому на лечение, как правило, решаются лишь самые тяжелые больные, для которых риск становится оправданной ценой за шанс вырваться из состояния постоянной боли. Таким образом, несмотря на доказанную эффективность, за клиническим успехом генной терапии стоят два ключевых вызова.
Первый — это высокая стоимость. Цена процедуры составляет от 1 до 2 миллионов долларов на одного пациента. Такая стоимость обусловлена сложностью производственного процесса, требующего персонализированного редактирования клеток, и необходимостью высокоспециализированной инфраструктуры. С другой стороны, сторонники терапии утверждают, что эта цена оправдана, поскольку пожизненные медицинские расходы на лечение серповидноклеточной анемии (SCD — Sickle Cell Disease ) могут превысить 5–6 миллионов долларов.
Второй — глобальное неравенство, ведь подавляющее большинство пациентов с серповидноклеточной анемией проживает в странах с низким уровнем дохода, особенно в Индии и странах Африки. В этих регионах отсутствует не только финансовая возможность, но и необходимая медицинская инфраструктура для проведения афереза, химиотерапии и последующего наблюдения [2].
История Виктории Грей —это история огромной надежды, связанной с Casgevy. Это лишь первый, но очень важный шаг. Теперь перед человечеством стоит не менее сложная задача сделать так, чтобы этот научный прорыв стал доступен не только избранным, но и всем, кто в нем нуждается. Технология готова, но мир должен подготовиться к ней, чтобы победа над генетическими болезнями стала общей, а не привилегией.
Литература
- Alex Philippidis. (2024). CASGEVY Makes History as FDA Approves First CRISPR/Cas9 Genome Edited Therapy. Human Gene Therapy. 35, 1-4;
- Essam Kerwash, Marija Sajic, Khadija Rerhou Rantell, James W. McBlane, John D. Johnston, et. al.. (2024). Regulatory Assessment of Casgevy for the Treatment of Transfusion-Dependent β-Thalassemia and Sickle Cell Disease with Recurrent Vaso-Occlusive Crises. CIMB. 46, 8209-8225;
- Просто о сложном: CRISPR/Cas;
- Natalie Healey. (2024). Next-generation CRISPR-based gene-editing therapies tested in clinical trials. Nat Med. 30, 2380-2381.