
Пить или не пить — два разных сигнала от нашего мозга
11 февраля 2015
Пить или не пить — два разных сигнала от нашего мозга
- 1215
- 0
- 2
Чувство жажды.
Рисунок в полном размере.
-
Автор
-
Редактор
Жажда — это чувство, знакомое каждому человеку. Стоит только наполнить стакан и сделать несколько глотков, как появляется удовлетворение — чувство жажды исчезает. Такие простые действия мы совершаем ежедневно, даже не представляя, как сложна регуляция ощущения жажды. Оказалось, что в процессе регуляции участвуют два игрока — две совершенно разные группы нейронов.
Как известно, организм млекопитающих большей частью состоит из воды: например, в мозге воды до 85%, а в крови вообще 92. Вода — незаменимый участник разнообразных биохимических процессов, которые протекают в клетках. Потеря воды в количестве 0,5% массы тела вызывает жажду, и привыкания к этому чувству не наступает. Каким же образом поддерживается водный баланс в организме?
Считается, что понижение внутриклеточного осмотического давления (это давление, которое изнутри оказывает вода с растворенными веществами на клеточную мембрану) в нейронах приводит к тому, что они отправляют тревожный сигнал: «Воды!». Кроме того, при уменьшении объема жидкости, циркулирующей в кровяном русле, падает артериальное давление, что вызывает синтез гормона ангиотензина II. Этот гормон проникает через гематоэнцефалический барьер и тоже бежит жаловаться нервным клеткам гипоталамуса [1].
Но если жалобы услышаны, и водный баланс пополнен, то пить больше НЕ ХОЧЕТСЯ! Животные потребляют ровно столько жидкости, сколько нужно для восстановления водного баланса. «Почему?» — подумали ученые... и нашли в мозге мышей две разные группы нейронов: первые требуют утолить жажду, а вторые — прекратить пить [2].
В исследованиях, проводившихся ранее, уже было показано, что очень важные зоны мозга — ядра гипоталамуса — активируются при дегидратации (например, если животным не давать пить в течение 48 часов).
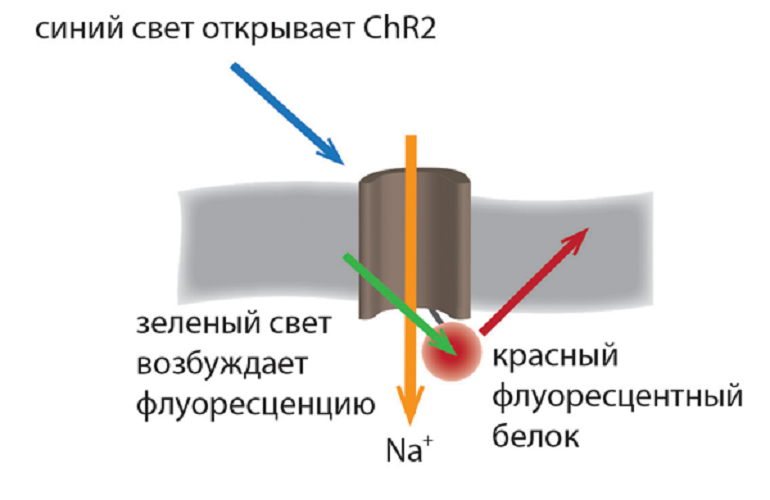
Рисунок 1. Оптогенетический метод. Под воздействием синего света канал, сформированный белком каналродопсином 2 (ChR2), открывает доступ притоку Na+ в клетку, в результате чего клетка возбуждается. Связанный с опсином на внутриклеточной стороне флуоресцентный белок светится под воздействием зеленого света, позволяя визуализировать клетки, экспрессирующие ChR2.
Для того, чтобы прояснить, какие конкретно области гипоталамуса отправляют сигналы, регулирующие потребление воды, ученые использовали оптогенетический метод [3]. С помощью этого метода исследуют работу нейронов путем внедрения в их мембрану специальных транспортных белков — опсинов, реагирующих на воздействие света . Проще говоря, белки-опсины являются каналами, встроенными в мембрану клеток и пропускающими ионы натрия внутрь клетки под воздействием света. Резкое увеличение количества положительно заряженных ионов с внутренней стороны мембраны приводит к быстрому изменению мембранного потенциала, за счет чего возникает нервный импульс. Для экспрессии каналов используют методы генной инженерии. В нашем случае учеными была создана генетическая конструкция, в которой ген самого популярного опсина — каналродопсина 2 (channelrhodopsin-2, ChR2) — был встроен «под промотор» гена CamKII (Са2+/кальмодулин-зависимой киназы II), который активно работает в возбуждающих нейронах [2]. Такая конструкция, доставленная в клетки, приводит к экспрессии в нейронах опсина ChR2 с последующим его встраиванием в мембрану (рис. 1). Нужно только одно дополнительное условие — доставить конструкцию точно в исследуемую зону мозга. Для этого ученые воспользовались методом стереотаксического наведения, который заключается в том, чтобы зафиксировать голову животного и, ориентируясь на расстояние от черепа до нужной области, а также на очень подробные и очень точные карты мозга, ввести конструкцию в целевую зону (в данном случае — в расположенный в районе гипоталамуса субфорникальный орган). После этого в мозг животного внедряется лазер, который подает световые импульсы.
Оптогенетический подход уже описывался биомолекулой применительно к изучению нейродегенеративных заболеваний — «Как Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона)» [4] — и к преодолению слепоты, вызванной дистрофией сетчатки — «Оптогенетика + голография = прозрение?» [5] — Ред.
Выяснилось, что при подаче светового импульса в «нейроны жажды», находящиеся в гипоталамусе, животное бежит к воде, чтобы напиться. При повторяющемся включении света оно делает это снова и снова (см. видео). Более того, стимуляция нейронов заставляет мышь пить, даже если она уже достаточно гидратирована. Мозг грызуна со встроенной в нейроны гипоталамуса генетической конструкцией в течение 15 минут стимулировали светом с интервалами по 30 секунд. В результате животное выпивало в среднем в полтора раза больше воды, чем мышь, которую не поили в течение 48 часов. Интересно, что ChR2-экспрессирующее животное отдавало предпочтение чистой воде и не желало употреблять воду с добавлением даже небольших количеств соли, меда, и уж тем более не стало пить минеральное масло, глицерин и полиэтиленгликоль. Эти эксперименты говорят о том, что возбуждающие нейроны одного из ядер гипоталамуса отвечают исключительно за побуждение пить воду, их действие не связано с чувством голода или разницей во вкусе потребляемой жидкости.
Видео 1. Впечатляющая демонстрация эксперимента.
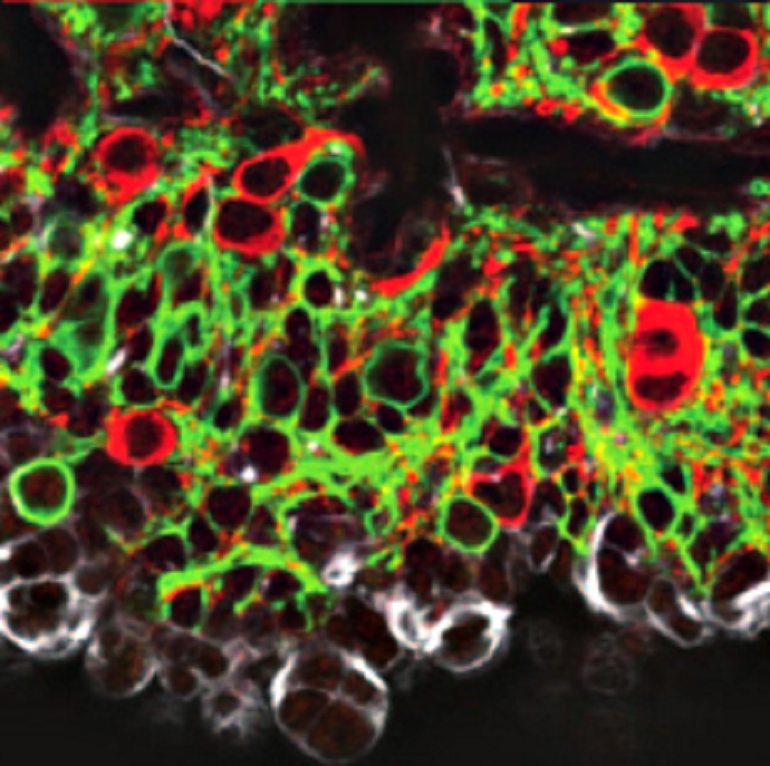
Рисунок 2. Область гипоталамуса трансгенных животных. Зеленым светятся клетки со встроенными в их мембрану опсинами (мечены антителами к флуоресцентному белку GFP). Эти клетки экспрессируют VGAT (см. в тексте) и являются «подавляющими жажду». Красным светятся клетки, активирующие чувство жажды (мечены антителами к белку nNOS, который экспрессируется в этих клетках). Заметно, что две группы клеток не перекрываются.
По соседству была найдена другая группа нейронов, отличающаяся от первой набором белков. В частности, вторая группа нейронов экспрессировала VGAT — один из белков, вовлеченных в процесс захвата ГАМК и глицина синаптическими пузырьками (рис. 2). Повторив эксперименты и с этими нейронами, ученые убедились, что нашли «выключатели жажды». Оптическая стимуляция VGAT-нейронов приводила обезвоженных животных к отказу от воды. Интересно, что при этом голодные и обезвоженные животные с аппетитом потребляли пищу, но не прикасались к воде.
Исходя из вышесказанного, получается, что для точной регуляции количества поступающей в организм жидкости должны быть задействованы две разные группы нейронов: одна группа призывает срочно пополнить запас жидкости, а как только воды в организме становится достаточно, вторая группа приказывает немедленно остановиться. Похоже, ученые действительно близко подобрались к разгадке механизмов, которые контролируют потребление воды. Вероятно, такой же принцип работы двух групп нейронов можно обнаружить у всех млекопитающих. Может быть, четкое разделение функций между двумя группами нейронов обусловлено еще более важными причинами? Каковы механизмы жажды у животных, обитающих в засушливых условиях, например верблюдов? (Верблюды, не употребляя воду, могут терять до 40% веса без угрозы для жизни, но неужели они не хотят пить?) На эти вопросы еще предстоит найти ответы.
Литература
- Физиология человека. В
3-х томах / Под ред. Р. Шмидта и Г. Тевса. Пер. с англ. —3-е изд. — М.: Мир, 2005. — Т.1 — 323 с., Т.2 — 314 с.; Т.3 — 228 с.; - Yuki Oka, Mingyu Ye, Charles S. Zuker. (2015). Thirst driving and suppressing signals encoded by distinct neural populations in the brain. Nature. 520, 349-352;
- Edward S Boyden, Feng Zhang, Ernst Bamberg, Georg Nagel, Karl Deisseroth. (2005). Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Оптогенетика + голография = прозрение?.





