
Оптогенетика + голография = прозрение?
01 марта 2013
Оптогенетика + голография = прозрение?
- 2261
- 2
- 1
В кинематографе для простоты восприятия зрителями зрение киборга изображают в виде «внутреннего экрана», на который проецируется всякая служебная информация. В наши дни такая технология известна под именем Google Glass Project.
-
Автор
-
Редакторы
Темы
Во всем мире множество людей страдает от дегенеративных поражений сетчатки, которые приводят к полной потере зрения. Однако современные научные достижения дают надежду на то, что в будущем создание кибернетических протезов этого «тонкого» органа станет повседневной операцией. Технологии оптогенетической инженерии позволяют сделать чувствительными к свету не деградировавшие клетки-фоторецепторы, а лежащие глубже ганглионарные клетки, а носимый микрокомпьютер с голографическим передатчиком будет транслировать им закодированный сигнал, имитирующий «выдачу» утерянной сетчатки.
Во всем мире около 20–25 миллионов людей страдают от потери зрения, вызванной дегенерацией желтого пятна (макулярной дистрофией) и пигментной дистрофией сетчатки. Особенность этих заболеваний в том, что поражаются главным образом фоторецепторы (клетки-«палочки» и «колбочки» ), а лежащие ниже ганглионарные клетки , «интегрирующие» информацию от светочувствительных клеток и передающие ее в мозг, остаются неповрежденными. Этот факт позволяет создать «протез» сетчатки, который передавал бы ганглионарным клеткам такие же сигналы, что и настоящая сетчатка. Интересно, что такие протезы уже созданы: американское ведомство FDA недавно одобрило для использования устройство Second Sight’s Argus II [1], состоящее из небольшой видеокамеры и передатчика, вмонтированных в очки, и имплантированного в глаз 60-электродного микрочипа, функционально замещающего дегенерировавшие клетки сетчатки. Но с помощью такого протеза зрение восстанавливается, конечно, лишь на малую долю от нормального: пациенты способны видеть свет, различать наиболее контрастные контуры предметов и слабо ориентироваться в пространстве. Но по общепринятым стандартам они лишь немногим отличаются от слепых людей.
О молекулярных основах зрения см. статью «Зрительный родопсин — рецептор, реагирующий на свет» [2].
Со строением сетчатки можно ознакомиться в статье «Сетчатка» в «Википедии».
Более продвинутый подход заключается не в имплантации микрочипа, а в придании световой чувствительности непосредственно тем клеткам, которые должны реагировать на сигналы, поступающие от сетчатки, — ганглионарным клеткам. В современной молекулярной биологии этот прием называется оптогенетикой и заключается во «встраивании» в нервные клетки светочувствительных белков. Наиболее часто в качестве такого белка используют каналородопсин — фоторецептор клеточной мембраны зеленых водорослей, который под действием света начинает пропускать в клетку ионы натрия — подобно тому, как это делают натриевые каналы мембраны нейронов, запуская в них потенциал действия. Подробнее о принципах оптогенетики можно прочесть в статье «Свет и генетика» [3].
Однако выясняется, что сделать ганглионарные клетки светочувствительными недостаточно для того, чтобы «реанимировать» сетчатку. Дело в том, что слой фоторецепторов (палочек и колбочек) не просто воспринимает световые импульсы и передает их далее на ганглионарный слой, но особым образом «кодирует» информацию, превращая ее в сложную последовательность импульсов, мало напоминающую «входной» сигнал. Поэтому одной из главных задач является не только совершенствование технических характеристик протеза, но и создание цифровой системы кодирования сигнала, чтобы ганглионарные клетки получали информацию в «привычном» для них виде (то есть, уже обработанную по алгоритму, заложенному в живую сетчатку).
Американские исследователи создали такую систему, включающую модуль кодирования, «натренированный» на сигналах, считанных со здоровых сетчаток, и мини-проектор, передающий закодированную информацию на слой ганглионарных клеток. Последние при этом несли в своих клеточных мембранах каналородопсин ChR2, что позволяет возбуждать клетки, просто посветив на них [4] . Принципиальная схема этой системы приведена на рисунке 1.
Немного технических подробностей: модель «слепой» сетчатки, которую планируется «вылечить» с помощью каналородопсина, получали из специально выведенной линии мышей. Эту линию создали скрещиванием двух других линий: rd1 — стандартной «мышиной» модели дегенерации сетчатки — и линии, в геном которой встроили ген каналородопсина ChR2 под специальным промотором Thy1, активным только в ганглионарных клетках. В результате были получены мыши с дефектной сетчаткой, ганглионарные клетки которых при этом чувствуют свет.
В случае лечения реальных больных сетчатка должна генетически модифицироваться с помощью трансфекции аденовирусными векторами. Работоспособность и безопасность такого метода уже продемонстрирована.
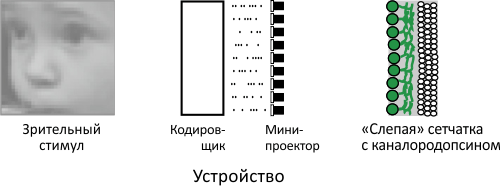
Рисунок 1. Принципиальная схема «протеза» сетчатки. Устройство (в центре) состоит из двух главных блоков: 1) «кодировщика» сигнала, который превращает зрительный стимул (слева) в последовательность импульсов, имитирующих электрическую активность сетчатки, и 2) «передатчика» (здесь — мини-проектора), посылающего «закодированные» сигналы в виде вспышек света на дефектную сетчатку (справа). Ганглионарный слой сетчатки воспринимает эти импульсы аналогично тому, как принимал бы сигнал от фоторецепторов — благодаря наличию каналородопсина.
Проверку «работоспособности» протеза сетчатки проводили в несколько этапов. Первым делом сравнили электрическую активность «выхода» ганглионарных клеток нормальной сетчатки со «слепой» сетчаткой, снабженной кодирующим сигнал протезом. В качестве контроля взяли, как это принято в рекламе стирального порошка, «обычный» протез сетчатки (рис. 2, сверху). «Обычность» заключается в том, что ганглионарные клетки здесь возбуждаются непосредственно зрительным стимулом, без кодирования сигнала в понятную им форму. Паттерн электрической активности в первых двух случаях почти совпал, тогда как на «обычном» протезе картина резко отличалась. Это подтверждает, что этап «кодирования» зрительного стимула совершенно необходим для адекватной имитации работы сетчатки.
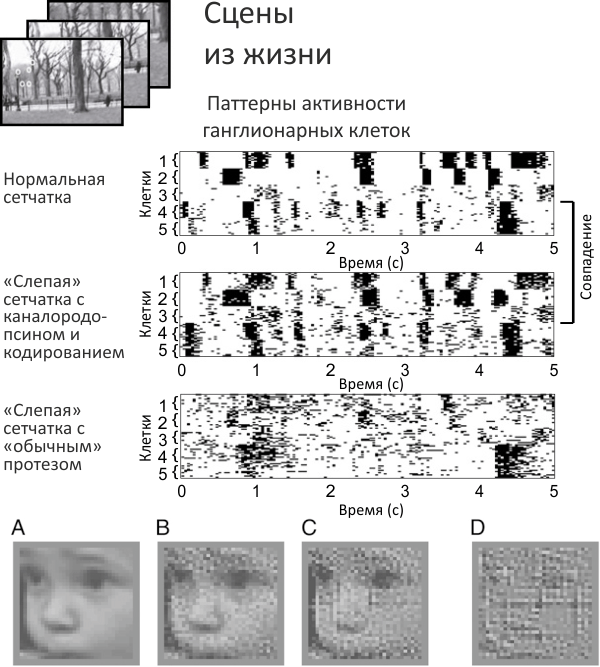
Рисунок 2. Работоспособность протеза сетчатки. Сверху: «Слепая» сетчатка с протезом, кодирующим зрительный стимул (график в центре), активирует ганглионарные клетки почти так же, как и нормальная сетчатка (вверху). При этом «обычный» протез, не включающий стадию кодирования сигнала, формирует аномальную картину активности ганглионарных клеток (внизу). На графиках показана электрическая активность пяти ганглионарных клеток в течение пяти секунд. Снизу: Реконструкция изображения на основе активности ганглиев сетчатки. А. Исходный зрительный стимул. B. Картинка, восстановленная по выдаче кодировщика. С. Картинка, восстановленная в случае протеза с «кодом сетчатки». D. Картина с «обычного» протеза сетчатки: отсутствие стадии кодирования сигнала искажает восстановленное изображение почти до неузнаваемости.
Потом провели более наглядную проверку, основанную на реконструкции изображения по «записанным» с ганглионарных клеток сигналам. Мозг, скорее всего, не занимается реконструкцией картинки как таковой, но для анализа адекватности передаваемой информации этот тест очень показателен. Результат оказался «на лицо» — протез сетчатки с кодированием зрительного стимула выдавал картину, в которой легко можно было установить первоначальное лицо ребенка, подаваемое системе на вход (рис. 2, внизу). В случае же «обычного» протеза в реконструированной картине едва ли можно узнать лицо вообще, не говоря уже про индивидуальные черты.
Последним провели тест на мышах, подтвердивший важность модуляции зрительного стимула «кодом сетчатки» при попытках восстановления зрения. Для эксперимента использовали таких же животных, из которых получали препараты сетчатки для изучения. Мышам фиксировали положение головы и использовали систему отслеживания движения глаз, чтобы определить, следит ли животное за происходящим на экране. Оказалось, что мыши с «кодированным» протезом обретали способность отслеживать объекты на экране, а вот «обычный» протез такой возможности, увы, не предоставлял.
На основе проделанных экспериментов ученые делают вывод, что будущие поколения протезов сетчатки должны предусматривать не только более высокое разрешение, но и блок цифрового кодирования зрительного импульса, переводящий обычное изображение на язык последовательностей импульсов, воспринимаемых ганглионарными клетками. Можно даже пофантазировать и представить себе различные «прошивки» такого блока, обеспечивающие лучшую остроту зрения или какие-нибудь особенные визуальные эффекты, недоступные истинно зрячим людям.
Однако совершенствовать можно не только систему генетической трансформации ганглионарных клеток фоточувствительными белками или способ кодирования сигналов для них. Исследователи из Израильского технологического института (Техниона) разрабатывают систему голографической стимуляции ганглионарных клеток, имеющую ряд преимуществ перед уже упомянутыми «мини-проекторами» [5]. Это высокая интенсивность, равномерность освещения (отсутствие необходимости в системах развертки), низкое энергопотребление, высокая разрешающая способность и возможность создавать трехмерную картину возбуждения. Ведь для передачи «кода сетчатки» на ганглионарные клетки нужно импульсно освещать очень маленькие области пространства (размером в считанные микрометры) с возможностью быстрого переключения и фокусировки на разных слоях клеток — в отличие от грызунов, у человека ганглионарный слой не плоский, а объемный. Кроме того, ганглионарные клетки с каналородопсином — это все-таки не природные фоторецепторы, и их чувствительность намного хуже, чем у наших палочек и колбочек. Поэтому высокая яркость и точность управления голографической системы — чрезвычайно важное преимущество перед мини-проектором или просто электронным дисплеем, встроенным в очки.
Ученые создали экспериментальную установку для голографической стимуляции ганглионарных клеток сетчатки, основанную на лазере, луч которого модулируется управляемым компьютером жидкокристаллическим ферроэлектрическим чипом. Это устройство позволяет контролировать дифракцию и одновременно «адресовать» от сотен до нескольких тысяч «пикселов» в ганглионарном слое, чтобы стимулировать зрительные импульсы. (Конечно, в этом случае тоже идет речь о ганглионарных клетках, экспрессирующих каналородопсин и возбуждаемых светом.) В результате мощность исходного луча лазера (≈700 мкВт) дробится на множество «пятен» с мощностью 1–10 мкВт, что как раз достаточно для активации каналородопсина и совершения элементарного акта зрения. Высокая скорость переключения голографической системы (2000 Гц) позволяет устранять дефекты голограммы и (в перспективе) использовать многоцветную стимуляцию в надежде восстановить зрение во всех его красках.
Руководитель разработок профессор Шай Шохам (Shy Shoham) вот как объясняет преимущества голографического подхода: «Электронные дисплеи могут стимулировать много клеток одновременно, но у них слишком низкая яркость и энергоэффективность. Лазеры дают высокую эффективность, но от них не получить параллельный пучок. Так вот голография — оптимальный способ использования преимуществ лазерного света в стимуляции нервных клеток сетчатки» [6].
И хотя создание протеза сетчатки, полностью устранившего бы проблему дегенеративных заболеваний глаза, пока находится где-то на горизонте, сегодня вполне можно вдохновиться научным прогрессом, способным обратить вспять потерю одного из самых главных наших органов чувств. Опираясь на это вдохновение, можно проникнуться пониманием футуристических идей трансгуманизма, сулящего человеку в будущем полный апгрейд его бренного тела с использованием более современных компонентов. Но можно этого и не делать.
Литература
- Greenemeier L. (2013). FDA Approves First Retinal Implant. Scientific American;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Тулинов Д. (2012). Свет и генетика. «Наука и технологии России»;
- S. Nirenberg, C. Pandarinath. (2012). Retinal prosthetic strategy with the capacity to restore normal vision. Proceedings of the National Academy of Sciences. 109, 15012-15017;
- Inna Reutsky-Gefen, Lior Golan, Nairouz Farah, Adi Schejter, Limor Tsur, et. al.. (2013). Holographic optogenetic stimulation of patterned neuronal activity for vision restoration. Nat Commun. 4;
- Researchers Test Holographic Technique for Restoring Vision. (2013). ScienceDaily.





