
По каким трубам путешествует медь в организме: непростой метаболизм простого элемента
16 февраля 2023
По каким трубам путешествует медь в организме: непростой метаболизм простого элемента
- 2300
- 0
- 3
Механизмы поглощения и транспорта меди могут показаться сложными, но это только на первый взгляд.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Микроэлементы. Все мы знаем это слово, и уже как-то привыкли к его звучанию. Какие-то там элементы, их в организме немного, но они очень важны. Калий, магний, кальций — их все любят. В то же время, не так много людей, в том числе и специалистов, вникает в глубины метаболизма этих самых микроэлементов. Все знают, что кальций в костях, а магний важен для работы сердца, но что с остальными? В этой статье мы постараемся разобраться с другим металлом, медью, уникальные свойства которой нашли свое не менее уникальное применение в организме.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного о самой меди
Давайте начнем с ответа на вопрос: «А чем же так особенна медь?». Как и железо или, например, цинк, медь — это переходный металл. Она располагается в 11-й группе 4-го периода Периодической системы под атомным номером 29. Медь особенна тем, что может находиться в двух степенях окисления (не то, чтобы это было совсем уникальным свойством, но все же), чем схожа с другими переходными металлами. При этом двух- и одновалентная медь обладают разной растворимостью в воде, растворимость Cu1+ очень низкая, и чаще всего этот ион встречается в составе нерастворимых соединений, таких как Cu2O [1]. Двухвалентная медь обладает большей растворимостью и реакционной способностью в водных растворах. В этом контексте важно упомянуть участие меди в окислительно-восстановительных реакциях, которые приводят к генерации активных форм кислорода (АФК), чем обуславливается токсичность данного металла для живой клетки.

Рисунок 1. Фриц Габер (1868–1934).
Рассмотрим этот момент подробнее, так как он пригодится нам в дальнейшем. Эти процессы были в подробностях изучены лауреатом Нобелевской премии Фрицем Габером (рис. 1) и его студентом Йозефом Вэйсом.
Двое исследователей выяснили, что перекись водорода (H2O2) способна разлагаться на гидроксильный радикал и гидроксид-ион под действием супероксид-радикала [2]. Химическое уравнение реакции, которую впоследствии назовут в их честь, выглядит так:
·O2− + H2O2 → ·OH + HO− + O2 (1)
Константа скорости этой реакции невелика, однако переходные металлы обладают способностью катализировать ее за счет передачи электрона от супероксида на перекись водорода. Наиболее изученным с этой точки зрения является железо, которое принимает участие в данных превращениях в реакции Фентона:
Fe2+ + H2O2 → Fe3+ + OH· + OH− (2)
Однако это еще не конец, ведь трехвалентное железо может восстанавливаться обратно до двухвалентного при участии супероксид-радикала или той же перекиси:
Fe3+ + H2O2 → Fe2+ + HOO· + H+ (3)
Если совместить уравнения (2) и (3), то получим следующее общее уравнение:
2 H2O2 → HOO· + OH· + H2O (4)
При этом в этой реакции железо уже будет выступать как катализатор. Если в уравнении (3) перекись заменить на супероксид-радикал, то уравнение (4) трансформируется в уравнение реакции Габера—Вейса, то есть в уравнение (1). Все это говорит нам о том, что АФК способны легко переходить друг в друга, а ионы металлов значительно ускоряют этот процесс.
Медь обладает теми же свойствами, и потому также способна вступать в реакции Фентона и Габера—Вейса [3]. Вот почему в клетке мы практически никогда не встретим свободных ионов меди, все они находятся в связанном с белками или переносчиками состоянии, о чем мы еще поговорим ниже.
С другой стороны, способность меди свободно менять степень окисления позволяет ей выполнять важные с биологической точки зрения функции. Предлагаю подробнее рассмотреть этот момент, чтобы понять, с каким на самом деле важным металлом мы имеем дело и насколько он необходим для поддержания нормальной жизнедеятельности.
Немного про роль меди в организме
Итак, чем так важна медь и с чем ее едят. Медь принимает участие в тех процессах, где необходима передача электронов либо перенос определенных групп или атомов. В частности, медь успешно справляется с переносом кислорода в составе гемоцианина у головоногих и большинства брюхоногих моллюсков, а также у некоторых членистоногих, например, мечехвостов, ракообразных и паукообразных. Это лишний раз доказывает схожесть данных металлов в контексте биологических свойств.
Если говорить именно про человеческий организм, то, прежде всего, основная роль меди сводится к функциям основных белков, в состав которых она входит. Что же это за белки? Они следующие:
- Цитохром-c-оксидаза (принимает участие в функционировании электрон-транспортной цепи (ЭТЦ) в митохондриях);
- Супероксиддисмутаза (СОД) (белок, который, как ясно из названия, борется с супероксидным радикалом, постоянно возникающим в митохондриях как побочный продукт метаболизма);
- Церулоплазмин (участвует в транспорте меди по кровеносному руслу, кроме того, гомолог церулоплазмина, гефестин, помогает в окислении Fe2+ до Fe3+ и включении его в трансферрин, о чем было подробно написано в уже упомянутой статье про железо на «Биомолекуле» [4]);
- АЛК-синтаза (участвует в синтезе аминолевулиновой кислоты, необходимой для биосинтеза порфиринов, в частности, гема);
- Тирозиназа (фермент, катализирующий окисление тирозина и синтез из него меланина; именно этот белок виноват в почернении на воздухе нарезанного вами для жарки картофеля);
- Лизилоксидаза (участвует в образовании сшивок в протоколлагене, преобразуя его в собственно коллаген);
- Дофамин бета-гидроксилаза (катализирует реакцию превращения дофамина в норадреналин).
Как видим, набор белков не самый большой, но если присмотреться, то их функции довольно существенны для поддержания нормальной жизнедеятельности организма [5]. Кроме того, медь способна значительно влиять на функции других белков, в которых не выступает кофактором. В частности, имеются данные о том, что медь способна ингибировать каталазу при достижении некой концентрации [6], проявляя свойства неконкурентного ингибитора. Кроме того, этот металл даже способен изменять активность клеточного сигналинга, способствуя клеточному росту и делению, о чем мы еще поговорим ниже. Принимая все это во внимание, неудивительно, что организм нуждается в регулярном поступлении меди вместе с пищей и тщательном контроле ее метаболизма.
Кстати, что там по суточным нормам? Для взрослого человека она, по разным данным, составляет от 0,9 до 2–3 мг в день, для детей немного меньше [7]. Основными продуктами, богатыми медью, являются животные органы (особенно печень), зеленые листовые овощи, фрукты, орехи, моллюски [8]. Поглощение меди осуществляется в тонком кишечнике, причем механизмы транспорта в некоторых местах схожи с поглощением других металлов. Давайте же разберемся в деталях.
Молекулярная кухня поглощения меди из пищи
А теперь пробежимся по метаболизму меди чуть подробнее и рассмотрим молекулярные аспекты поглощения, транспорта, накопления и экскреции меди (рис. 2).
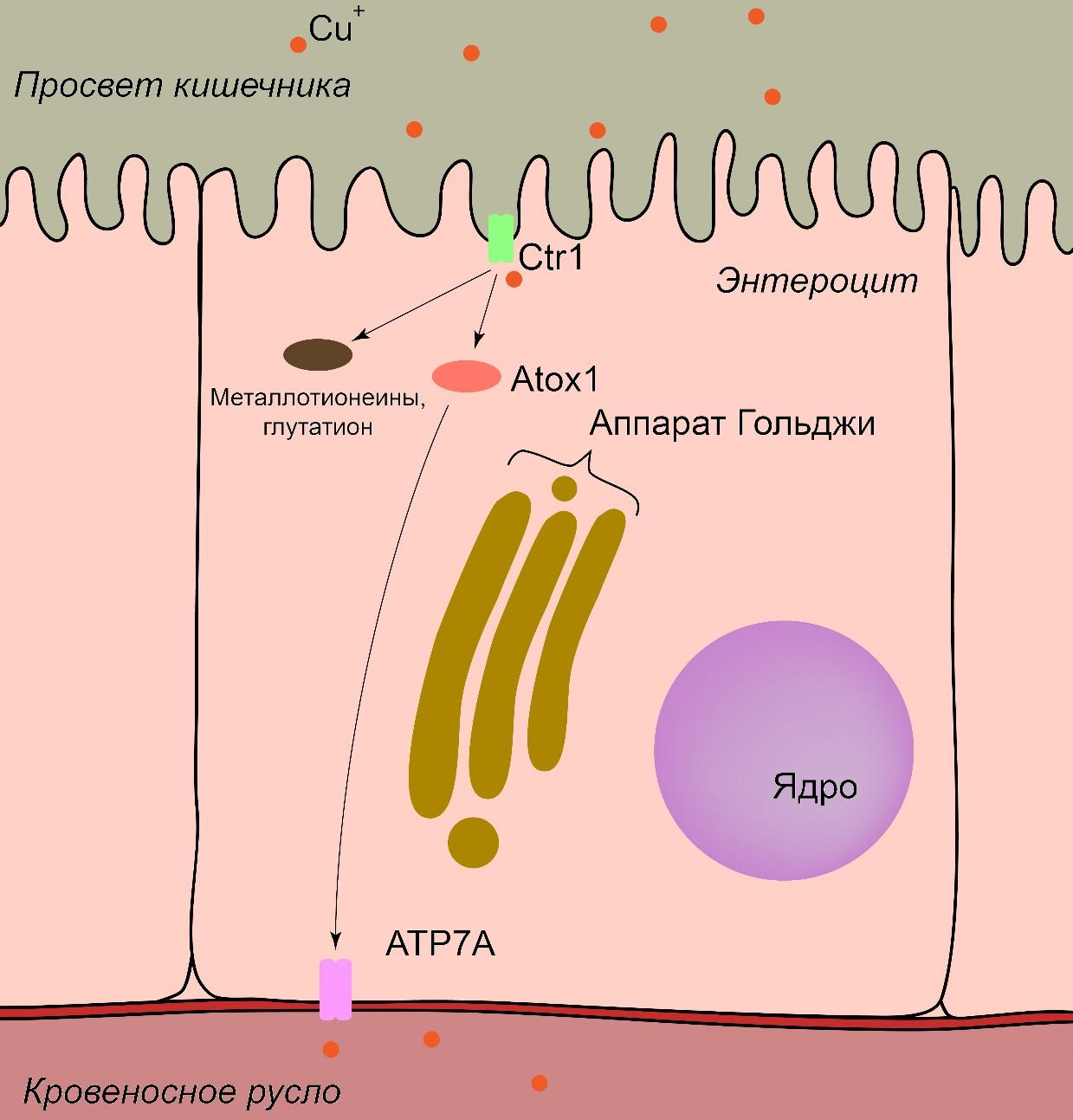
Рисунок 2. Процесс поглощения меди в кишечнике. Попадая в просвет кишечника, ионы меди переносятся внутрь энтероцита транспортером Ctr1, после чего переносятся во внеклеточное пространство транспортером ATP7A (подробности в тексте).
рисунок автора
После попадания в тонкий кишечник, медь абсорбируется энтероцитами. Да, здесь важно упомянуть что, говоря слово «медь», мы будем подразумевать именно ионы меди (Cu2+ или Cu1+), а не металлическую медь как таковую (так как грызть медную проволоку не рекомендуется). Итак, медный транспортер CTR1 (copper transporter 1) переносит медь внутрь энтероцита, причем этот транспортер специфичен именно для одновалентной меди. В его составе содержатся остатки цистеина и метионина в определенной пространственной конфигурации, ответственные за распознавание и транспорт именно меди. Двухвалентная же медь может транспортироваться белком DMT1 (divalent metal transporter 1), который загоняет внутрь и другие двухвалентные металлы (в том числе железо). Однако значение именно DMT1 в транспорте меди оказывается невысоким [9]. Но как же тогда быть с двухвалентной формой? Не выбрасывать же? Нет, на поверхности плазматической мембраны энтероцита находятся также и редуктазы (например, STEAP), которые восстанавливают Cu2+ до Cu1+, позволяя CTR1 транспортировать одновалентный ион внутрь [10]. Предполагается, что такая специфичность необходима для того, чтобы развести дальнейшие пути метаболизма переходных металлов друг от друга.
Внутри клетки ионы меди связываются с различными белками и пептидами для предотвращения цитотоксического эффекта, который, как мы помним, возникает из-за реакции Габера—Вейса. К этим белкам и пептидам относятся глутатион, металлошапероны, которые участвуют в фолдинге медьсодержащих белков, и металлотионеины, которые создают пул металла в клетке. Внутриклеточный переносчик меди Atox1 (antioxidant protein 1) переносит медь от CTR1 на АТФ-зависимые помпы, которые выкачивают медь из клетки. В кровеносном русле ионы меди связываются с альбуминами плазмы и верхом на них мчатся по воротной вене к печени [11].
Метаболизм меди и его регуляция
Хоть мы и говорим, что медь связывается с альбуминами после того, как попала в кровеносное русло из энтероцитов, однако эта связь довольно слаба. Настолько, что такую медь называют свободной медью или свободными ионами меди, однако это лишь термин, не отражающий реального положения вещей. Итак, прибыв в таком виде в печень, медь поглощается гепатоцитами при помощи того же транспортера CTR1. Здесь будет происходить основное перераспределение металла (рис. 3):

Рисунок 3. Метаболизм меди в гепатоците. Поглощенные из пищи ионы меди по воротной вене попадают в печень, где поглощаются гепатоцитами. В гепатоцитах происходит основное перераспределение металла: «свободные» ионы связываются с церулоплазмином для дальнейшей транспортировки по кровеносному руслу, а избытки меди выводятся вместе с желчью (подробности в тексте).
рисунок автора
В гепатоцитах, так же, как и в энтероцитах, ионы меди после попадания в клетку связываются с различными белками и пептидами. Рассмотрим теперь подробнее, что это за звери такие. Общим их свойством является наличие большого количества остатков цистеина, которые вступают в координационные взаимодействия с медью, обеспечивая таким образом связывание и хранение металла. В целом, все белки, в строении которых имеется дисульфидная связь, образованная двумя остатками цистеина, могут выступать в роли акцепторов меди (ведь, как мы выяснили, серу и медь связывают необъяснимые узы), однако из-за высокой вероятности повреждения макромолекул ионы меди пребывают в связанном со специализированными белками или переносчиками состоянии. Их названия мы уже слышали, пришло время познакомиться с ними поближе.
Металлотионеины — небольшие белки (1–14 кДа), функция которых заключается в создании пула металлов (в основном, меди и цинка), т.е. в создании запасов этих металлов на черный день, когда возникнет внезапная потребность в них. Выделяют целое семейство металлотинеинов с четырьмя изоформами, которые в основном экспрессируются в печени и почках [12].
Глутатион — трипептид, довольно распространенный внутри клетки. Принимает участие в антиоксидантной защите и детоксификации ксенобиотиков. За счет наличия SH-группы и высокой внутриклеточной концентрации способен эффективно связывать медь, предотвращая реализацию ее цитотоксического эффекта [13], [14].
Металлошапероны — белки, которые не только создают пул меди, но и выполняют роль ее переносчиков и «загрузчиков» на другие медьсодержащие белки. К металлошаперонам относится уже известный нам Atox1, который переносит медь на транспортер для выкачки из клетки. Кроме того, существует еще свой металлошаперон у SOD, который так и называется — copper chaperone for superoxide dismutase (CCS). У цитохромоксидазы целых два металлошаперона: Cox17 и SCO2 [15].
Здесь сделаем также небольшое отступление и обозначим, что у данных медьсвязывающих белков есть и иные функции помимо переноса или накопления меди. В случае с глутатионом уже было упомянуто, что он также выполняет роль антиоксиданта и участвует в детоксификации различных ксенобиотиков. Но что же с остальными? Atox1 в последнее время изучается довольно интенсивно, так как были обнаружены свидетельства, указывающие на его участие в регуляции транскрипции. Несколько работ [16–18], посвященных этому белку, пришли к выводу, что Atox1 является не просто звеном в цепи транспорта меди, но что он также способен заходить в ядро клетки и присоединяться к ДНК в связанном с медью состоянии, оказывая влияние на экспрессию определенных генов. Эти гены связаны, в первую очередь, с метаболизмом меди — так обеспечивается обратная связь для поддержания адекватного уровня экспрессии соответствующих белков. Однако, кроме этого, также нашлись доказательства влияния Atox1 на экспрессию циклина D1, который обеспечивает переход клетки из фазы G1 клеточного цикла в S-фазу. CCS, Cox17 и SCO2 также могут оказывать влияние на различные процессы и даже участвовать в малигнизации, то есть развитии опухолей. Как именно это происходит, мы разберем чуть ниже в специальной главе. Именно благодаря этому биологические функции данного металла в последнее время начали изучаться более интенсивно.
Но мы отвлеклись, вернемся к тому, что происходит с медью дальше. Итак, центральная ветвь метаболизма проходит по оси CTR1—Atox1—ATP7A или ATP7B (первый — в энтероцитах, второй — в гепатоцитах). Если присмотреться к схеме 2, то мы увидим, что Atox1 после получения меди от CTR1 передает ее транспортру ATP7B на мембране аппарата Гольджи (АГ). Дальнейшая судьба иона металла зависит от того, нужно ли организму больше меди или, наоборот, необходимо удалить излишки. В первом случае медь связывается в АГ с церулоплазмином, который способен образовывать комплекс с 6-ю ионами меди. Во втором случае медь при помощи везикул выводится в желчный пузырь и дальше удаляется вместе с желчью из организма [19].
В связанном с церулоплазмином состоянии медь дальше переносится по крови. Кроме этого, часть ионов данного металла продолжает циркулировать в плазме крови, не связываясь с церулоплазмином. Таким образом, общий пул меди в крови состоит из ионов, связанных с церулоплазмином, и из свободной меди, которая слабо связана с альбуминами. Эти два параметра — количество свободных ионов меди и количество церулоплазмина — используются для медицинской диагностики заболеваний, ассоциированных с метаболизмом меди, о чем будет сказано ниже. Обычно медь, связанная с церулоплазмином составляет 95% всей меди крови.
Поглощение меди тканями и органами происходит по тому же механизму, что и в энтероцитах или гепатоцитах: при участии транспортера CTR1. Регуляция поступления меди происходит путем уменьшения или увеличения числа активных транспортеров на мембране за счет интернализации в везикулы или усиления транскрипции, соответственно. Также может изменяться экспрессия и транспортеров ATP7A и ATP7B. Как это происходит на системном уровне, пока не совсем понятно. Какого-то особого гормона, который регулировал бы именно метаболизм меди, пока не найдено, а влияние остальных на рассмотренные нами процессы описано лишь косвенно [20], [21]. Пока общепринятой считается точка зрения о том, что метаболизм поддерживается за счет активности CTR1 и ATP7A или ATP7B всех клеток организма, и какая-то особая регуляция не требуется. Однако имеются некоторые данные относительно того, что экспрессия как минимум ATP7A, а также ATP7B может находиться под контролем инсулина и глюкагона, что интересно в свете уже упомянутого нами факта о влиянии меди на рост и пролиферацию клеток [22], [23]. Кроме того, как мы знаем, наука постоянно открывает новое, а потому можно не сомневаться, что и эти пробелы в регуляции метаболизма меди будут заполнены.
Медь-ассоциированные заболевания
Давайте теперь поговорим о том, что будет, если в организме появится патология в том или ином звене усвоения, перераспределения или выведения меди. Начнем с двух наиболее известных примеров заболеваний со сходной патологией, но абсолютно разными симптомами. Речь идет про заболевания Вильсона и Менкеса.
Болезнь Вильсона
Заболевание Вильсона обусловлено тем, что из-за мутации в гене ATP7B медь перестает, во-первых, поступать в кровеносное русло в связанном с церулоплазмином состоянии, а во-вторых, выводиться из организма вместе с желчью. Результатом становится накопление металла в печени и мозге, что ведет к ухудшению функционирования данных органов. Одним из ярких признаков наличия заболевания Вильсона являются кольца Кайзера—Флешера, отложения меди на десцеметовой мембране роговицы, которые иногда можно наблюдать даже невооруженным взглядом (рис. 4). Иногда вместо полного кольца могут обнаруживаться какие-то его части, «полумесяцы». Это самый заметный и очевидный признак, который, однако, не обязательно присутствует при проявлении данного заболевания.
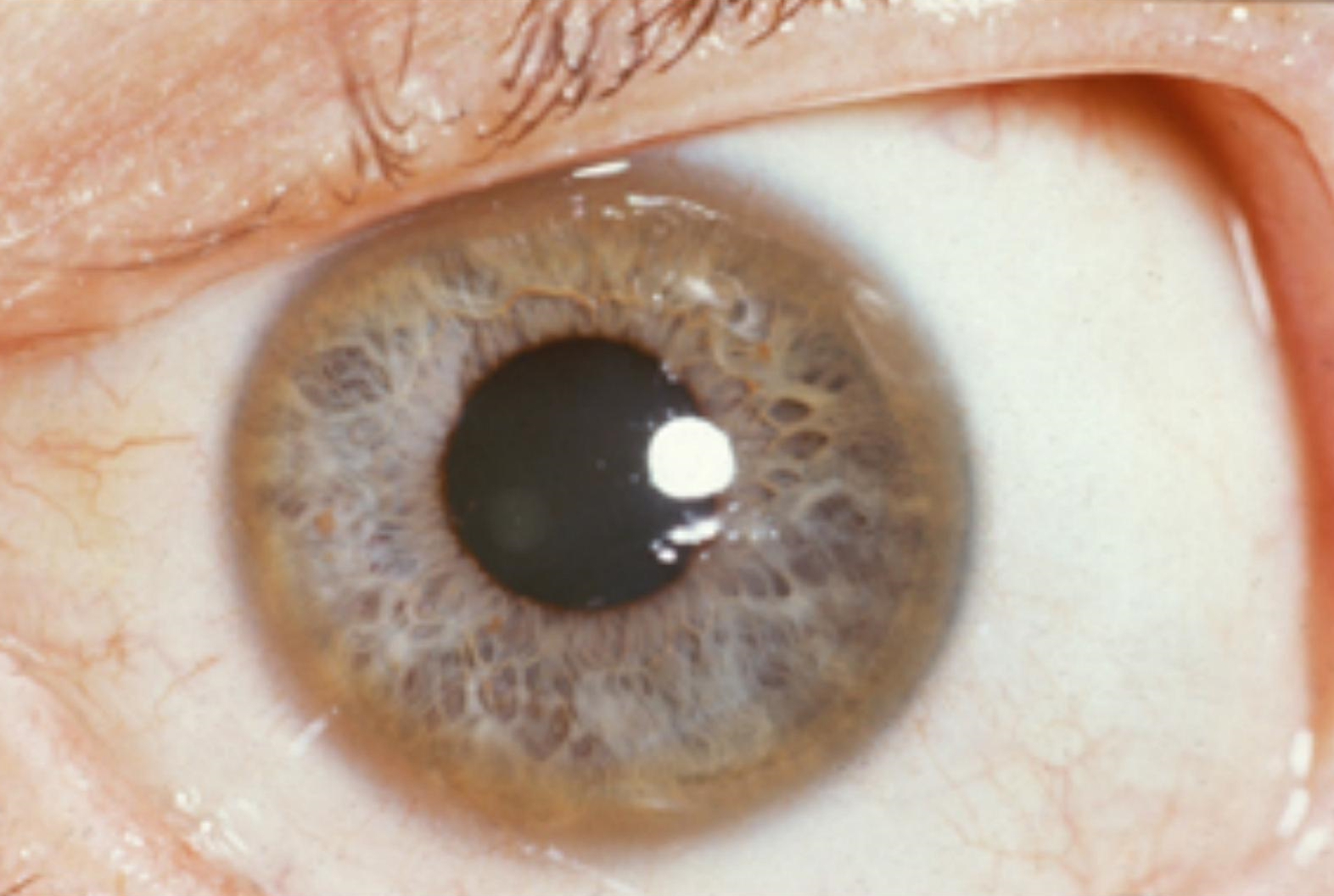
Рисунок 4. Кольцо Кайзера–Флешера.
Наиболее часто встречаются патологии печени, чаще всего именно проблемы с этим органом приводят пациентов к врачу, причем в раннем или среднем подростковом возрасте. Могут наблюдаться желтуха, повышенная утомляемость и склонность к кровотечениям, гипертензия портальной вены. Последний признак может усугубиться и привести к кровоточащим варикозам в пищеводе, что уже является опасным для жизни [24].
Примерно половина пациентов с болезнью Вильсона страдает от различных неврологических расстройств, так как экспрессия CTR1 в нервных клетках выше, соответственно, накопление меди здесь больше. Проявляются они сначала как обычная неуклюжесть и небольшие альтерации в поведении, потом же симптомы прогрессируют, приобретая форму паркинсонизма (брадикинезия, притупленное чувство баланса, нарушения речи). Характерный тремор руки, как и головные боли при этом присутствуют очень часто [25]. Кроме того, типичными являются проблемы с памятью, скоростью мышления, импульсивностью и апатией.
Нарушения в работе сердца (кардиомиопатии) и почек также могут сопровождать данную болезнь. Кроме того, может наблюдаться анемия, связанная с нарушением выработки и транспорта церулоплазмина, который, как мы помним, принимает участие в окислении железа и дальнейшем связывании его с трансферрином.
Основная рекомендация при болезни Вильсона — снизить потребление меди. Достигается это двумя способами: путем снижения поступления металла с пищей или применением хелаторов меди для ограничения токсичности тех ионов, которые уже оказались в организме.
Распространенность заболевания достигает примерно 30 случаев на 1 000 000 популяции. При этом в азиатских странах этот показатель почти в два раза выше — 58 заболевших на 1 000 000. Любопытно, что носителями мутации является почти 1 % населения.
Заболевание Менкеса
Заболевание Менкеса также связано с инактивирующей мутацией в АТФ-зависимой помпе, однако, на этот раз ATP7A. Что произойдет, если мы выключим этот транспортер (на месте читателя я бы сейчас остановился и подумал, что и вправду произойдет, а потом сравнил бы свои догадки с этим текстом)?
Итак, ATP7A, как мы уже знаем, находится на плазматической мембране энтероцитов и других клеток, за исключением гепатоцитов, где экспрессируется ATP7B. Интересно, что ген данного белка располагается на Х-хромосоме, поэтому заболевание чаще всего проявляется у мужчин, так как отсутствует вторая Х-хромосома. Нарушение функции этого транспортера будет приводить к тому, что меньшее количество меди будет поступать в организм, снижая активность систем, которые зависят от этого металла, т. е. будет развиваться эффект, обратный заболеванию Вильсона.
Какие же симптомы мы можем наблюдать у тех, кому не повезло с транспортером ATP7A? Самые очевидные признаки болезни Менкеса будут проявляться из-за снижения активности лизилоксидазы, что будет приводить к уменьшению числа сшивок в коллагене. Это, в свою очередь, будет приводить к тому, что волосы будут становиться редкими и курчавыми, а кожа недостаточно эластичной и упругой (рис. 5). Это один из самых ярких и заметных симптомов, поэтому болезнь Менкеса иногда называют болезнью курчавых волос [26].
Продолжительность жизни детей с болезнью Менкеса невелика и составляет в среднем 3 года. Универсального лечения не существует, однако назначение меди внутривенно (в форме ацетата или глицината) способно несколько облегчать состояние пациента. Эпидемиология заболевания включает 1 заболевшего на в среднем 250 тыс. новорожденных.
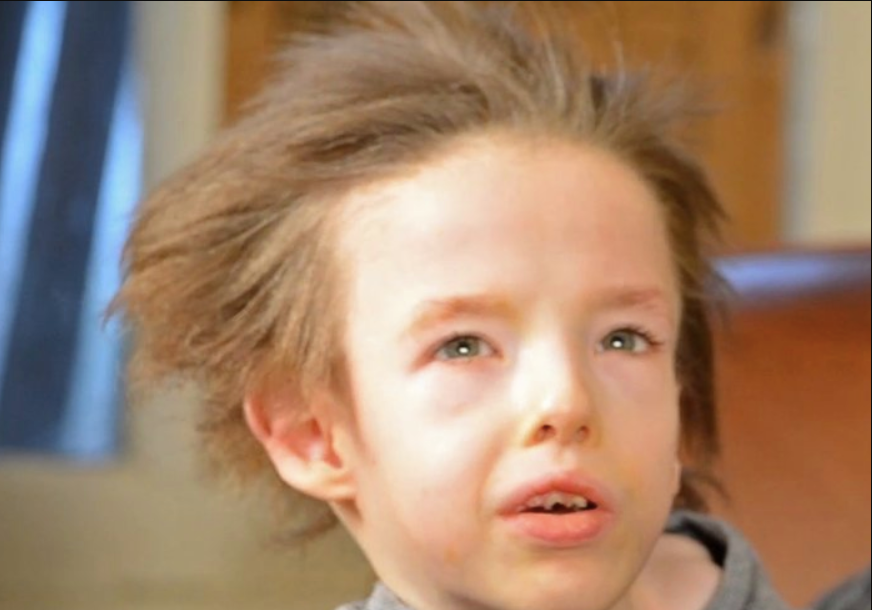
Рисунок 5. Ребенок с заболеванием Менкеса.
Анемия. Как мы уже говорили ранее, транспорт железа в организме зависит от церулоплазмина, который способствует окислению иона двухвалентного до трехвалентного и загрузке его на трансферрин. Так вот, если транспорт меди по каким-либо причинам нарушен, это приводит к нарушению синтеза церулоплазмина, и, соответственно, к проблемам в метаболизме железа. Таким образом проявляется взаимосвязь между двумя этими металлами в организме.
Нарушения проницаемости сосудов. Как было отмечено выше, медь является кофактором многих ферментов, одним из которых является лизилоксидаза. Нарушения ее функционирования приводят к неправильному созреванию коллагена, из-за чего стенка сосудов оказывается менее прочной и эластичной. В результате чаще всего возникает аневризма или даже разрыв аорты. Данное заболевание, как можно догадаться, может быть частью проявления заболевания Менкеса.
Гипопигментация. Так как медь принимает участие в синтезе меланина, то недостаток меди приводит к ослаблению пигментации кожи [27].
Роль меди в росте и развитии опухолевых заболеваний
Последняя часть нашей статьи будет посвящена роли меди в онкогенезе. Почему это важно? Во-первых, сейчас ведется множество исследований, которые указывают на необходимость меди для онкогенеза. Во-вторых, проводятся испытания ряда противоопухолевых препаратов, механизм действия которых так или иначе опосредован манипуляциями с внутриклеточным уровнем меди либо пересекается с метаболизмом этого металла. Итак, разберемся же в деталях.
Начнем с того, что внутриклеточный уровень меди в опухолевых тканях выше, нежели в здоровых [28]. Отчего так происходит? Дело в том, что медь имеет критическое значение сразу в нескольких процессах, так или иначе связанных с канцерогенезом, а именно: в контроле клеточного цикла, окислительного фосфорилирования, проопухолевого сигналинга и метастазирования. Если вспомнить функции медьсодержащих белков, то они легко накладываются на только что озвученное, поэтому мы легко можем представить, почему меди в раковых клетках больше: это позволяет им расти быстрее, получать больше ресурсов за счет ангиогенеза, а в будущем — метастазировать. Но ведь повышенные концентрации меди токсичны для клетки, почему же опухоль живет? Дело в том, что опухолевые клетки начинают экспрессировать больше металлотионеинов и металлошаперонов [29], а также имеют повышенное содержание глутатиона [30], что позволяет им выживать. Давайте также взглянем чуть внимательнее, откуда тут взялся сигналинг? Неужели медь может принимать участие в обработке сигналов в клетке, влиять на работу каскадов? И ответом будет «да».
Как мы уже знаем, белок Atox1 способен проникать в ядро и связываться там с ДНК, изменяя экспрессию генов, в частности, циклина D1. Таким образом, медь способна влиять на протекание клеточного цикла. Этим дело не ограничивается, ведь новые исследования обнаруживают, что поступление меди необходимо для реализации MAPK-каскада [31], [32]. Напомним, что MAPK-каскад является белковым каскадом, который обеспечивает передачу сигнала от рецепторов факторов роста в ядро (рис. 6). Медь, как оказалось, необходима для фосфорилирования одного из участников каскада (а именно, ERK1) другим участником каскада (MEK1). Исследователи обнаружили, что уменьшение концентрации меди, вызванное нокаутом Ctr1 или добавлением хелаторов, снижает B-RAF-опосредованный сигналинг. Таким образом, препараты, использующиеся для лечения болезни Вильсона, возможно применять для борьбы с опухолевыми заболеваниями. Но это лишь один из множества сигнальных путей [33].

Рисунок 6. Каскад MAPK (mitogen-activated protein kinase). Сигнальный каскад обеспечивает передачу сигнала от ростовых факторов в ядро через серию реакций фосфорилирования, которые осуществляются консервативными протеинкиназами. На рисунке представлена упрощенная схема ERK-пути каскада, который регулирует рост и пролиферацию клеток.
Помимо этого, медь также способна влиять на каскады NF-kB [34], HIF1 [35], Akt [36] и JNK [37]. Пока нет четкого понимания, каков именно механизм влияния в каждом случае. Одни предполагают, что имеет место генерация АФК, которая уже и влияет на сам каскад. Другие утверждают, что медь влияет непосредственно, связываясь с определенными сайтами в белках. Кроме того, не следует забывать, что многие каскады пересекаются друг с другом, а потому требуется дополнительно определять, где имеет место прямое воздействие, а где оно реализуется через активацию совершенно других механизмов. Сейчас очевидно лишь то, что влияние меди на клеточный рост и пролиферацию гораздо существеннее, чем считалось ранее, и этот металл способен запускать или угнетать иногда весьма специфические механизмы.
Совокупность всех этих исследований и открытий позволила сделать весьма логичный вывод о том, что манипуляции с внутри- и внеклеточным уровнем меди могут использоваться для противоопухолевой терапии. Более того, новые препараты позволяют по-новому воздействовать на клетку, что, в свою очередь, позволяет открывать новые аспекты молекулярных механизмов. Эти разработки отталкиваются от простого факта, что меди в клетках больше, а значит, с одной стороны, снижение концентрации хелаторами должно давать позитивный эффект, а с другой, превышение некоего предела концентрации также должно эффективно снижать выживаемость опухолевых клеток из-за накопления металла и реализации цитотоксического воздействия. Это в теории, а что есть на практике? Давайте рассмотрим, какие сейчас есть препараты, как они работают и на какой стадии разработки находятся.
Существует несколько классов таких веществ, а именно: хелаторы меди, медные комплексы и специфические ингибиторы медь-связывающих белков. Пройдемся по всем по порядку.
| Класс препарата | Описание | Примеры и ссылки |
|---|---|---|
| Хелаторы меди | Данная группа препаратов, действие которых направлено на снижение концентрации ионов меди в клетке, наиболее изучена. Противоопухолевый эффект при этом реализуется частично из-за снижения активности антиоксидантных систем (медь ведь входит в состав супероксиддисмутазы) и окислительного стресса, а частично из-за метаболических нарушений и замедления пролиферации. Препараты находятся на разных стадиях клинических испытаний. Доказана эффективность на лабораторных животных. |
Тетратиомолибдат [38], D-пеницилламин [39], дитиокарбаматы [40], куркумин [41], куместрол [42]. |
| Медьорганические комплексы и ионофоры | Данный подход противоположен хелаторам и реализуется за счет дополнительной накачки опухолевых клеток медью, что вызывает повреждение органелл, мембран, белков и нуклеиновых кислот, приводя в конечном итоге к гибели. В данном случае противоопухолевый эффект также реализуется за счет генерации АФК, однако причина прямо противоположна: меди становится слишком много. Такие соединения даже предлагается использовать совместно с диетой с повышенным содержанием меди. Данные вещества также проходят клинические испытания. Пока противоопухолевая эффективность не доказана. |
Органические комплексы меди на основе бистиосемикарбазона [43], оснований Шиффа [44], а также ионофоры: дисульфирам [38], N-ацетилцистеин [45]. |
| Специфические ингибиторы | Данный класс соединений появился сравнительно недавно, так как раньше не было большой необходимости в ингибировании специфических белков, вовлеченных в метаболизм меди. В данный момент существуют малые молекулы, специфично ингибирующие Atox1 и CCS, а также SOD1. Среди молекулярно-биологических последствий авторы вновь описывают окислительный стресс (что, скорее всего, связано с нарушениями функционирования SOD1), а также снижение синтеза АТФ. Оба соединения пока находятся на стадии исследований in vitro. |
DC_AC50 (ингибитор Atox1 и CCS) [46], ATN-224 (ингибитор SOD1) [47]. |
Вы, должно быть, обратили внимание, что применение всех обозначенных выше соединений приводит к окислительному стрессу. Здесь проявляется все та же особенность меди, с которой мы начали наш рассказ, а именно, способность находиться в двух степенях окисления и участвовать в окислительно-восстановительных реакциях. Хотя применение препаратов, описанных выше, еще не началось, результаты проведенных экспериментов довольно многообещающие. Причем развитие идет по нескольким направлениям, так что мы можем ожидать хороших результатов. Конечно, нельзя считать это панацеей, но свою нишу данная терапевтическая стратегия точно найдет.
Пара слов в конце
Итак, пришло время завершать наше краткое знакомство с медью и ее биологическим значением для человека. В конце хотелось бы сделать краткий комментарий, который внимательный читатель наверняка сделал про себя сам: метаболизм меди довольно непрост и при этом изучен не до конца. Как именно происходит регуляция поступления и перераспределения металла на системном уровне? Активность каких сигнальных каскадов может изменяться в зависимости от концентрации меди? Каковы механизмы этого влияния, и первостепенна ли роль АФК? Насколько больших успехов можно добиться в области лечения онкологических заболеваний, используя эти знания? Ответы на эти вопросы ждут своего часа и своего исследователя, но абсолютно уверенно можно сказать, что изучение метаболизма металлов, не только меди — это тренд, который набирает популярность, и приведет нас не к одному удивительному открытию.
Литература
- C. A. Flemming, J. T. Trevors. (1989). Copper toxicity and chemistry in the environment: a review. Water Air Soil Pollut. 44, 143-158;
- James P Kehrer. (2000). The Haber–Weiss reaction and mechanisms of toxicity. Toxicology. 149, 43-50;
- Marisa G. Repetto, Nidia F. Ferrarotti, Alberto Boveris. (2010). The involvement of transition metal ions on iron-dependent lipid peroxidation. Arch Toxicol. 84, 255-262;
- Немного о железе. Теория;
- Maria C. Linder Biochemistry of Copper — Springer US, 1991;
- Fang Hao, Mingyang Jing, Xingchen Zhao, Rutao Liu. (2015). Spectroscopy, calorimetry and molecular simulation studies on the interaction of catalase with copper ion. Journal of Photochemistry and Photobiology B: Biology. 143, 100-106;
- Ross A., Caballero B., Cousins R., Tucker K., Ziegler T. In: Modern Nutrition in Health and Disease: Eleventh edition. Baltimore: Lippincott Williams & Wilkins, 2014. P. 206–216;
- Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc — National Academies Press, 2001;
- Ali Shawki, Sarah R. Anthony, Yasuhiro Nose, Melinda A. Engevik, Eric J. Niespodzany, et. al.. (2015). Intestinal DMT1 is critical for iron absorption in the mouse but is not required for the absorption of copper or manganese. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, G635-G647;
- Robert S. Ohgami, Dean R. Campagna, Alice McDonald, Mark D. Fleming. (2006). The Steap proteins are metalloreductases. Blood. 108, 1388-1394;
- Yuta Hatori, Svetlana Lutsenko. (2016). The Role of Copper Chaperone Atox1 in Coupling Redox Homeostasis to Intracellular Copper Distribution. Antioxidants. 5, 25;
- Nikita Gudekar, Vinit Shanbhag, Yanfang Wang, Martina Ralle, Gary A. Weisman, Michael J. Petris. (2020). Metallothioneins regulate ATP7A trafficking and control cell viability during copper deficiency and excess. Sci Rep. 10;
- Xiqian Jiang, Jianwei Chen, Aleksandar Bajić, Chengwei Zhang, Xianzhou Song, et. al.. (2017). Quantitative real-time imaging of glutathione. Nat Commun. 8;
- Edward B. Maryon, Shannon A. Molloy, Jack H. Kaplan. (2013). Cellular glutathione plays a key role in copper uptake mediated by human copper transporter 1. American Journal of Physiology-Cell Physiology. 304, C768-C779;
- Nigel J. Robinson, Dennis R. Winge. (2010). Copper Metallochaperones. Annu. Rev. Biochem.. 79, 537-562;
- Shinichi Itoh, Ha Won Kim, Osamu Nakagawa, Kiyoshi Ozumi, Susan M. Lessner, et. al.. (2008). Novel Role of Antioxidant-1 (Atox1) as a Copper-dependent Transcription Factor Involved in Cell Proliferation. Journal of Biological Chemistry. 283, 9157-9167;
- Wissam Beaino, Yunjun Guo, Albert J. Chang, Carolyn J. Anderson. (2014). Roles of Atox1 and p53 in the trafficking of copper-64 to tumor cell nuclei: implications for cancer therapy. J Biol Inorg Chem. 19, 427-438;
- Patricia A.J. Muller, Leo W.J. Klomp. (2009). ATOX1: A novel copper-responsive transcription factor in mammals?. The International Journal of Biochemistry & Cell Biology. 41, 1233-1236;
- Eve A. Roberts. (2012). Using metalloproteomics to investigate the cellular physiology of copper in hepatocytes. Metallomics. 4, 633;
- N. O. Johnson, T. Kheim, W. B. Kountz. (1959). Influence of Sex Hormones on Total Serum Copper.. Experimental Biology and Medicine. 102, 98-99;
- Lucianna Fernandes J. C. Marques, Carmen Marino Donangelo, Juliana Gastao Franco, Luciane Pires, Aderval Severino Luna, et. al.. (2011). Plasma Zinc, Copper, and Serum Thyroid Hormones and Insulin Levels After Zinc Supplementation Followed by Placebo in Competitive Athletes. Biol Trace Elem Res. 142, 415-423;
- Belinda Hardman, Agnes Michalczyk, Mark Greenough, James Camakaris, Julian F. B. Mercer, M. Leigh Ackland. (2007). Hormonal regulation of the Menkes and Wilson copper-transporting ATPases in human placental Jeg-3 cells. Biochemical Journal. 402, 241-250;
- Elaine Hilário-Souza, Martine Cuillel, Elisabeth Mintz, Peggy Charbonnier, Adalberto Vieyra, et. al.. (2016). Modulation of hepatic copper-ATPase activity by insulin and glucagon involves protein kinase A (PKA) signaling pathway. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1862, 2086-2097;
- Anna Członkowska, Tomasz Litwin, Petr Dusek, Peter Ferenci, Svetlana Lutsenko, et. al.. (2018). Wilson disease. Nat Rev Dis Primers. 4;
- Peter Ferenci, Karel Caca, Georgios Loudianos, Georgina Mieli-Vergani, Stuart Tanner, et. al.. (2003). Diagnosis and phenotypic classification of Wilson disease1. Liver International. 23, 139-142;
- Zeynep Tümer, Lisbeth B Møller. (2010). Menkes disease. Eur J Hum Genet. 18, 511-518;
- Vincent J. Hearing. (2011). Determination of Melanin Synthetic Pathways. Journal of Investigative Dermatology. 131, E8-E11;
- Delphine Denoyer, Shashank Masaldan, Sharon La Fontaine, Michael A. Cater. (2015). Targeting copper in cancer therapy: ‘Copper That Cancer’. Metallomics. 7, 1459-1476;
- E.A. Ostrakhovitch, Y.P. Song, M.G. Cherian. (2016). Basal and copper-induced expression of metallothionein isoform 1,2 and 3 genes in epithelial cancer cells: The role of tumor suppressor p53. Journal of Trace Elements in Medicine and Biology. 35, 18-29;
- Anshul Gupte, Russell J. Mumper. (2009). Elevated copper and oxidative stress in cancer cells as a target for cancer treatment. Cancer Treatment Reviews. 35, 32-46;
- Cheng-Yu Tsai, J. Cameron Finley, Sameh S. Ali, Hemal H. Patel, Stephen B. Howell. (2012). Copper influx transporter 1 is required for FGF, PDGF and EGF-induced MAPK signaling. Biochemical Pharmacology. 84, 1007-1013;
- Donita C. Brady, Matthew S. Crowe, Michelle L. Turski, G. Aaron Hobbs, Xiaojie Yao, et. al.. (2014). Copper is required for oncogenic BRAF signalling and tumorigenesis. Nature. 509, 492-496;
- 10.18027/2224-5057-2015-4s2-20-27;
- V L Goodman, G J Brewer, S D Merajver. (2004). Copper deficiency as an anti-cancer strategy.. Endocr Relat Cancer. 11, 255-263;
- Damiano Cosimo Rigiracciolo, Andrea Scarpelli, Rosamaria Lappano, Assunta Pisano, Maria Francesca Santolla, et. al.. (2015). Copper activates HIF-1α/GPER/VEGF signalling in cancer cells. Oncotarget. 6, 34158-34177;
- Elena A. Ostrakhovitch, Mohammad Reza Lordnejad, Freimut Schliess, Helmut Sies, Lars-Oliver Klotz. (2002). Copper Ions Strongly Activate the Phosphoinositide-3-Kinase/Akt Pathway Independent of the Generation of Reactive Oxygen Species. Archives of Biochemistry and Biophysics. 397, 232-239;
- Michael D. Mattie, Matthew K. McElwee, Jonathan H. Freedman. (2008). Mechanism of Copper-Activated Transcription: Activation of AP-1, and the JNK/SAPK and p38 Signal Transduction Pathways. Journal of Molecular Biology. 383, 1008-1018;
- Manuel Rieber. (2020). Cancer Pro-oxidant Therapy Through Copper Redox Cycling: Repurposing Disulfiram and Tetrathiomolybdate. CPD. 26, 4461-4466;
- Anshul Gupte, Russell J. Mumper. (2007). Copper chelation by D-penicillamine generates reactive oxygen species that are cytotoxic to human leukemia and breast cancer cells. Free Radical Biology and Medicine. 43, 1271-1278;
- Yanhong Li, Hongxue Qi, Xiaobo Li, Xueling Hou, Xueying Lu, Xiangwen Xiao. (2015). A novel dithiocarbamate derivative induces cell apoptosis through p53-dependent intrinsic pathway and suppresses the expression of the E6 oncogene of human papillomavirus 18 in HeLa cells. Apoptosis. 20, 787-795;
- Wei Zhang, Changmai Chen, Hengfei Shi, Manyi Yang, Yu Liu, et. al.. (2016). Curcumin is a biologically active copper chelator with antitumor activity. Phytomedicine. 23, 1-8;
- Atif Zafar, Swarnendra Singh, Imrana Naseem. (2017). Cytotoxic activity of soy phytoestrogen coumestrol against human breast cancer MCF-7 cells: Insights into the molecular mechanism. Food and Chemical Toxicology. 99, 149-161;
- Franco Bisceglie, Rossella Alinovi, Silvana Pinelli, Maricla Galetti, Marianna Pioli, et. al.. (2016). Autophagy and apoptosis: studies on the effects of bisthiosemicarbazone copper(
ii ) complexes on p53 and p53-null tumour cell lines. Metallomics. 8, 1255-1265; - Emil Bulatov, Regina Sayarova, Rimma Mingaleeva, Regina Miftakhova, Marina Gomzikova, et. al.. (2018). Isatin-Schiff base-copper (II) complex induces cell death in p53-positive tumors. Cell Death Discovery. 4;
- Jie Zheng, Jessica R. Lou, Xiao-Xi Zhang, Doris M. Benbrook, Marie H. Hanigan, et. al.. (2010). N-Acetylcysteine interacts with copper to generate hydrogen peroxide and selectively induce cancer cell death. Cancer Letters. 298, 186-194;
- Jing Wang, Cheng Luo, Changliang Shan, Qiancheng You, Junyan Lu, et. al.. (2015). Inhibition of human copper trafficking by a small molecule significantly attenuates cancer cell proliferation. Nature Chem. 7, 968-979;
- Andrea Glasauer, Laura A. Sena, Lauren P. Diebold, Andrew P. Mazar, Navdeep S. Chandel. (2014). Targeting SOD1 reduces experimental non–small-cell lung cancer. J. Clin. Invest.. 124, 117-128.






