Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?
22 декабря 2020
Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?
- 1268
- 0
- 10
-
Автор
-
Редакторы
Темы
Революционный метод лечения злокачественных опухолей, известный как неклеточная иммунотерапия ингибиторами контрольных точек иммунного ответа, — один из ведущих предметов исследования в онкологии. Несмотря на потенциально высокую эффективность, имеет ряд проблем, решение которых станет толчком не только к его активному развитию, но и широкому применению в клинической практике — в отношении всех без исключения локализаций злокачественных новообразований, независимо от стадии. Однако подвластно ли это человеческому разуму в наши дни?
История открытия контрольных точек иммунного ответа
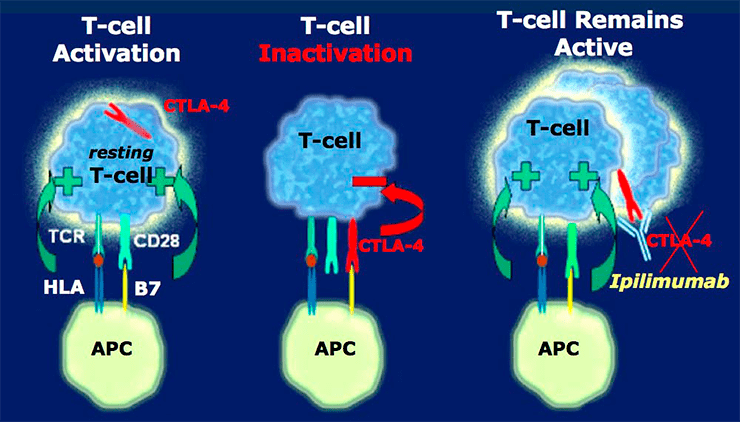
Открытие контрольных точек иммунного ответа — революция в онкоиммунологии . Это поворотное событие произошло в 90-х годах прошлого столетия благодаря упорной работе выдающегося американского иммунолога Джеймса Эллисона — преподавателя Техасского университета. В результате многолетних исследований на мышиных моделях и многочисленных попыток понять сущность взаимодействия злокачественного новообразования с иммунной системой организма-хозяина, он обнаружил, что в борьбу со злокачественной опухолью цитотоксических Т-лимфоцитов — основной популяции клеточного иммунитета — вмешиваются Т-регуляторные клетки, которые постоянно экспонируют на своей мембране молекулу CTLA-4 (рис. 1). Исходя из названия, эти клетки, в целом, регулируют процесс иммунного ответа. Они различаются по происхождению и функциям. Выделяют естественные (природные) и адаптивные субпопуляции. Естественные Т-регуляторные клетки формируются непосредственно в тимусе, адаптивные образуются из зрелых Т-лимфоцитов в результате антигенной стимуляции. Миссия естественных Т-регуляторов заключается в подавлении аутоагрессивных клонов и поддержании толерантности к антигенам плода при беременности во избежание самопроизвольного аборта. Адаптивные же Т-регуляторы препятствуют развитию аутоиммунных заболеваний, а также отторжению тканей после трансплантации органа. Иммунная система макроорганизма, как показывают исследования Джеймса Эллисона (рис. 2), способна распознавать злокачественную опухоль, и дендритные клетки, выступающие в роли антигенпрезентирующих клеток, захватывая опухолевые антигены, знакомят с ними «наивные» Т-лимфоциты (ранее не контактировавшие с антигенами) посредством формирования иммунологического синапса — контакта антигенпрезентирующей клетки (дендритной клетки) с клеткой-мишенью — «наивным» Т-лимфоцитом (в случае адаптивного иммунитета) либо натуральным киллером (NK-клеткой в случае врожденного иммунитета). Ключевым этапом в формировании синапса будет связь антигена с антигенспецифическим рецептором (Т-клеточным рецептором), необходимая для активации «наивного» Т-лимфоцита и дальнейшего уничтожения им чужеродных молекул. Иными словами, этот процесс и становится пусковым механизмом иммунного ответа.
Онкоиммунология — медицинская наука, изучающая закономерности взаимодействия иммунной системы с опухолью.
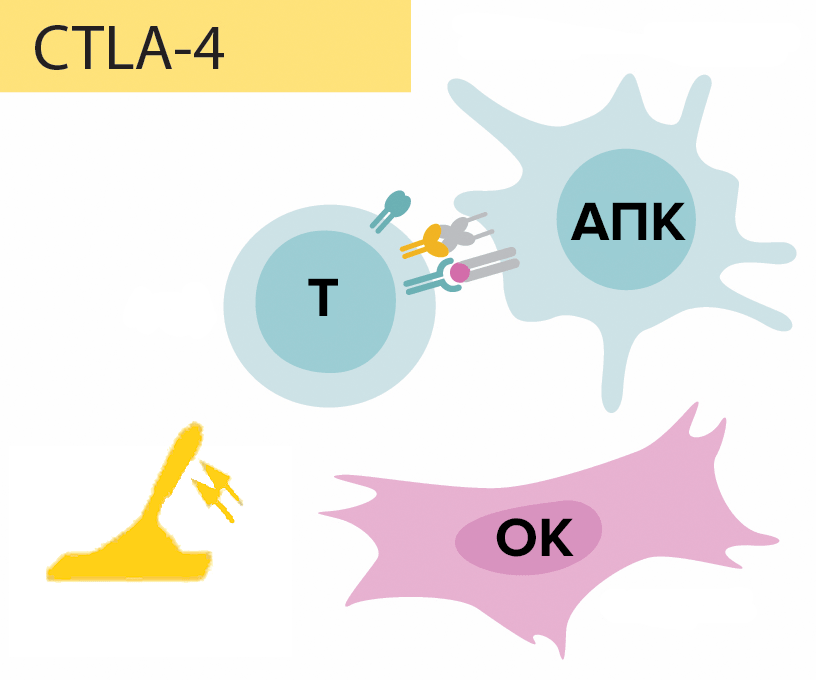
Рисунок 1. Схема функционирования молекулы CTLA-4. Сформированный иммунологический синапс активирует «наивный» цитотоксический Т-лимфоцит (Т-киллер), и на его мембране выставляется молекула CTLA-4. Она передает Т-киллеру ингибирующий сигнал (механизм досконально не изучен), иначе говоря, действует подобно рычагу. В результате «наивный» цитотоксический Т-лимфоцит утрачивает способность к образованию специфичных клонов с последующей их дифференцировкой в рабочие (эффекторные) Т-киллеры, которые элиминируют опухолевые антигены.
Treatments that cause the immune system to attack cancer earn a Nobel, рисунок адаптирован
Помимо этого важны костимулирующие и корецепторные взаимодействия мембранных белков антигенпрезентирующей клетки и «наивного» Т-лимфоцита, способствующие его активации. Мембранными белками-стимуляторами антигенпрезентирующей клетки являются белки CD80/86, белками Т-лимфоцитов — CD28. Молекула CTLA-4 передает ингибирующий сигнал цитотоксическому Т-лимфоциту, тем самым подавляя иммунологическую реактивность в начальной фазе иммунного ответа — индуктивной. Она состоит из следующих этапов:
- переработка (процессинг) антигена и представление его «наивным» цитотоксическим Т-лимфоцитам либо Т-лимфоцитам-хелперам;
- формирование иммунологического синапса;
- активация «наивных» Т-клеток;
- пролиферация (деление) их специфических (в зависимости от типа антигена — внеклеточный или внутриклеточный инфекционный агент (бактерия / вирус / гриб), опухолевый и т.д.) клонов;
- дифференцировка клонов Т-клеток в рабочие (эффекторные) клетки и клетки памяти.
Индуктивная фаза иммунного ответа реализуется в течение первых 5–7 суток с момента попадания чужеродной молекулы в организм.
Важно понимать, что процесс иммунного ответа слагается из двух фаз, второй из которых является эффекторная фаза, в которой происходит элиминация (удаление, уничтожение) чужеродного антигена из организма и формирование иммунологической памяти. Это отличает адаптивный иммунитет от врожденного. Иммунологическая память — феномен, при котором антигенспецифические клоны Т- либо B-клеток — клетки памяти, которые ранее контактировали с тем или иным чужеродным антигеном, — запоминают его, и при повторном внедрении его в организм ускоренно и усиленно элиминируют (уничтожают) его. Например, течение вирусной либо бактериальной инфекции изначально может быть средней тяжести, или тяжелым и длительным. Если формируется стойкий иммунитет к ней, то в случае повторного инфицирования (повторном контакте с каким-либо из данных антигенов) ее течение более легкое и короткое, так как антиген (патоген — вирус или бактерия) элиминируется в два раза быстрее, чем при первом контакте с ним.
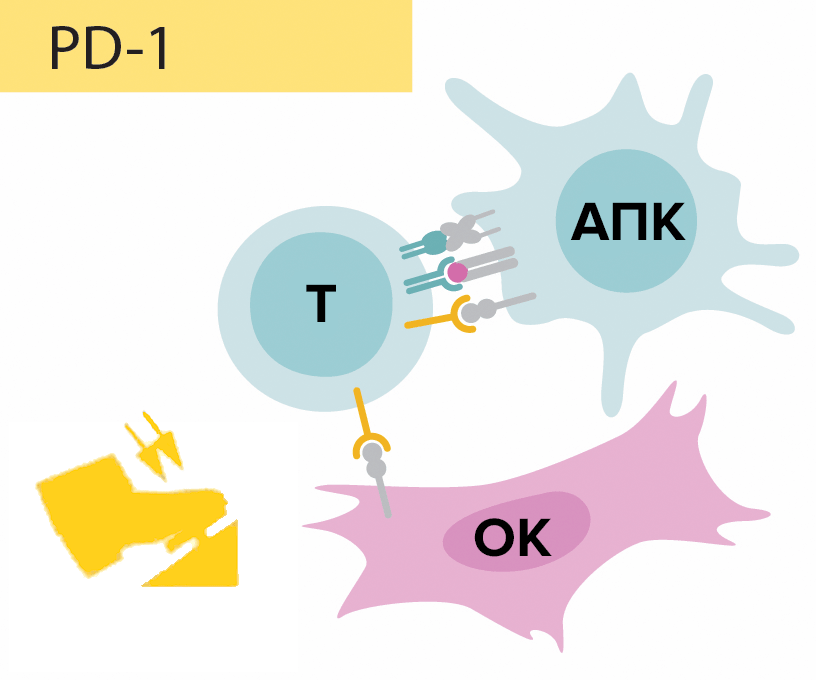
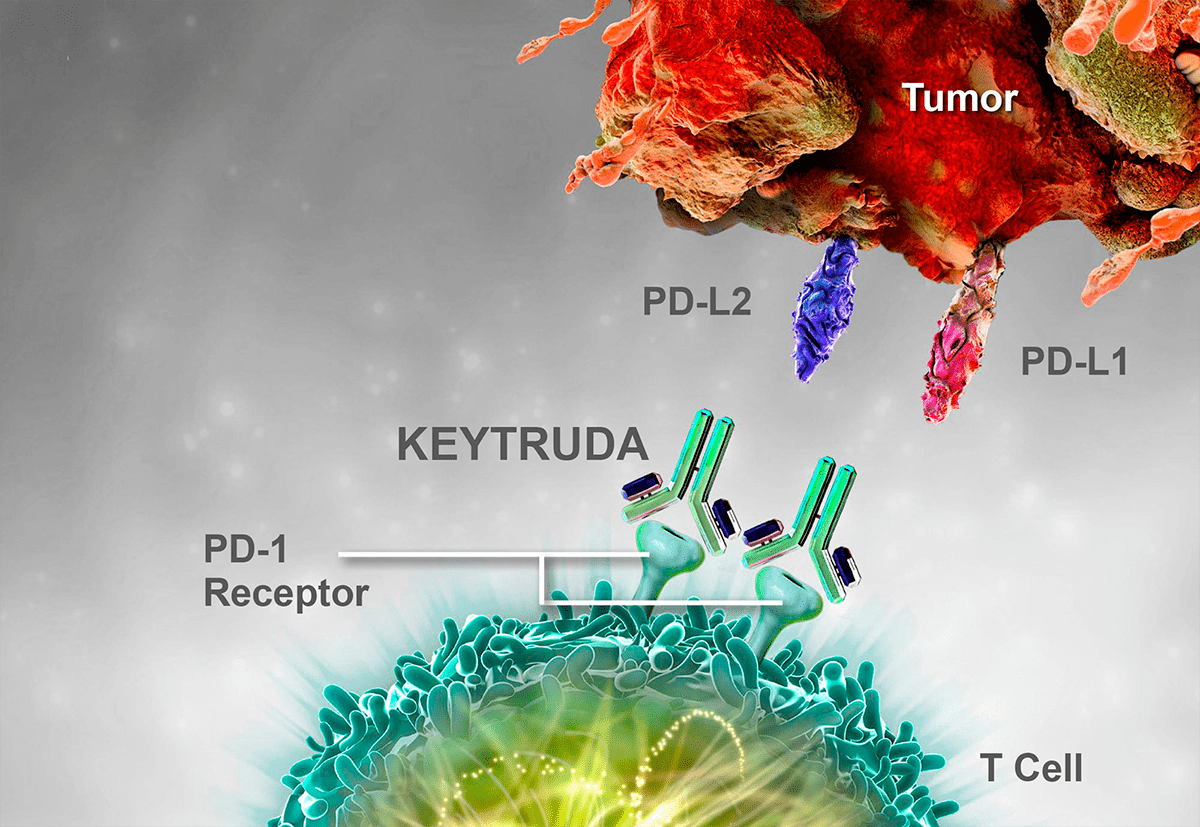
Японский иммунолог Тасуку Хондзё (рис. 2), профессор университета Киото, и его команда, проведя исследования также на мышиных моделях, обнаружили еще одну молекулу — белок PD-1, экспонируемый на мембране активированных Т-лимфоцитов, в то время как опухолевые клетки выставляют на своей мембране белки PD-L1 и PD-L2, являющиеся лигандами белка PD-1. Образовавшийся сигнальный путь PD-1/PD-L1, PD-L2 (рис. 3) вдвойне стимулирует апоптоз активированных Т-киллеров, что препятствует дальнейшему осуществлению иммунного ответа, иначе говоря, подавляет иммунный ответ в эффекторной фазе [1]. Если же сигнальный каскад не сработает, то иммунная система будет атаковать собственные здоровые ткани организма, что приведет к развитию аутоиммунных заболеваний. Этим и значимы контрольные точки иммунного ответа — они обеспечивают адекватность функционирования иммунной системы, регулируя процесс иммунного ответа (в отличие от Т-регуляторных клеток они не оказывают влияние на клоны Т-лимфоцитов), тем самым препятствуя развитию аутоиммунных процессов.
На основе этих выдающихся исследований разработан новый класс препаратов гуманизированных моноклональных антител [2]. Они были получены в конце 80-х годов XX века путем замены в составе антигена белков иммунизированной мыши белками человека [2]. Связываясь с молекулами CTLA-4 и PD-1 на поверхности злокачественно трансформированных клеток, эти антитела ингибируют контрольные точки иммунного ответа и тем самым способствуют уничтожению злокачественной опухоли собственными защитными силами организма. Первые представители этого класса препаратов — ипилимумаб (антагонист CTLA-4; рис. 4), ниволумаб, пембролизумаб (ингибитор PD-1; рис. 5) — в ходе клинических испытаний оказались эффективными в отношении меланомы и немелкоклеточного рака легкого.
Меланома — злокачественная опухоль кожи, реже слизистых оболочек (полости рта, чаще всего десны, влагалища, прямой кишки), сетчатки глаза, — образуется из пигментных клеток — меланоцитов. Меланома кожи является одной из наиболее опасных злокачественных опухолей, поскольку метастазирует стремительно: ответная реакция организма оказывается весьма слабой (в том числе и со стороны иммунной системы) а распространение — обширное, поражаются практически все органы и ткани организма-хозяина.
Немелкоклеточный рак легкого — гистологическое название злокачественной опухоли легкого. Такое название опухоль получила исходя из того, что при окраске среза биоптата легкого, в нем не обнаруживались мелкоклеточные элементы. Различают две локализации первичной опухоли: центральный рак — локализуется в области бронха крупного калибра, отходящего от трахеи, или периферический рак — локализуется в области бронхов мелкого калибра либо бронхиол, отдаленных от трахеи. Клиническая симптоматика центрального рака легкого проявляется раньше периферического вследствие ускоренного развития дыхательной недостаточности, что является непосредственной причиной смерти при раке легкого как крупноклеточном, так и мелкоклеточном, аденокарциноме легкого и т.д.
Выдающийся успех неклеточной иммунотерапии
Экспериментальную терапию меланомы провели в 2015 году с грандиозным успехом. Испытуемым был 39-й Президент США Джимми Картер, который, в почтенном возрасте узнав о смертельном диагнозе — четвертой стадии меланомы с отдаленными метастазами в головной мозг, — публично попрощался с народом, при этом тайно дав согласие на экспериментальное лечение пембролизумабом. На тот момент стандартом лечения онкологических заболеваний в развитых странах была химиотерапия препаратами, непосредственно влияющими на пролиферацию клеток. Такие лекарства высокотоксичны и имеют значительное количество побочных эффектов, поскольку оказывает влияние на все быстро делящиеся клетки. В связи с этим разрабатывалась таргетная терапия, которая постепенно вытесняла стандартную химиотерапию.
В результате контрольное МРТ-сканирование не выявило в ткани мозга Картера метастатических очагов меланомы [3].
Проблемы неклеточной иммунотерапии
Иммунотерапия ингибиторами контрольных точек иммунного ответа, несомненно, одно из наиболее прогрессивных и активно развивающихся направлений таргетной терапии рака. Однако в чем кроется причина избирательного действия препаратов антител на злокачественные новообразования?
Во-первых, исходя из того, что данный вид таргетной терапии находится на ранней стадии развития, далеко не все препараты испытаны на всех без исключения видах злокачественных опухолей, следовательно, недостаточно данных об их фармакодинамике и побочных эффектах.
Во-вторых, злокачественная опухоль способна «ускользать» от иммунологического надзора еще несколькими путями, в которых не задействованы иммунные чекпойнты:
- Низкой иммуногенностью или отсутствием антигенного эпитопа. В данной ситуации иммунная система не распознает опухолевые антигены как чужеродные молекулы. Это характерно для низкодифференцированных опухолей, где злокачественно перерожденные клетки очень похожи на нормальные клетки, следовательно, схожи их антигенные структуры. Иммунной системе очень легко их принять за свои.
- Антигенной вариабельностью — частым изменением антигена. В этом случае иммунная система распознает только некоторые клоны злокачественных клеток, в связи с чем и не способна полностью уничтожить опухоль.

Рисунок 6. Андреа Шитинджер, доцент кафедры иммунологии и патогенеза микроорганизмов, ассистент программы иммунологии в онкологическом центре Мемориал Слоан Кеттеринг
Изучением проблем неклеточной иммунотерапии также занимались ученые из Института изучения рака в Лондоне (Великобритания), в том числе и Андреа Шитинджер (рис. 6), доцент кафедры иммунологии и патогенеза микроорганизмов, ассистент программы иммунологии в онкологическом центре Мемориал Слоан Кеттеринг.
Она и ее команда, проведя исследования на мышиных моделях, идентифицировали белок TOX, который селективно (избирательно) воздействует на процесс дифференцировки тимоцитов . Они задались вопросом: значим ли этот фактор клинически и физиологически в отношении человека? Для проверки этого провели испытания на пациентах с четырьмя различными видами злокачественных опухолей: раком молочной железы, яичников, легкого и меланомой. Оказалось, что белок TOX интенсивно синтезируется в организме человека и приводит к формированию тех же субпопуляций Т-лимфоцитов, что и в организме мыши — цитотоксических Т-лимфоцитов и Т-регуляторных клеток [4]. Гипотетически эти субпопуляции Т-клеток не только экспонируют молекулы CTLA-4 и PD-1, но и способствуют формированию резистентности злокачественных опухолей к терапии ингибиторами иммунных чекпойнтов.
Тимоциты — незрелые клетки тимуса (вилочковой железы), предшественники «наивных» Т-лимфоцитов.
В заключение следует сказать, что как бы стремительно не развивалась онкология как наука, сложно что-либо прогнозировать в лечении онкологических заболеваний. Их исход практически во всем зависит от потенциала организма пациента, что, к сожалению, на данном этапе предсказать невозможно.
Литература
- Yoshiko Iwai, Junzo Hamanishi, Kenji Chamoto, Tasuku Honjo. (2017). Cancer immunotherapies targeting the PD-1 signaling pathway. J Biomed Sci. 24;
- Моноклональные антитела;
- Лечение Джимми Картера;
- Brodsky A.N. (2020). Meet Dr. Andrea Schietinger, one of our new Lloyd J. Old STAR scientists. Cancer Research Institute.