Прямо в мозг: препятствия и способы их преодолеть
03 марта 2021
Прямо в мозг: препятствия и способы их преодолеть
- 4700
- 0
- 6
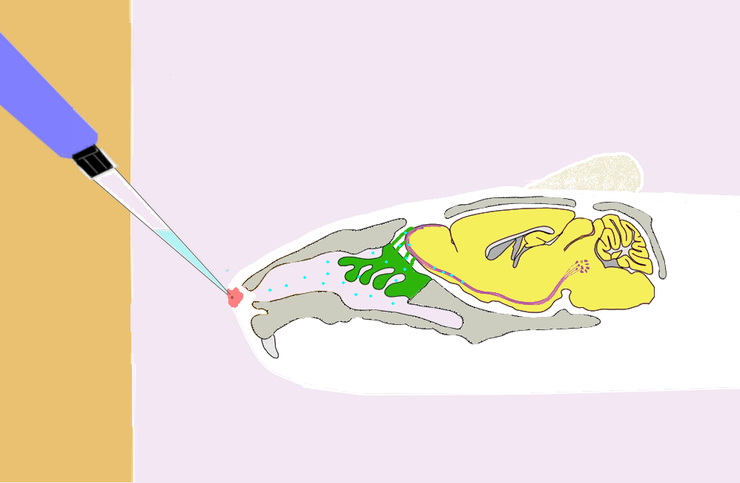
Введение наночастиц в носовую полость мыши для изучения транспорта веществ в мозг в обход гематоэнцефалического барьера.
Рисунок в полном размере.
рисунок автора статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В ходе работы мы выяснили механизм проникновения наночастиц из носовой полости в мозг, минуя гематоэнцефалический барьер (ГЭБ). Для этого были использованы наночастицы оксида марганца (Mn3O4), которые визуализировались при томографии. На данный момент описано несколько возможных путей транспорта веществ из носовой полости в мозг, но точный механизм еще не определен. Чтобы увидеть, как именно наночастицы проникают в мозг, проводились серии экспериментов по блокированию захвата/транспорта наночастиц в нейронах; проверялась и гипотеза транспорта по внеклеточному пространству. Актуальность данной работы — выявление путей доставки лекарственных препаратов и изучение проникновения вирусов в мозг в обход ГЭБ.
Конкурс «Био/Мол/Текст»-2020/2021
 Фаворит Российского научного фонда в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Фаворит Российского научного фонда в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Партнер номинации — Российский научный фонд.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
В организме человека существует специальная система защиты мозга от проникновения в него крупных молекул, в том числе инфекционных агентов — это гематоэнцефалический барьер (ГЭБ). Давайте подробнее рассмотрим его структуру (рис. 1). Первая линия защиты — плотный стой эндотелия капилляров, соединенных плотными контактами. В отличие от большинства капилляров тела, в них нет крупных щелей (пор) для прохождения некоторых белков плазмы [1]. Далее на пути к мозгу находятся перициты (клетки соединительной ткани) и астроциты (вспомогательные клетки в нервной ткани), которые механически не позволяют пройти молекулам крупнее определенного размера. Гематоэнцефалический барьер не пропускает вещества более 400–500 Да по массе, в зависимости от свойства вещества. (Для сравнения, сывороточный альбумин человека, самый распространенный белок в крови, имеет массу 65 000 Да). Также барьер непроницаем для ионов, но пропускает жирорастворимые вещества, воду, кислород, углекислый газ, некоторые обезболивающие и алкоголь (рис. 1).
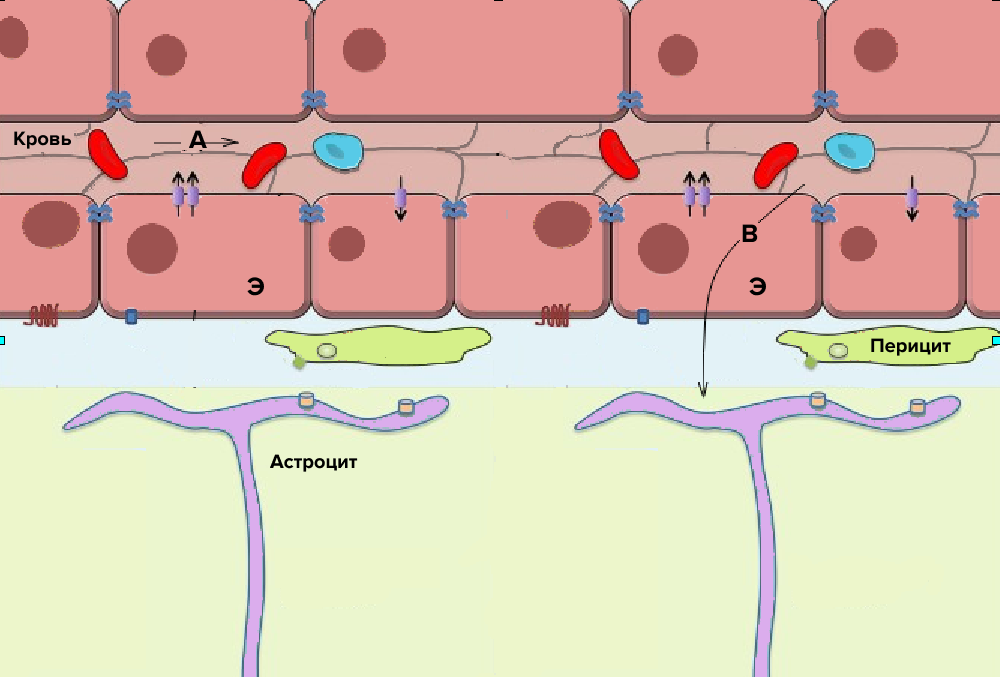
Рисунок 1. Схема строения гематоэнцефалического барьера.
Э — клетки капилляров, соединенные плотными контактами; A — вещества, не проникающие через ГЭБ; B — вещества, проникающие через ГЭБ каким-либо способом, описанным ниже. Стрелками обозначены белковые системы транспорта веществ внутрь клетки и из нее.
рисунок автора статьи
Таким образом, долгое время считалось, что мозг полностью защищен от проникновения некоторых веществ из крови, пока не было обнаружено возможности прохода через ГЭБ. Такой способ доставки нужен прежде всего для доставки лекарств в нервную систему, поэтому было важно найти способы преодолеть барьер: ослабить клеточные контакты эндотелия (клеточного слоя) капилляров мозга, использовать системы транспорта веществ через мембрану капилляров или проникнуть в мозг с помощью эндоцитоза [2]. У данных способов есть свои недостатки, например, разрушение плотных контактов эндотелия приводило к местному накоплению веществ в мозге, повышению внутричерепного давления и требовало значительного времени на восстановление барьера [3]. Использование систем транспорта растворимых в воде метаболитов для доставки действующего вещества в мозг накладывает ограничения на само вещество. В данном случае оно должно либо имитировать «привычный» для данного белка-транспортера метаболит клетки, либо связываться с метаболитом для прохождения через мембрану [4]. Транспорт веществ путем эндоцитоза (захвата внешнего материала) клетками эндотелия тоже имеет свои недостатки — неспецифический эндоцитоз сведен к минимуму в капиллярах мозга, а специфический эндоцитоз часто включает в себя частичное пропускание вещества. Например, при доставке ионов железа посредством белка ферритином этот белок связывается с рецептором на эндотелии капилляра, проникает в клетку, высвобождает ионы железа для их дальнейшего транспорта в мозг, а потом удаляется из клетки обратно в просвет капилляра [5]. У всех перечисленных выше способов есть общий нюанс — вещество попадает в мозг через кровь, а значит, вещество распределяется равномерно по всему организму, поэтому нужно учитывать его системный эффект. Это накладывает дополнительные ограничения и увеличивает время испытания нового лекарства. В последние десятилетия ученые пытались преодолеть барьер и доставить лекарства с помощью наночастиц, введенных в кровь [6–8].
Наночастицы — собирательное название для группы веществ размером от 1 до 1000 нм. Они могут иметь различаться по форме и своим свойствам, в зависимости от пути преодоления ГЭБа. Это могут быть различные полимеры, натуральные или синтетические, или металлические частицы. Однако пока что наночастицы показывают не лучшие результаты в качестве транспортеров лекарств через барьер, если их вводить в кровь, а способ их проникновения через барьер — все еще спорный вопрос [9]. Как отметил Франческо Элдро, было потрачено много времени на изменение (модификацию) действующих веществ в составе лекарств для преодоления барьера, но гораздо меньше изучали способы их проникновения в мозг [10], [11].
Существуют способы проникнуть в нервную систему, даже минуя стадию попадания в кровь. Конечно, можно просверлить отверстие в черепе и ввести вещество иглой через барьер — это довольно эффективный способ преодолеть ГЭБ. Единственный недостаток в том, что введенное вещество практически не распространяется по мозгу [12]. Но есть и гораздо менее инвазивный вариант — проникнуть в мозг через носовую полость в обход ГЭБа. Рассмотрим, почему этот способ вызывает особый интерес у ученых. Вспомним строение обонятельной системы позвоночных на примере мыши (рис. 2). В носовой полости есть специальный участок скопления рецепторных окончаний нейронов — обонятельный эпителий. От дендритов сигнал проходит через тело, транспортируется по аксону и передается митральной клетке, входящей в состав обонятельной луковицы; место передачи называется синапсом.
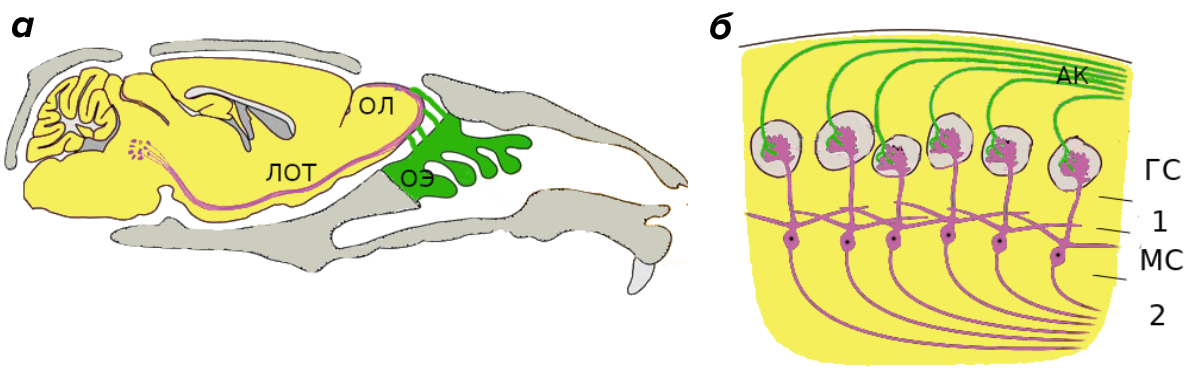
Рисунок 2. Строение обонятельной системы.
(a) — строение обонятельной системы мыши в разрезе. ОЭ — обонятельный эпителий, ОЛ — обонятельная луковица, ЛОТ — латеральный обонятельный тракт.
(б) — cтроение обонятельной луковицы мыши. АК) — аксоны обонятельных рецепторов, ГС — гломерулярный слой, МС — митральный слой, 1 и 2 — внешний и внутренний плексиформные слои обонятельной луковицы.
рисунок автора статьи
Тела митральных клеток образуют митральный слой, а аксоны этих клеток формируют латеральный обонятельный тракт. По нему передается информация о запахах в центры головного мозга, которые обрабатывают сигнал. Из-за «доступности» такого способа попадания в мозг, который вдобавок не требует серьезных ограничений по структуре и размерам веществ, данная тема требует более подробного анализа.
Данная работа посвящена изучению процесса проникновения наночастиц в головной мозг через носовую полость. Этот путь актуален не только с точки зрения доставки лекарственных препаратов, но и с точки зрения изучения процесса проникновения вирусов в головной мозг. У всех сейчас на слуху специфический симптом коронавирусной инфекции — потеря обоняния, что свидетельствует о возможности неспецифического проникновения любого вещества в нашу нервную систему.
Описание эксперимента и результаты
Для более точной визуализации транспорта веществ в мозг через носовую полость мы использовали наночастицы оксида марганца (Mn3O4, диаметр ~34 нм). Введя их в одну ноздрю мыши, можно увидеть положение наночастиц при томографии (рис. 3).
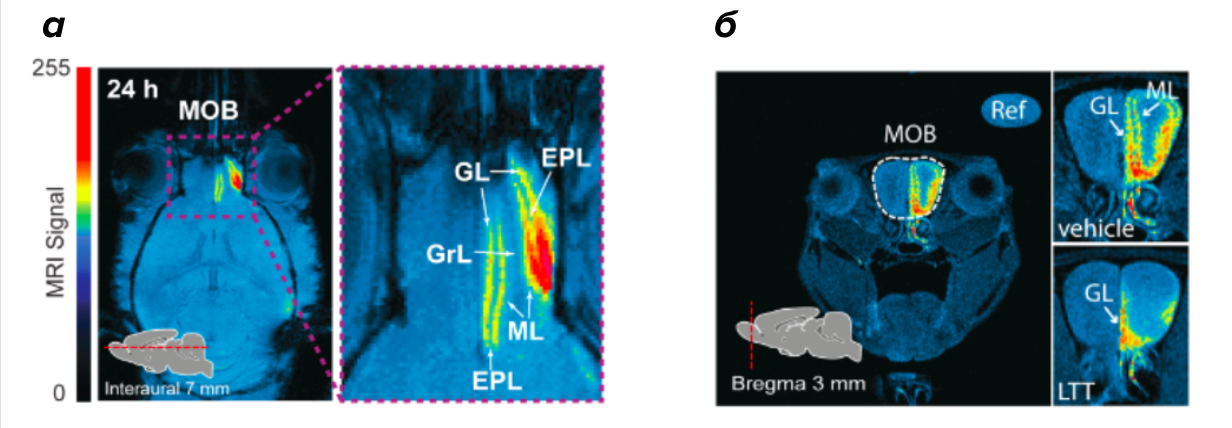
Рисунок 3. Томограмма обонятельной луковицы мыши.
(a) — распределение МРТ сигнала по слоям обонятельной луковицы (MOB): гломерулярному слою (GL), наружному плексиформному слою (EPL), слою митральных клеток (ML), слою зернистых клеток (GrL) спустя 24 часа после введения Mn3O4-наночастиц в правую ноздрю. Интенсивность сигнала выделена с помощью псевдоокрашивания (компьютер окрашивает изображение в различные цвета в зависимости от интенсивности МРТ-сигнала).
(б) — снимок в присутствии (LTT) и отсутствии (vehicle) ингибитора пресинаптической активности нейрона. Белыми стрелками показаны слои: гломерулярный слой (GL) и слой митральных клеток (ML).
рисунок автора статьи
В ходе работы было проанализировано влияние различных ингибиторов на захват и транспорт наночастиц в головной мозг мыши для ответа на основной вопрос: наночастицы проходят из носовой полости по нейронам или они попадают в нервную систему через внеклеточное пространство [13].
Чтобы проследить путь наночастиц из обонятельного эпителия в обонятельную луковицу, были использованы специфические и неспецифические ингибиторы эндоцитоза, а также вещества, разрушающие плотные контакты клеток обонятельного эпителия. Отличия между ингибиторами эндоцитоза в том, что специфические ингибиторы блокируют захват клетками определенного вещества, а неспецифические снижают общую способность клеток к эндоцитозу. Исходя из полученных данных, мы заключили, что частицы поглощаются клетками ольфакторного эпителия, а не проходят между ними. Также можно сделать вывод, что захват наночастиц происходит без сопряжения с каким-либо веществом, так как специфические ингибиторы эндоцитоза не влияли на уровень МРТ-сигнала.
Чтобы проследить дальнейший путь наночастиц, мы использовали ингибиторы аксонального транспорта (колхицин, лидокаин). Колхицин блокирует перемещение грузов от тела нейронов до синапса; лидокаин подавляет проведение импульсов в нейронах вследствие блокирования натриевых каналов (поэтому наночастицы, попав в нейрон, не могут передаваться дальше в синапс). Оба ингибитора достоверно повлияли на транспорт Mn3O4-наночастиц из носовой полости в мозг. Таким образом, мы показали, что Mn3O4-наночастицы проникают в обонятельную луковицу через аксон, а их транспорт зависит от активности нейрона.
Продолжая двигаться в мозг с наночастицами, мы попадаем во внешний слой обонятельной луковицы. Здесь наночастицы стоят перед выбором: либо идти через синапс в следующий нейрон и дальше транспортироваться по латеральному обонятельному тракту, либо перемещаться через межклеточное пространство.
Понять это возможно посредством влияния блокаторов. Ингибиторы пре- и постсинаптической активности нейронов влияют лишь на стадию транспорта наночастиц из обонятельной луковицы (MOB) в латеральный обонятельный тракт (LOT). Причем значительное влияние оказывают только ингибиторы пресинаптической активности — баклофен и LTT (левитриацетам). Такой эффект появляется из-за того, что наночастицы не работают как нейромедиаторы. Чтобы вызвать у нейрона постсинаптическую активность, вещество должно связаться с рецептором на поверхности нейрона и вызвать появление потенциала действия в нем (передать сигнал дальше по нервной цепочке). Наночастицы не могут связываться со специфическими рецепторами; они попадают в следующий нейрон за счет неспецифического эндоцитоза. Из-за этого ингибиторы постсинаптической активности практически никак не влияют на транспорт наночастиц из обонятельной луковицы в латеральный обонятельный тракт. Поэтому можем сделать вывод: наночастицы передаются транссинаптически по структурам головного мозга, отвечающим за обоняние в обход ГЭБ.
Обсуждение
Таким образом, на примере магнитных наночастиц мы показали, что возможен транспорт частиц из носа в мозг в обход ГЭБ внутри нейрональных клеток. Более того, процесс назального транспорта частиц зависит от активности нейронов. Так как данные наночастицы схожи по размерам и другим физическим свойствам с респираторными вирусами, можно предположить что транспорт вирусов в нервную систему возможен не только путем проникновения через ГЭБ [14]. Таким образом, найденный способ транспорта наночастиц в обход ГЭБ дает основу для исследования передачи вирусных заболеваний этим путем, а также для создания новых противовирусных препаратов. Особой актуальностью обладает исследование транспорта SARS-CoV-2, так как одним из симптомов коронавирусной инфекции является потеря вкуса и обоняния.
Заключение
Итогом работы стало подтверждение гипотезы о том, что наночастицы транспортируются через нейроны в головной мозг, а не через межклеточное пространство. Также мы можем сказать, что они не только захватываются обонятельными рецепторами, но и проходят через синапс в митральную клетку обонятельной луковицы, после чего по латеральному обонятельному тракту транспортируются в головной мозг. Понимание точного механизма транспорта веществ в обход ГЭБ может значительно упростить создание лекарственных препаратов против известных заболеваний — болезни Паркинсона и болезни Альцгеймера, а также поможет расширить представление о способах проникновения вирусов в нервную систему человека.
Литература
- Гайтон Артур К., Холл Джон Э. Медицинская физиология. Логосфера, 2008. — 857 с.;
- Yan Zhang, Donald W. Miller. (2005). Pathways for Drug Delivery to the Central Nervous System. Drug Delivery. 29-56;
- Marc-André Bellavance, Marie Blanchette, David Fortin. (2008). Recent Advances in Blood–Brain Barrier Disruption as a CNS Delivery Strategy. AAPS J. 10, 166-177;
- Yasuo Uchida, Sumio Ohtsuki, Yuki Katsukura, Chiemi Ikeda, Takashi Suzuki, et. al.. (2011). Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117, 333-345;
- Wilfred A. Jefferies, Malcolm R. Brandon, Simon V. Hunt, Alan F. Williams, Kevin C. Gatter, David Y. Mason. (1984). Transferrin receptor on endothelium of brain capillaries. Nature. 312, 162-163;
- Cláudia Saraiva, Catarina Praça, Raquel Ferreira, Tiago Santos, Lino Ferreira, Liliana Bernardino. (2016). Nanoparticle-mediated brain drug delivery: Overcoming blood–brain barrier to treat neurodegenerative diseases. Journal of Controlled Release. 235, 34-47;
- Luca Bors, Franciska Erdő. (2019). Overcoming the Blood–Brain Barrier. Challenges and Tricks for CNS Drug Delivery. Sci. Pharm.. 87, 6;
- Débora Braga Vieira, Lionel Fernel Gamarra. (2018). Multifunctional Nanoparticles for Successful Targeted Drug Delivery across the Blood-Brain Barrier. Molecular Insight of Drug Design;
- Jean-Christophe Olivier. (2005). Drug transport to brain with targeted nanoparticles. Neurotherapeutics. 2, 108-119;
- Franciska Erdő, Luca Anna Bors, Dániel Farkas, Ágnes Bajza, Sveinbjörn Gizurarson. (2018). Evaluation of intranasal delivery route of drug administration for brain targeting. Brain Research Bulletin. 143, 155-170;
- Dhrisya Chenthamara, Sadhasivam Subramaniam, Sankar Ganesh Ramakrishnan, Swaminathan Krishnaswamy, Musthafa Mohamed Essa, et. al.. (2019). Therapeutic efficacy of nanoparticles and routes of administration. Biomater Res. 23;
- Christine E. Krewson, Michele L. Klarman, W. Mark Saltzman. (1995). Distribution of nerve growth factor following direct delivery to brain interstitium. Brain Research. 680, 196-206;
- Zian Wang, Guojun Xiong, Wai Chun Tsang, Andreas G. Schätzlein, Ijeoma F. Uchegbu. (2019). Nose-to-Brain Delivery. J Pharmacol Exp Ther. 370, 593-601;
- L. V. Rubis. (2018). CHARACTERISTICS OF THE CAUSATIVE AGENTS OF ACUTE RESPIRATORY VIRAL INFECTIONS AND THE IMPORTANCE OF DISINFECTION MEASURES IN PREVENTING THEIR SPREAD. Det. infekc.. 17, 34-40.