Прокариотический напарник для CAR-T-клеточной терапии
28 февраля 2024
Прокариотический напарник для CAR-T-клеточной терапии
- 432
- 0
- 3
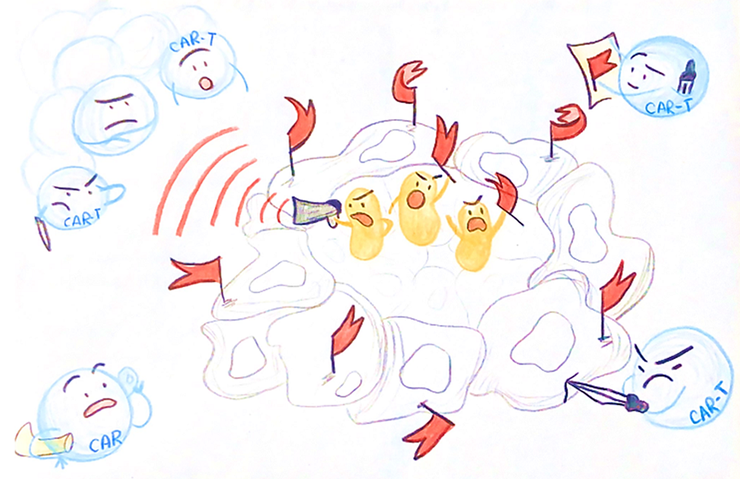
Прокариотический напарник помогает направить CAR-T-клетки для уничтожения опухолевых клеток.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: CAR-T-клеточная терапия уже вошла в историю как эффективный и высокоспецифичный подход к лечению онкологических заболеваний. Однако, несмотря на впечатляющие результаты в случаях лечения гематологических опухолей, остается много проблем в CAR-T терапии злокачественных новообразований, которые развились не из клеток кроветворной системы. А что будет, если иммунным клеткам взять прокариотического напарника в качестве штурмана, который будет «отдавать приказ», куда CAR-T-клеткам бежать и кого уничтожать? Таким вопросом задалась исследовательская группа из Колумбийского университета и создала революционный двухэтапный подход в CAR-T-клеточной терапии, получивший название ProCAR (probiotic-guided), который расширяет возможности персонализированного лечения.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Современное положение дел
Сейчас никого не удивить, если сказать, что злокачественные новообразования различной локализации остаются одной из лидирующих причин смертности во всем мире, из-за чего до сих пор существует острая необходимость в разработке новых эффективных подходов к лечению онкологических заболеваний. Одним из перспективных подходов является адоптивная клеточная иммунотерапия, ведущим направлением которой является CAR-T-терапия. Она заключается во введении антиген-специфических иммунных Т-клеток с искусственно созданной противоопухолевой активностью с целью подавления роста опухоли. Подробный обзор CAR-T-клеточной терапии представлен в сборнике на «Биомолекуле».
«Классическая» CAR-T терапия (рис. 1) заключается в выделении Т-клеток из периферической крови пациента, создании из них модифицированных Т-лимфоцитов с химерным антигенраспознающим рецептором (chimeric antigen receptor, CAR) и обратном введении иммунных клеток в кровь больного.
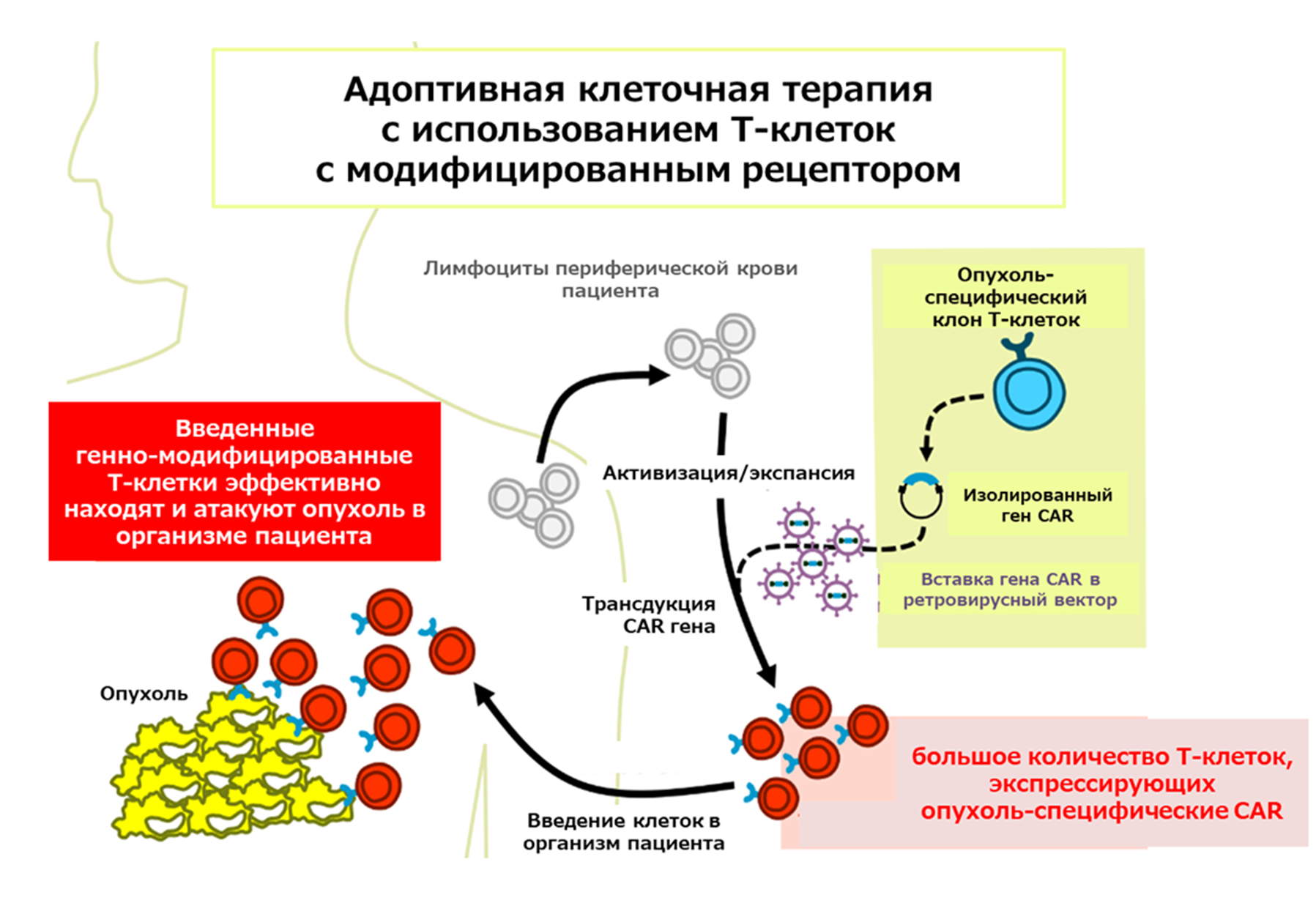
Рисунок 1. Общая схема иммунотерапии модифицированными лимфоцитами. На схеме изображены основные этапы CAR-T-клеточной терапии:
1) забор периферической крови пациента и выделение Т-клеток;
2) активация лимфоцитов и их трансдукция ретровирусным или лентивирусным вектором с геном рецептора CAR против эпитопа опухоль-ассоциированного антигена;
3) размножение модифицированных T-клеток;
4) инфузия модифицированных лимфоцитов в организм пациента.
рисунок автора
CAR-T-клетки хорошо себя зарекомендовали в терапии гематологических опухолей. С 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) одобрило шесть CAR-T-клеточных терапий (табл. 1) для лечения рака крови, включая лимфомы, некоторые формы лейкемии и множественную миелому. К примеру, генетически модифицированные Т-клетки, нацеленные на антиген В-лимфоцитов CD19, с исключительным успехом применяются при различных гематологических заболеваниях, не поддающихся терапии [1].
| Название препарата | Имя бренда | Мишень | Заболевания |
|---|---|---|---|
| Тисагенлеклеусел | Kymriah | CD19 |
|
| Аксикабтаген цилолеусел | Yescarta | CD19 |
|
| Брексукабтаген аутолеусел | Tecartus | CD19 |
|
| Лисокабтаген маралеусел | Breyanzi | CD19 | В-клеточная неходжкинская лимфома |
| Идекабтаген виклеусел | Abecma | BCMA | Множественная миелома |
| Цильтакабтаген аутолеусел | Carvykti | BCMA | Множественная миелома |
Структура химерного антигенраспознающего рецептора
Сам CAR состоит из нескольких структурных частей — внеклеточной, петлевой, трансмембранной и внутриклеточной (рис. 2) [2]. Более подробное описание строения CAR вы можете найти в статье на «Биомолекуле», посвященной более подробному описанию строения CAR рецептора [3].
- Внеклеточный домен представляет собой рекомбинантный домен, полученный соединением легкой (VL) и тяжелой (VH) вариабельной цепей антитела специальным линкером. Именно этой частью химерный рецептор распознает опухоль-ассоциированный антиген.
- Шарнирный, или петлевой домен чаще всего представлен последовательностями CD8α, CD28 или IgG1/IgG4. Он задает размер образующегося синапса с эпитопом, который определяет эффективность запуска каскада фосфорилирования и активации Т-клеток. Таким образом, с помощью модификации петлевого домена можно определять функциональность рецептора CAR [4].
- Вне- и внутриклеточный домены связаны трансмембранным доменом, который в большинстве случаев является трансмембранным рецепторным белком. Выбор трансмембранного домена влияет на передаваемый на внутриклеточный домен активирующий сигнал и на стабильность рецепторного комплекса в целом [5].
- Внутриклеточный домен отличается у разных поколений CAR. В первом поколении домен представлен гликопротеином CD3ζ, во втором — комплексом CD3ζ с костимулирующими доменами, которые способствуют длительному существованию клеток в организме пациента и повышают успех терапии [6]. Примерами CAR новейшего поколения являются Т-клетки, перенаправленные для универсального цитокинового киллинга (T-cells redirected for universal cytokine killing, TRUCKS), которые содержат индукторы цитокинов, усиливающие секрецию интерлейкина 12 (ИЛ 12) Т-клетками. Это увеличивает персистенцию данных клеток (сохранение в функционально активном состоянии) и более высокую противоопухолевую эффективность [7].
Внеклеточный домен окружен большим мультибелковым комплексом, который содержит шесть дополнительных субъединиц: CD3γ, CD3δ, две копии CD3ϵ и две копии ζ-цепи Т-клеточного рецептора. Они участвуют в трансдукции Т-клеточного сигнала, а не в распознавании антигена. Эта передача сигнала обеспечивается фосфорилированием тирозина в цитоплазматических областях, называемых ITAMs (immunoreceptor tyrosine-based activation motifs) в цепях CD3ε, CD3γ, CD3δ и ζ [8].
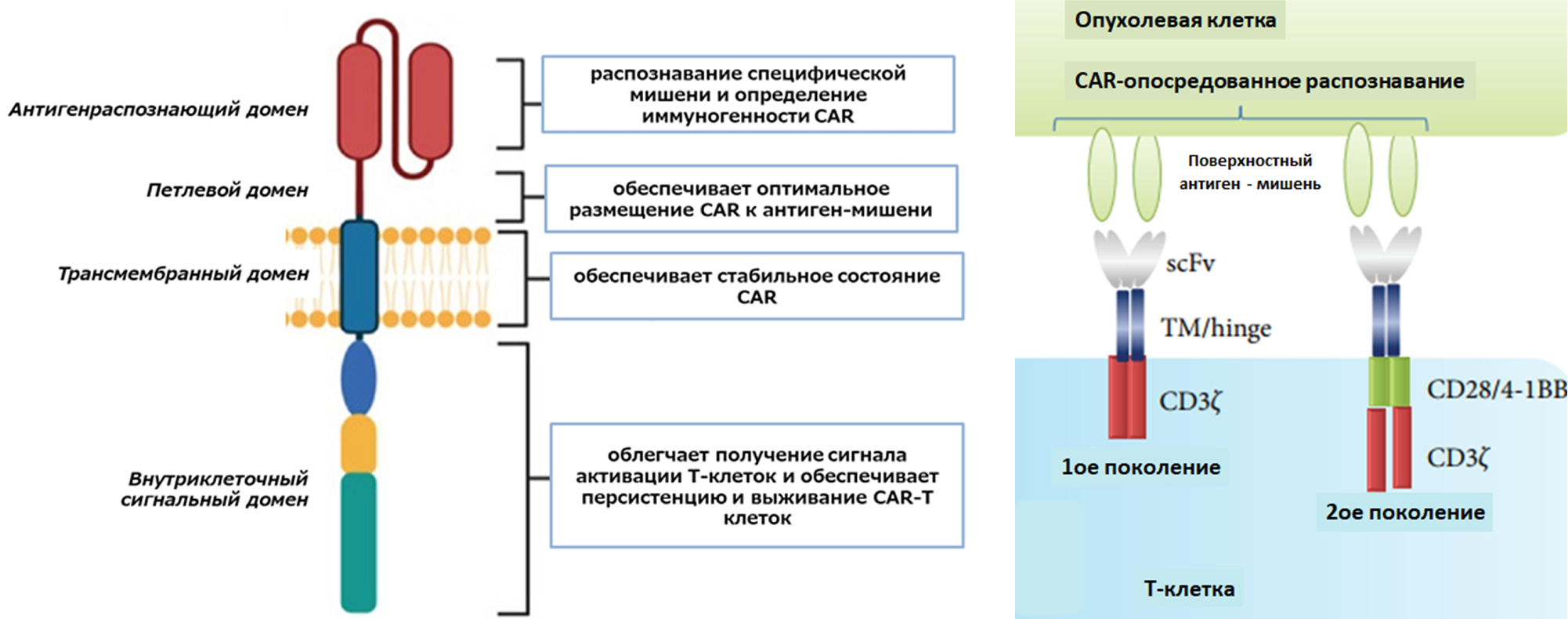
Рисунок 2. Схема строения химерного антигенраспознающего рецептора (CAR) и функции каждого домена.
Проблемы CAR-T-клеточной терапии в лечении солидных опухолей
Внеклеточный сегмент CAR (одноцепочечный вариабельный фрагмент, scFv) не взаимодействует с MHC I класса — главным комплексом гистосовместимости, функция которого заключается в процессинге внутриклеточных или поверхностных белков и презентации антигенных пептидов иммунным клеткам [8]. Ввиду этого CAR-T-клетки распознают антигены, представленные исключительно на поверхности клеток вне комплекса MHC-I.
С одной стороны, это может повысить эффективность терапии, так как многие опухоли снижают уровень экспрессии MHC-I, в результате чего количество главных комплексов гистосовместимости на поверхности раковых клеток сокращается [9]. С другой стороны, в случае солидных опухолей, чьи опухоль-специфические антигены чаще всего внутриклеточные, количество доступных поверхностных антигенов в качестве мишеней CAR-T-клеток ограничено.
Еще одним фактором, который снижает эффективность CAR-T-клеточной терапии, является иммуносупрессивное микроокружение опухоли. Выделяя иммуносупрессивные цитокины, окружающие опухоль клетки препятствуют функционированию иммунных эффекторных клеток, а также подавляют воспалительный Т-клеточный ответ и клеточно-опосредованный иммунитет [10]. В это же время синтезированный микроокружением коллаген создает физический барьер для взаимодействия опухоли с клетками иммунной системы и их инфильтрации.
Не менее важной проблемой является гетерогенность сóлидных опухолей (то есть развивающихся не из клеток кроветворной системы): они неоднородны по генетическому и эпигенетическому статусу, и, что более важно, могут совсем прекратить экспрессию опухолевых антигенов.
Из-за этих проблем сложно подобрать идеальные мишени для каждого пациента так, чтобы терапия работала с одинаковой продуктивностью и уничтожала опухоль полностью. Логическим решением может стать создание CAR-Т-клеток с универсальным антигенраспознающим доменом, специфичность которых относительно легко изменить, используя различные комплементарные к нему метки.
Революционный подход предложили исследователи из Колумбийского университета. Они решили создать универсальные СAR-T-клетки, специфичные к антигену, которого нет в организме, а также прокариотического напарника — специальный штамм бактерий, который будет размножаться только в опухоли и экспрессировать опухоль-ассоциированный антиген, комплементарный к CAR-рецептору, тем самым повышая специфичность CAR-Т-клеток к мишени.
Этап первый. Создание бактерий — хороших напарников для T-клеток
Использование бактерий в терапии опухолей открывает возможности, казавшиеся до этого немыслимыми и недостижимыми при использовании стандартных методов лечения. В отличие от токсичных для нормальных тканей химиотерапии и облучения, определенные штаммы бактерий могут целенаправленно воздействовать на опухоль, активно проникать в ткани; они легко обнаруживаются и являются цитотоксичными для опухоли [11]. Геном прокариот можно легко модифицировать, что позволяет создать из бактерий настоящую маленькую молекулярную фабрику (рис. 3). Она будет выполнять несколько функций:
- Реагировать на внешние сигналы и свободно перемещаться в пространстве;
- Нарабатывать терапевтические молекулы, такие как токсины, цитокины, опухолевые антигены и факторы, индуцирующие апоптоз, которые будут селективно токсичны для опухоли;
- Вырабатывать молекулы, способные маркировать раковые клетки для иммунных клеток.
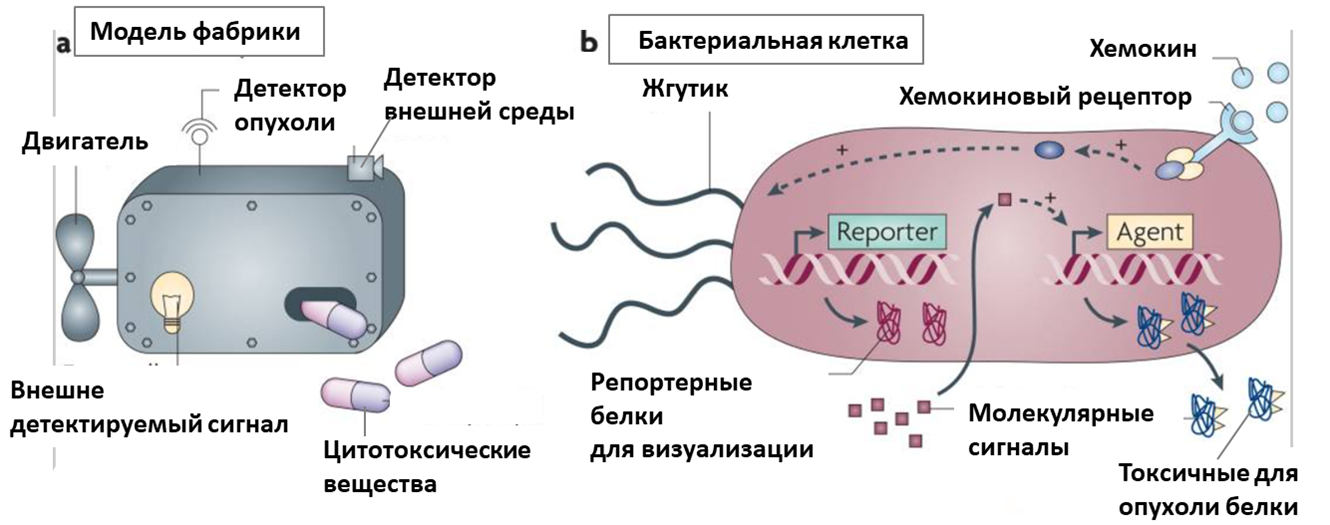
Рисунок 3. Бактерии как фабрики для лечения рака. Слева на рисунке представлена модель молекулярной фабрики для терапии онкологических заболеваний, справа — ее реализация в виде бактериальной клетки.
Углубимся в модель эксперимента ученых из Колумбийского университета [12]. Первым этапом было создание специального штамма бактерий E. coli, способного мигрировать к солидным опухолям, создавать там колонии и продуцировать специальный синтетический антиген — метку (tag) для CAR-T-клеток.
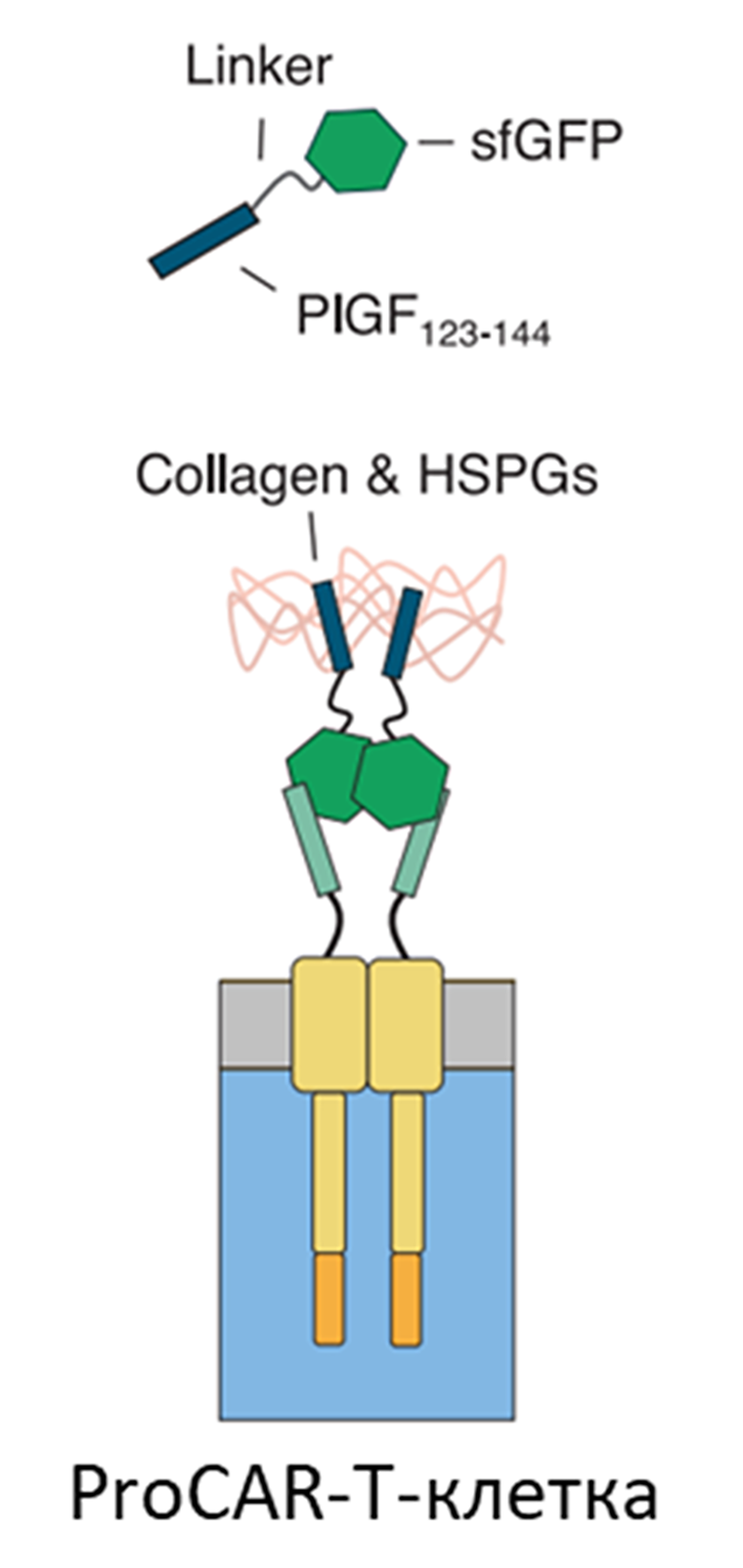
Рисунок 4. Строение метки Tag, состоящей из гомодимера суперскрученного зеленого флуоресцирующего белка sfGFP и гепаринсвязывающего домена HBD фактора роста плаценты-2 (PlGF-2123-144), соединенных линкером. PIGF-часть прочно связывается с элементами внеклеточного матрикса — с коллагеном и гепарансульфатными протеогликанами, тем самым заякоривывается в межклеточном матриксе опухоли, а sfGFP-часть связывается с CAR (GFP28z).
В геном бактерий была встроена система синхронизированного лизиса (synchronized lysis circuit, SLIC) [13], позволяющая этим бактериям расти в нише солидной опухоли до критического уровня. Затем запускаются события лизиса бактериальных клеток, в ходе которого циклически высвобождаются in situ генетически закодированные антигены и хемокины, необходимые для направленного хемотаксиса CAR-T-клеток.
Также еще одной вставкой в ДНК бактерий стал мутантный ген человеческого хемокина CXCL16K42A (CXCL16) для повышенная инфильтрации и рекрутирования CXCR16+ CAR-T клеток непосредственно к месту опухоли.
Авторы статьи разработали внеклеточный белок, который может «помечать» компоненты иммуносупрессивного микроокружения опухоли для CAR-опосредованного лизиса. Этот белок был получен путем слияния (рис. 4) гомодимера суперскрученного зеленого флуоресцирующего белка (superfolder green fluorescent protein, disfGFP) с гепаринсвязывающим доменом (heparin-binding domain, HBD) фактора роста плаценты-2 (PlGF-2123-144), прочно связывающимся с элементами внеклеточного матрикса (коллагеном, фибронектином и гепарансульфатными протеогликанами) [14], которые в большом количестве присутствуют в солидных опухолях и в плотном внеклеточном матриксе ее стромы.
Таким образом, размножаясь только в клетках опухоли и ее микроокружения, в ходе лизиса бактерии высвобождают антигены-метки, которые маркируют только область опухоли (рис. 5). Так как PIGF-часть химерного белка сразу связывается с элементами внеклеточного матрикса опухоли, то она ограничивает дальнейшую диффузию «меток» за пределы плотной стромы опухоли и повышает безопасность для здоровых тканей пациента. Также PIGF-часть белка способствует поляризации CAR на поверхности Т-клеток, что приводит к большей противоопухолевой активности CAR-T-клеток.
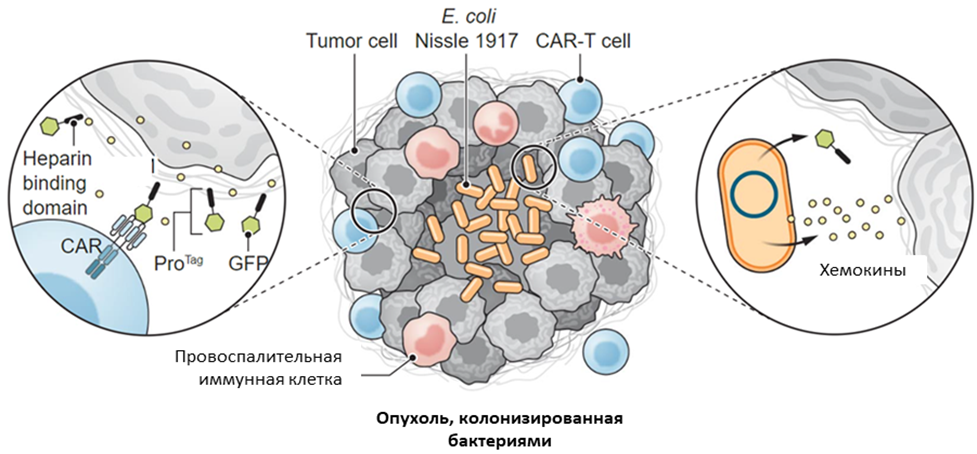
Рисунок 5. Схема ProCAR. Синтетические метки для CAR-T-клеток производятся и высвобождаются in situ колонизирующими опухоль бактериями (E. coli), маркируют компоненты солидных опухолей и вызывают CAR-опосредованный лизис. Метки представлены в виде димеров sfGFP, соединенных с HBD (PlGF123-144), которые широко связываются с клеточной поверхностью опухолевых клеток и внеклеточным матриксом микроокружения опухоли.
Этап второй. Создание направляющих бактериями ProCAR-T-клеток
Далее исследователи создали GFP-специфичный CAR (рис. 6) [15]. Данный химерный рецептор состоит из sfGFP-связывающей последовательности антитела, соединенной с внутриклеточными сигнальными доменами CD28 и CD3ζ короткой петлей иммуноглобулина G4 (IgG4) для коэкспрессии с репортером mScarlet. Он позволяет контролировать эффективность трансдукции человеческих Т-клеток и подтвердить экспрессию CAR на поверхности T-клеток путем связывания рецептора CAR с метками.
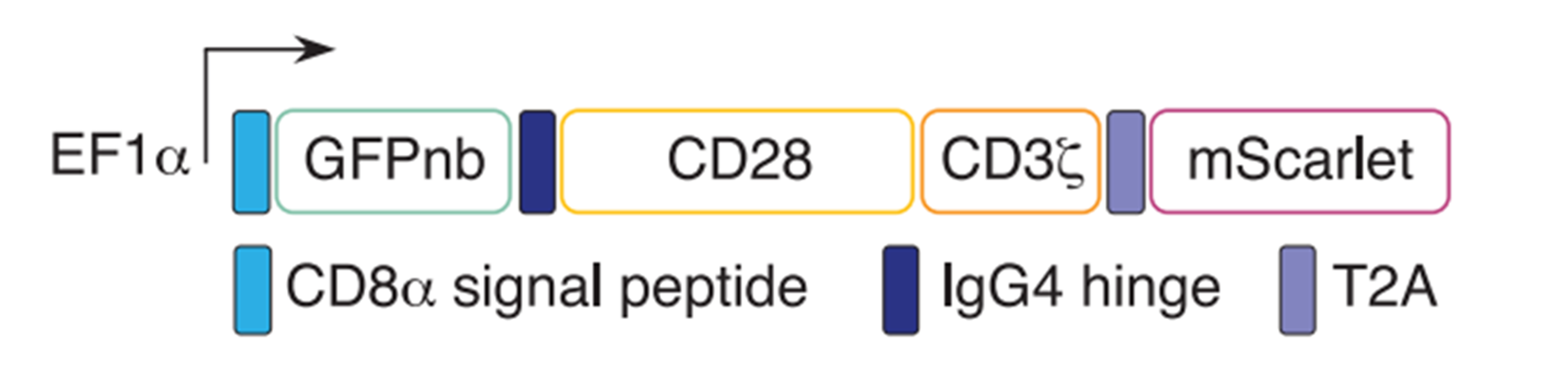
Рисунок 6. Схема генетической конструкции, которой трансдуцировали Т-клетки пациента с помощью вирусного вектора. GFPnb — sfGFP-связывающая последовательность антитела, CD28 и CD3ζ — сигнальные домены, IgG4 — петля иммуноглобулина G4, связывающая внеклеточный и внутриклеточный домен CAR, mScarlet — репортерный ген для контроля эффективности трансдукции.
После разработки бактерий и CAR-T-клеток исследователям предстояло оценить эффективность всей системы ProCAR (от probiotic-guided) с помощью функциональных тестов. Во-первых, с помощью измерения экспрессии маркеров активации — CD25 (рис. 7) и CD69, выяснили, что GFP-CAR-T-клетки активировались и пролиферировали при взаимодействии с меткой и с гомодимером sfGFP (diGFP), однако модифицированные Т-клетки оставались неизменными при воздействии мономерного sfGFP.
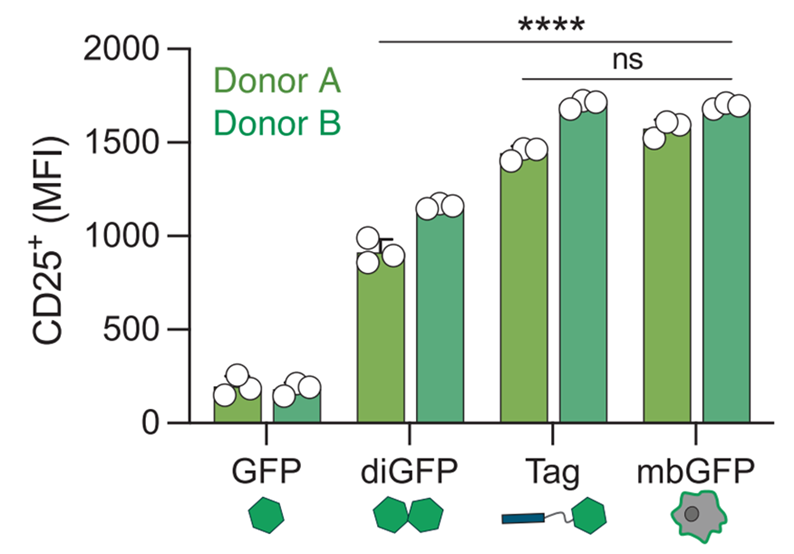
Рисунок 7. Количественная оценка экспрессии CD25 на поверхности. GFP — мономерный sfGFP, diGFP — растворимый гомодимер sfGFP, Tag — связанный с коллагеном GFP. Повышение экспрессии CD25 показана относительно клеток MDA-MB-468, экспрессирующих mbGFP — форму sfGFP, связанного с мембранной в соотношении 1:1. MFI — средняя интенсивность флуоресценции.
Также при инкубации семи генетически различных линий раковых клеток человека с GFP-CAR-T-клетками ученые обнаружили дозозависимую цитотоксичность модифицированных Т-клеток по отношению к клеткам с коллагенсвязывающими метками и их толерантность к клеткам, покрытым растворимыми димерами sfGFP. В ответ на взаимодействие с меткой CAR-T-клетки вырабатывали в основном перфорины и гранзимы А и В, которые вызывают последующий лизис помеченных клеток.
В результате только поверхностно-связанные метки действительно могут способствовать образованию иммунологических синапсов между CAR-T-клетками и клеткой-мишенью и вызывать цитотоксический Т-клеточный ответ (рис. 8). Помимо этого, было показано, что конструкция меток универсальна, т.е. она пригодна для терапии разных видов рака.
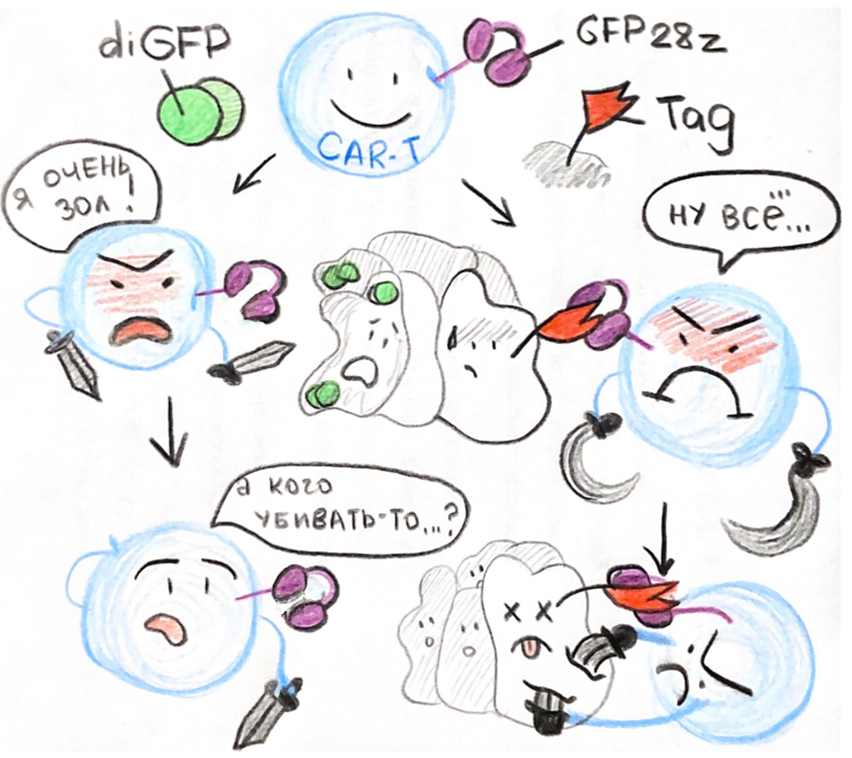
Рисунок 8. Только поверхностно-связанные метки действительно могут способствовать образованию синапсов между CAR и клеткой-мишенью, в отличие от diGFP белков, которые вовсе не связываются с поверхностью покоящихся или активированных Т-клеток.
рисунок автора
Эти многообещающие результаты позволили ученым перейти к следующему шагу — к экспериментам на модели ксенографтов опухолей человека. Они использовали линию иммунодефицитных мышей с диабетом без ожирения, вводя им подкожно опухолевые клетки различных типов рака человека. После достижения оптимального объема опухоли мышам вводили в опухолевую ткань штамм бактерий E. coli с системой синхронизированного лизиса, продуцирующий или diGFP (EcN-SLIC-Pro-diGFP), или Tag (EcN-SLIC-Pro-Tag), или контрольный штамм, не производящий никаких антигенов (EcN-SLIC-Pro -). Через фиксированное время после обработки бактериями вводили ProCAR-T-клетки, далее оценивали изменение размеров опухоли, строили кривую выживания и проверяли локализацию продуцируемых бактериальных антигенов в крови и опухоли (рис. 9).
ProCAR-T-клетки в сочетании с Pro-diGFP не продемонстрировали заметной терапевтической эффективности и не замедлили рост опухоли по сравнению с опухолями, обработанными контрольными Pro-штаммами (рис. 10 б, в). Штаммы Pro-Tag, напротив, вызывали мощный противоопухолевый ответ, что привело к значительному замедлению роста опухоли и, соответственно, улучшению выживаемости. Кроме того, ученые не обнаружили рост бактерий вне гомогенатов опухоли на 3-й и 14-й день после обработки бактериями. Отсутствие содержания меток в крови, по сравнению с diGFP, может говорить об отсутствии распространения антигена в здоровые ткани и в кровяное русло благодаря конструкции меток.
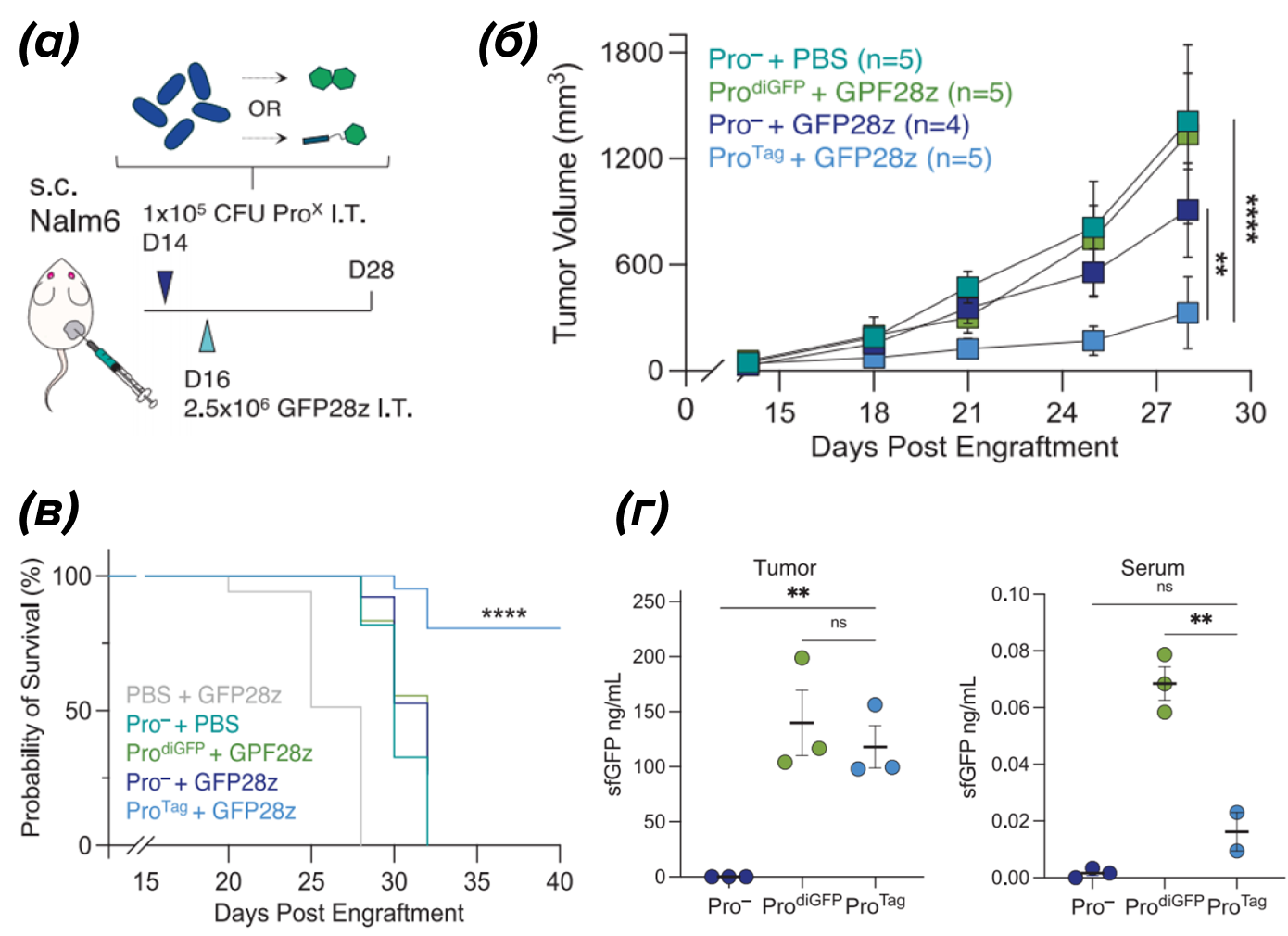
Рисунок 9. ProCAR-T-клетки обеспечивают антигенно-диагностическую терапевтическую эффективность в ответ на коллаген-связанные метки (Tags) и бактериальные адъюванты, предоставляемые пробиотиками in situ.
(а) — схема эксперимента;
(б) — график средних траекторий опухолей;
(в) кривые выживания;
(г) — данные иммуноферментного анализа на оценку содержания sfGFP (антигена, продуцируемого бактериями) в опухоли и сыворотке крови.
Заключение
Модели ксенографта различных опухолей показали многообещающие результаты двухэтапного лечения с помощью ProCAR, что подтверждает эффективность комплексной терапии солидных опухолей бактериями с CAR-T-клетками. Исследование в корне меняет подход к таргетной иммунотерапии: теперь вместо подбора мишени для каждого пациента по фенотипу их опухоли можно создать ProCAR-систему, в которой бактерии будут продуцировать в опухоли антиген, отсутствующий в здоровой ткани. Это открывает широкое поле для исследований и создания ускоренных программ лечения для самых разных типов рака.
Литература
- Marcela V. Maus, Stephan A. Grupp, David L. Porter, Carl H. June. (2014). Antibody-modified T cells: CARs take the front seat for hematologic malignancies. Blood. 123, 2625-2635;
- Hilde Almåsbak, Tanja Aarvak, Mohan C. Vemuri. (2016). CAR T Cell Therapy: A Game Changer in Cancer Treatment. Journal of Immunology Research. 2016, 1-10;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Кулемзин С.В., Кузнецова В.В., Мамонкин М., Таранин А.В., Горчаков А.А. (2017). Основы дизайна химерных антигенных рецепторов. Acta Naturae (русскоязычная версия). 32, 6–15;
- Sonia Guedan, Avery D. Posey, Carolyn Shaw, Anna Wing, Tong Da, et. al.. (2018). Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3;
- Jaromir Tomasik, Marcin Jasiński, Grzegorz W. Basak. (2022). Next generations of CAR-T cells - new therapeutic opportunities in hematology?. Front. Immunol.. 13;
- Mythili Koneru, Terence J. Purdon, David Spriggs, Susmith Koneru, Renier J. Brentjens. (2015). IL-12 secreting tumor-targeted chimeric antigen receptor T cells eradicate ovarian tumorsin vivo. OncoImmunology. 4, e994446;
- Murphy K., Weaver C., Berg L. Janeway’s immunology (Tenth Edition). W. W. Norton & Company, Inc., 2022. P. 672–728;
- Gianpietro Dotti, Stephen Gottschalk, Barbara Savoldo, Malcolm K. Brenner. (2014). Design and development of therapies using chimeric antigen receptor‐expressing T cells. Immunological Reviews. 257, 107-126;
- Jiali Cheng, Lei Zhao, Yuanyuan Zhang, Yun Qin, Yuqi Guan, et. al.. (2019). Understanding the Mechanisms of Resistance to CAR T-Cell Therapy in Malignancies. Front. Oncol.. 9;
- Neil S. Forbes. (2010). Engineering the perfect (bacterial) cancer therapy. Nat Rev Cancer. 10, 785-794;
- Rosa L. Vincent, Candice R. Gurbatri, Fangda Li, Ana Vardoshvili, Courtney Coker, et. al.. (2023). Probiotic-guided CAR-T cells for solid tumor targeting. Science. 382, 211-218;
- M. Omar Din, Tal Danino, Arthur Prindle, Matt Skalak, Jangir Selimkhanov, et. al.. (2016). Synchronized cycles of bacterial lysis for in vivo delivery. Nature. 536, 81-85;
- Mikaël M. Martino, Priscilla S. Briquez, Esra Güç, Federico Tortelli, Witold W. Kilarski, et. al.. (2014). Growth Factors Engineered for Super-Affinity to the Extracellular Matrix Enhance Tissue Healing. Science. 343, 885-888;
- Eric M. Bressler, Wilson W. Wong. (2023). Engineered bacteria guide T cells to tumors. Science. 382, 154-155.