
Просто космос: судьбы метаболитов
06 марта 2025
Просто космос: судьбы метаболитов
- 331
- 0
- 2
Лазерный луч светит на клетку, находящуюся на подложке, «освещая» вселенную метаболитов клетки для анализа.
коллаж автора
-
Автор
-
Редакторы
Мир фрактален: внутри клетки спрятаны галактики малых молекул — метаболитов. Примеры известных метаболитов — глюкоза (главный источник питания клеток), ацетил-КоА (основной источник углерода для синтеза жирных кислот), аминокислоты (строительные блоки белков), и т.д. Метаболиты находятся в состоянии постоянного биохимического превращения в другие метаболиты. Как узнать прошлое и предсказать будущее метаболита? Как связаны судьбы метаболитов с судьбой клетки? Об этом и пойдет речь в статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: «Разницу видишь? А она есть!»
В 1988 году исследовательница Нэнси Найт в своей работе No two alike («Не найти двух одинаковых») показала, что хотя похожие снежинки встречаются, абсолютно идентичные — огромная редкость. В биологии наблюдается схожий феномен: клетки одной ткани, выполняя одинаковую функцию, внешне практически неотличимы друг от друга. Но внутри каждой клетки скрывается уникальный набор метаболитов — малых молекул, которые играют роль «строителей», источников энергии и регуляторов клеточных процессов.
Особенности клеточного метаболизма могут менять судьбу клетки: например, в условиях опухолевой микросреды, возникающей в силу разрастания злокачественной опухоли, измененный метаболизм позволяет злокачественным клеткам адаптироваться к дефициту питательных веществ и кислорода, обеспечивая их выживание.
Представим гипотетический сценарий возникновения рака. В однородном слое клеток вдруг одна начинает бесконтрольно делиться, становясь источником опухоли. Почему именно она? Что заставило эту клетку «сойти с ума», если внешне все клетки одинаковы?
Ответ на этот вопрос ученым помогает найти SpaceM — метод, который позволяет заглянуть внутрь клетки и изучить ее уникальный «метаболом» — совокупность метаболитов и их изменений. SpaceM открывает новую страницу в понимании клеточного поведения, приближая ученых к разгадке механизмов, лежащих в основе раковых заболеваний [1].
SpaceM: взять и облучить
SpaceM — это инновационная технология, созданная командой под руководством Фёдора Александрова и позволяющая изучать метаболизм на уровне отдельных клеток. Метод сочетает световую микроскопию и MALDI (matrix-assisted laser desorption ionization, опосредованную матрицей лазерную десорбцию-ионизацию) масс-спектрометрию, основной принцип которой описан в статье журнала «Биомолекула» «12 методов в картинках: протеомика».
Как происходит анализ методом SpaceM? Ниже приведено описание процесса, а для лучшего понимания каждый шаг анализа отображен на рисунке 1.
Все начинается с подготовки клеток: для анализа их могут выращивать на специальной стеклянной пластине для масс-спектрометрического анализа, либо если клетки растут в состоянии суспензии в растворе, то их помещают на пластину из раствора при помощи центрифугирования.
На поверхность такого клеточного образца наносится матрица — тонкий слой вещества, помогающий молекулам стать заряженными частицами — ионами — под воздействием лазерного облучения.
Без этого этапа успешный MALDI-анализ был бы невозможен.
После нанесения матрицы образец изучают под микроскопом. Так получают точное изображение формы, типов клеток, и их координат в образце.
Далее в игру вступает лазер. Он светит на образец, облучая его в формате «пиксель за пикселем» и вызывая превращение молекул в ионы, которые затем разделяются в электромагнитном поле MALDI масс-спектрометра по соотношению их массы к заряду (m/z).
Результат масс-спектрометрического анализа — набор данных, включающий соотношения m/z для всех задетектированных в ходе анализа ионов, а также значения интенсивности сигналов для каждого иона.
Что дальше? Полученные данные световой микроскопии и масс-спектрометрии объединяют. Сначала изображения проходят серию математических преобразований, после чего пространственная информация накладывается на «пиксельные» масс-спектрометрические данные.
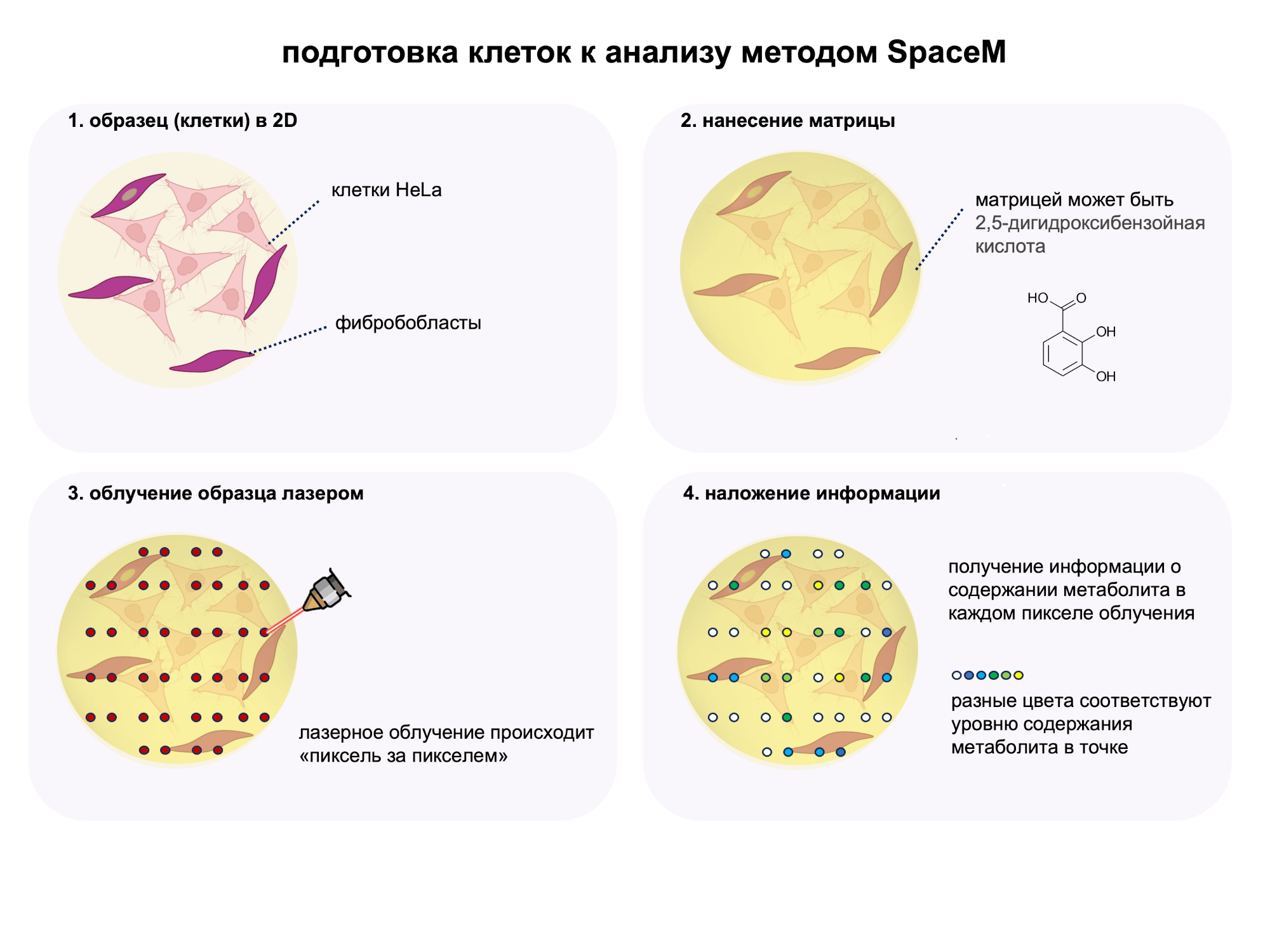
Рисунок 1. Для метода SpaceM, процесс может быть представлен в нескольких шагах. Клетки располагают в 2D на подложке (стеклянном слайде для MALDI). На этом этапе выполняется гистологическая характеристика клеток с помощью микроскопа. Далее образец покрывают матрицей и облучают лазером с попиксельным снятием спектра с каждой клетки. Различные цвета представляют различные интенсивности метаболитов в точке. С помощью специальных расчетных преобразований метаболомные данные накладываются на гистологическое изображение.
коллаж автора c использованием программы Biorender, более подробно процесс представлен в презентации Theodore Alexandrov Spatial single-cell metabolomics reveals metabolic cell states | Dr. Theodore Alexandrov | SCP2022
Вернемся к исходной задаче: как метод SpaceM может помочь исследовать клеточную неидентичность, называемую гетерогенностью?
Разные клетки — разные метаболомные профили
Итак, в 2019 году, разрабатывая метод SpaceM, команда ученых под руководством Федора Александрова решила проанализировать самую очевидную модель клеточной гетерогенности: смесь двух типов клеток. Понятно, что под микроскопом различить два разных по виду типа клеток не проблема, но сможет ли это сделать SpaceM на основании данных о клеточных метаболитах?
Для эксперимента выбрали два вида клеток — человеческие клетки HeLa и мышиные фибробласты NIH3T3 (далее детали эксперимента отображены на рисунке 2).
Почему именно эти клетки? Во-первых, оба типа клеток являются универсальными моделями в клеточной биологии. Клетки HeLa — настоящая легенда в мире науки.
Это первые полученные раковые клетки, обладающие уникальной способностью делиться бесконечно долго в лабораторных условиях и ставшие незаменимым инструментом для исследований в биологии, медицине и фармацевтике. Клетки NIH3T3 — мышиные фибробласты, которые легко выращиваются в лаборатории и быстро размножаются. В паре с клетками HeLa они образуют удобную модель для проверки метода SpaceM: клетки принципиально отличаются друг от друга, а значит вероятность различить их с помощью SpaceM должны быть выше.
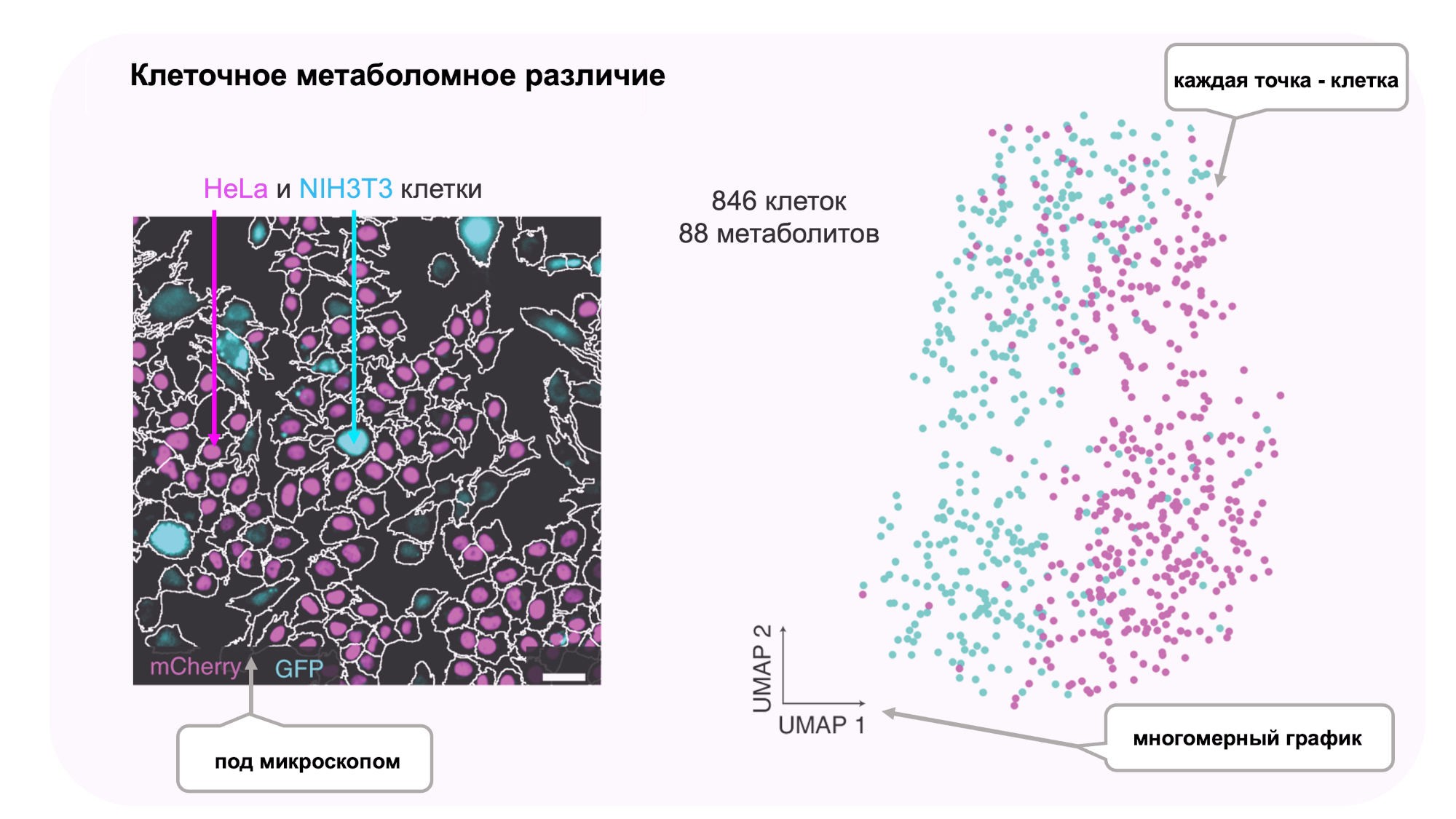
Рисунок 2. Микроскопическое изображение совместно выращенных клеток HeLa и NIH3T3. Клетки HeLa окрашены лиловым (флуоресцентный краситель H2B-mCherry), клетки NIH3T3 — голубым (зеленый флуоресцентный белок GFP). В обоих типах клеток (всего 846) было идентифицировано 88 метаболитов, результаты метаболомного анализа отображены на многомерном графике UMAP, каждая точка представляет клетку, цвета типов клеток соответствуют цветам микроскопического анализа.
Как проходил эксперимент?
Клетки HeLa были модифицированы так, чтобы синтезировать внутри себя (экспрессировать белок) H2B-mCherry, благодаря чему они светились красным под микроскопом. Клетки NIH3T3, в свою очередь, экспрессировали зеленый флуоресцентный белок GFP. Свечение клеток было необходимо для точного определения типов клеток под микроскопом.
В рамках эксперимента методом SpaceM проанализировали смесь из 445 клеток HeLa и 400 клеток NIH3T3. В каждой клетке было определено 88 метаболитов. Полученные метаболомные данные визуализировали с помощью многомерного графика UMAP, где каждая точка представляла клетку, а ее положение определялось набором 88 задетектированных внутри клетки метаболитов.
На многомерном графике клетки четко разделились на две группы, соответствующие HeLa и NIH3T3, разделение типов клеток по метаболомным данным и данным флуоресцентного окрашивания совпало.
Конечно, следующей логической целью было показать, что SpaceM не только различает клетки совершенно разных типов, но и способен различать клетки одного типа в здоровом состоянии и при наличии патологий. Ученые успешно провели и этот эксперимент (все детали приводить здесь не имеет смысла, тк метод ровно тот же самый, однако желающие могут прочитать подробности в статье [1]).
Важный вывод №1: Получается, SpaceM способен исследовать межклеточную неоднородность — гетерогенность. А значит, имея набор клеток, можно найти те, которые функционируют «неправильно».
Предсказания 13C-SpaceM
Как понять, как именно клетка стала функционировать «неправильно»? Можно проследить, что происходит с конкретным метаболитом внутри клетки!
Генеалогия метаболита
Возьмем ацетил-КоА — ключевую молекулу, которая служит «строительным кирпичиком» для синтеза жирных кислот.
Пути образования ацетил-КоА разнообразны, и при патологиях, таких как рак, интенсивность синтеза по разным путям может меняться.
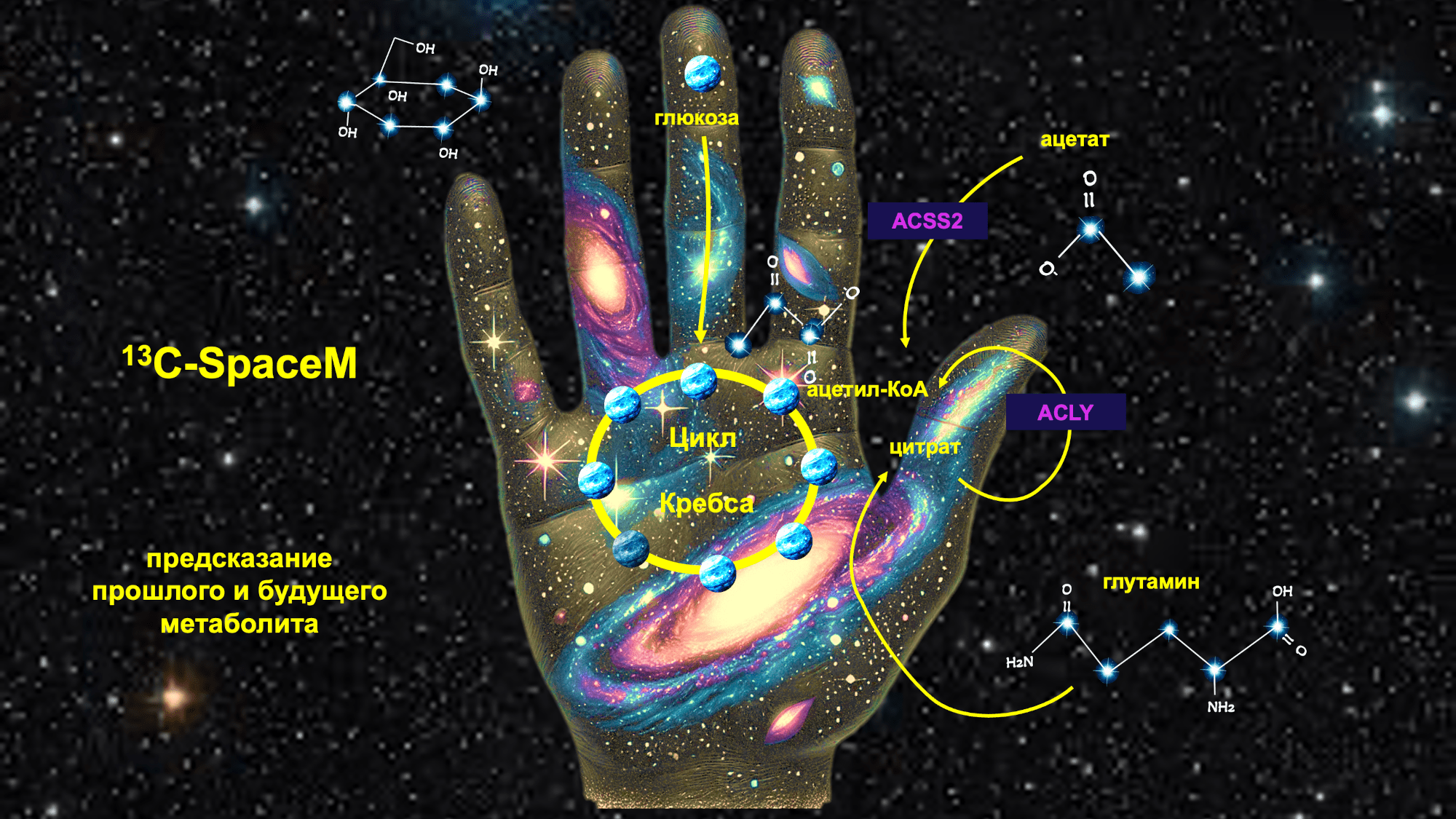
Рисунок 3. Модифицированный метод SpaceM (13C-SpaceM) отслеживает происхождение и судьбу метаболитов.
коллаж автора
Хорошая новость в том, что ученые уже составили карты метаболических превращений и собрали их в базы данных, такие как знаменитая база KEGG. Плохие новости в том, что зачастую карты клеточных и метаболических путей сложные и напоминают сильно запутанную карту метро (рис. 4).
Итак, существует три основных пути образования ацетил-КоА (рис. 4):
-
Из глюкозы через промежуточные метаболиты (пируват, цитрат). Этот путь характерен для здоровых клеток. Превращение цитрата в ацетил-КоА происходит с участием фермента ATP-цитрат-лиазы (ACLY).
-
Из глутамина при недостатке кислорода (гипоксия).
-
Из ацетата — путь, характерный для раковых клеток, с участием фермента ацетил-КоА-синтетазы 2 (ACSS2).
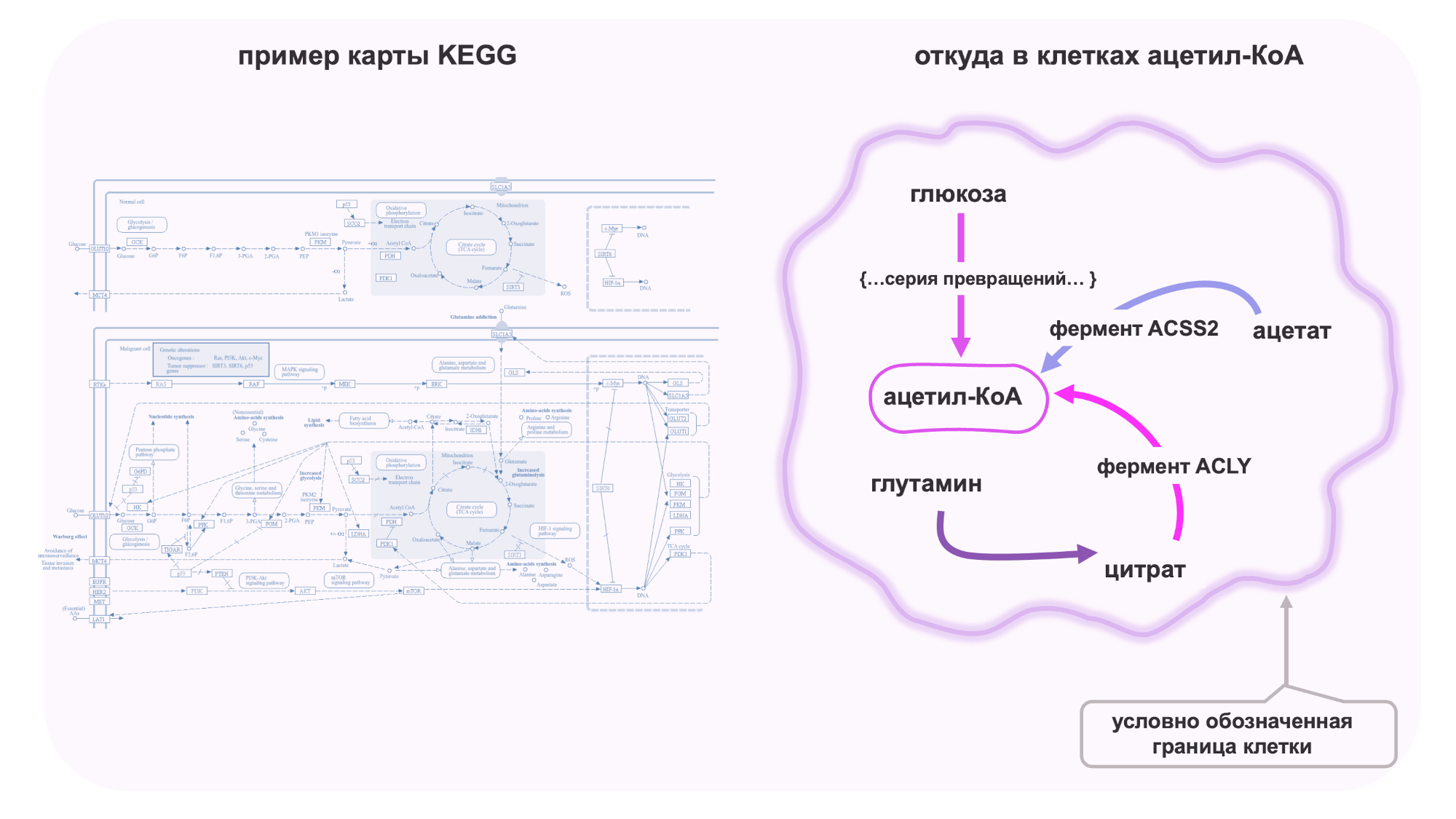
Рисунок 4. Многогранность метаболизма
Слева: Пример сложной схемы метаболических путей базы данных KEGG.
Справа: ацетил-КоА может синтезироваться в клетках различными путями, наиболее часто используемыми являются синтез из глюкозы, глутамина и ацетата.
KEGG, рисунок автора
Как с помощью масс-спектрометрии понять, используется путь синтеза для здорового или ракового состояния?
Идея элегантна: можно заменить обычную глюкозу с атомами углерода 13C на глюкозу с изотопами углерода 13C. Внутри клетки меченая глюкоза метаболизируется так же, как и обычная. Однако молекулы, содержащие 13C, становятся «тяжелее» по массе на +1, что влияет на соотношение массы к заряду m/z и. соответственно, отражается на масс-спектре.
Ожидание-реальность
Перейдем к самому интересному — эксперименту. Команда ученых под руководством Александрова решила выяснить, что произойдет, если «отключить» фермент ACLY — то есть «заблокировать« синтез ацетил-КоА из глюкозы.
Ученые придумали использовать клетки с определенной генетической конструкцией, позволяющей контролированно выключать (производить нокаут) гена ACLY при добавлении антибиотика доксициклина. Одновременно та же конструкция под действием доксициклина включала наработку клеткой зеленого флуоресцентного белка GFP. Таким образом, зеленое свечение клеток сигнализировало о выключении гена ACLY.
Для чистоты эксперимента брали клетки с разными модификациями упомянутой генетической конструкции (обозначены как конструкция 1 и конструкция 2, рис. 6). В качестве контроля использовали клетки с похожей генетической конструкцией, не выключающей ACLY.
Итак, при проведении все клеточные образцы находились в среде с 13C глюкозой, к клеткам добавляли доксициклин и анализировали клеточные метаболиты методом SpaceM.
Ученые хотели посмотреть, насколько много образуется 13C-меченого ацетил-КоА, однако при оценке результата эксперимента смотрели на образовавшийся в клетках из ацетил-КоА пальмитат.
Почему пальмитат, а не сам ацетил-КоА? Во-первых, ацетил-КоА трудно измерить напрямую, так как он является транзиторным метаболитом, быстро расходующимся в различных метаболических путях. Во-вторых, единственным источником синтеза пальмитата является ацетил-КоА (рисунок 5) , то есть мечение пальмитата отражает мечение ацетил-КоА.
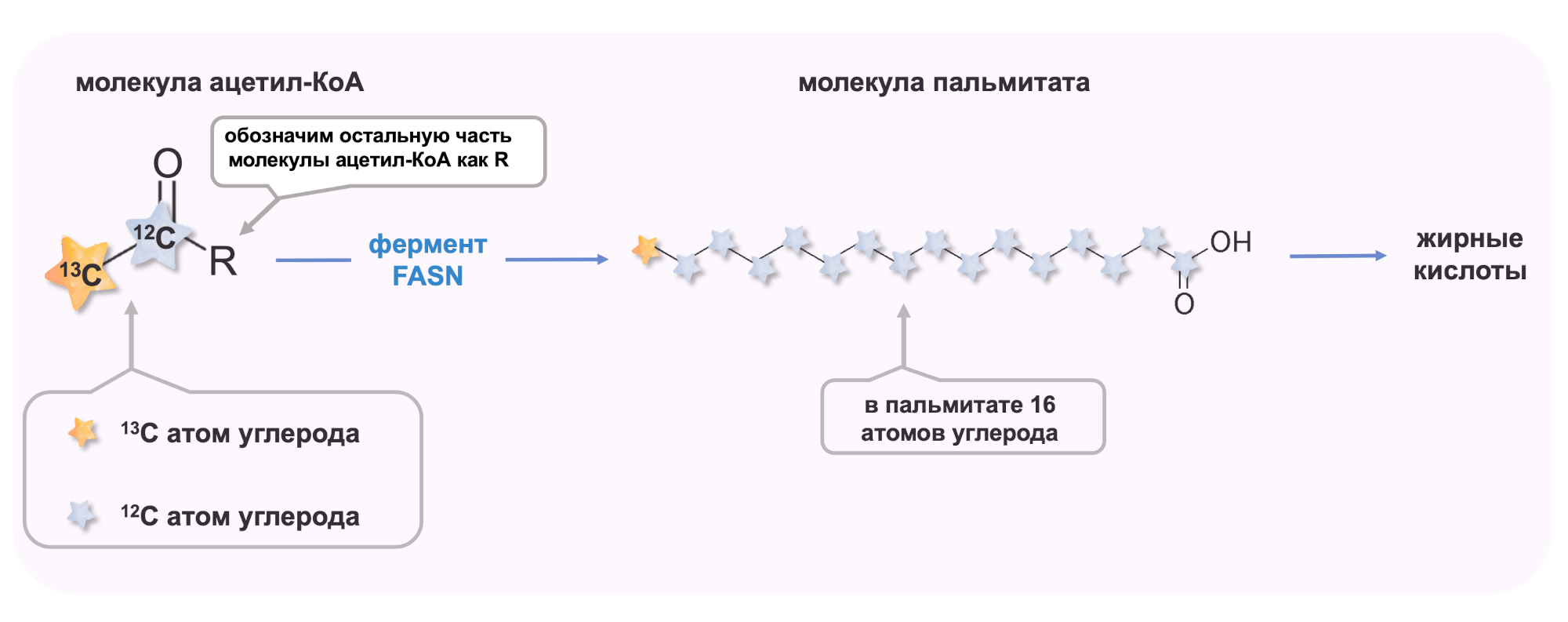
Рисунок 5. Ацетил-КоА является предшественником синтеза пальмитата и жирных кислот.
рисунок автора
Ожидалось, что при выключении ACLY основными источниками ацетил-КоА станут ацетат и глутамин (это логическое заключение следует из схемы путей синтеза ацетил-КоА, см. рис. 4). В целом, ожидания и реальность совпали.
После отключения фермента ACLY в клетках образовалось значительное количество пальмитата с низким уровнем замещения атомов 12C на 13C. Это указывает на то, что клетки, вероятно, использовали альтернативные источники, такие как ацетат или глутамин, для синтеза ацетил-КоА, а не 13C-глюкозу.
На рисунке 6 cправа представлены данные масс-спектрометрического анализа, показывающие распределение молекул пальмитата в клетках образца по степени изотопного мечения: M + 0 — немеченый пальмитат (синий), M + 2 — пальмитат с двумя атомами 13C (зеленый), M + 8 — пальмитат с восемью атомами 13C (красный). Анализ проводили трижды для повышения статистической достоверности. Разница в уровнях сигналов M + 2 (зеленый) и M + 8 (красный) на рисунке 6 справа отражает вклад 13C-глюкозы в синтез ацетил-КоА.
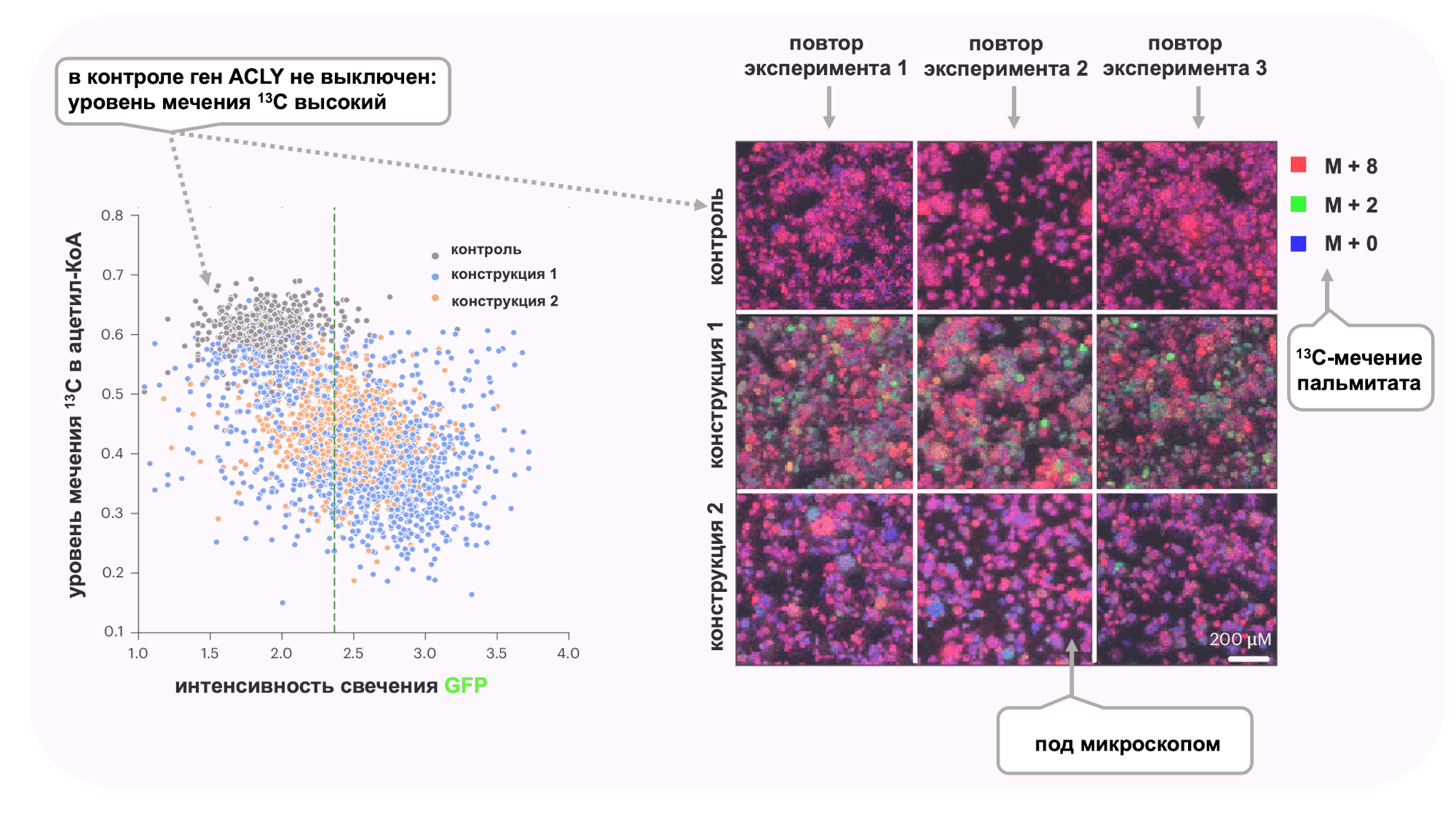
Рисунок 6. Как наблюдать за ацетил-КоА.
Слева: Из уровня мечения пальмитата с помощью хитрых математических вычислений получили уровень мечения ацетил-КоА.
На графике показано, как клетки использовали меченую глюкозу для синтеза жирных в трех условиях: контроль (серый), конструкция 1 (синий) и конструкция 2 (оранжевый). Видно четкое распределение клеток в трех упомянутых образцах по уровню мечения ацетил-КоА и уровню экспрессии клеткой GFP.
Справа: Уровень мечения пальмитата в образцах. Итак, исследователи увидели, выключение ACLY в олиго 1 и олиго 2 спровоцировало наличие большего количества маломеченого пальмитата M + 0 и M + 2, а значит, синтез ацетил-КоА в этих образцах происходил в основном не из 13C глюкозы.
Еще более интересный факт: в молекуле пальмитата 16 атомов углерода(возвращаемся к рисунку 5) и две молекулы пальмитата M + 2 могут иметь 13C атомы углерода «в разных позициях». Такие молекулы называются изотопологами и различаются на масс-спектре.
При использовании генетической конструкции 1 было наличие изотопологов пальмитата M + 2 и изотопологов пальмитата M + 8. Получается, в этом образцe 13C атомы углероды вставали в разных клетках на разные позиции молекулы пальмитата, и, соответственно, клетки по-разному синтезировали пальмитат. То есть клетки в одной и той же опухоли могут использовать различные метаболические пути для выживания.
Важный вывод №2: 13C-SpaceM позволяет понимать важные для раковой клетки пути. То есть можно применить такие знания для разработки новых методов лечения, нацеленных на «выключение» адаптивных путей раковых клеток, что помешает опухолям расти.
Тканевые узоры
Метод SpaceM интересен в контексте применения к материалам пациента. В этом смысле гораздо удобнее и логичнее использовать метод не на клетках (которые получают из тканей пациента путем взятия биопсии), а на самих тканях. точнее срезах тканей. При таком подходе дополнительно сохраняется архитектура (пространственное распределение клеток и их метаболитов) опухоли.
Таким образом, команда Александрова имплантировала (вживляла) раковые клетки мозга (глиому) в мышей. Мышей кормили диетой, обогащенной меченой 13C-глюкозой, по истечении срока эксперимента опухоль извлекали (брали биопсию) и анализировали тканевые срезы методом SpaceM.
Поскольку жирные кислоты играют важную роль в прогрессии глиом, ученые изучали степень включения меченого углерода в жирные кислоты, синтезируемые опухолевыми клетками (рис. 7).
По результатам анализа особенно ярко проявила себя миристиновая кислота, которая показала высокий уровень замещения атомов углерода на 13C, преимущественно в формах M + 10, M + 12 и M + 14 (М — масса миристиновой кислоты с атомами углерода 13C). Это важно, так как миристиновая кислота играет ключевую роль в модификации сигнальных белков, что, вероятно, связано с ускорением роста опухоли глиомы.
Напротив, другие жирные кислоты (стеариновая, олеиновая, пальмитиновая, пальмитолеиновая и др.) показали значительно меньший уровень включения 13C, что указывает на их менее активное использование опухолью в процессе роста.
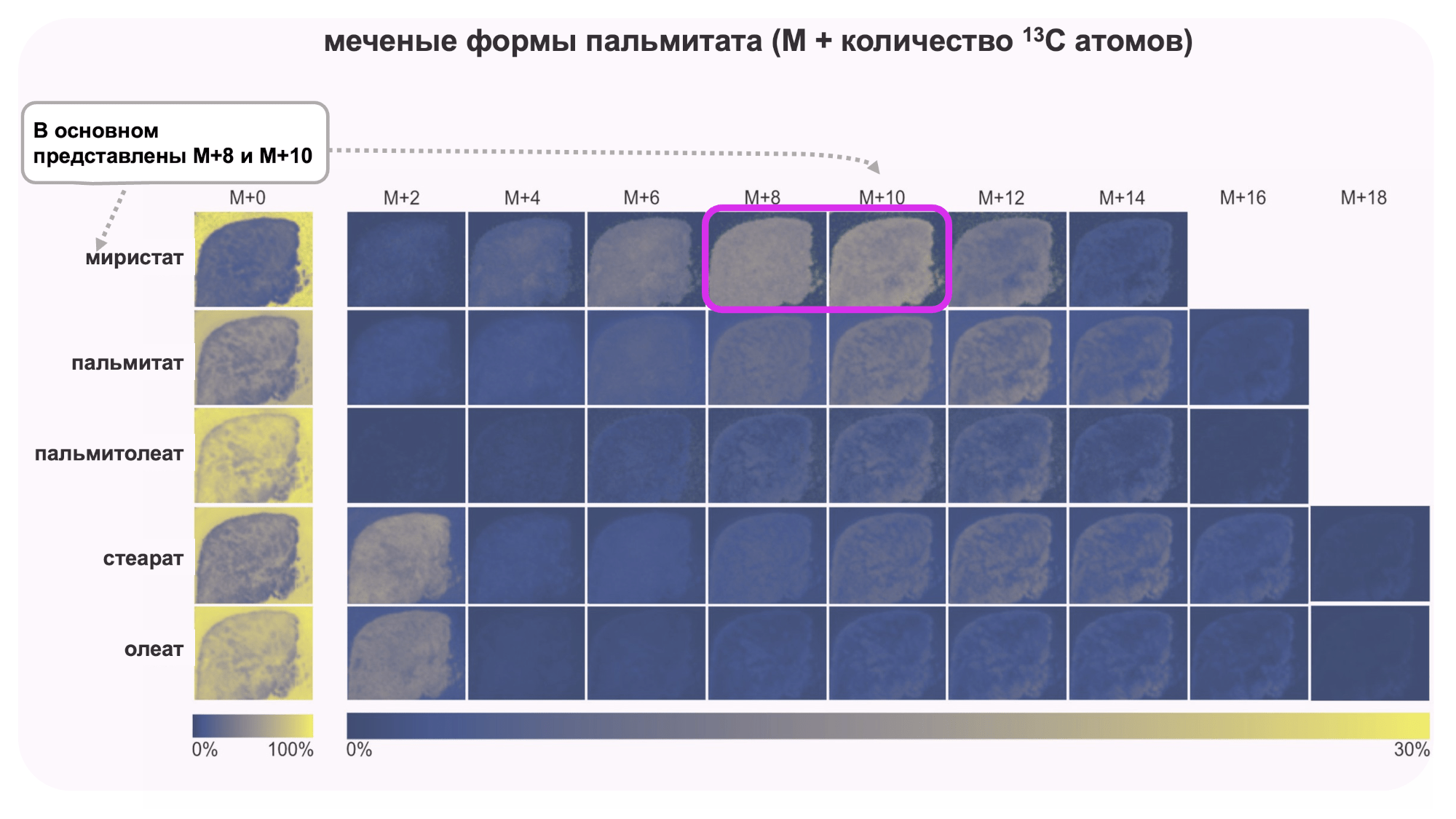
Рисунок 7. Метаболические изображения для миристиновой кислоты (14:0), пальмитиновой кислоты (16:0), пальмитолеиновой кислоты (16:1), стеариновой кислоты (18:0) и олеиновой кислоты (18:1) в опухолевой ткани (опухоль №1) мыши, которой была имплантирована глиома. Цвета на изображениях отображают долю каждого изотополога в суммарном количестве изотопологов для каждой жирной кислоты.
Важный вывод №3: Данный эксперимент показал возможность исследования «архитектуры и поведения раковой опухоли» в пространстве — подобные исследования способны улучшить понимание функционирования раковых опухолей и, соответственно, подходов к их лечению.
Далеко идущие выводы
Теперь, когда мы рассмотрели все эти шаги, давайте ответим на часто задаваемый научный вопрос: «Зачем все это нужно?»
С помощью метода SpaceM можно исследовать метаболом единичной клетки, что предоставляет уникальные возможности для исследования клеточной гетерогенности внутри одной популяции/опухоли/ткани/и т.д. Модификация метода — 13C-SpaceM — позволяет отследить судьбу каждого метаболита и оценить использование клеткой того или иного метаболического пути.
SpaceM открывает новые горизонты для персонализированной медицины. Например, данный метод может быть использован в биомедицинских исследованиях опухолевых материалов пациентов. Так как технология SpaceM учитывает не один параметр (окрашивание опухоли разнообразными красителями/изменение размера опухоли при воздействии лекарств, например), а много параметров сразу — сотни метаболитов — она открывает возможности для улучшения диагностики патологий и разработки терапии.
Литература
- Luca Rappez, Mira Stadler, Sergio Triana, Rose Muthoni Gathungu, Katja Ovchinnikova, et. al. (2021). SpaceM reveals metabolic states of single cells. Nat Methods. 18, 799-805;
- 12 методов в картинках: протеомика;
- Elena Buglakova, Måns Ekelöf, Michaela Schwaiger-Haber, Lisa Schlicker, Martijn R. Molenaar, et. al. (2024). Spatial single-cell isotope tracing reveals heterogeneity of de novo fatty acid synthesis in cancer. Nat Metab. 6, 1695-1711.







