Растительные клеточные биофабрики: на службе здоровья человечества
10 октября 2023
Растительные клеточные биофабрики: на службе здоровья человечества
- 2091
- 0
- 5
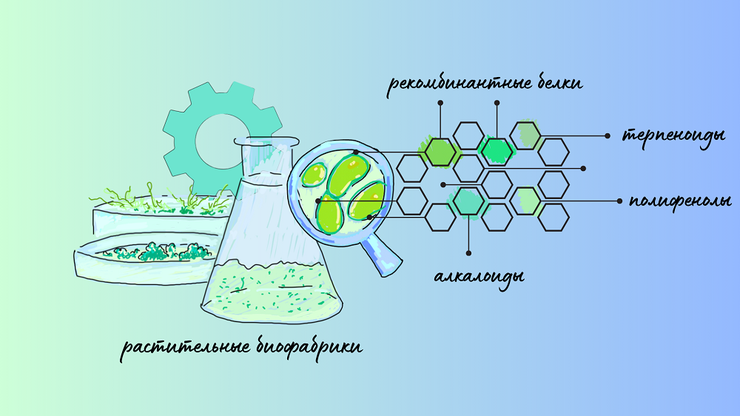
На обложке представлены наиболее популярные варианты выращивания растительных клеток в контролируемых условиях (в колбе — суспензионная культура; в верхней чашке Петри — культура «бородатых» корней; в нижней — каллусная культура), которые могут продуцировать широкий спектр биологически активных веществ (алкалоидов, терпеноидов, полифенольных соединений, а также рекомбинантных белков).
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Недавние вспышки вирусных инфекций, в том числе нашумевшего вируса Эбола и коронавируса, подчеркивают необходимость разработки новых лекарств, потому как старые добрые противовирусные препараты, например, умифеновир, не оказывают выраженного действия на подавление активности возбудителей. Вместе с тем, увеличивается число бактериальных заболеваний, вызванных известной всем кишечной палочкой (Escherichia coli) и бактериями рода Salmonella spp., а спектр антибиотиков от ципрофлоксацина до ампициллина оказывается неэффективным. Все потому, что микроорганизмы научились противостоять специфическому действию антибактериальных препаратов и выработали механизмы устойчивости (антибиотикорезистентность). Появление новых заболеваний и потеря эффективности ряда лекарственных средств становятся причинами поиска новых источников ценных молекул.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Поэтому в фокусе ученых оказываются растительные ресурсы, содержащие богатый комплекс биологически активных соединений. В нашем столетии подход «полечись травами» приобретает несколько иной смысл и открывает широкое поле деятельности для изучения и выделения индивидуальных веществ, обладающих выраженным фармакологическим действием. Биологически активные вещества растений — вторичные метаболиты — представляют немалый интерес для решения задач фармацевтической отрасли. Однако сколько растений нужно использовать для добычи этих метаболитов? Чтобы не вредить экологическому состоянию планеты и ускорить процесс наработки ценных веществ, ученые нашли выход — выращивать изолированные клетки растения в контролируемой среде. В результате получились платформы биосинтеза нужных молекул. В этой статье мы рассмотрим, как именно создаются такие растительные биофабрики.
Как растения синтезировать начали
Синтез активных соединений в растительных организмах происходит не случайно. В отличие от других существ, растения ведут прикрепленный образ жизни, поэтому выживать в суровых условиях естественной среды обитания им намного сложнее. Все то, что их окружает, начиная от микроорганизмов, климатических условий — и заканчивая пагубным влиянием человека, является стресс-факторами. Поэтому у растения есть два пути: сдаться и умереть или же бороться и выживать. Памятуя принцип естественного отбора, растительные организмы начинают активно сопротивляться стресс-факторам путем выработки специальных веществ. То есть растение запускает процессы биосинтеза своеобразных молекул-регуляторов, которые в зависимости от потребности «включают» процессы, необходимые для существования в конкретных изменившихся условиях. К таким молекулам относятся алкалоиды, полифенольные и терпеновые соединения, а также растительные гормоны. Например, при механическом травмировании растения продуцируют фитогормоны — жасмоновую кислоту и метилжасмонат, которые обладают отпугивающим и ядовитым действием для травоядных животных. При этом происходит и усиление передачи сигналов ионов кальция Ca2+ по всему организму (рис. 1). В ответ на повышение уровня ионов Ca2+ рецепторы в клетках растений активируют ферменты протеинкиназы, запуская таким образом работу генов, отвечающих за стрессовые воздействия [1].
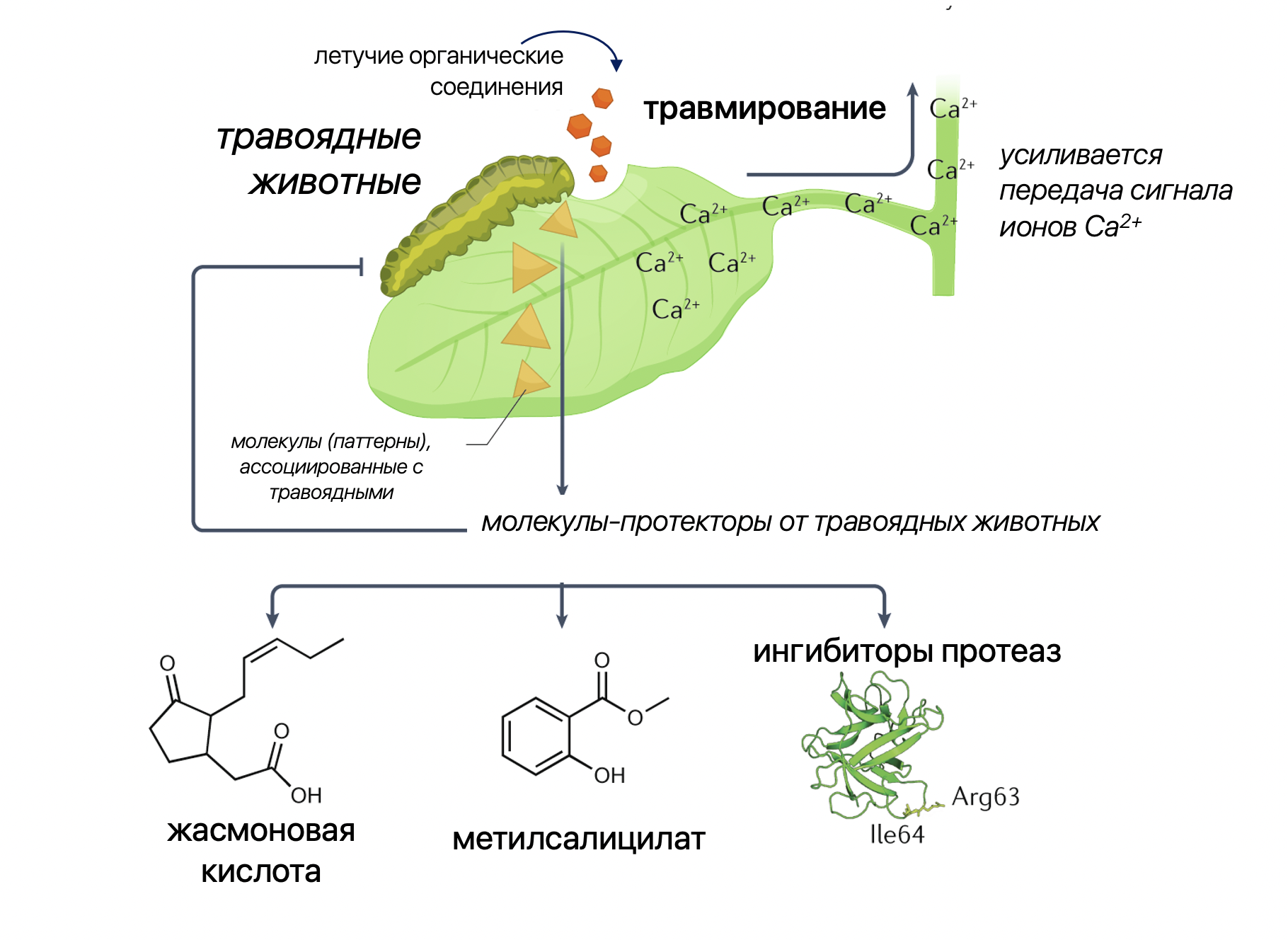
Рисунок 1. Схема ответной реакции растения на стрессовые воздействия в виде механического травмирования и поедания травоядными животными.
В ответ на «ранения» растительные организмы также начинают активно выделять летучие органические соединения (терпеноиды, бензоиды, производные жирных кислот и аминокислот). Их концентрация сравнительно невысока и для растений безопасна. Но для травоядных животных, патогенных микроорганизмов и человека такие молекулы могут представлять потенциальную угрозу. Интересно, что летучие органические соединения не только отпугивают вредителей, но и привлекают хищников, которые атакуют травоядных животных, или выступают в роли сигнальных соединений, переносимых по воздуху и предупреждающих других растений об опасности. Например, в листьях томата при механическом повреждении увеличивается количество терпенов и терпинеола, в случае заражения фитофторой (заболевание, вызываемое оомицетами или псевдогрибами — Phytophthora infestans) повышается уровень летучего соединения (E)-2-гексенала, который действует на паразитов как отравляющее вещество [2]. Другим интересным примером является табак Nicotiana attenuata, в листьях которого осуществляется выработка того же (E)-2-гексенала в ответ на поедание гусеницами-бражниками Manduca sexta. Это летучее соединение привлекает клопов рода Geocoris, которые враждуют с гусеницами [3]. Подобным образом растение устраняет своих врагов и защищается от нападений.
Вторичные метаболиты обладают выраженной биологической активностью и, как обнаружили ученые, не только для самого растительного сообщества, но и для человека. Широкий спектр фармакологических эффектов делает вторичные метаболиты перспективными и порой незаменимыми агентами при лечении и профилактике разнообразных заболеваний, в том числе и социально значимых (онкологии, диабета, гепатитов различных типов, ВИЧ-инфекции, сердечно-сосудистых патологий и пр.). Сегодня на фармацевтическом рынке можно найти немалое количество фитопрепаратов: от индивидуальных соединений (дигитоксина, диосмина, гесперидина, скополамина и атропина) до экстрактов, содержащих комплексы биологически активных веществ [4].
Однако разработка лекарственных препаратов с использованием сырья в виде отдельных частей растений весьма затруднительна. Во-первых, не все растения могут быть заготовлены для производства фитопрепаратов. Как правило, в медицинской практике применяется лишь официнальное сырье — те растения, информация о которых задокументирована в Государственной Фармакопее. По этой причине на фоне ограничений использования растительного сырья браконьерство в сфере несанкционированного сбора ценных растений с каждым годом процветает все больше. Более 95% лекарственных видов собираются незаконно, браконьеры совершенно не заботятся о правилах заготовки, полностью уничтожая таким образом представителей флоры [5]. В результате чрезмерной эксплуатации многие виды находятся на грани исчезновения. Во-вторых, уровень накопления вторичных метаболитов в образцах, произрастающих в естественной среде обитания, крайне низок. Получается, что для промышленного производства нескольких килограммов чистой субстанции может потребоваться не одна тонна сырья. А это неэкологично, невыгодно и слишком трудозатратно.
В поисках альтернативы растениям
Еще в ХХ веке стало очевидно, что традиционными методами производства невозможно решить ряд задач, связанных с созданием фитопрепаратов. Поэтому вектор поисков весомых альтернатив направили в сторону биотехнологии. «Почему бы не использовать растительные клетки как платформы для накопления вторичных метаболитов?», — решили ученые. Первооткрывателем в этой области стал австрийский ботаник Готлиб Хаберландт, который рассматривал клетки как простые, отдельные «элементарные организмы» или относительно независимые «живые единицы», способные самостоятельно расти и развиваться в контролируемых условиях. В ходе исследований возникал вполне резонный вопрос: как клетки это делают? В ответ Хаберланд предложил концепцию тотипотентности, которая впоследствии стала основополагающей для технологии культивирования растительных клеток. Наряду с тем, как клетки животных, например, зигота, способны производить все типы дифференцированных клеток организма, так и «любая клетка растения может дать начало целому организму» (рис. 2) [6], [7]. Это и есть свойство тотипотентности. Получалось, что клетка способна работать самостоятельно, и в зависимости от действий извне выступать в роли маленькой биофабрики. Так появилась технология культивирования растительных клеток в контролируемых условиях in vitro, то есть в пробирке, изолированно от всего растения. Однако на пути исследователей и разработчиков данного подхода возникло немало трудностей и крутых поворотов.
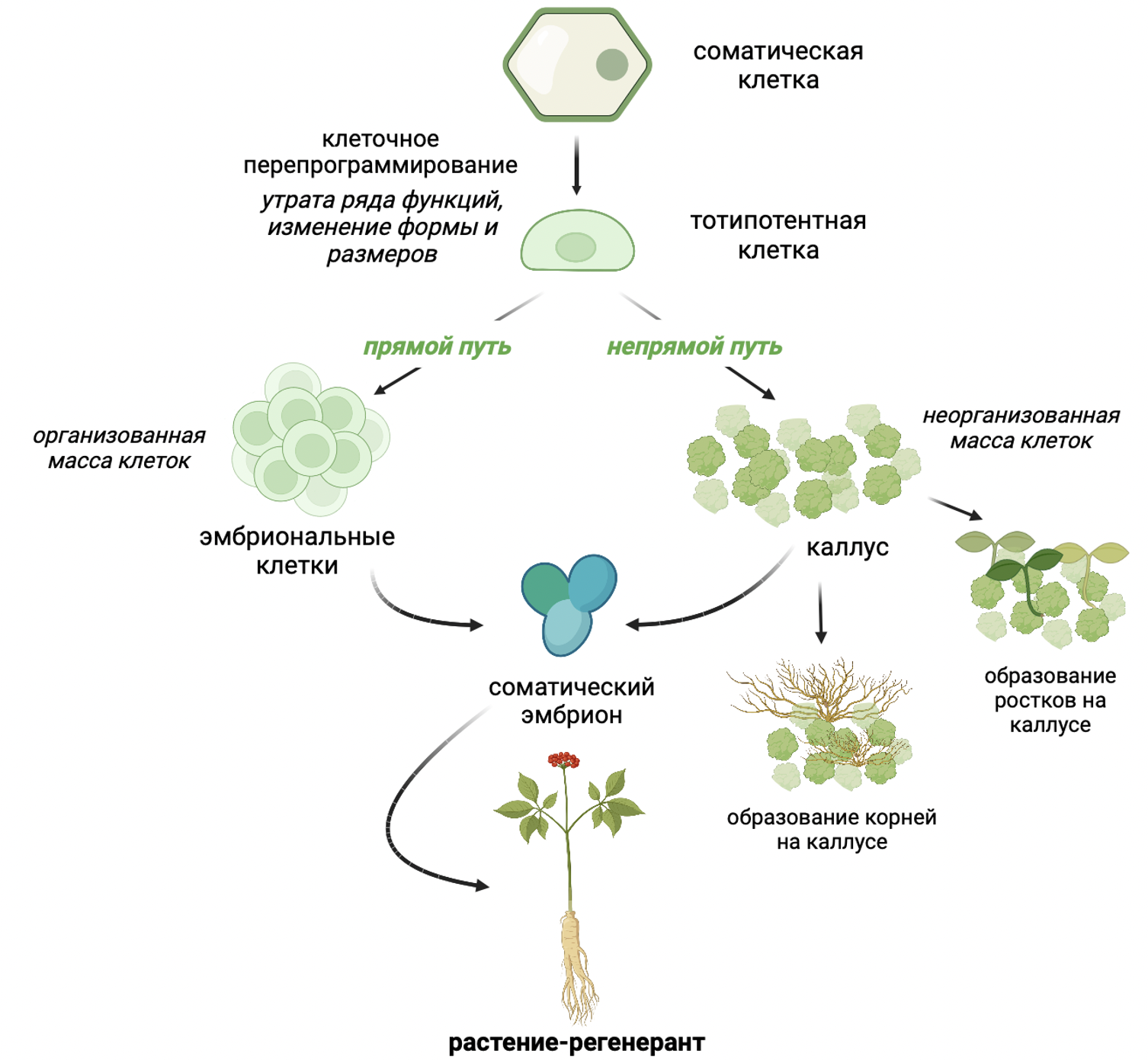
Рисунок 2. Тотипотентность растительных клеток.
на основе [6]
Основная сложность на этапе становления технологии культивирования заключалась в самой растительной клетке. Как элементарная единица целого организма, клетка растения — многогранный, нетривиально устроенный механизм, который функционирует по заданной программе развития. Перенос клеток в условия in vitro способствует появлению новых специфических особенностей, поскольку эти самые клетки освобождаются от влияния нейрогуморальных факторов растительного организма. Здесь снова срабатывает принцип естественного отбора: чтобы жить в искусственной среде, надо приспосабливаться. Поэтому культуры растительных клеток отличаются по морфологическим, физиологическим, метаболическим и генетическим признакам от клеток и тканей родительского растения.
Исторически технология культивирования растительных клеток и клеток микроорганизмов развивались параллельно. Бактерии обнаруживали лучшую склонность к процессам роста, развития и продуцирования полезных веществ в условиях in vitro, нежели растительная биомасса. Дело в том, что клетки растений тяжелее бактериальных, а потому требуют более интенсивного перемешивания при выращивании в объеме жидкой питательной среды для предотвращения образования застойных зон. В таких зонах биомасса начинает ускоренно стареть и умирать. Кроме того, растительные клетки по сравнению с микробными дольше делятся, обладают способностью к агрегации (слипанию), чувствительностью к сторонним усилиям (например, к тому же перемешиванию) (рис. 3). Период деления бактериальных клеток в биомассе существенно меньше, что делает их более привлекательными объектами для ведения процесса наработки активных веществ [7–9].
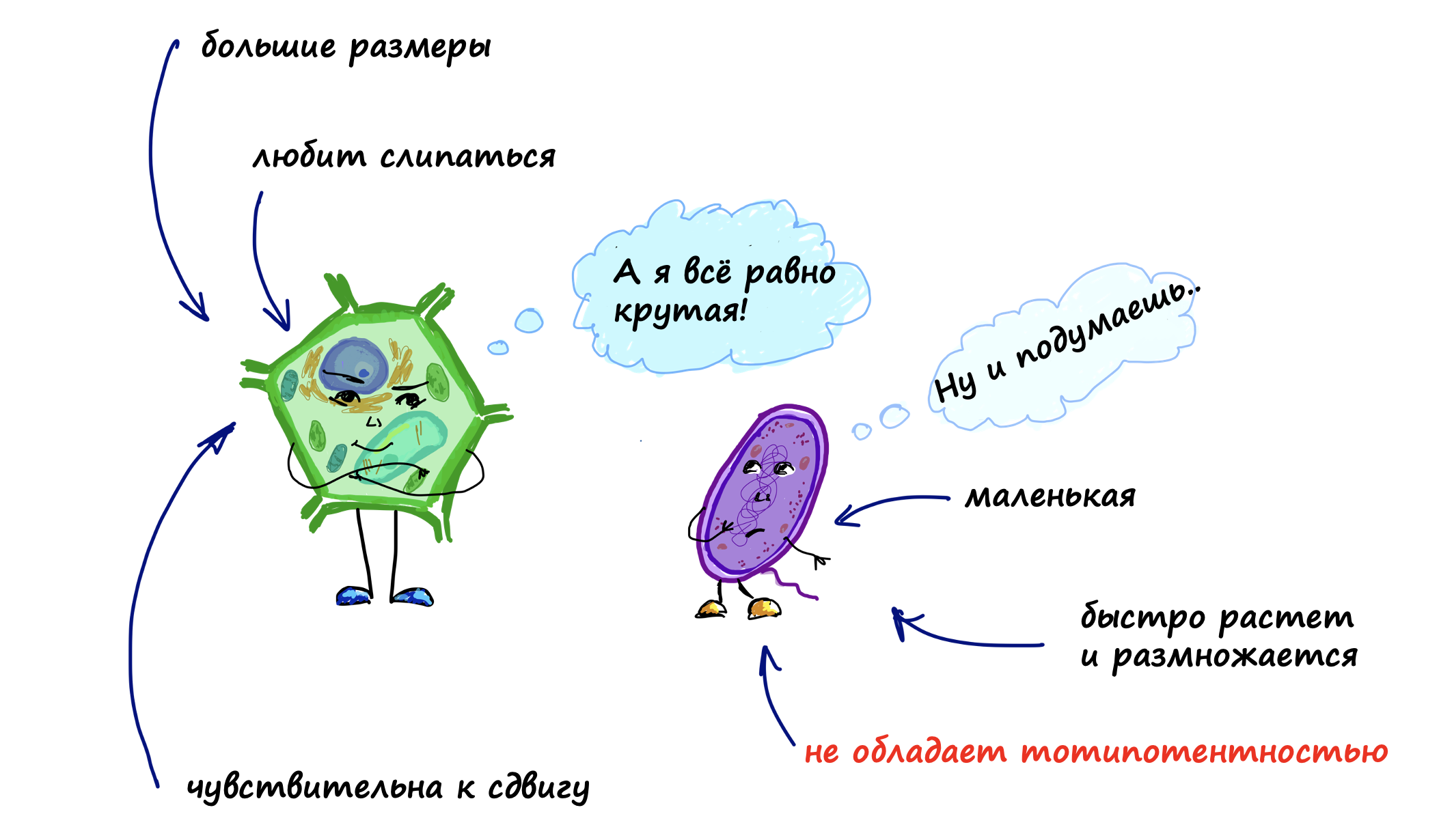
Рисунок 3. Растительная клетка vs. бактериальная клетка.
на основе [7–9]
Однако, несмотря на недостатки, растительные клетки имеют существенные отличия, которые позволяют им занять уверенную позицию в качестве биотехнологической системы. С одной стороны, они разрастаются (пролиферируют) in vitro неограниченно долго, тогда как первичные культуры, например, животных клеток, обычно претерпевают ограниченное число клеточных делений. С другой стороны, растительные клетки тотипотентны, т.е. при соответствующих условиях могут регенерировать весь растительный организм. Следовательно, практических применений у такой системы довольно-таки много: от селекции и сохранения видов до платформ биосинтеза молекул!
И начали они культивировать
Итак, прошедшее столетие ознаменовалось бурным развитием контролируемых систем выращивания растительных клеток. Появились возможности культивирования in vitro изолированных систем, чтобы в дальнейшем вырастить в пробирке как целый организм, так и необходимый кусочек растительной ткани. Например, можно создать культуру неорганизованных клеток на плотной питательной среде (каллусную) и более упорядоченных и диспергированных клеток в объеме жидкой питательной среды (суспензионную). А если хочется большего, то можно получить культуру одиночных клеток — изолированных протопластов, клеток с удаленной клеточной оболочкой. Или пойти дальше и заставить части растений в условиях in vitro запускать процессы формирования отдельных органов — «бородатых» корней (в англ. варианте: hairy root cultures). Этот процесс называется органогенезом. Или же просто можно заставить каллусную или суспензионную культуру образовывать зародыши в среде in vitro и выращивать микроклоны — реализовать соматический эмбриогенез. Такой процесс позволяет регенерировать в пробирке совершенно новое растение, идентичное тому, из которого были получены экспланты и клетки. Для фармацевтической промышленности наиболее привлекательными оказались суспензионные культуры по причине более удобной организации процесса производства, высокой скорости наработки большого количества ценных веществ и адаптивных технологических режимов выращивания клеток [10], [11].
Вне зависимости от того, какой вариант культивирования хочет реализовать исследователь, существует ряд общих принципов и факторов, определяющих успех процесса. В первую очередь, возраст экспланта (части родительского растения), его физиологическое состояние и генотип становятся важными показателями возможности роста клеток в условиях in vitro. Если растение старое или растет в условиях повышенного стресса, заставить его клетки самостоятельно расти в пробирке будет слишком сложно или невозможно. Затем исследователю приходится примерить на себя роль сотрудника бюро рисков и прогнозов и подобрать режим культивирования (температуру, рН, освещенность, аэрацию, при необходимости — встряхивание или перемешивание), а также состав питательных веществ и фитогормонов в культуральной среде. Известно, что в зависимости от соотношения ауксинов и цитокининов (растительных гормонов), можно запускать определенные программы развития клеточной культуры. Например, если в контролируемую среду добавить сопоставимое количество указанных гормонов, клетки начинают интенсивно пролиферировать. В случае, когда в питательную среду внесено больше ауксинов (2,4-дихлорфеноксиуксусной кислоты или индолил-3-уксусной кислоты) по сравнению с цитокининами, активируются процессы формирования и роста корней. В обратном случае, когда цитокинины (например, самый известный из них — кинетин) преобладают по количественному содержанию, происходит развитие (органогенез) побегов. Наглядно влияние растительных гормонов можно продемонстрировать результатами исследования польских ученых, посвященного изучению различных типов цитокининов (производных пуринового ряда — мета-тополина, бензиламинопурина; производных мочевины — тидиазурона и форхлорфенурона) в процессах регенерации эксплантов шалфея буллейского (Salvia bulleyana) (рис. 4) [12].

Рисунок 4. Регенерированная линия побегов S. bulleyana, полученная в присутствии различных цитокининов:
(а) — 2 мг/л бензиламинопурина;
(б) — 2 мг/л мета-тополина;
(в) — 0,2 мг/л тидиазурона;
(г) — 4 мг/л форхлорфенурона;
(д) — контроль — культура побегов через 5 недель роста на среде Мурасиге-Скуга с 0,1 мг/л индолилуксусной кислотой (ауксин) и 1 мг/л бензиламинопурина
В данном случае, стимуляция фитогормонами позволила увеличить количество розмариновой кислоты (полифенольного соединения с выраженными антиоксидантными, гепатопротекторными и нейропротекторными свойствами) в полученных линиях приблизительно в три раза по сравнению с побегами шалфея, произрастающими в естественных условиях [12].
Таким образом, подобранные параметры культивирования должны способствовать созданию фактически идеальных условий для биомассы — своеобразного пятизвездочного отеля, где клетки могут спокойно адаптироваться, расти, размножаться и развиваться. От этого напрямую зависит профиль вторичных метаболитов, накапливаемых культурой.
Всё начинается с каллуса
С латинского «каллус» переводится как «мозоль», и в действительности представляет собой защитную ткань, которая накапливает питательные вещества для запуска процессов регенерации на месте травмирования. В целом, интактное растение может образовывать каллусную ткань in vivo, т.е. в естественных условиях. Например, в том случае, когда на его поверхности по тем или иным причинам появляется рана. Для получения каллуса в условиях in vitro используется похожий принцип: выбирается нужная часть растения (эксплант), подвергается поверхностной стерилизации с удалением эпифитной микрофлоры (тех микроорганизмов, которые обитают на поверхности частей растений) с помощью специальных химических агентов, помещается в асептических условиях в чашку Петри с питательной средой, после чего образец «ранят». Другой способ заключается в выборе подходящего экспланта, его стерилизации и размещении на питательной среде, содержащей растительные гормоны, которые запускают процессы образования каллуса.
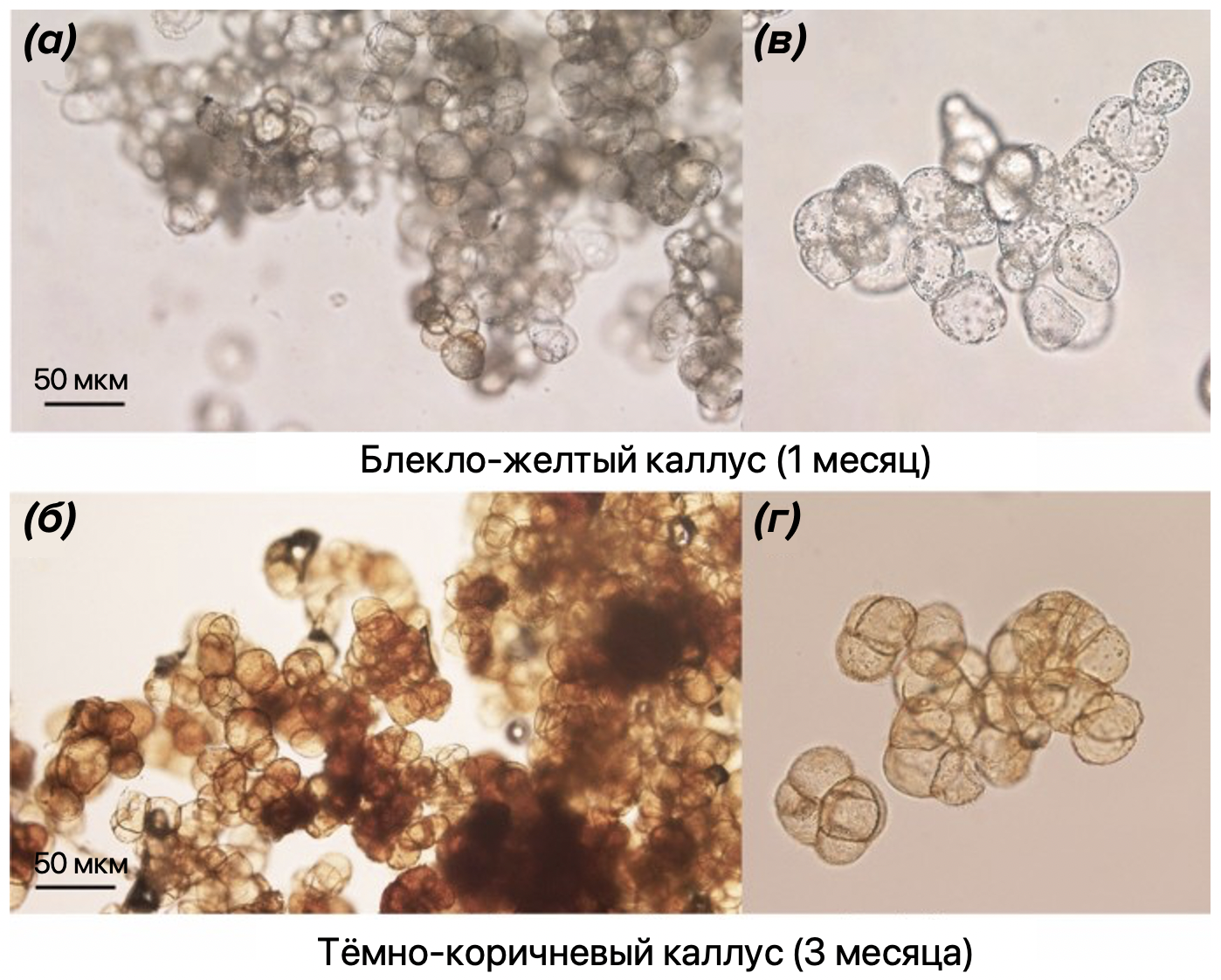
По внешнему виду каллус напоминает аморфную массу — рыхлую или плотную кашицу. Если поместить каллусную ткань под микроскоп, то можно обнаружить скопление тонкостенных паренхимных клеток различных форм и размеров (рис. 5А) [13].
Гетерогенность клеток каллуса можно объяснить тем, что в экспланте (например, кусочке стебля) присутствуют клетки разных типов. Это могут быть эпидермальные (наружные) клетки, клетки камбия, ксилемы и флоэмы, паренхимы сердцевинных лучей (такие лучи являются скоплением клеток проводящей ткани между сердцевиной и первичной корой у древесных растений). Другими словами, это дифференцированные клетки, выполняющие строго определенные функции в растительном организме. Они могут находиться в разном физиологическом состоянии, поэтому при переносе в условия in vitro претерпевают стрессовые воздействия, которые влияют на изменение метаболических характеристик. И это не значит, что клетки становятся хуже, скорее, наоборот — изменение их свойств позволяет ученым осуществлять контроль наработки ценных биологически активных соединений.
Но вернемся к процессам образования каллуса in vitro. На раневой поверхности экспланта или же при внесении растительных гормонов в стерильных условиях клетки испытывают стресс и не понимают, что делать с теми функциями, которые они выполняли в родительском растении. После недолгих раздумий они осознают, что «старые» функции не нужны. Этот процесс иначе называется дедифференцировкой: прекращается митоз, клетки изменяют присущие им формы и размеры, структуру ядра и цитоплазмы, то есть все характерные для них свойства. Только после этого они начинают делиться в уже измененном состоянии. В результате формируется первичный каллус — масса неорганизованных клеток. По мере того, как протекают процессы клеточного деления и развития (на практике этот срок варьируется в пределах 4–6 недель), каллусы пересаживаются на свежую питательную среду, и так далее с учетом роста клеточной культуры. Ростовой цикл каллусов не является универсальным и зависит от конкретного вида растения, а также от подобранных условий культивирования in vitro. Общей закономерностью являются внешние признаки роста: в начале и середине цикла субкультивирования клетки рыхлые и светлые, к концу цикла они начинают стареть и темнеют ввиду накопления большого количества фенольных соединений (рис. 5А).
На сегодняшний день в виде каллусных культур выращиваются многие лекарственные растения: гинкго билоба, женьшень, раувольфия змеиная, шалфей и другие [14]. Конечно, культивировать такую клеточной массу в больших аппаратах не представляется возможным. Как уже было отмечено, «с каллусов все начинается» — в технологии производства биомассы растительных клеток они являются начальным звеном.
Растительные клетки плавают!
Суспензионные культуры растительных клеток нашли широкое применение в фармацевтической отрасли из-за более «удобной» организации производственного процесса. Этот способ характеризуется выращиванием клеток в объеме жидкой питательной среды. Просто поместить биомассу в культуральную среду и отправить в свободное плавание не получится: сила тяжести заставит клетки залечь на дно. А как известно, растительные клетки обладают повышенной склонностью к слипанию из-за целлюлозы, белков и слизей в составе их клеточных стенок. Следовательно, в таком состоянии они образуют плотные комки, коллективно стареют и умирают. Для предотвращения нежелательных последствий, суспензионные культуры должны постоянно встряхиваться или перемешиваться, чтобы клетки находились как бы во взвешенном состоянии. Усилия по перемешиванию, кроме того, способствуют постепенной клеточной диссоциации и лучшей пролиферации, то есть росту биомассы. Дополнительно при выращивании суспензионных культур используются специальные устройства — барботеры, которые позволяют насыщать культуральную среду пузырьками кислорода (рис. 6). Итог таких манипуляций очевиден: клетки постоянно плавают, дышат и начинают активно разрастаться и продуцировать необходимые исследователям вторичные метаболиты.
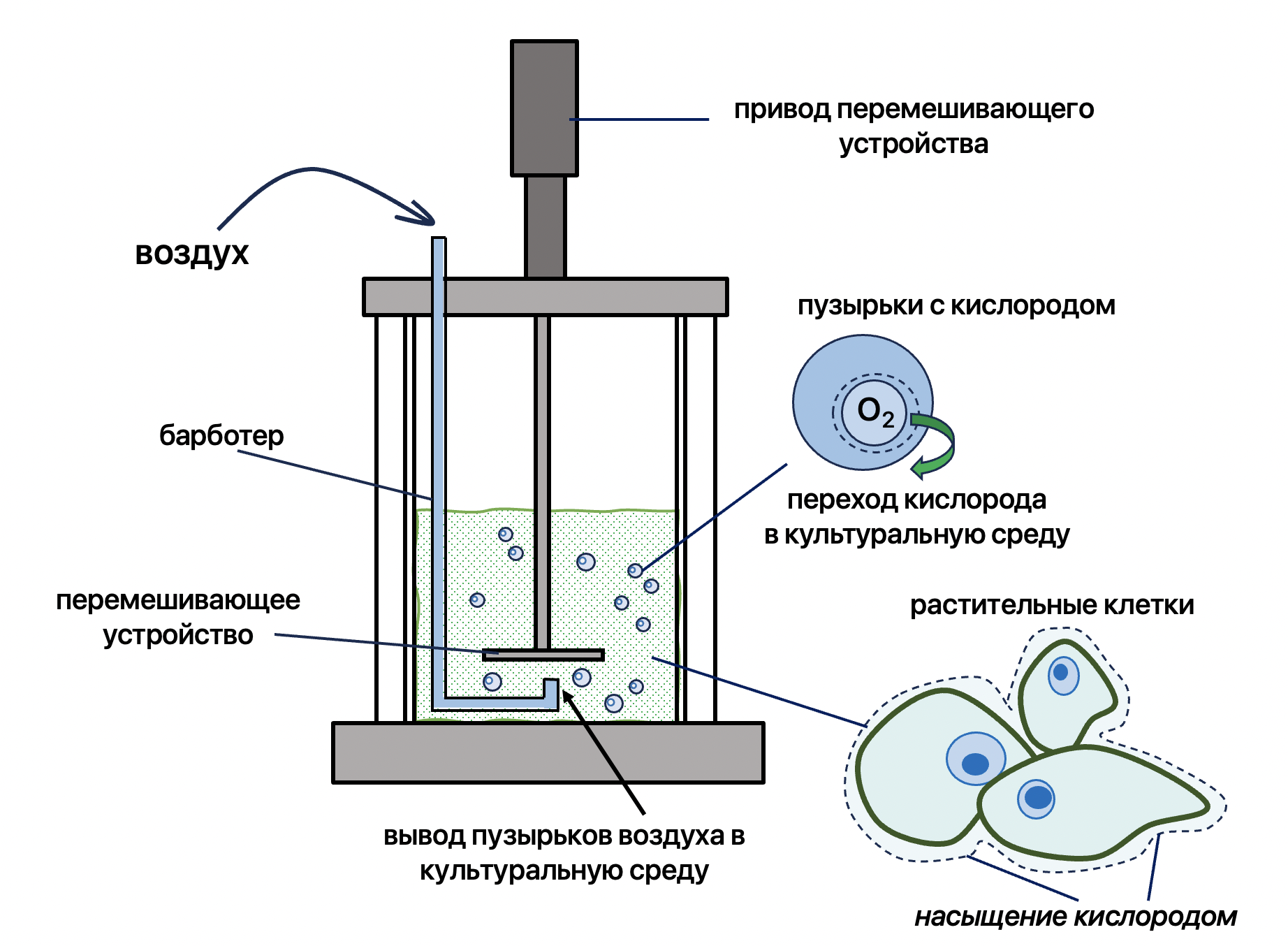
Рисунок 6. Схематичное изображение барботера в биореакторе.
рисунок автора
Такой способ выращивания зарекомендовал себя как эффективный, поэтому многие биофармацевтические компании используют именно суспензионные культуры в качестве платформ для биосинтеза ценных веществ. Почему же так происходит? Во-первых, клетки в суспензионной форме обладают более короткими ростовыми циклами, то есть растут примерно вдвое быстрее каллусных. Да и выращивать суспензии растительных клеток проще — биомасса лучше диссоциирована, в ходе цикла субкультивирования можно отбирать пробы для анализа морфологии, физиологии и жизнеспособности образцов. Во-вторых, культивирование в жидкой среде более адаптивно для масштабирования технологических процессов. Культуральный сосуд в лаборатории — коническая колба или пластиковый (полимерный) мешок — может быть заменен большим биореактором (стальным или пластиковым емкостным аппаратом, оснащенным перемешивающими устройствами и специальными датчиками контроля) (рис. 7). Увеличивается объем загрузки реактора, а значит, увеличивается выход по биомассе и получается больше сырья для извлечения вторичных метаболитов.
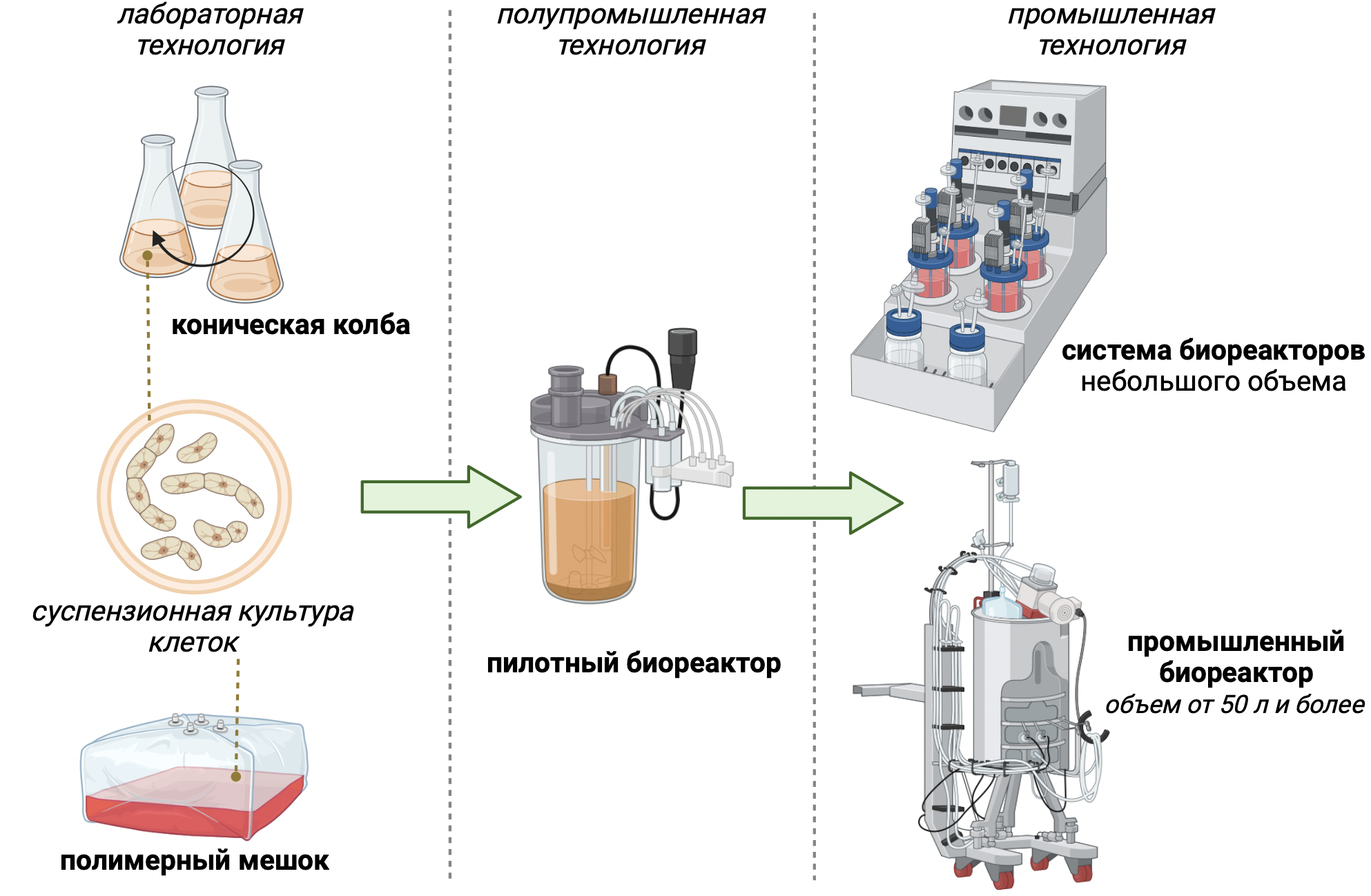
Рисунок 7. Масштабирование технологии суспензионного культивирования — от лабораторного до промышленного уровня.
рисунок автора
Но не будем забывать про каллусы! На производстве при работе с суспензионными культурами их все равно используют — на самой первой стадии подготовки материала. Сначала получают стабильно растущую линию клеток на плотной питательной среде, отбирают часть рыхлой биомассы в фазе роста и помещают в жидкую питательную среду. После 2–4 циклов субкультивирования (их называют «пассажами») и анализа профиля накопления вторичных метаболитов начинается стадия масштабирования. Из колбы клетки перемещают в более объемные сосуды — биореакторы от 2,5 л до нескольких сотен или тысяч литров, в зависимости от мощностей фармацевтического предприятия. По завершении процесса получают сырую биомассу, которую подвергают сушке, измельчению и экстракции специальными растворителями. Другими словами, на этом этапе происходит извлечение ценных соединений, их выделение и очистка. О промышленном применении суспензионных культур читайте ниже.
Мягкие и пушистые
Бывают случаи, когда исследователям становится необходимо запустить процессы органогенеза в каллусной культуре или взять готовый эксплант и вызвать образование «бородатых» корней. От обычных и привычных нам подземных органов полученные в культуре образцы отличаются повышенной мохнатостью и пушистостью, иначе говоря, «бородатостью». Здесь же необходимо понимать, что такие новообразования могут вырастать не только на самих корнях, но и на листья, стеблях и т.д. (рис. 8) [15]. Так называемая «бородатость» связана, как ни странно, с заболеванием, которое вызывается почвенными бактериями Agrobacterium rhizogenes. То есть бородатый корень есть не что иное, как синдром заболевания, возникающий в результате внедрения транспортных ДНК (Т-ДНК) почвенных бактерий в геном растения при заражении.
Почему такие корни привлекательны? Дело здесь не только во внешней красоте, но и в метаболитном потенциале. Благодаря генетическим трансформациям и добавлению специальных стимуляторов роста (их называют «элиситорами»), «бородатые» корни очень быстро растут в контролируемой среде in vitro, физиологически, генетически и биохимически стабильны и продуктивны (накапливают вторичные метаболиты в количестве, превышающим содержание активных веществ в родительском растении).
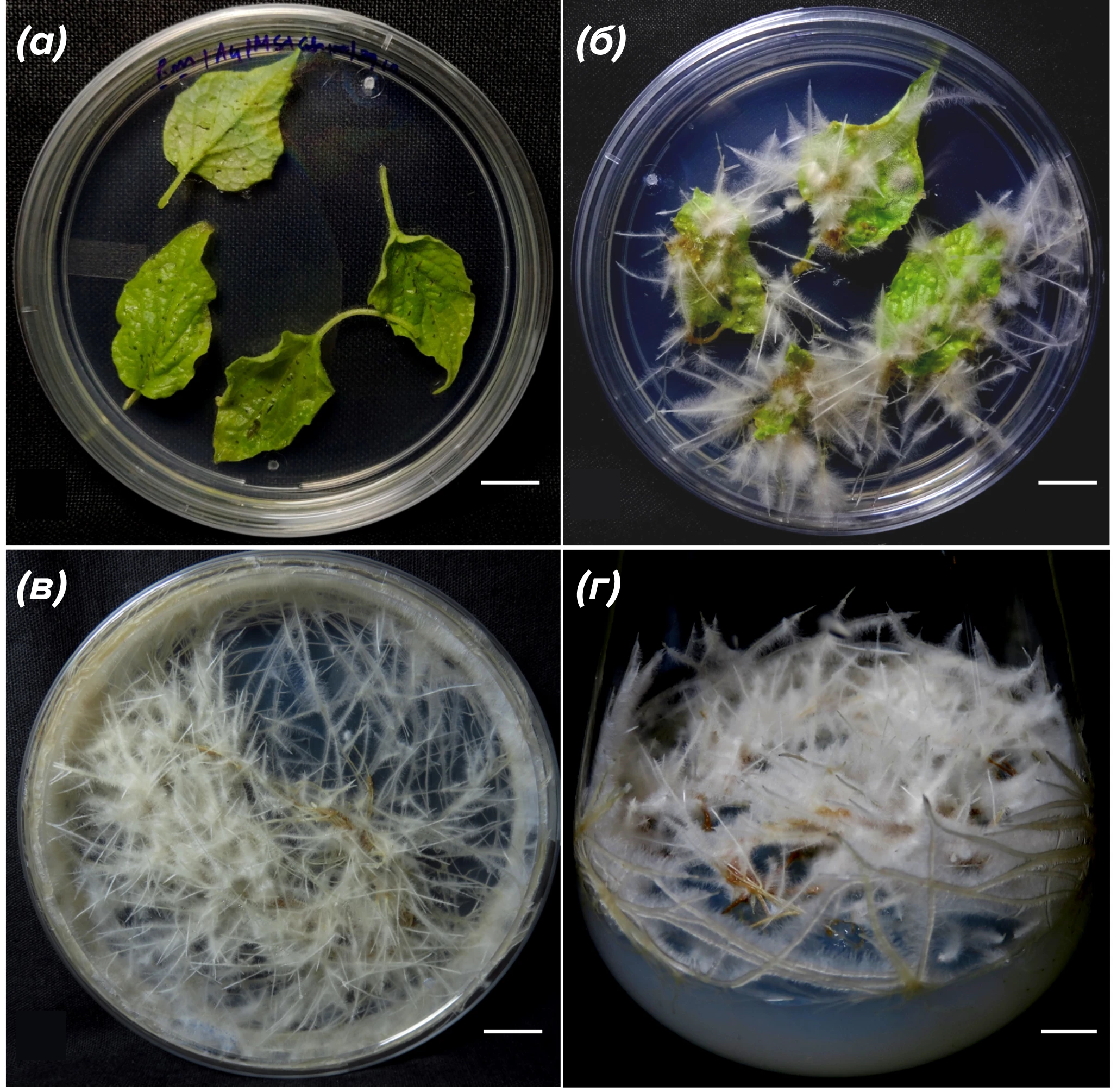
Рисунок 8. Индукция и последовательные стадии пролиферации культур бородатых корней физалиса наименьшего (Physalis minima).
(а) — экспланты после заражения Agrobacterium rhizogenes;
(б) — бородатые корни, появившиеся из листьев;
(в) — стерильные культуры бородатых корней в чашке Петри;
(г) — стерильные культуры бородатых корней в конической колбе.
Размер штриха = 1 см
Чтобы заразить эксплант, ученые вносят в контролируемые условия раствор с плазмидами почвенных бактерий. В данном случае плазмида представляет собой вектор (носитель) нужной исследователям генетической информации. При повреждении растительные клетки начинают продуцировать фенольные соединения (например, ацетосирингон), который выступает в качестве мишени для A. rhizogenes [16], [17]. Начинается процесс хемотаксиса, т.е. направленного движения бактерий к месту ранения. Затем бактерии проникают в клетки растения и переносят Т-ДНК, последовательность которой заключена в Ri-плазмиду (от англ. root-inducing plasmid — индуцирующая корнеобразование плазмида). Перенос Т-ДНК осуществляется с помощью генов вирулентности и генов хромосомной ДНК бактерии (рис. 9). После внедрения бактериальных плазмид в контролируемую среду, Т-ДНК интегрируется в геном растения-хозяина с помощью rol-генов типов А, В и С. Часть Т-ДНК содержит гены, кодирующие синтез опинов — модифицированных аминокислот-заменителей фитогормонов, которые необходимы для питания бактерий. При встраивании Т-ДНК происходит экспрессия различных генов, в результате вырабатываются ауксин и цитокинины, стимулирующие образование «бородатых» выростов из поврежденных участков экспланта. Индукция корней из поврежденных мест происходит в течение 7–30 дней [17]. В результате получаются трансформированные или трансгенные корни, продуцирующие повышенное количество ценных соединений.
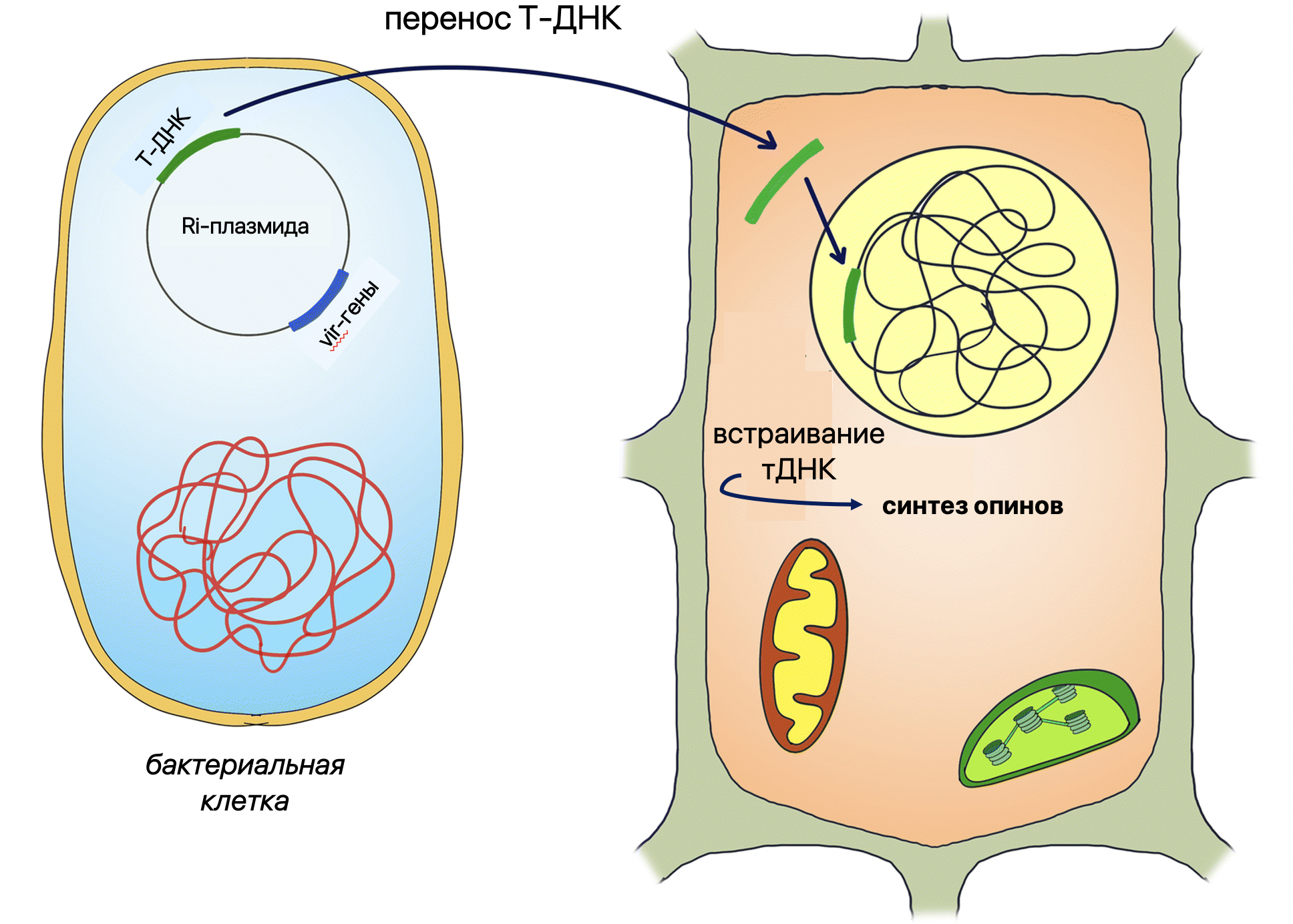
Рисунок 9. Схема клеточного механизма трансформации клетки растения-хозяина с помощью Agrobacterium rhizogenes.
За последние десятилетия интерес к получению культур «бородатых» корней заметно увеличился. Например, в культуре клевера лугового (Trifolium pratense) количество накапливаемых изофлавонов (дайдзеина, генистеина, формононетина и биоханина) практически в четыре раза больше по сравнению с интактным растением [18]. С помощью «бородатых» корней созданы эффективные системы выращивания клеток, продуцирующих паклитаксел (из лещины обыкновенной), фарнезиферол В (из ферулы вонючей), розмариновую кислоту (из шалфея зеленого), вербаскозид (из наперстянки китайской) и другие [19–22].
Культуры «бородатых» корней имеют неоценимый потенциал для биосинтеза вторичных метаболитов. Однако выращивание таких систем в биореакторе является сложным. Логика очевидна: «бородатые» корни слишком нежные и чувствительные, для их роста и развития необходимы специализированные конструкции, обеспечивающие соответствующий уровень аэрации и питательных веществ. Сложность заключается и в том, что предсказать кинетику роста таких корней практически невозможно. Поэтому такие биосинтетические платформы пока что не нашли коммерческого применения в фармацевтической отрасли. Тем не менее, прогресс не стоит на месте: изобретатели разрабатывают идеальную конструкцию биореактора для культур «бородатых» корней. И возможно, что в ближайшем будущем «бородатые» корни займут уверенные позиции среди биоплатформ вторичных метаболитов.
Промышленное культивирование и получение онкопрепаратов
Фитобиотехнологии уже давно перестали быть сказкой и активно используются в современной фармацевтической отрасли. Известным примером биосинтетического лекарственного средства, полученного на основе биомассы суспензионной культуры, является «Таксол». Этот лекарственный препарат предназначен для лечения опасных форм рака и давно зарекомендовал себя благодаря специфической способности подавлять пролиферацию опухолевых клеток путем стабилизации их микротрубочек. Механизм противоопухолевой активности связан с запуском многочисленных сигнальных путей, которые приводят к запрограммированной гибели клеток [23].
В состав препарата входит дитерпеноид паклитаксел («Таксол»), выделенный из клеточной массы тиса китайского (Taxus chinensis v. marei) и тиса ягодного (Taxus baccata) компанией Phyton Biotech (Германия). Открытие молекулы произошло в 1971 году, а уже к 1992 году, после успешно завершенных клинических испытаний, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) узаконило применение «Таксола» в терапии рака яичников.
Вы спросите: «При чем здесь культура клеток, если можно выделить паклитаксел из коры тисового дерева?». Действительно, в ХХ веке так и делали. Ученые обнаружили противоопухолевую активность паклитаксела и решили выделять его из коры тисов. Потребность населения в активном соединении оказалась настолько велика, что производство столкнулось с проблемой массовых заготовок растительного материала — его не хватало. Дело в том, что содержание паклитаксела в коре тиса относительно низкое. Поэтому для получения одного килограмма этого вещества требуется примерно 8–10 тысяч килограмм древесной коры, то есть до трех тысяч деревьев. Известно, что полный курс противоопухолевой терапии для одного пациента предполагает использование 2–3 г чистого вещества. Нетрудно посчитать, что индивидуальный курс такой терапии обойдется как минимум 30 кг коры, или 5–6 деревьями. А ведь по всему миру пациентов с онкологическими заболеваниями очень много. Основная загвоздка заключалась в том, что тисы — деревья-долгожители, которые способны жить приблизительно до четырех тысяч лет (рис. 10)! И осталось тисов не так много, поэтому использовать кору деревьев в массовых сырьевых заготовках представлялось чудовищным [23].

Рисунок 10. Тисовое дерево (Taxus baccata).
Тогда были предприняты попытки химического синтеза «Таксола» в условиях промышленного производства. Но и здесь возникли трудности: молекула паклитаксела по своей структуре объемная (рис. 11). Получить такое соединение с высоким выходом крайне сложно, требовалось по меньшей мере 20 стадий. Из-за экономической нецелесообразности впоследствии от химического синтеза отказались [23].
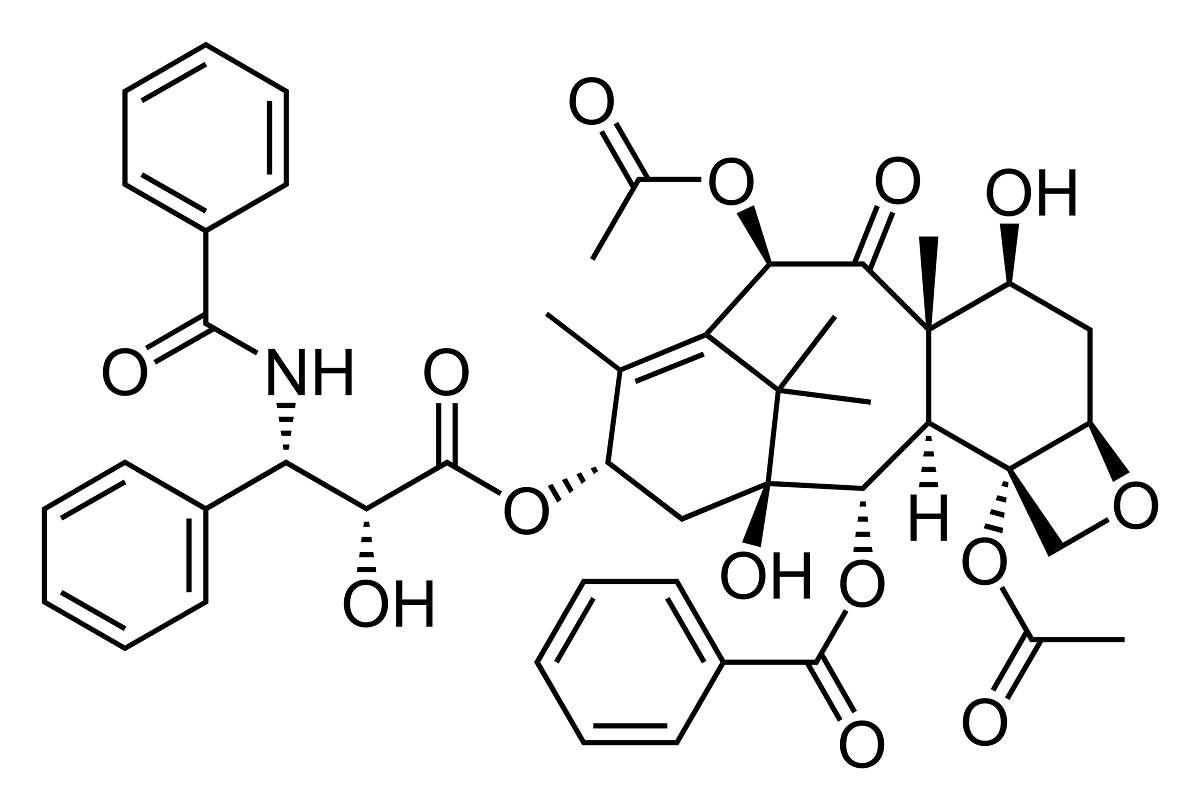
Рисунок 11. Молекула паклитаксела.
И тогда на помощь пришла фитобиотехнология: в 1991 году компания Phyton Biotech запатентовала клеточную линию суспензионной культуры (видео 1, рис. 12) для получения «Таксола» (заявленный выход активного вещества — 1–3 мг/л).
Видео 1. Механизм ферментации растительного сырья.
Впоследствии компания стала мировым поставщиком активной субстанции паклитаксела, в частности, для американской фирмы Bristol Myers Squibb, которая производит инъекционный лекарственный препарат TAXOL® [23].
Помимо «Таксола», Phyton Biotech запустила производство похожего химиотерапевтического агента из культуры клеток тиса — доцетаксела, который также поставляется ряду компаний как активная биофармацевтическая субстанция для создания противоопухолевых средств. Стоит отметить, что Phyton Biotech — не единственная компания, которая занимается наработкой биомассы тиса. В настоящее время корейская фирма Samyang Biopharm выпускает паклитаксел, полученный из культуры клеток, под торговым названием Genexol® [24]. Особенностью лекарственного препарата является специальная система доставки активного вещества — мицеллы, мельчайшие сферические частицы, в которых инкапсулирован «Таксол».
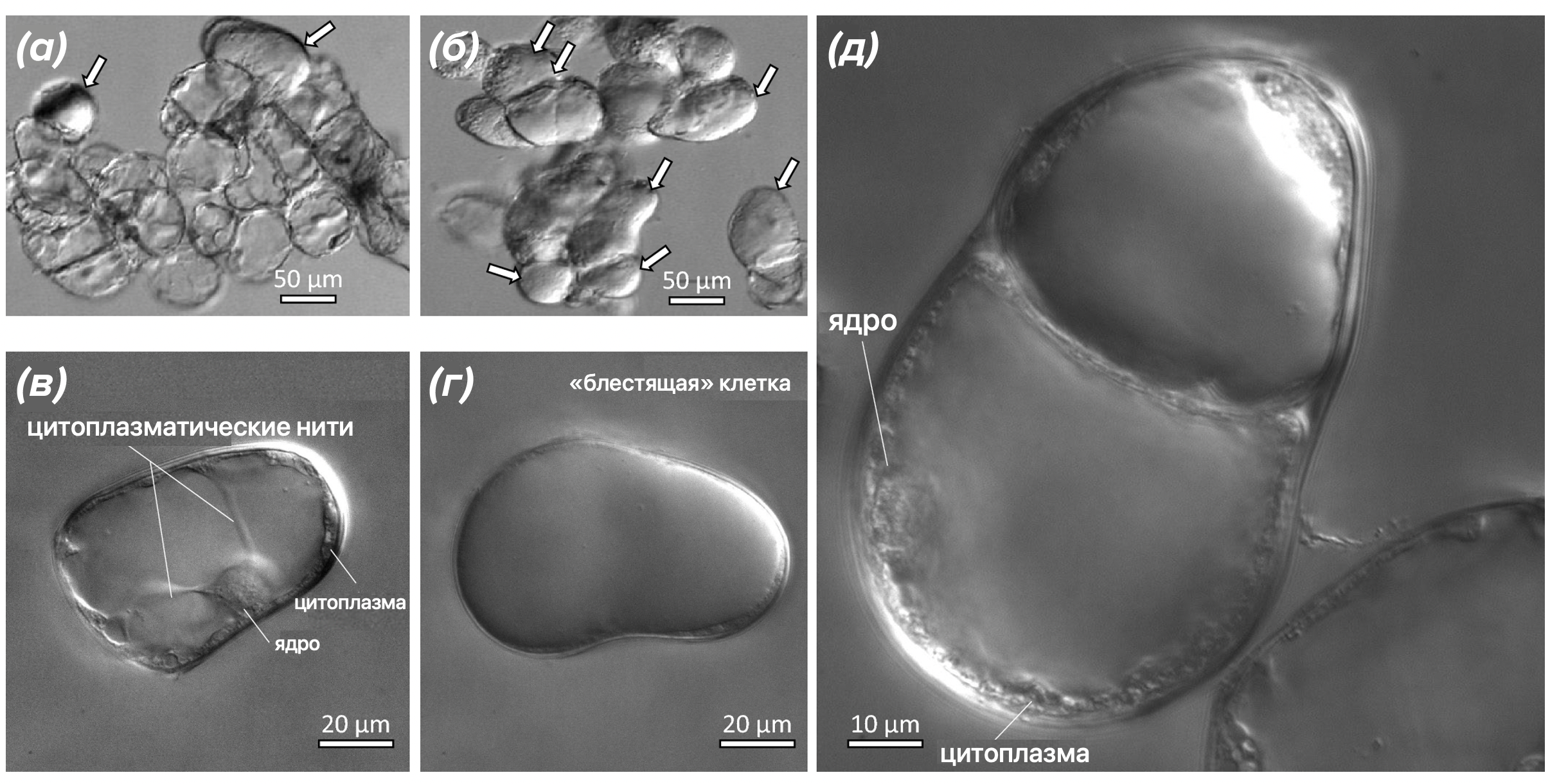
Рисунок 12. Морфологические особенности клеток в суспензионной культуре T. brevifolia.
(а) — клеточные скопления на начальной стадии;
(б) — стадии формирования клеток с «блестящей» поверхностью; такие клетки обозначены белыми стрелками;
(в) — клеточные органеллы паренхимной клетки-предшественницы;
(г) — полностью дифференцированная клетка с «блестящей» поверхностью;
(д) — асимметричная дифференцировка в клеточном материале: базальная клетка частично сохраняет черты паренхимной клетки-предшественницы.
Культуры клеток и биологически активные добавки
Ориентация населения на здоровый образ жизни и продукты натурального происхождения сподвигла исследователей на разработку нутрицевтиков (БАДов и продуктов функционального питания) на основе клеточных технологий. Ведь заболевания можно не только лечить, но и предупреждать путем профилактического употребления в пищу вторичных метаболитов. На современном рынке пищевых добавок можно найти немалое количество средств, основой для которых стала биомасса растительных клеток. Например, компания Diana Plant Sciences (США) выпускает полифенольные экстракты, полученные из суспензионных культур какао и ягодных кустарников рода Vaccinium (черники, голубики и пр.). Японская фирма Nitto Denko разработала технологию для получения экстракта гингенозидов женьшеня, которые обладают ярко выраженным антиоксидантным и противовоспалительным действием. Другой японской компанией, Mitsui Chemicals Group, разработаны технологии получения биомассы горного винограда (Vitis coignetiae), ареал произрастания которого весьма органичен в естественной среде обитания. Клетки этой культуры активно продуцируют ресвератрол — полифенольный компонент с антиоксидантными свойствами.
Отечественные производители также не стоят в стороне. Российскими учеными (BioPharmos Group, Россия) разработана технология экстракта биомассы женьшеня папортниколистного и диоскореи дельтовидной, которые являются основными компонентами биологически активных добавок «Витагмал», «Трифитол» и других. Экстракты содержат тритерпеновые сапонины (например, бета-ситостерол и его производные, олеаноловую и урсоловую кислоты), а также полифенольные соединения, которые в совокупности провоцируют адаптогенные и тонизирующие свойства пищевых добавок.
Растительные рекомбинантные белки
Суспензионные культуры растительных клеток могут выступать в роли биоплатформы по синтезу рекомбинантных белков и тем самым составлять конкуренцию клеткам млекопитающих! Единственное условие — растение должно быть модельным. Оно отличается от обычного хорошей изученностью, легкостью выращивания и быстрым размножением, а также способностью к генетической трансформации. К модельным растениям, среди прочих, относятся: табак обыкновенный (Nicotiana tabacum), а именно — его клеточная линия BY-2 (Bright Yellow-2), рис посевной (Oryza sativa) и морковь обыкновенная (Daucus carota).
Самым известным коммерческим продуктом является лекарственный препарат «Элисо», выпускаемый компанией Pfizer, Inc. (США) по технологии Protalix BioTherapeutics, Inc. (Израиль). Для получения биомассы используются генетически модифицированные клетки моркови, которые выращиваются в суспензионной форме в одноразовых биореакторах (пластиковых мешках, закрепленных на стальных опорах). В данном случае использование одноразовых технологий — это решение целого комплекса задач высокотехнологичного производства. С одной стороны, одноразовые биореакторы компактны и достаточно просто утилизируются, с другой — сокращаются расходы на их обслуживание и уменьшается количество отходов производства. То есть, такое технологическое решение экологично и эффективно для процесса наработки биомассы растительных клеток.
При подобранных условиях культивирования клетки моркови продуцируют рекомбинантную активную форму лизосомального фермента человека — β-D-глюкозил-N-ацилсфингозин глюкогидролазу (Талиглюцеразу альфа). Этот лекарственный препарат был одобрен еще в 2012 году и до сих пор применяется как одно из эффективных средств для лечения болезни Гоше [26].
В настоящее время Protalix BioTherapeutics проводит серии доклинических испытаний препарата с альфа-1-антитрипсином — рекомбинантным белком, выделенным из культуры клеток табака [8]. На третьей стадии клинических исследований находится продуцируемый культурой табака фермент альфа-галактозидаза А, недостаток которого в организме человека провоцирует развитие болезни Фабри [27].
В поисках альтернативы клеткам млекопитающих немецкая компания Greenovation Biotech GmbH предложила использовать суспензионную культуру земляного мха (Physcomitrella patens). Препарат под названием MOSS-GAA содержит активное вещество в виде фермента альфа-глюкозидазы. Нехватка этого лизосомального фермента препятствует распаду гликогена до глюкозы, иначе говоря, гликогена становится слишком много (развивается болезнь Помпе) [8]. Благодаря суспензионному культивированию мха открываются перспективы ускоренного получения продуктивной растительной биомассы в условиях in vitro и наработке фермента по сравнению с использованием клеток китайского хомячка. Сейчас препарат находится на доклинических испытаниях.
Заключение
Растительные клеточные биофабрики представляются инновационным биотехнологическим подходом, который может стать одним из перспективных способов получения лекарств в ближайшем будущем. Прогресс исследований в этой области с каждым годом увеличивается: в культуру вводятся новые виды, оптимизируются составы питательных сред, используются генетические технологии.
Несмотря на внушительный успех, растительные культуры сегодня занимают немногочисленные позиции на фармацевтическом рынке. Все потому, что клетки растений вышли на этот рынок позднее, нежели клетки бактерий и животных. А масштабирование и оптимизация технологии новых объектов — всегда сложный и долгий процесс, требующий дополнительных исследований. Преодоление трудностей культивирования растительных клеток — одна из основополагающих задач современной фитобиотехнологии; достижение успеха будет напрямую зависеть от совместных усилий широкого круга специалистов. Хочется верить, что в обозримом будущем растительные биофабрики станут не просто альтернативой, а реальной платформой синтеза биологических молекул.
Литература
- Philip Coatsworth, Laura Gonzalez-Macia, Alexander Silva Pinto Collins, Tolga Bozkurt, Firat Güder. (2022). Continuous monitoring of chemical signals in plants under stress. Nat Rev Chem. 7, 7-25;
- Yuechen Bai, Caiqiong Yang, Rayko Halitschke, Christian Paetz, Danny Kessler, et. al.. (2022). Natural history–guided omics reveals plant defensive chemistry against leafhopper pests. Science. 375;
- Silke Allmann, Ian T. Baldwin. (2010). Insects Betray Themselves in Nature to Predators by Rapid Isomerization of Green Leaf Volatiles. Science. 329, 1075-1078;
- Hema Chandran, Mukesh Meena, Tansukh Barupal, Kanika Sharma. (2020). Plant tissue culture as a perpetual source for production of industrially important bioactive compounds. Biotechnology Reports. 26, e00450;
- Diptesh Biswas, Avijit Chakraborty, Swapna Mukherjee, Biswajit Ghosh. (2023). Hairy root culture: a potent method for improved secondary metabolite production of Solanaceous plants. Front. Plant Sci.. 14;
- Ying Hua Su, Li Ping Tang, Xiang Yu Zhao, Xian Sheng Zhang. (2021). Plant cell totipotency: Insights into cellular reprogramming. JIPB. 63, 228-243;
- Attila Fehér. (2019). Callus, Dedifferentiation, Totipotency, Somatic Embryogenesis: What These Terms Mean in the Era of Molecular Plant Biology?. Front. Plant Sci.. 10;
- Sagar S. Arya, James E. Rookes, David M. Cahill, Sangram K. Lenka. (2020). Next-generation metabolic engineering approaches towards development of plant cell suspension cultures as specialized metabolite producing biofactories. Biotechnology Advances. 45, 107635;
- Michael E. Pyne, Lauren Narcross, Vincent J.J. Martin. (2019). Engineering Plant Secondary Metabolism in Microbial Systems. Plant Physiol.. 179, 844-861;
- Tong Wu, Sandra M. Kerbler, Alisdair R. Fernie, Youjun Zhang. (2021). Plant cell cultures as heterologous bio-factories for secondary metabolite production. Plant Communications. 2, 100235;
- Christoph Wawrosch, Sergey B. Zotchev. (2021). Production of bioactive plant secondary metabolites through in vitro technologies—status and outlook. Appl Microbiol Biotechnol. 105, 6649-6668;
- Izabela Grzegorczyk-Karolak, Katarzyna Hnatuszko-Konka, Marta Krzemińska, Monika A. Olszewska, Aleksandra Owczarek. (2021). Cytokinin-Based Tissue Cultures for Stable Medicinal Plant Production: Regeneration and Phytochemical Profiling of Salvia bulleyana Shoots. Biomolecules. 11, 1513;
- Hyo Bin Koo, Hwan-Su Hwang, Jung Yeon Han, Eun Ju Cheong, Yong-Soo Kwon, Yong Eui Choi. (2022). Enhanced production of pinosylvin stilbene with aging of Pinus strobus callus and nematicidal activity of callus extracts against pinewood nematodes. Sci Rep. 12;
- Thomas Efferth. (2019). Biotechnology Applications of Plant Callus Cultures. Engineering. 5, 50-59;
- Tarun Halder, Biswajit Ghosh. (2023). Hairy root cultures of Physalis minima L. — an alternative source of withaferin A production. Plant Cell Tiss Organ Cult. 152, 31-44;
- Shahla Amani, Mehdi Mohebodini, Shahram Khademvatan, Morad Jafari. (2020). Agrobacterium rhizogenes mediated transformation of
Ficus carica L. for the efficient production of secondary metabolites. J Sci Food Agric. 100, 2185-2197; - Saikat Gantait, Eashan Mukherjee. (2021). Hairy root culture technology: applications, constraints and prospect. Appl Microbiol Biotechnol. 105, 35-53;
- M. Anil Kumar, S. S. Sravanthi Pammi, M. S. Sukanya, Archana Giri. (2018). Enhanced production of pharmaceutically important isoflavones from hairy root rhizoclones of Trifolium pratense L.. In Vitro Cell.Dev.Biol.-Plant. 54, 94-103;
- Ewelina Piątczak, Agnieszka Jeleń, Joanna Makowczyńska, Sylwia Zielińska, Łukasz Kuźma, Ewa Balcerczak. (2019). Establishment of hairy root cultures of Rehmannia elata N.E. Brown ex Prain and production of iridoid and phenylethanoid glycosides. Industrial Crops and Products. 137, 308-314;
- Kobra Jalalipour Parizi, Sara Alsadat Rahpeyma, Shahram Pourseyedi. (2020). The novel paclitaxel-producing system: establishment of Corylus avellana L. hairy root culture. In Vitro Cell.Dev.Biol.-Plant. 56, 290-297;
- Abedin Khazaei, Bahman Bahramnejad, Ali-Akbar Mozafari, Dara Dastan, Sima Mohammadi. (2019). Hairy root induction and Farnesiferol B production of endemic medicinal plant Ferula pseudalliacea. 3 Biotech. 9;
- Izabela Grzegorczyk-Karolak, Łukasz Kuźma, Ewa Skała, Anna K. Kiss. (2018). Hairy root cultures of Salvia viridis L. for production of polyphenolic compounds. Industrial Crops and Products. 117, 235-244;
- S. V. Tomilova, E. B. Globa, E. V. Demidova, A. M. Nosov. (2023). Secondary Metabolism in Taxus spp. Plant Cell Culture In Vitro. Russ J Plant Physiol. 70;
- Kim J.Y., Do Y.R., Song H.S. (2017). Multicenter Phase II Clinical Trial of Genexol-PM® with Gemcitabine in Advanced Biliary Tract Cancer. AR. 37, 1467-1474;
- Christina Manz, Manish L. Raorane, Jan Maisch, Peter Nick. (2022). Switching cell fate by the actin–auxin oscillator in Taxus: cellular aspects of plant cell fermentation. Plant Cell Rep. 41, 2363-2378;
- Shohei Nosaki, Ken Hoshikawa, Hiroshi Ezura, Kenji Miura. (2021). Transient protein expression systems in plants and their applications. Plant Biotechnology. 38, 297-304;
- Tali Kizhner, Yaniv Azulay, Mariana Hainrichson, Yoram Tekoah, Gil Arvatz, et. al.. (2015). Characterization of a chemically modified plant cell culture expressed human α-Galactosidase-A enzyme for treatment of Fabry disease. Molecular Genetics and Metabolism. 114, 259-267.