Ремоделирование костной ткани — ломать и строить
27 марта 2025
Ремоделирование костной ткани — ломать и строить
- 1224
- 0
- 5
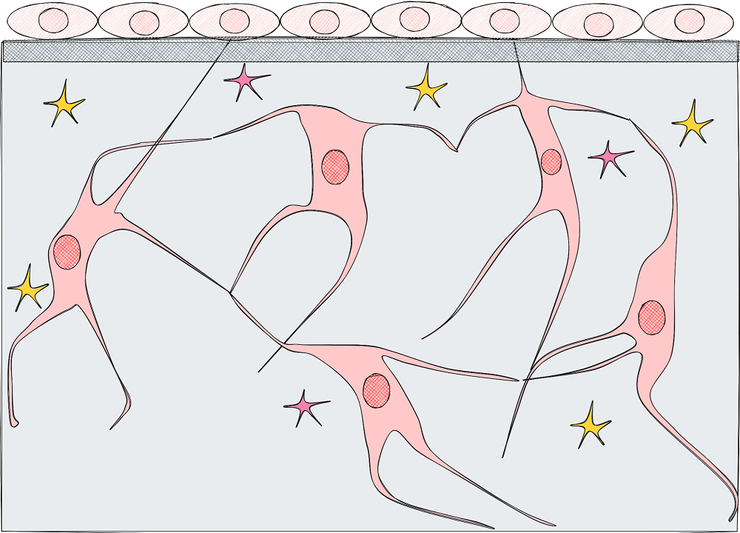
Остеоциты и выстилающие клетки покоятся в костной ткани.
Рисунок в полном размере.
иллюстрация автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: На первый взгляд кости кажутся статичным минеральным каркасом, который лишь обеспечивает нам поддержку, но, как и все органы, кости непрерывно обновляются и изменяются под действием внешних факторов. В основе этих изменений лежит ремоделирование костной ткани — сложный и длительный гомеостатический процесс. Это непрерывный цикл саморазрушения и самовосстановления, который обеспечивается слаженной работой костных клеток.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Кость как орган
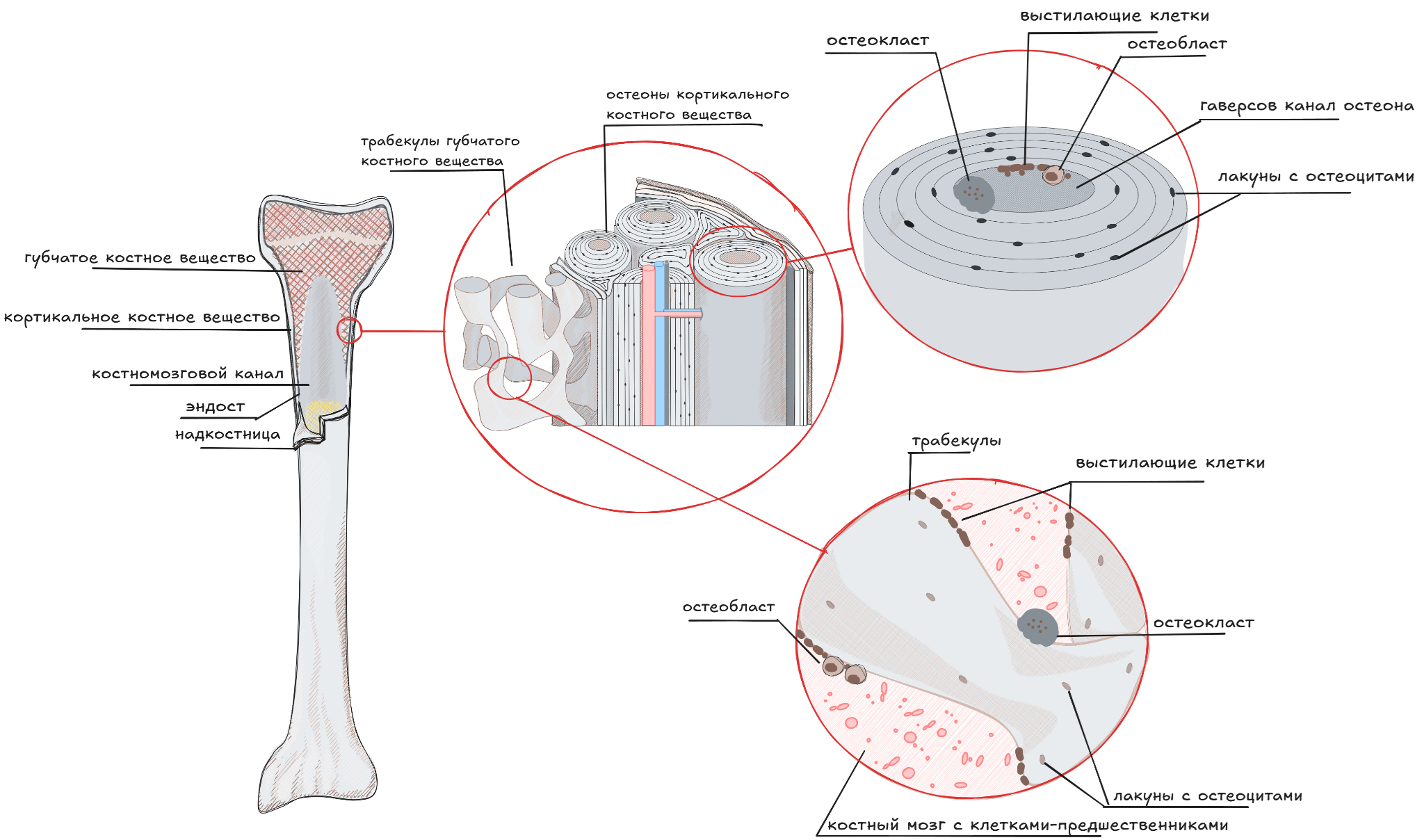
рисунок автора
Как и все органы нашего организма, кости претерпевают изменения в течение жизни: они растут, адаптируются под изменения внешних условий, самообновляются и участвуют в поддержании гомеостаза организма, например, участвуя в регуляции кальций-фосфорного баланса и служа депо для различных минералов.
В теле взрослого человека обычно около 206 костей, они отличаются друг от друга по форме и строению, но все они состоят из костной ткани, которая представлена кортикальным (компактным) и губчатым (трабекулярным) веществами. Снаружи кости покрыты надкостницей, а их внутренняя полость, в которой располагается костный мозг, выстлана эндостомом. Также в костях располагаются кровеносные сосуды и нервы.
Костная ткань преимущественно представлена минеральным матриксом (на 80–90% в кортикальном и на 15–20% — в губчатом веществе). Однако, как и во всех тканях организма, в ней есть клетки, которые ее формируют и обеспечивают нормальную жизнедеятельность.
Какие клетки живут в наших костях
В костной ткани представлены две линии клеток: клетки остеобластического ряда (остеобласты, остеоциты и выстилающие клетки) и остеокласты, но знать следует и о их предшественниках. О каждом из них можно говорить отдельно долго и подробно, но сейчас мы обозначим их только в контексте разбираемого процесса.
МСК
рисунок автора
Мезенхимальные стромальные клетки (МСК) — это мультипотентные клетки, которые способны дифференцироваться в различные типы клеток (адипоциты, миоциты, хондроциты и т.д.). Они являются предшественниками клеток остеобластического ряда.
Остеобласт
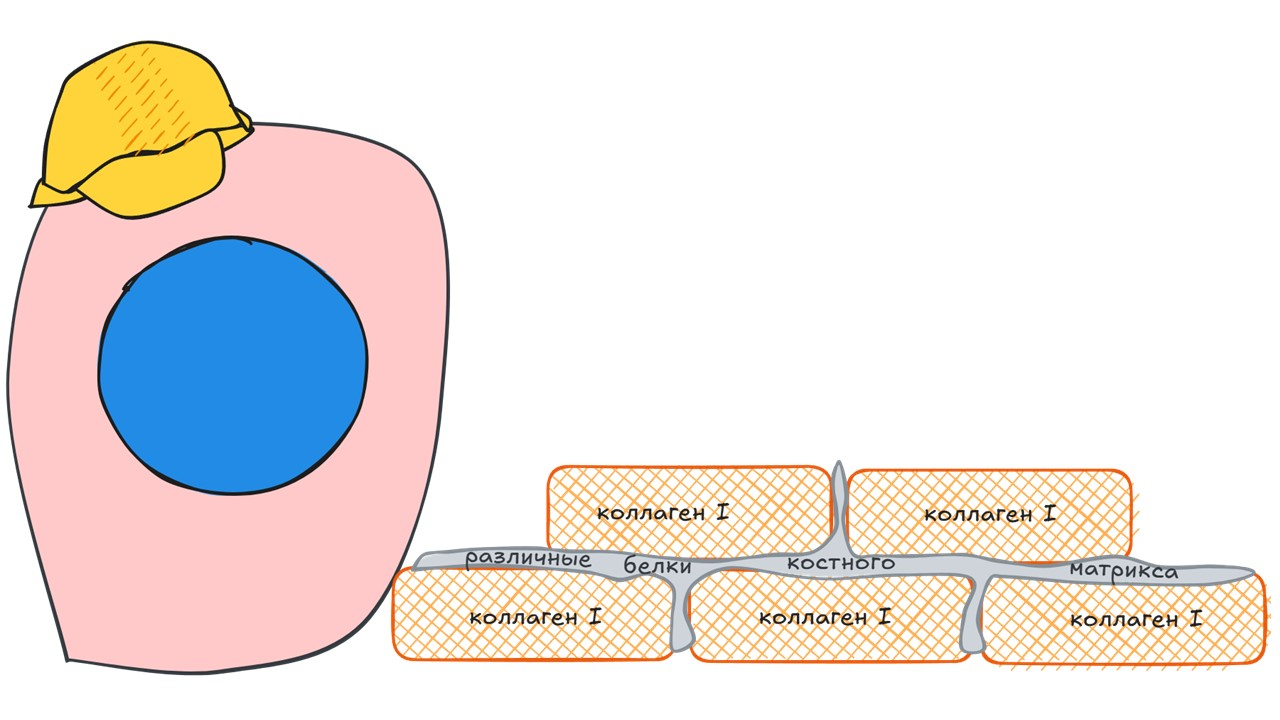
рисунок автора
Остеобласт — одноядерная клетка, обеспечивающая костеобразование. Они располагаются на поверхности кости. Остеобласты отвечают за формирование костного матрикса посредством синтеза коллагена I типа и других белков, а также за дальнейшую минерализацию костного матрикса. Это не конечная форма дифференциации, остеобласт в перспективе может стать выстилающей (покровной) клеткой или остеоцитом.
Остеоцит
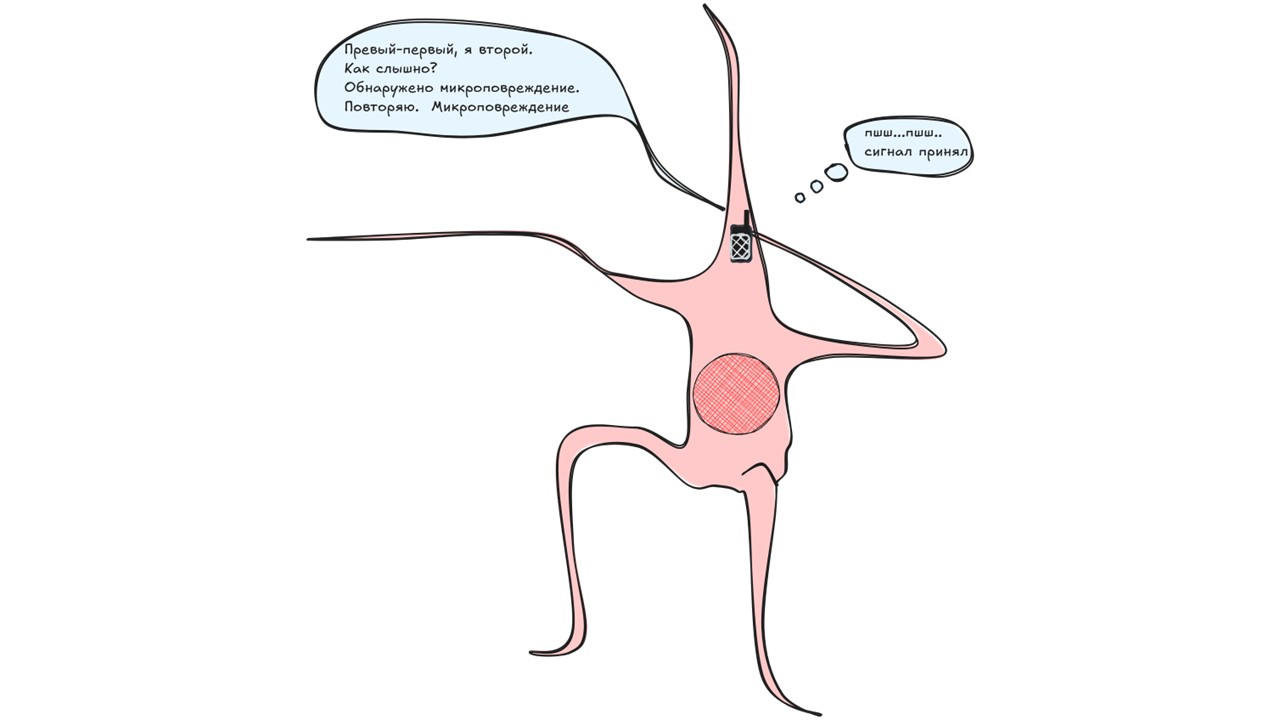
рисунок автора
Остеоцит — это остеобласт, который в свое время погрузился в костную ткань и обзавелся множеством отростков. Остеоциты располагаются в специальных полостях в костной ткани — в лакунах, от которых отходят канальцы, соединяющие их с соседними лакунами. В канальцах пролегают отростки остеоцитов. Все вместе это остеоцитарная сеть. Отростки остеоцитов также связываются с выстилающими клетками. Такое сложное сплетение отростков обеспечивает передачу сигналов о любых изменениях, происходящих в кости. Передача сигналов может осуществляться как посредством механотрансдукции, так и при использовании простагландинов, факторов роста и других веществ. Именно остеоциты определяют необходимость начала и запускают процесс разрушения костной ткани, называемый резорбцией.
Выстилающие клетки
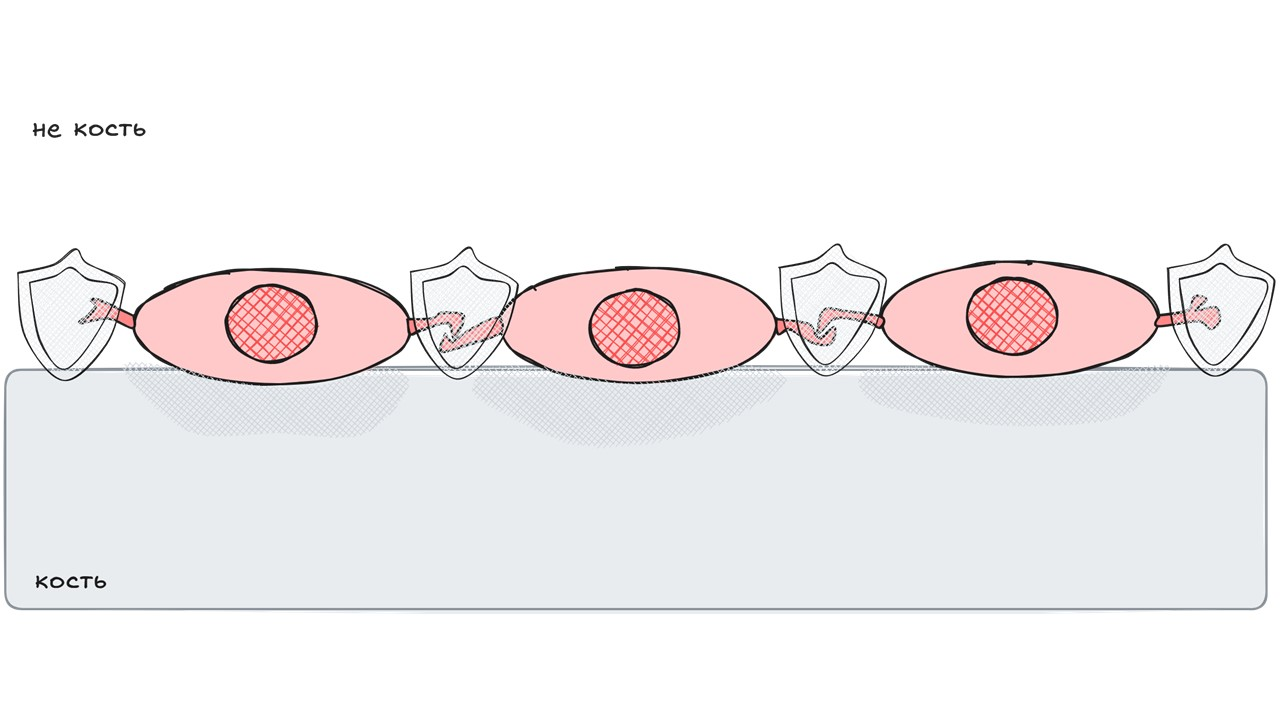
рисунок автора
Выстилающие (покровные) клетки — это плоские некогда остеобласты, соединенные друг с другом щелевыми контактами и покрывающие внутреннюю поверхность кости. Они образуют своего рода биологический барьер между костной тканью и костным мозгом. Как было сказано ранее, выстилающие клетки способны улавливать сигналы остеоцитов.
Макрофаг
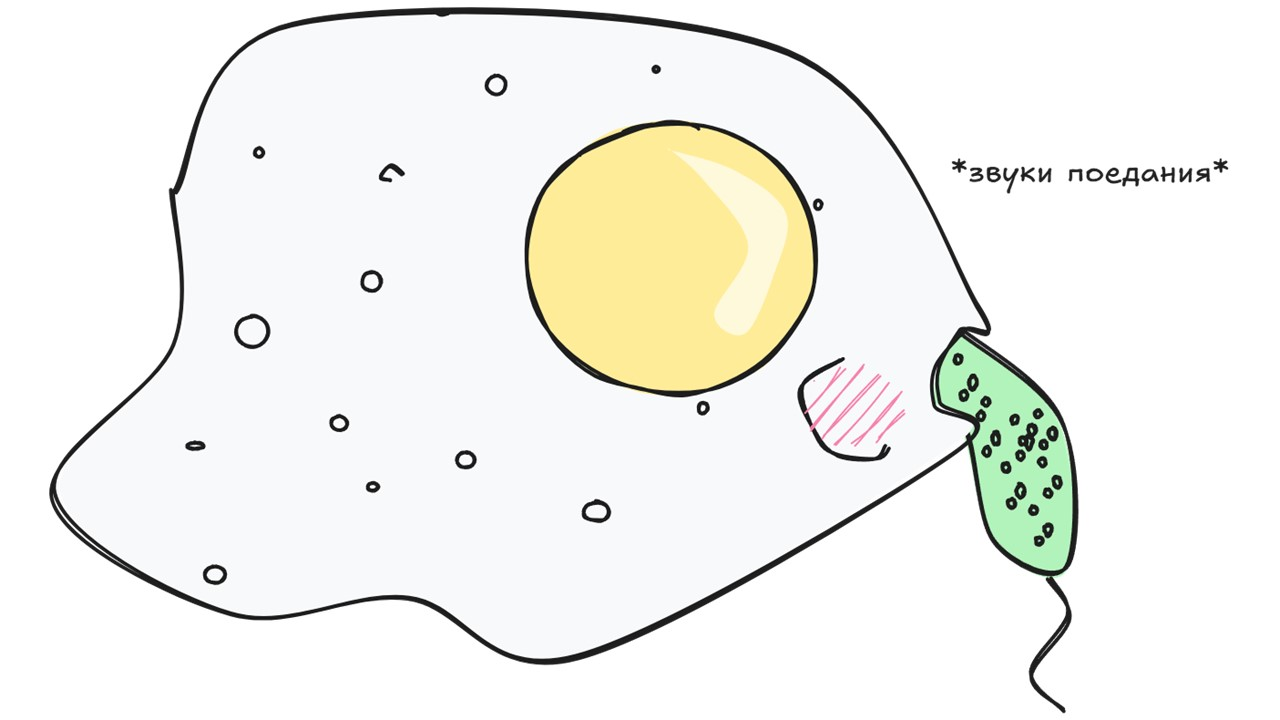
рисунок автора
Макрофаг относится к миелоцитарному ряду. Макрофаги происходят из моноцитов, которые, в свою очередь, дифференцируются из монобластов в костном мозге. Макрофаги в грубом переводе — «большие пожиратели», которые являются важной частью иммунной системы (о том, какие клетки ее составляют на «Биомолекуле» есть отличная статья [1]). Их задача — освобождать организм от инородных тел: бактерий, отходов метаболических процессов и всего, что ими воспринимается как «враг». Макрофаги распространены по всему организму, но продолжительность их жизни и судьба зависят от микроокружения, в которое они попали. В нашем случае им суждено стать остеокластами.
Остеокласт
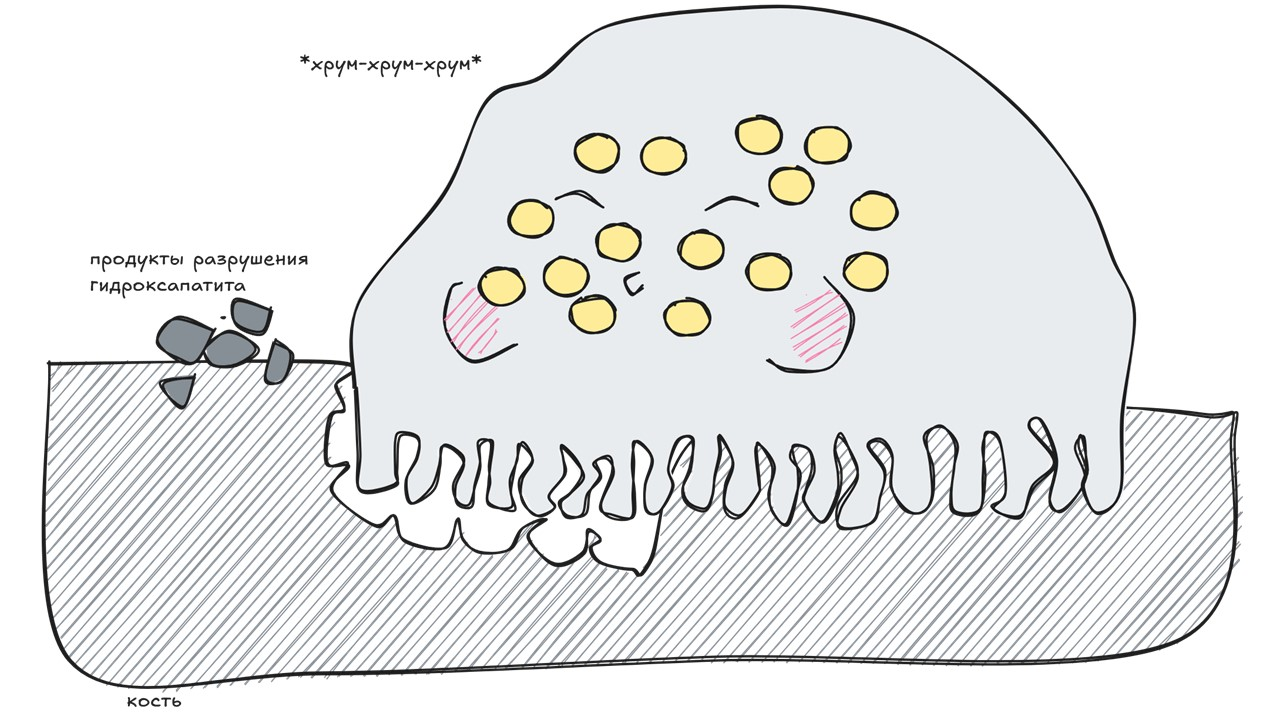
рисунок автора
Остеокласты — огромные многоядерные клетки. Их задача — разрушать костную ткань. Участок мембраны, которым остеокласт крепится к кости, представляет собой гофрированную каемку, через которую к резорбируемому участку поступают ферменты, разрушающие коллаген и минеральный матрикс кости.
Ремоделирование кости
Как уже было сказано выше, костная ткань постоянно изменяется, и ключевым процессом этих изменений является ремоделирование.
Ремоделирование костной ткани — это рутинный процесс, во время которого кость перестраивается, реагируя на какие-либо изменения, восстанавливается в ответ на микроразрушения и самообновляется. Также ремоделирование обеспечивает поддержание минерального гомеостаза организма, так как во время отдельных его стадий минералы высвобождаются из костного матрикса и разносятся по организму. В норме весь процесс занимает примерно 120 дней в кортикальном костном веществе и 200 дней — в губчатом. За год ремоделированию подвергается от 2 до 10% скелета взрослого человека.
Стадия покоя
Это просто существование костной ткани, когда все идет так, как должно идти, и все клетки костной ткани и прилегающих к ней пространств спокойно существуют и выполняют свои обычные функции.
В обычное время остеоциты синтезируют склеростин (SOST) и диккопф-родственный белок 1 (DKK1). DKK1 и SOST воздействуют на МСК, ингибируя Wnt/β- катенин-сигнальный путь, что, в свою очередь, препятствует их дифференциации.
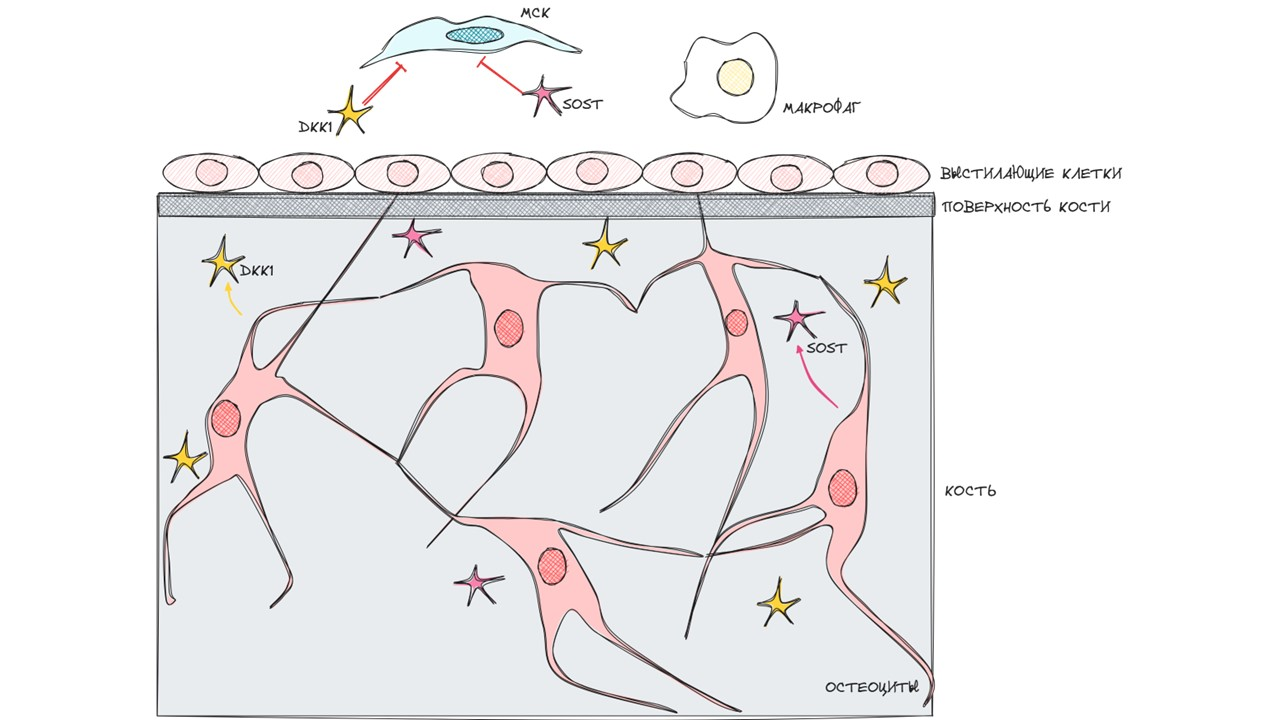
рисунок автора
Стадия активации
На данной стадии происходит подбор и активация одноядерных предшественников, но все начинается с «сигнала тревоги».
Остеоциты в любой момент времени могут уловить сигнал о необходимости начала ремоделирования. Они передают этот сигнал при помощи отростков своим соседям-остеоцитам и выстилающим клеткам, которые, как известно, умеют улавливать этот сигнал и правильно на него реагировать. Лучшей реакцией в данном случае является «отрыв» от поверхности кости и образование некоего навеса.
Клетки навеса соединены между собой и другими выстилающими клетками неактивной кости посредством щелевых контактов.
Всё это собрание выстилающих клеток, остеоцитов и одноядерных предшественников называется компартментом костного ремоделирования.
МСК еще какое-то время продолжает находиться под действием SOST и DKK1, но лишь пока на нее не подействуют факторы роста и интерлейкин 1 (IL1). Освобождение от SOST и DKK1 приводит к активации Wnt/β-катенин-сигнального пути и переходу МСК в преостеобласт.
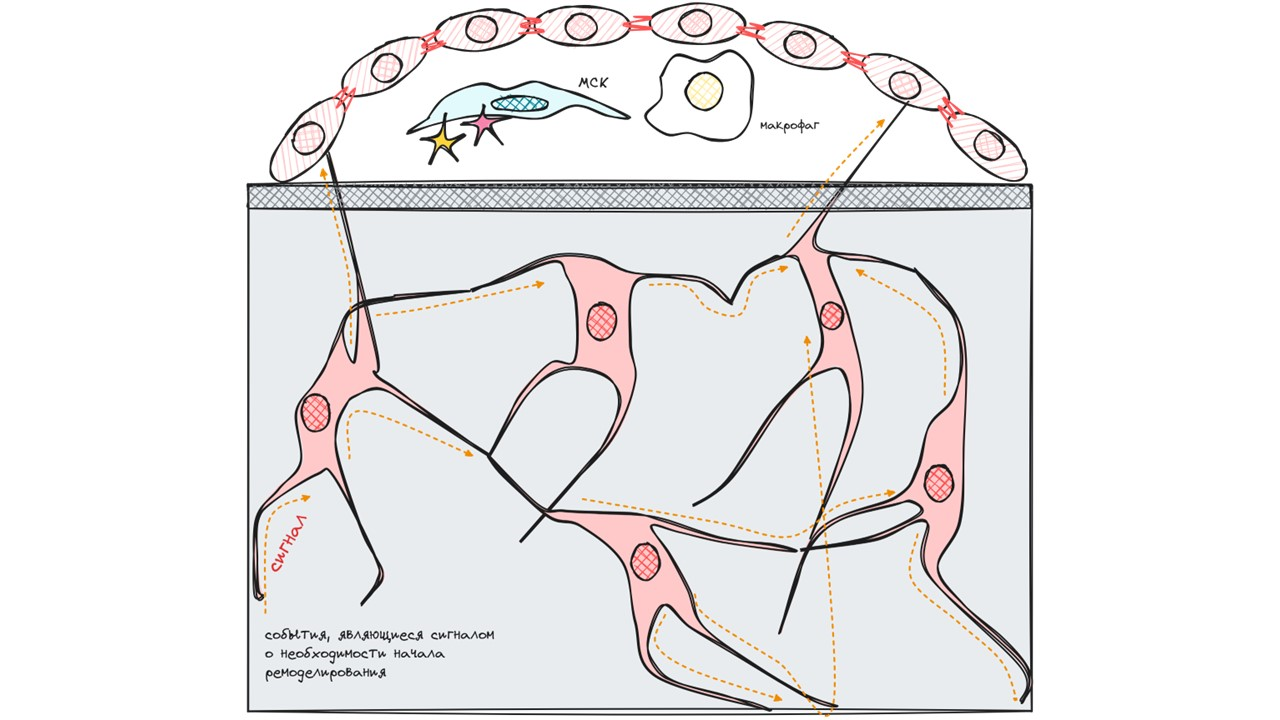
рисунок автора
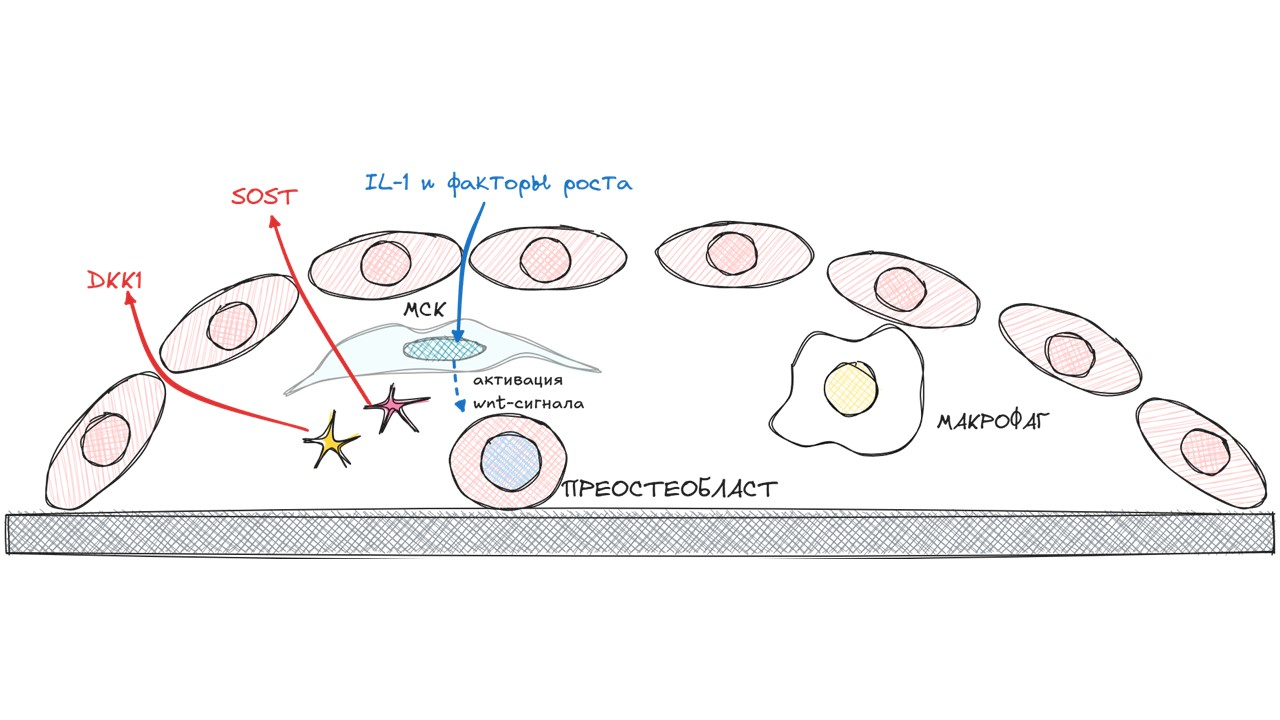
рисунок автора
Новоиспеченный преостеобласт является одним из источников макрофагального колониестимулирующего фактора (M-CSF) — основного цитокина, влияющего на дифференциацию макрофага в преостеокласт.
Макрофаг несет на себе для этих целей высокоаффинный трансмембранный рецептор — c-fms. Взаимодействие M-CSF и рецептора c-fms приводит к появлению в компартменте костного ремоделирования преостеокласта.
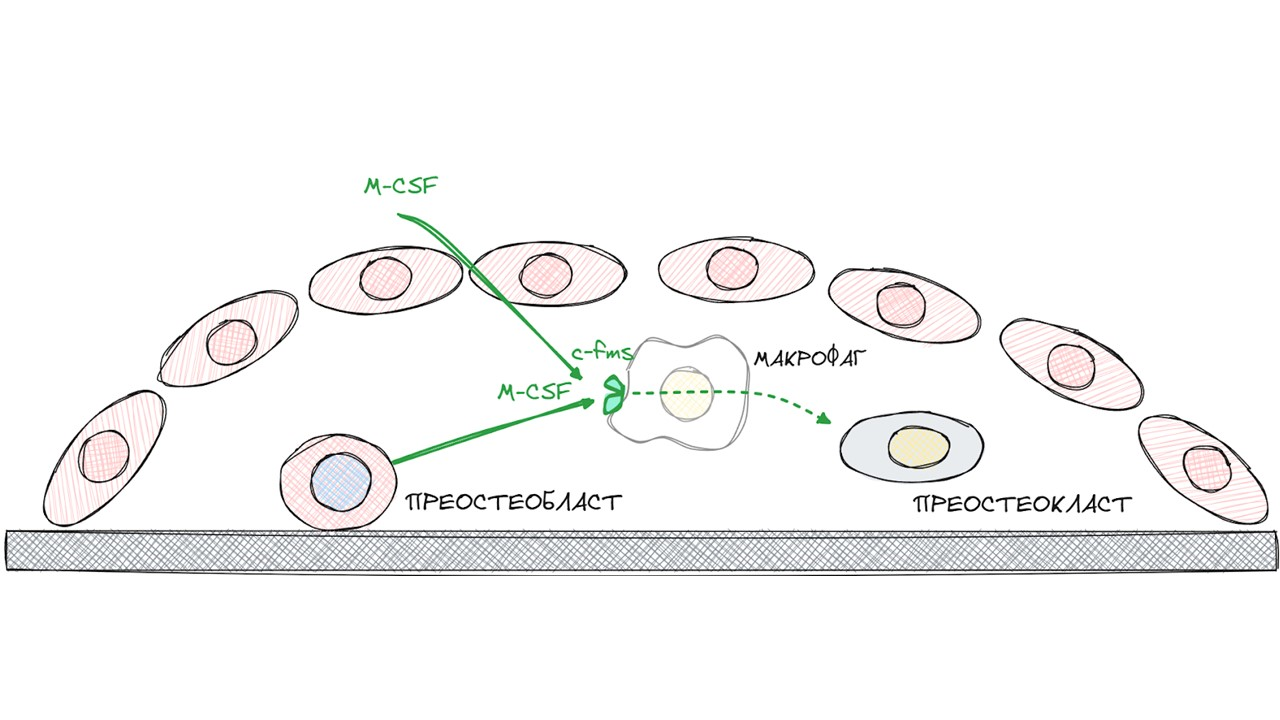
рисунок автора
Одним из продуктов преостеобластов является лиганд рецептора-активатора ядерного транскрипционного фактора kB (RANKL). RANKL может быть как мембраносвязанный (тот, который продуцирует преостеобласты) и растворимый — который синтезируется зрелыми остеобластами, Т-лимфоцитами и В-лимфоцитами.
Преостеокласт имеет рецептор-активатор ядерного транскрипционного фактора kB (RANK). RANKL + RANK = активация ряда транскрипционных факторов, в числе которых транскрипционный фактор kB, TRAF-6, NFATc1 и др. Эти события приводят к появлению многоядерного остеокласта.
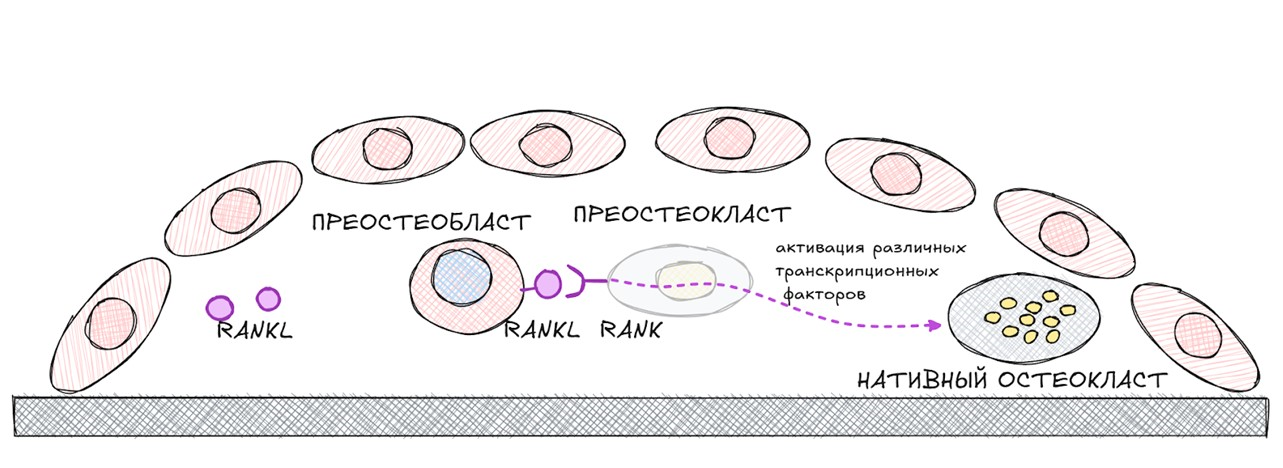
рисунок автора
Стадия резорбции
Эта стадия длится 30–40 дней.
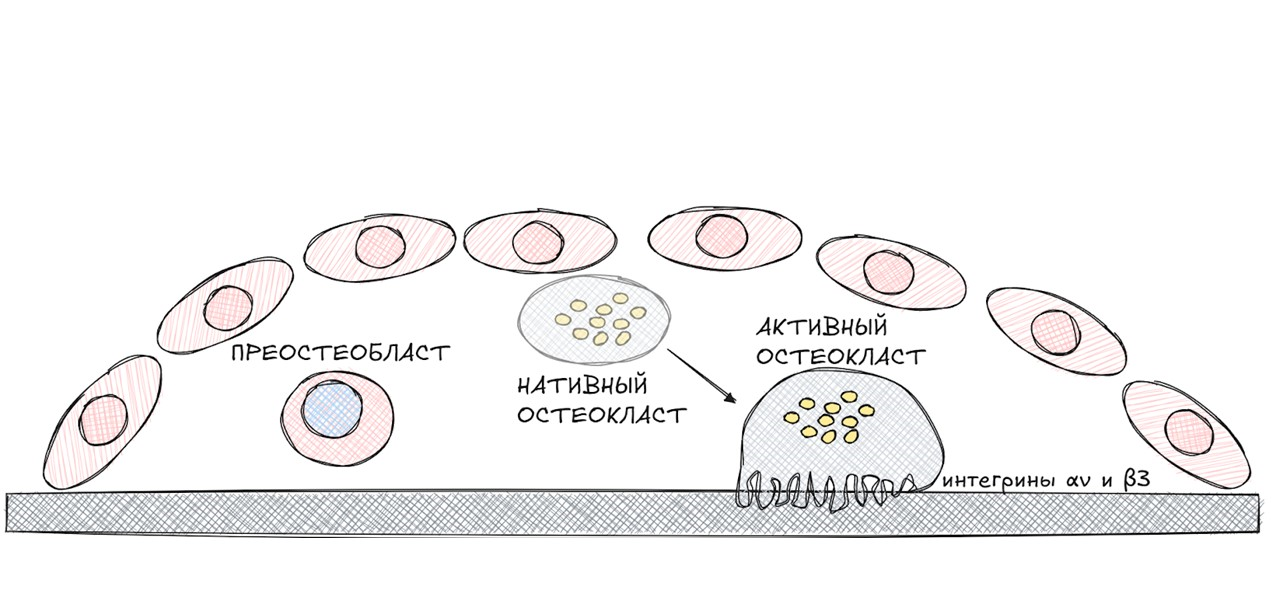
рисунок автора
За счет интегринов αν и β3, взаимодействующих с костными матриксными протеинами (остеопонтином и костным сиалопротеином), остеокласт крепится к поверхности кости и приступает к своей основной работе — резорбции.
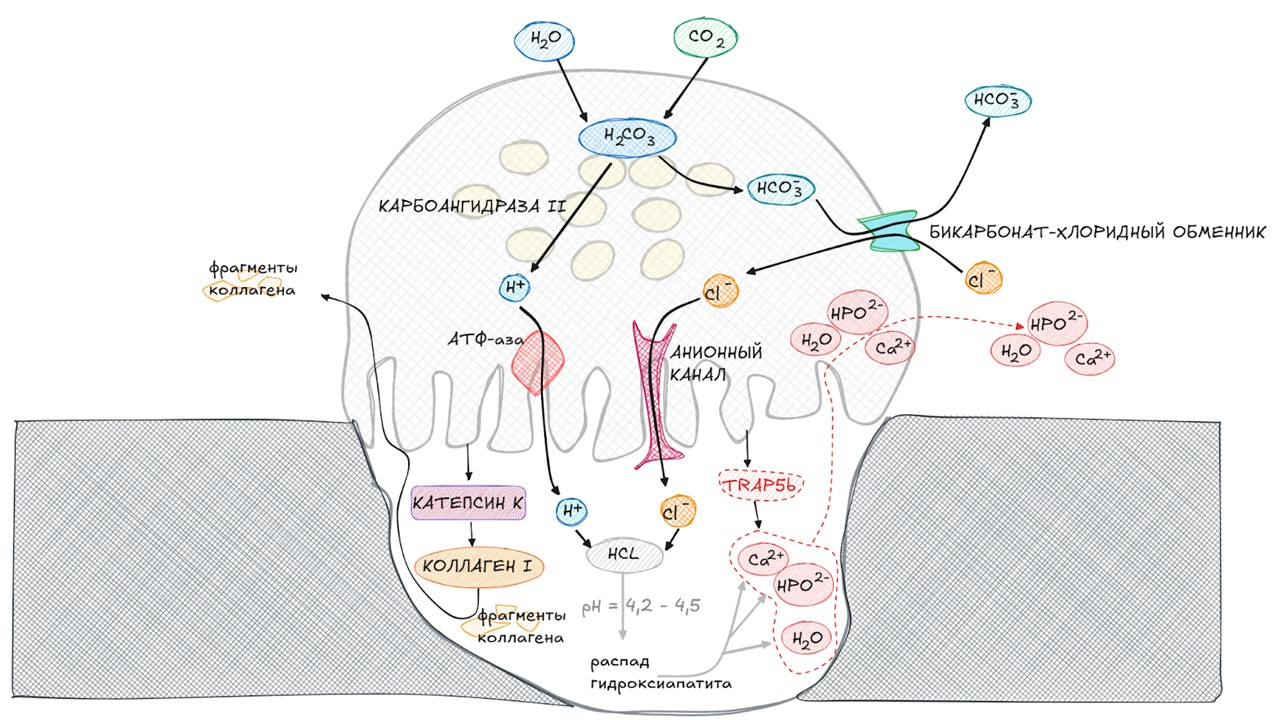
рисунок автора
Прикрепляясь к кости, остеокласт обзаводится гофрированной мембраной и начинает разрушать костную ткань. Область резорбции называется подосома. В ней за счет соляной кислоты происходит разрушение гидроксиапатита (основы минерального матрикса костной ткани). Также остеокласт выделяет в нее протеолитический фермент катепсин К, который обеспечивает расщепление коллагена I типа и вывод его фрагментов в кровоток, и тартрат-резистентную кислую фосфатазу (TRAP5b), которая участвует в трансцеллюлярном транспорте микропузырьков, содержащих продукты деградации костной ткани. Стабильность рН внутри самого остеокласта обеспечивается карбоангидразой II.
Стадия реверсии
Пока остеокласты разрушают костную ткань, преостеобласты дифференцируются в остеобласты, которые, в свою очередь, начинают секретировать остеопротегерин (OPG).
OPG — это рецептор-ловушка. Он связывается с RANK вместо RANKL и блокирует дальнейшую дифференциацию преостеокластов в остеокласты.
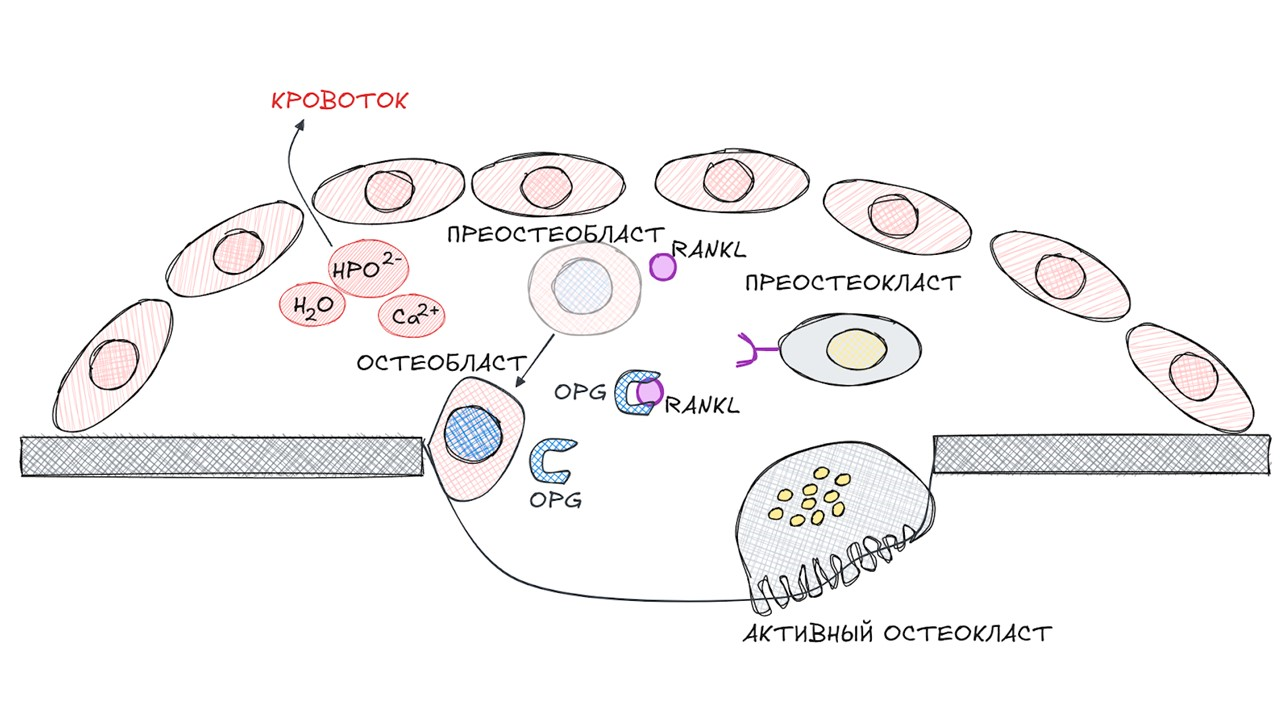
рисунок автора
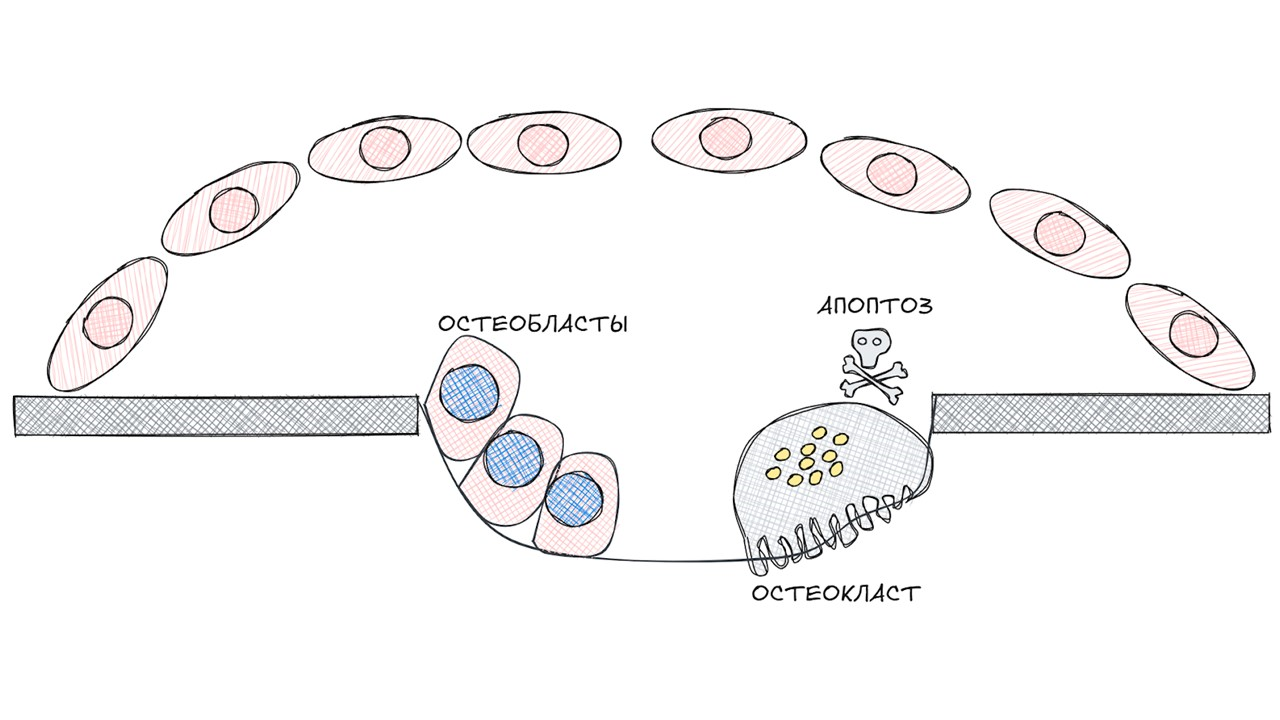
рисунок автора
На данной стадии остеокласты завершают свой жизненный путь, а остеобласты постепенно приступают к своей работе.
Костеобразование
Остеобласты начинают вырабатывать различные белки костного матрикса и коллаген I типа, формируя органический матрикс — остеоид, который в дальнейшем минерализуется.
Остеоид представлен преимущественно коллагеном I типа, который образуется из проколлагена I типа, синтезируемого фибробластами и остеобластами. Проколлаген типа I имеет N-концевой и С-концевой пропептиды, которые удаляются специальными протеазами при обращении проколлагена в коллаген.
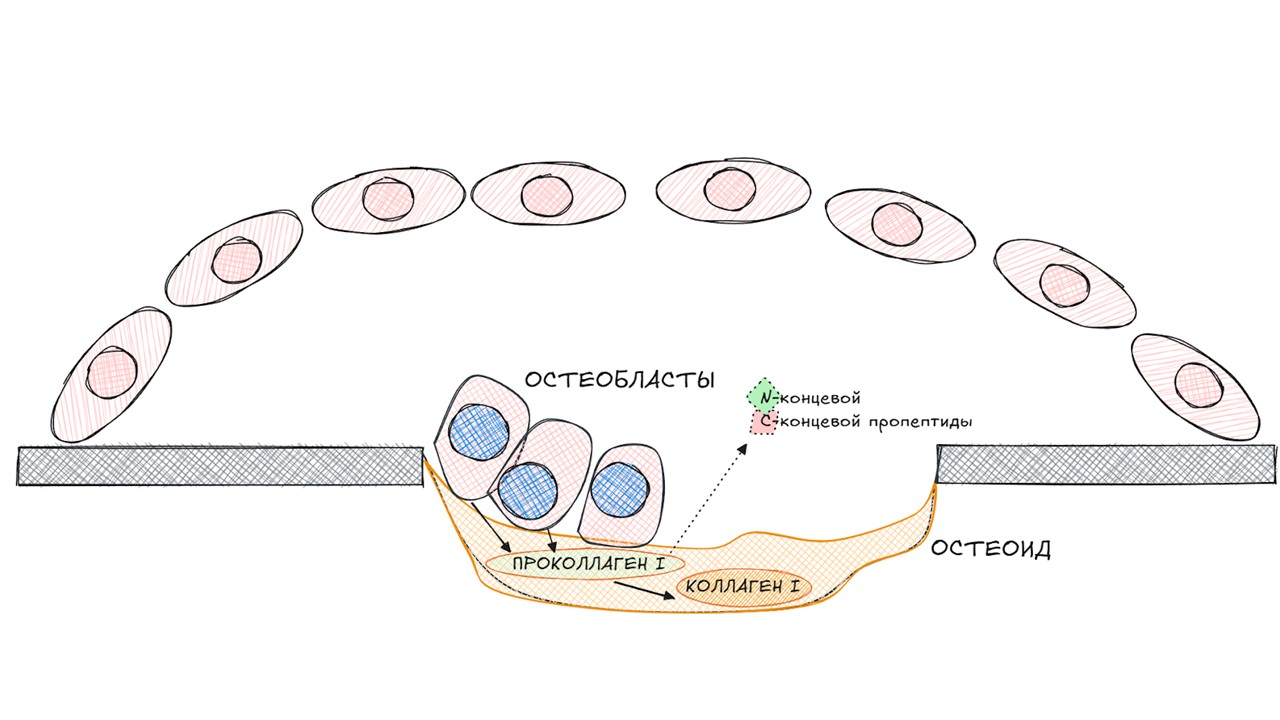
рисунок автора
Минерализация остеоида занимает 3–4 месяца.
После завершения минерализации часть остеобластов погружается в остеоид и становится остеоцитами, часть становится покровными клетками и часть — подвергается апоптозу.
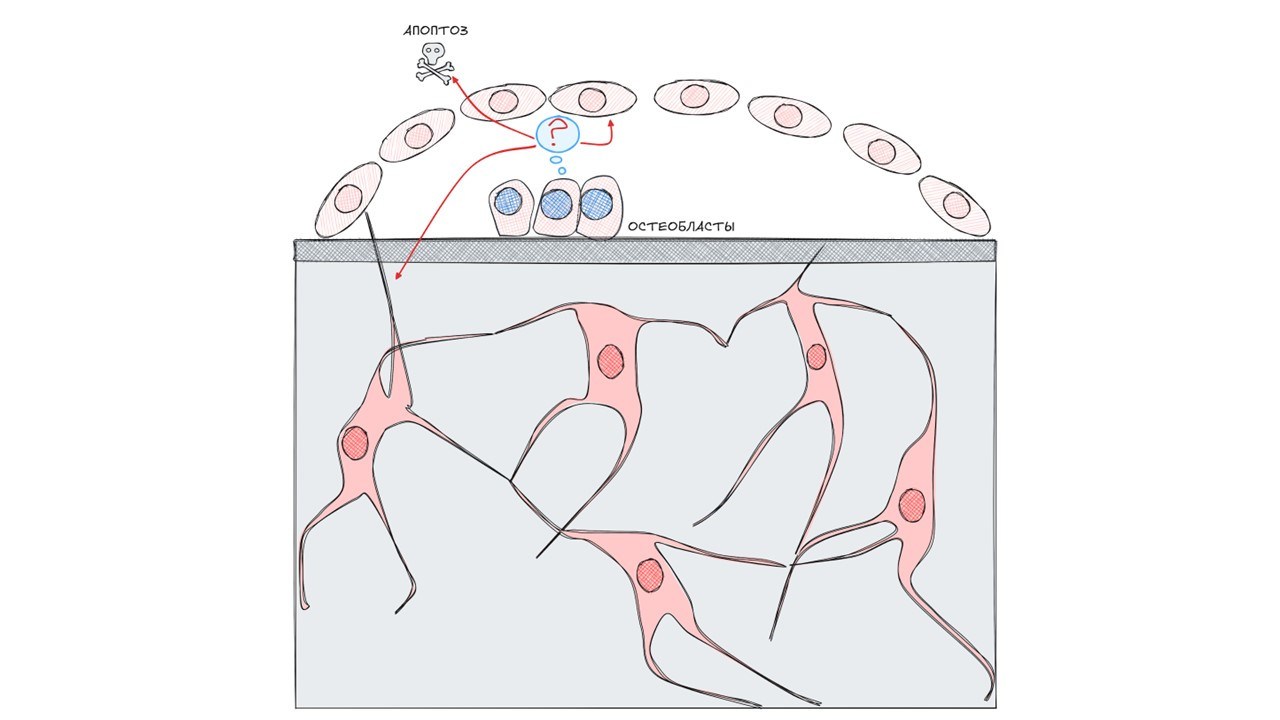
рисунок автора
Постепенно остеоциты восстанавливают свою связь друг с другом в месте, где происходила резорбция, и начинают секретировать SOST и DKK1. Выстилающие клетки возвращаются на место. Начинается стадия покоя.
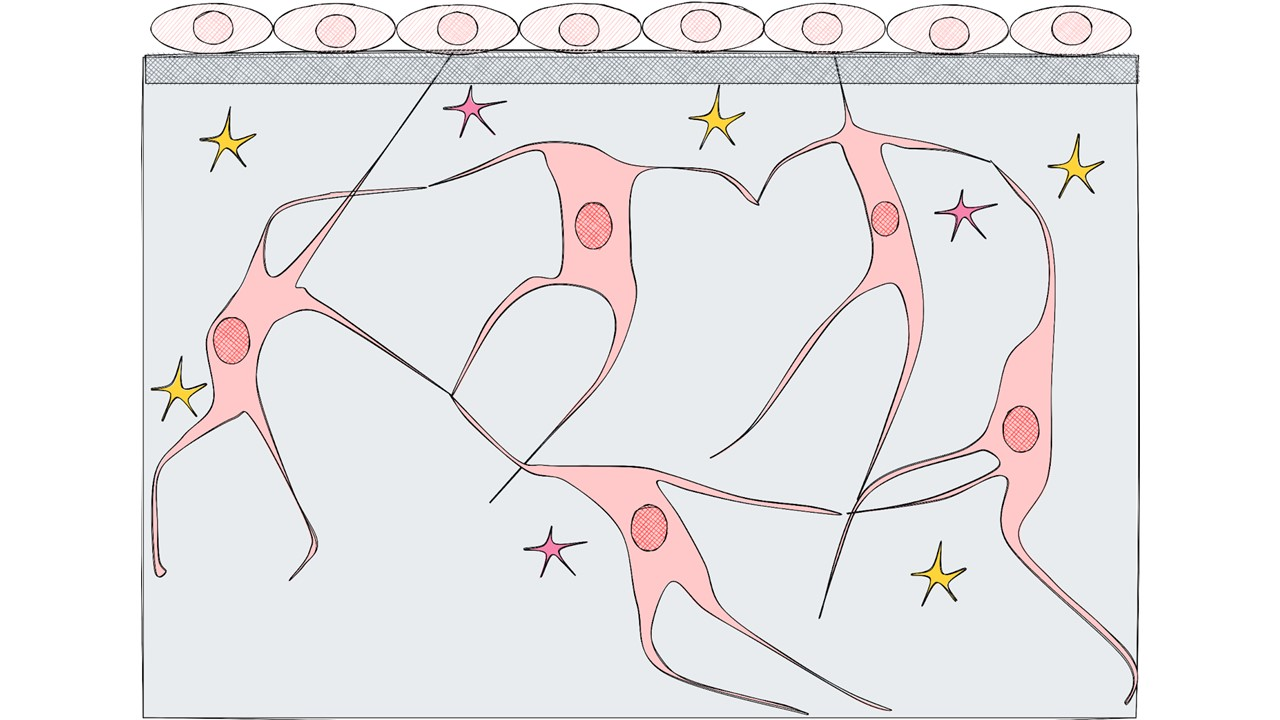
рисунок автора
Заключительное слово
Ремоделирование — это баланс между разрушением и образованием новой костной ткани.
Благодаря ему наши кости довольно длительное время сохраняют свою прочность и служат нам поддержкой и опорой. Но, как и все в нашем организме, это хрупкий процесс, к нарушению которого приводят как самые обычные причины, например, старость, гормональные изменения и болезни, так и довольно экзотические, например, космический полет... но это совсем другая история.
Литература
- Иммунитет: борьба с чужими и… своими;
- Bart Clarke. (2008). Normal Bone Anatomy and Physiology. Clinical Journal of the American Society of Nephrology. 3, S131-S139;
- Rowe P., Koller A., Sharma S. (2023). Physiology, Bone Remodeling. StatPearls Publishing;
- Tsung-Rong Kuo, Chih-Hwa Chen. (2017). Bone biomarker for the clinical assessment of osteoporosis: recent developments and future perspectives. Biomark Res. 5;
- Teresita Bellido, Vaibhav Saini, Paola Divieti Pajevic. (2013). Effects of PTH on osteocyte function. Bone. 54, 250-257;
- Hua Zhu Ke, William G. Richards, Xiaodong Li, Michael S. Ominsky. (2012). Sclerostin and Dickkopf-1 as Therapeutic Targets in Bone Diseases. Endocrine Reviews. 33, 747-783;
- Смирнов А. В., Румянцев А. Ш. (2015). Строение и функции костной ткани в норме и при патологии. Нефрология. 19, 8–17;
- Siyu Zhu, Wei Chen, Alasdair Masson, Yi-Ping Li. (2024). Cell signaling and transcriptional regulation of osteoblast lineage commitment, differentiation, bone formation, and homeostasis. Cell Discov. 10;
- G. M. Nurullina, G. I. Akhmadullina. (2018). BONE REMODELING IN NORM AND IN PRIMARY OSTEOPOROSIS: THE SIGNIFICANCE OF BONE REMODELING MARKERS. Arhivʺ vnutr. med.. 8, 100-110;
- D. S Aganov, V. V Tyrenko, E. N Tsygan, M. M Toporkov, S. G Bologov. (2014). The role of cytokine system RANKL/RANK/OPG in the regulation of bone metabolism. Genes & Cells. 9, 50-52;
- Erik Fink Eriksen. (2010). Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11, 219-227.