
Рецепторы следовых аминов (TAAR): невидимые дирижеры нашего мозга
15 января 2025
Рецепторы следовых аминов (TAAR): невидимые дирижеры нашего мозга
- 867
- 0
- 5
Новые горизонты изучения мозга.
Рисунок в полном размере.
рисунок Сильвестра Сизова
-
Автор
-
Редакторы
-
Иллюстратор
Статья на конкурс «Био/Мол/Текст»: Статья посвящена рецепторам следовых аминов (TAAR) — малоизученным, но значимым регуляторам физиологических процессов. Рассматривается их роль в обонянии, влиянии на мозговые процессы, а также их потенциал в лечении психиатрических заболеваний.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025 и получила приз «Огненный дебют».
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025 и получила приз «Огненный дебют».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В каждом из нас ежедневно разыгрываются сложные симфонии химических сигналов, которые регулируют настроение, поведение и когнитивные процессы. Но кто же управляет этим биохимическим оркестром? В числе множества таких «дирижеров» есть как очевидные, так и едва заметные, но от этого не менее значимые. Одними из таких «невидимых» фигур являются рецепторы следовых аминов (Trace amine-associated receptor, TAAR).
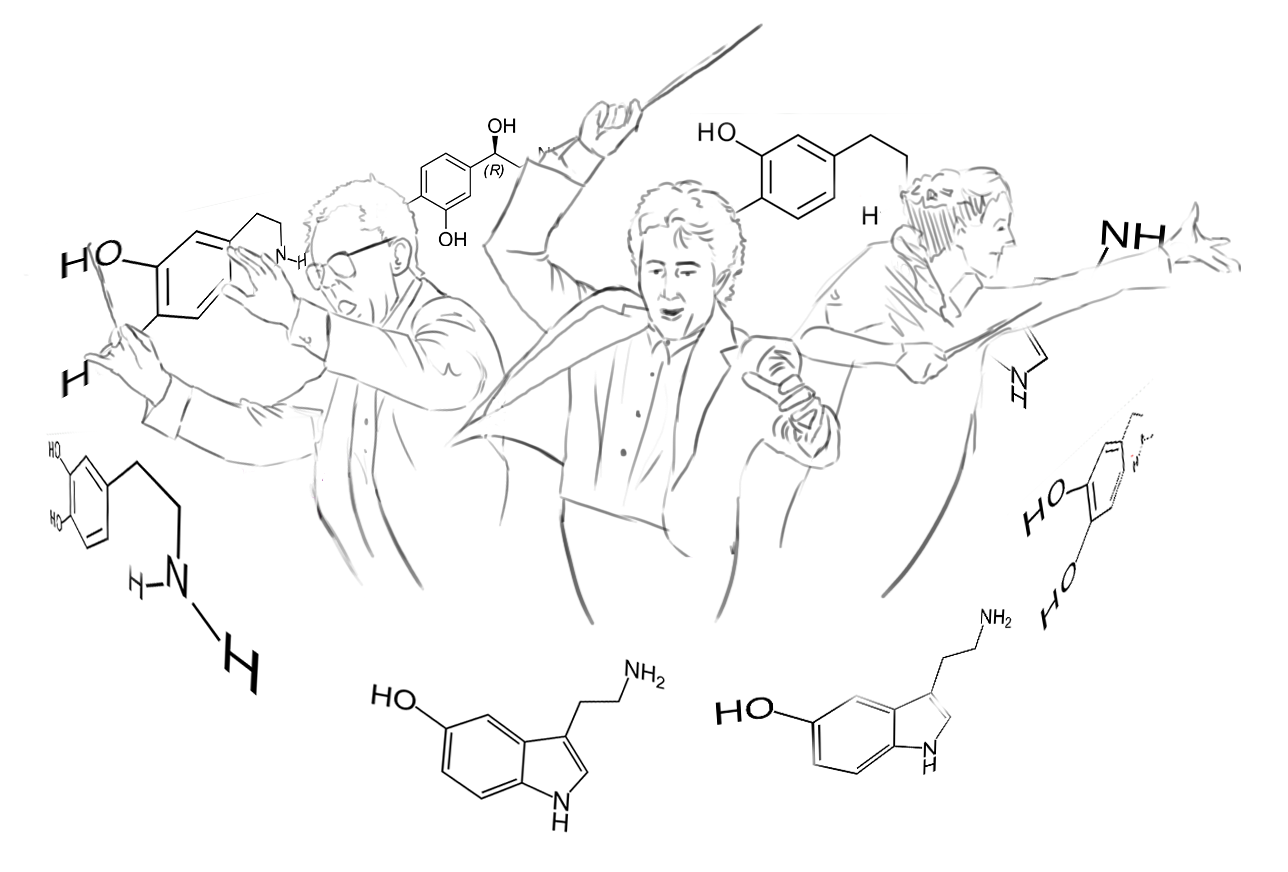
Рисунок 1. Биохимическая симфония мозга.
рисунок Сильвестра Сизова
Они, как теневые игроки, роль которых можно заметить не сразу, но их влияние пронизывает множество процессов. Несмотря на то, что TAAR были открыты сравнительно недавно, в 2001 году, они уже привлекли внимание ученых как возможные регуляторы настроения, поведенческих реакций и мишени для терапии заболеваний [1].

Рисунок 2. «Теневые игроки» в управлении мозгом.
рисунок Сильвестра Сизова
Следовые амины и их рецепторы: как все начиналось
В 1878 году польский ученый Марцелий Ненцкий открыл первый и наиболее изученный сейчас следовой амин — бета-фенилэтиламин. Исследуя процесс гниения белков при разложении яиц, он обнаружил, что из аминокислоты фенилаланина образуется более простое химическое вещество. Позже были зафиксированы физиологические эффекты этого амина: когда его вводили кроликам, у них повышалось давление, что, как выяснилось позже, было связано с выбросом норадреналина [2].
Следовые амины — это крошечные «осколки» аминокислот, образующиеся в процессе их метаболизма. При расщеплении от аминокислот отсоединяется кислотная часть, оставляя небольшие фрагменты, каждый из которых соответствует определенной аминокислоте. У людей чаще всего можно встретить тирамин, триптамин, октопамин и бета-фенилэтиламин [3].
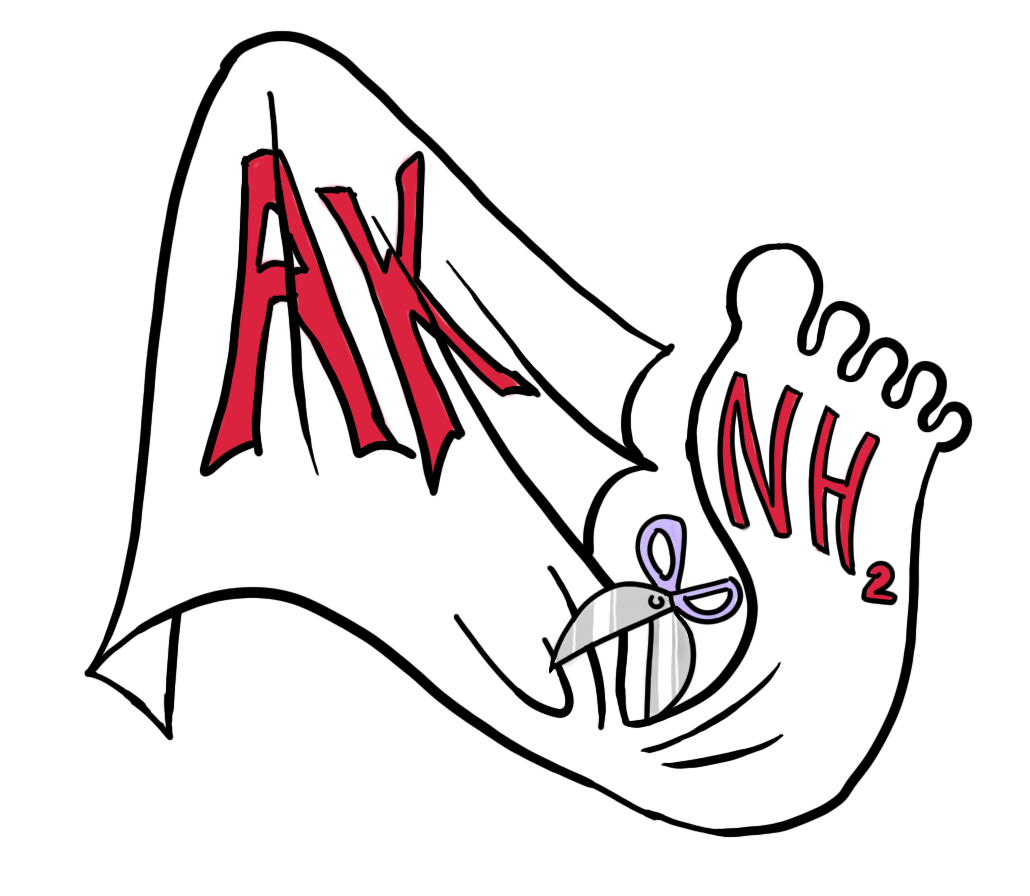
Рисунок 3. Образование аминокислотного «следа».
рисунок Сильвестра Сизова
Отщепление аминов происходит с помощью ферментов декарбоксилаз, которые есть как в организме человека, так и у бактерий. Именно поэтому большое количество следовых аминов можно найти в ферментированных продуктах: сыре, вине и пиве, или, например, в расщепленных тканях. Это объясняет, почему считается, что средиземноморская диета, включающая в себя множество молочнокислых продуктов и вино, считается «антидепрессантной». Хотя концентрация следовых аминов в организме значительно ниже, чем у классических нейромедиаторов, таких как дофамин или серотонин, они могут вносить свой вклад в работу нервной системы, регулируя работу нейромедиаторов и влияя на широкий спектр процессов, от настроения до двигательной активности [4], [5].
Бета-фенилэтиламин, или PEA, о котором мы уже говорили, стал популярен в начале 1980-х годов после выхода книги Майкла Либовица «Химия любви». Либовиц утверждал, что шоколад содержит большое количество PEA. В свою очередь, PEA описывался как молекула, оказывающая на человека эйфорическое действие. Это способствовало популяризации этой молекулы и привело к появлению «шоколадной теории любви» — предположению, что чувство влюбленности похоже на ощущение, которое человек испытывает при поедании шоколада. При этом люди, переживающие расставание, начинают поедать шоколад куда активнее, что может говорить об их «привыкании» к данному веществу [6]. Однако это оказалось мифом, так как бета-фенилэтиламин очень быстро разрушается при употреблении с пищей и даже при высоком его содержании в шоколаде просто не успеет достигнуть мозга [5], [7].

Рисунок 4. Шоколадная теория любви.
рисунок Сильвестра Сизова
Кроме эйфорического действия, PEA может усиливать сосредоточенность и имеет схожие структуру и свойства с амфетамином при инъекционном введении [8]. Это вызывает к нему большой интерес со стороны ученых и, например, спортсменов, которые используют PEA в качестве биодобавки, что, тем не менее, сейчас считается допингом [9].
Другой известный следовой амин — тирамин, — стал популярен не в самом позитивном ключе после открытия «сырного эффекта». Существует легенда о том, что впервые об этом синдроме сообщил фармацевт, жена которого лечилась от депрессии с помощью ингибиторов моноаминооксидазы (МАО) и время от времени жаловалась на сильную головную боль. Обеспокоенный недомоганием жены, фармацевт вскоре выяснил, что голова у нее болела только в те дни, когда она ела сыр, который очень любила. Неизвестно, правда ли это, однако гипертонические кризы на фоне приемов ингибиторов МАО действительно были зафиксированы у пациентов, которые употребляли много ферментированных продуктов. Виной тому был тирамин, который, в норме расщепляется моноаминооксидазой, но при ее ингибировании накапливался в большом количестве и вызывал высвобождение норадреналина и запуск реакций симпатической нервной системы [5].

Рисунок 5. «Захотел сыр? Получи по шапке!».
рисунок Сильвестра Сизова
Исследования рецепторов, воспринимающих следовые амины, то есть TAAR, начались с открытия первых рецепторов, сопряженных с G-белками — своеобразными «почтальонами» биохимической почты, которые передают сигналы от рецепторов на поверхности клетки к ее внутренним системам. Ученые Роберт Лефковиц и Марк Карон, изучая адреналиновые и норадреналиновые рецепторы, нашли бета-2 адренорецептор и доказали его роль в передаче сигналов в клетках. Сегодня известно более 800 таких рецепторов, и среди них — серотониновые, дофаминовые и, в том числе, рецепторы следовых аминов [2].

Рисунок 6. Биохимическая почта.
рисунок Сильвестра Сизова
Поначалу функции следовых аминов и их рецепторов казались второстепенными из-за их низкой концентрации в организме, гораздо большее внимание уделялось классическим нейротрансмиттерам (дофамину, серотонину и другим), тогда как следовые амины называли «ложными нейромедиаторами». Однако потом ученые обнаружили, что эти малые молекулы могут влиять на концентрации дофамина и серотонина, и, возможно, именно они «дирижируют» их выбросом, поддерживая сложные сети взаимодействий в нервной системе. Это открытие пробудило особый интерес к следовым аминам и их рецепторам, положив начало активному исследованию их роли в организме.
TAAR в обонятельной системе: как рецепторы «чуют» опасность?
Изначально TAAR изучались в контексте участия в обонянии, и действительно, здесь они выполняют важнейшие функции. Рецепторы TAAR2—TAAR9 локализуются в обонятельных ресничках и аксонах обонятельных нейронов и могут определять летучие соединения, связанные, например, с разложением органических веществ — путресцина, кадаверина и др. [9], [10].
У животных TAAR играют большую роль и в социальном поведении, распознавая феромоны, сигнализирующие о перспективе спаривания, или запах хищника [11]. В эволюционном плане TAAR, судя по всему, имели большое значение для выживания видов, помогая избегать испорченной пищи и определять территориальные метки других особей [10].

Рисунок 7. «Запахло жареным».
рисунок Сильвестра Сизова
Особенно хорошо рецепторы следовых аминов развиты у грызунов, они помогают им в определении физиологического состояния своих сородичей. Интересно, что у человека количество функциональных TAAR генов значительно меньше, чем у других млекопитающих, что может быть связано с уменьшением роли обоняния в жизни людей и развитием у них других сенсорных систем [5].
TAAR1 и его роль в регуляции нейромедиаторов
TAAR1 стал «звездой» среди рецепторов следовых аминов — он получил больше всего внимания ученых благодаря его локализации в лимбических структурах мозга. Это единственный рецептор следовых аминов, который не участвует в передаче обонятельных сигналов, зато играет роль в регуляции дофаминовых, серотониновых и норадреналиновых путей. При активации TAAR1 запускает сигнальные каскады, повышающие уровень циклического аденозинмонофосфата (цАМФ) внутри клеток, изменяя активность нейронов [5], [12].
Влияние TAAR на психические расстройства
Сами по себе следовые амины могут в будущем служить маркерами для выявления психических расстройств. Например, у людей с различными патологиями, такими как шизофрения, депрессия и СДВГ, изменялись уровни PEA, тирамина и триптамина в моче. Это может помочь при диагностике, сделав ее более точной [5], [13].
Что касается TAAR, исследования показывают, что активация рецептора TAAR1 может снижать гиперактивность и улучшать когнитивные способности за счет влияния на нейромедиаторные системы, отвечающие за внимание и импульсивность [14].
Помимо TAAR1, в контексте депрессии изучались и другие TAAR-рецепторы, а именно, в 2024 году был показан антидепрессантный эффект с TAAR2 и TAAR5 [15].
Для больных болезнью Паркинсона агонисты TAAR1, то есть вещества, активирующие эти рецепторы — это шанс не только замедлить дегенерацию нейронов, но и укрепить «дофаминовые мосты», нарушенные болезнью. Гибель нейронов черной субстанции при этой патологии сопровождается снижением дофаминовой передачи, и TAAR1 может здесь сыграть роль «архитектора», поддерживая остаточные пути. При этом TAAR влияют на патогенез заболевания, еще и уменьшая нейроиммунологические процессы, замедляя уничтожение нейронов. Исследования показывают, что TAAR1, активируя сигнальные каскады, способен защищать нейроны от апоптоза и сохранять хрупкую нейронную сеть от разрушения [13].

Рисунок 8. «Не нервничай. TAAR рядом».
рисунок Сильвестра Сизова
Сейчас в мире проходят клинические испытания агонистов рецепторов следовых аминов, например, Ulotaront от компании Sunovion находится на второй стадии клинических исследований, как и Ralmitaront от компании La Roche. При этом оба этих препарата исследуются в контексте лечения шизофрении. Результаты клинических испытаний показывают эффективность агонистов TAAR1, и вероятно, скоро эти препараты получат разрешения для использования в врачебной практике [16–19].
TAAR и нейропластичность
Кроме того, что рецепторы следовых аминов влияют на концентрацию нейромедиаторов, которые непосредственно действуют на деление нервных клеток, TAAR могут вносить вклад в нейропластичность еще несколькими путями. Например, через регуляцию иммунного ответа в центральной нервной системе, что может косвенно влиять на нейрогенез у детей. Активация TAAR может воздействовать на миграцию и активацию иммунных клеток, что, в свою очередь, может оказывать влияние на микроокружение нейронов и их способность к делению. Кроме того, TAAR помогают нейронам справляться со стрессом — главным врагом нейропластичности, регулируя уровни норадреналина и создавая внутреннее равновесие [13].
И, возможно, самое интересное: TAAR могут играть роль в нейрогенезе и у взрослых, особенно в лимбических структурах мозга, таких как гиппокамп. У животных с «выключенными» TAAR2 и TAAR5 наблюдается повышение концентраций маркеров нейропластичности BDNF и GDNF, что говорит о роли следовых аминов в делении нейронов и восстановлении мозга [22], [23].
Рисунок 9. «МОЗГострой».
рисунок Сильвестра Сизова
TAAR и микробиота
Необычно, но микробиота также может взаимодействовать с TAAR, добавляя «нот» в симфонию мозга. Многие наверняка слышали о связи «микробиота-мозг», и что кишечные микроорганизмы могут посылать сигналы в центральную нервную систему и наоборот. Так вот, рецепторы следовых аминов имеют свое применение и в этом ключе. Микробиота может влиять на уровень экспрессии TAAR в организме. Кроме того, метаболиты, производимые бактериями, могут активировать TAAR, особенно TAAR1 и TAAR2, что, в свою очередь, влияет на иммунные и метаболические реакции в организме, играющие роль в регуляции поведения и аппетита. Возможно, что TAAR являются одними из посредников в невидимой беседе между кишечником и мозгом, и в будущем можно будет воздействовать на эту связь [13], [24].

Рисунок 10. «Связь с периферией».
рисунок Сильвестра Сизова
TAAR и другие заболевания
Но и это еще не все! Хотя TAAR больше всего изучаются в контексте психиатрических заболеваний и работы мозга, однако они были найдены и во многих других органах, и могут быть мишенями для терапии самых разных заболеваний:
- TAAR1 и другие рецепторы этого класса могут играть роль в регуляции метаболизма и энергетического баланса. Агонисты TAAR1 могут помочь в лечении диабета 2 типа, способствуя секреции инсулина и снижению риска ожирения. Это делает TAAR потенциальными мишенями для разработки новых антидиабетических препаратов.
- Как мы уже обсуждали, TAAR могут участвовать в регуляции иммунного ответа, что делает их интересными для изучения в контексте аутоиммунных заболеваний, таких как болезнь Крона и астма. Исследования показывают, что некоторые TAAR, такие как TAAR2 и TAAR5, могут быть вовлечены в воспалительные процессы [13].
- TAAR1 также рассматриваются как потенциальные мишени для лечения зависимостей, включая зависимость от наркотиков. Агонисты TAAR1 могут снижать склонность к употреблению наркотиков и уменьшать симптомы, связанные с зависимостями [13], [25].
- TAAR, ответственные за обоняние, могут быть связаны с поведением животных, например, с миграцией или выбором полового партнера. Это открывает возможности для исследований в области экологии и поведения животных [13]. И хотя на человека с высокой точностью это можно будет транслировать еще очень нескоро, может быть, следовые амины смогут применяться и в лечении сексуальных расстройств, что тоже немаловажно.
Невероятные предположения, которые могут быть правдой
Так TAAR, выполняя обонятельные и нейротрансмиттерные функции, словно соединяют в себе два мира. В этом контексте ароматерапия как способ успокоения может иметь научные обоснования. Например, уже было показано, что тимберол, компонент хвойных растений, активирует TAAR5, который обладает антидепрессантным эффектом [2], [13], [15], [26], [27].

Рисунок 11. Хвойные «антидепрессанты».
рисунок Сильвестра Сизова
TAAR, скрывающие в себе целую микровселенную сигналов, могут оказаться не просто обонятельными, а «внутренними обонятельными рецепторами». Рауль Гайнетдинов, один из самых цитируемых психофармакологов в мире, предполагает, что рецепторы следовых аминов, такие как TAAR5, обладают уникальной способностью улавливать определенные химические сигналы, связанные с разложением и «запахом гнили» [27]. Эта их способность, изначально эволюционно обусловленная для распознавания внешних угроз, может быть также полезна для восприятия сигналов внутри организма. Например, гипотетически TAAR-рецепторы могут реагировать на молекулы, возникающие при воспалении или клеточном распаде, и через них нейроны будто «чувствуют» внутренние процессы.
В исследованиях с нокаутными животными, у которых TAAR5 отключен, наблюдались изменения в эмоциональных реакциях, как будто отсутствовал инстинктивный страх перед потенциальной угрозой. Это открывает новые перспективы для изучения связи между обонятельными рецепторами и внутренним мониторингом состояния организма [2], [27].
Рисунок 12. TAAR — «нос» нейронов.
рисунок Сильвестра Сизова
Невидимые дирижеры: почему TAAR оставались в тени?
Мы уже обсуждали выше, что роль следовых аминов в организме долгое время оставалась недооцененной на фоне известных нейромедиаторов, таких как дофамин и серотонин. Это связано с их «молекулярной скрытностью»: следовые амины действуют на локальном уровне и в малых концентрациях, что затрудняет их изучение. Сложность активации TAAR также является причиной их незаметности; они специфичны к отдельным аминам и не реагируют на другие нейромедиаторы, что делает их потенциальными мишенями для прицельной терапии психиатрических расстройств [12].
Рецепторы следовых аминов остаются невидимыми дирижерами нашего настроения и поведения, играя при этом ключевые партии в симфонии нейробиологических процессов. Возможно, их исследование позволит создать новые препараты, которые будут точечно воздействовать на эмоциональное состояние и психическое здоровье, снижая побочные эффекты, которые могут возникать при приеме классических лекарств, и улучшая качество жизни многих людей.
Кто знает, сколько еще таких тайных «дирижеров» спрятано в биохимических недрах нашего организма? Возможно, TAAR — это лишь один из многих пока еще не раскрытых талантов, и их история — пролог к новым открытиям, которые изменят наше понимание психики.
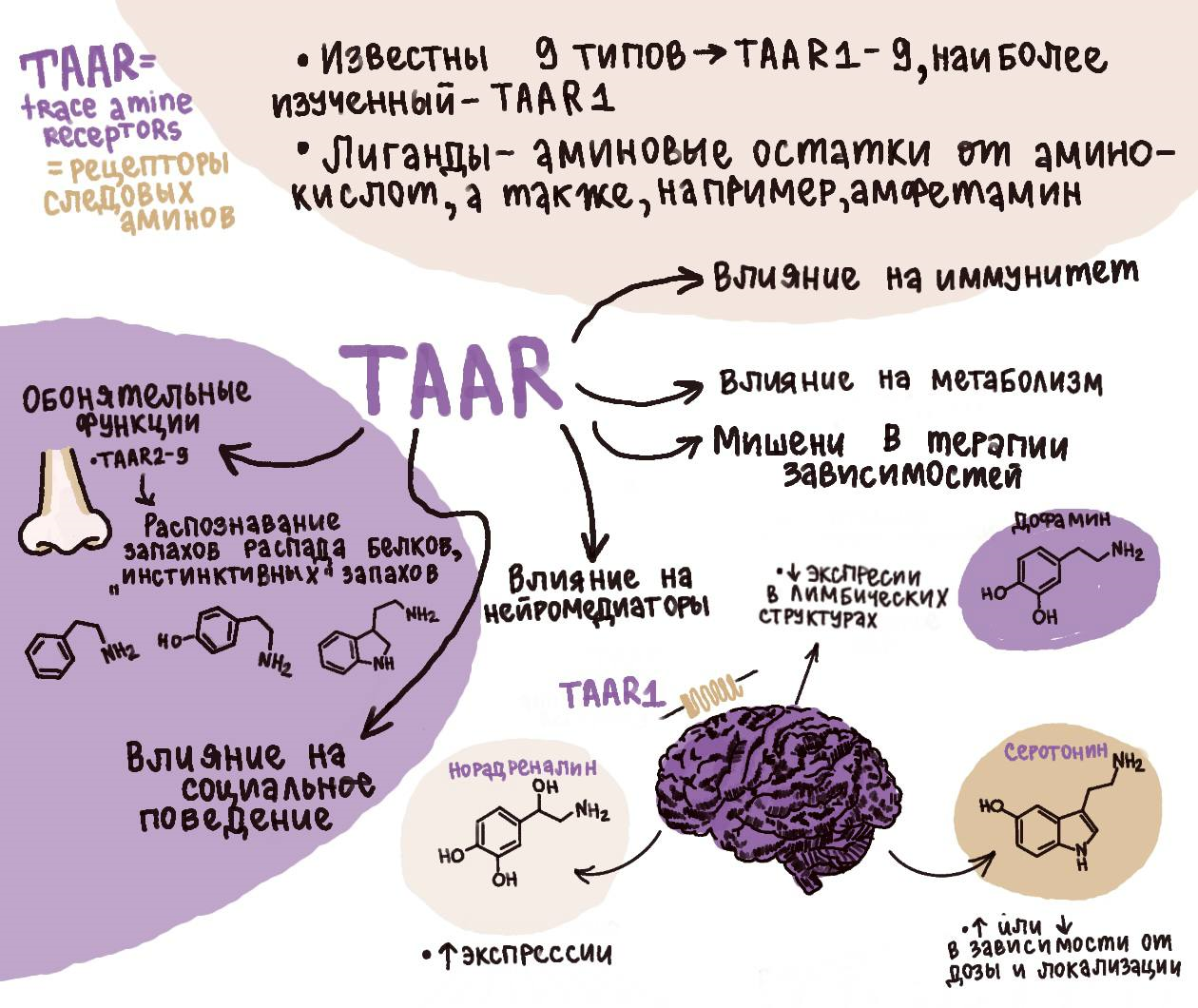
Рисунок 13. Многообразие функций TAAR.
рисунок Сильвестра Сизова
Литература
- Beth Borowsky, Nika Adham, Kenneth A. Jones, Rita Raddatz, Roman Artymyshyn, et. al.. (2001). Trace amines: Identification of a family of mammalian G protein-coupled receptors. Proc. Natl. Acad. Sci. U.S.A.. 98, 8966-8971;
- PCR News: Следовые амины и лекарство от шизофрении;
- D. A. Zhukov, E. P. Vinogradova. (2020). Trace Amines and Behavior. Neurochem. J.. 14, 347-352;
- Zhihua Xie, Gregory M. Miller. (2009). Trace amine-associated receptor 1 as a monoaminergic modulator in brain. Biochemical Pharmacology. 78, 1095-1104;
- Yue Pei, Aman Asif-Malik, Juan J. Canales. (2016). Trace Amines and the Trace Amine-Associated Receptor 1: Pharmacology, Neurochemistry, and Clinical Implications. Front. Neurosci.. 10;
- Liebowitz M. R. The Chemistry of Love. Boston: Little, Brown, & Co., 1983. — 213 p.;
- Hector C. Sabelli, Walter A. Pedemonte, Christopher Whalley, A.David Mosnaim, Alfredo J. Vazquez. (1974). Further evidence for a role of 2-phenylethylamine in the mode of action of Δ9-tetrahydrocannabinol. Life Sciences. 14, 149-156;
- J.L. Howard, G.T. Pollard, K.W. Rohrbach, N.E. Harto. (1976). Effect of β-phenylethylamine and d-amphetamine on electrical self-stimulation of brain. Pharmacology Biochemistry and Behavior. 5, 661-664;
- Ashiq Hussain, Luis R. Saraiva, David M. Ferrero, Gaurav Ahuja, Venkatesh S. Krishna, et. al.. (2013). High-affinity olfactory receptor for the death-associated odor cadaverine. Proc. Natl. Acad. Sci. U.S.A.. 110, 19579-19584;
- Stephen D Liberles. (2015). Trace amine-associated receptors: ligands, neural circuits, and behaviors. Current Opinion in Neurobiology. 34, 1-7;
- David M. Ferrero, Stephen D. Liberles. (2010). The secret codes of mammalian scents. WIREs Mechanisms of Disease. 2, 23-33;
- Amyaouch Bradaia, Gerhard Trube, Henri Stalder, Roger D. Norcross, Laurence Ozmen, et. al.. (2009). The selective antagonist EPPTB reveals TAAR1-mediated regulatory mechanisms in dopaminergic neurons of the mesolimbic system. Proc. Natl. Acad. Sci. U.S.A.. 106, 20081-20086;
- Raul R. Gainetdinov, Marius C. Hoener, Mark D. Berry. (2018). Trace Amines and Their Receptors. Pharmacol Rev. 70, 549-620;
- Ícaro Raony, Ivan Domith, Mychael V. Lourenco, Roberto Paes-de-Carvalho, Pablo Pandolfo. (2022). Trace amine-associated receptor 1 modulates motor hyperactivity, cognition, and anxiety-like behavior in an animal model of ADHD. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 117, 110555;
- Taisiia S. Shemiakova, Evgeniya V. Efimova, Raul R. Gainetdinov. (2024). TAARs as Novel Therapeutic Targets for the Treatment of Depression: A Narrative Review of the Interconnection with Monoamines and Adult Neurogenesis. Biomedicines. 12, 1263;
- Michele L. R. Heffernan, Lee W. Herman, Scott Brown, Philip G. Jones, Liming Shao, et. al.. (2022). Ulotaront: A TAAR1 Agonist for the Treatment of Schizophrenia. ACS Med. Chem. Lett.. 13, 92-98;
- Eric D. Achtyes, Seth C. Hopkins, Nina Dedic, Heather Dworak, Courtney Zeni, Kenneth Koblan. (2023). Ulotaront: review of preliminary evidence for the efficacy and safety of a TAAR1 agonist in schizophrenia. Eur Arch Psychiatry Clin Neurosci. 273, 1543-1556;
- Richard Ågren, Nibal Betari, Marcus Saarinen, Hugo Zeberg, Per Svenningsson, Kristoffer Sahlholm. (2023). In Vitro Comparison of Ulotaront (SEP-363856) and Ralmitaront (RO6889450): Two TAAR1 Agonist Candidate Antipsychotics. International Journal of Neuropsychopharmacology. 26, 599-606;
- Christoph U. Correll, Kenneth S. Koblan, Seth C. Hopkins, Yan Li, Heather Dworak, et. al.. (2021). Safety and effectiveness of ulotaront (SEP-363856) in schizophrenia: results of a 6-month, open-label extension study. npj Schizophr. 7;
- Chi-Un Pae, Hye-Sook Yu, Daniela Amann, Jung-Jin Kim, Chang-Uk Lee, et. al.. (2008). Association of the trace amine associated receptor 6 (TAAR6) gene with schizophrenia and bipolar disorder in a Korean case control sample. Journal of Psychiatric Research. 42, 35-40;
- Britto Shajan, Tarun Bastiampillai, Pramod C. Nair. (2024). The association between trace amine-associated receptor 1 (TAAR1) genetic mutations and neuropsychiatric disorders. Genomic Psychiatry. 1-4;
- Evgeniya V. Efimova, Saveliy R. Kuvarzin, Mikael S. Mor, Nataliia V. Katolikova, Taisiia S. Shemiakova, et. al.. (2022). Trace Amine-Associated Receptor 2 Is Expressed in the Limbic Brain Areas and Is Involved in Dopamine Regulation and Adult Neurogenesis. Front. Behav. Neurosci.. 16;
- Nataliia V. Katolikova, Anastasia N. Vaganova, Evgeniya V. Efimova, Raul R. Gainetdinov. (2022). Expression of Trace Amine-Associated Receptors in the Murine and Human Hippocampus Based on Public Transcriptomic Data. Cells. 11, 1813;
- Ilya S. Zhukov, Anastasia N. Vaganova, Ramilya Z. Murtazina, Lyubov S. Alferova, Elena I. Ermolenko, Raul R. Gainetdinov. (2022). Gut Microbiota Alterations in Trace Amine-Associated Receptor 9 (TAAR9) Knockout Rats. Biomolecules. 12, 1823;
- Ruyan Wu, Jun-Xu Li. (2021). Potential of Ligands for Trace Amine-Associated Receptor 1 (TAAR1) in the Management of Substance Use Disorders. CNS Drugs. 35, 1239-1248;
- Stefano Espinoza, Ilya Sukhanov, Evgeniya V. Efimova, Alena Kozlova, Kristina A. Antonova, et. al.. (2020). Trace Amine-Associated Receptor 5 Provides Olfactory Input Into Limbic Brain Areas and Modulates Emotional Behaviors and Serotonin Transmission. Front. Mol. Neurosci.. 13;
- N+1: «„Следовые амины очень вкусные“. Рауль Гайнетдинов — о самом малоизученном классе биогенных аминов и основах ароматерапии».







