
Рибосомы тоже спят: почему белковые машины впадают в гибернацию?
15 декабря 2025
Рибосомы тоже спят: почему белковые машины впадают в гибернацию?
- 132
- 0
- 0
Возможно, именно так выглядела бы гибернация рибосом, если бы они буквально засыпали.
Рисунок в полном размере.
иллюстрация сгенерирована автором статьи при помощи нейросети ChatGPT
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Рибосомы часто называют «фабриками» клетки, ведь они производят белки — основу для существования жизни. Но известно ли вам, что эти фабрики могут впадать в нечто вроде сна? Недавние исследования показали, что под действием специальных белковых факторов рибосомы способны временно прекращать синтез белка, пережидая неблагоприятные условия. Читая статью, вы погрузитесь в «грезы» белковых машин и узнаете, какие молекулярные механизмы могут участвовать в гибернации рибосом, как это явление было открыто, какие исследования проводятся на данный момент и различные версии, почему же рибосомы впадают в гибернацию.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — Благотворительный фонд «Белая лилия», который поддерживает школьников, студентов профильных вузов, научных коллективов врачей и ученых по разработке и созданию прорывных технологий в области медицины.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Лондон охвачен экономическим кризисом. Богатый углепромышленник Гилберт, опасаясь неминуемого краха, бросается в самые рискованные предприятия и соглашается на предложение прожектера Карлсона — ввести своих рабочих в анабиоз и пробудить их после окончания кризиса, когда мир будет более устойчив. Для главных героев анабиоз — не сон, а нечто среднее между сном и жизнью...
Теперь представьте, что о таких событиях пишет не Александр Беляев в произведении «Ни жизнь, ни смерть», а биологи в научных статьях. И в это несложно поверить! Находясь в стрессовых условиях, клетки могут умело вводить своих рабочих-рибосом в «анабиоз», как это делает Гилберт. Конечно, рибосомы не переходят в состояние сна (это невозможно в первую очередь по причине отсутствия у них нервной системы), они лишь на некоторое время перестают синтезировать белок, оставаясь готовыми снова начать трансляцию. Подобное состояние остановки трансляции называется гибернация. В этом процессе участвуют особые белки — факторы гибернации. Они не только помогают «усыпить» рибосомы, но и защищают их от разрушения клеточными ферментами. Гибернация характерна не только для рибосом, но и для других биологических молекул.
Структура и роль рибосом в клетке
Поскольку рибосомы занимают центральное место в нашей истории, давайте кратко повторим, что мы о них знаем. Рибосомы сопровождали клетки еще до того, как жизнь разделилась на домены бактерий, архей и эукариот — настолько древние это структуры (есть гипотеза, что такие структуры появились еще в древнем РНК-мире [1], существовавшем задолго до появления клеток). Все потому, что они выполняют жизненно важную для клеток роль — синтез белка. Состоят эти органеллы из компонентов, присущих каждой клетке на Земле — рРНК и белков. В строении рибосом выделяют две субъединицы: малая расшифровывает мРНК, а большая соединяет аминокислоты в цепочку — будущий белок. Однако у разных доменов жизни есть незначительные структурные отличия, которые могут быть выявлены с помощью измерения коэффициента седиментации (S) при центрифугировании. У бактерий и архей, как правило, встречаются 70S рибосомы, а для эукариот характерны бóльшие по размеру 80S (рис. 1) [2].
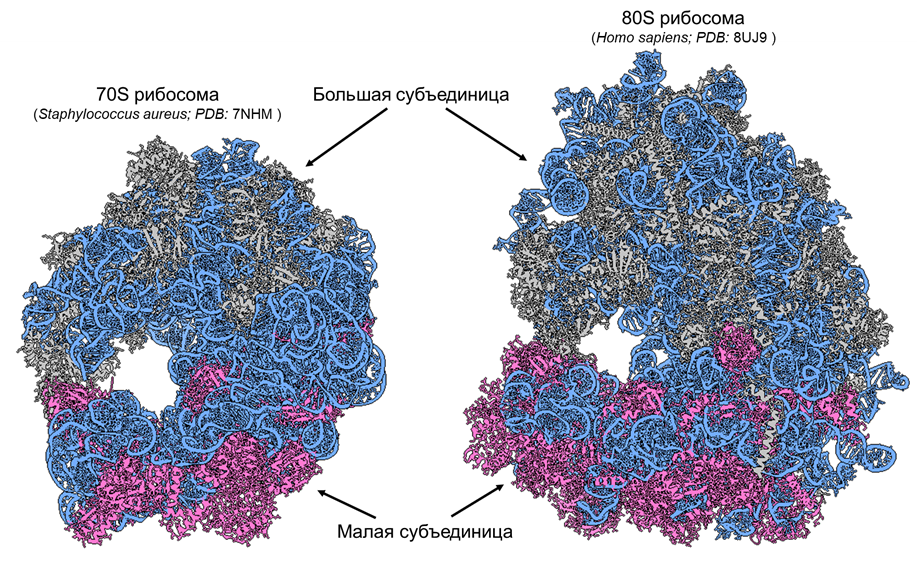
Рисунок 1. Рибосомы прокариот (слева) и эукариот (справа). Серый цвет — белки большой субъединицы, розовый — белки малой субъединицы, синий — рРНК.
изображения из ChimeraX, сделанные автором статьи
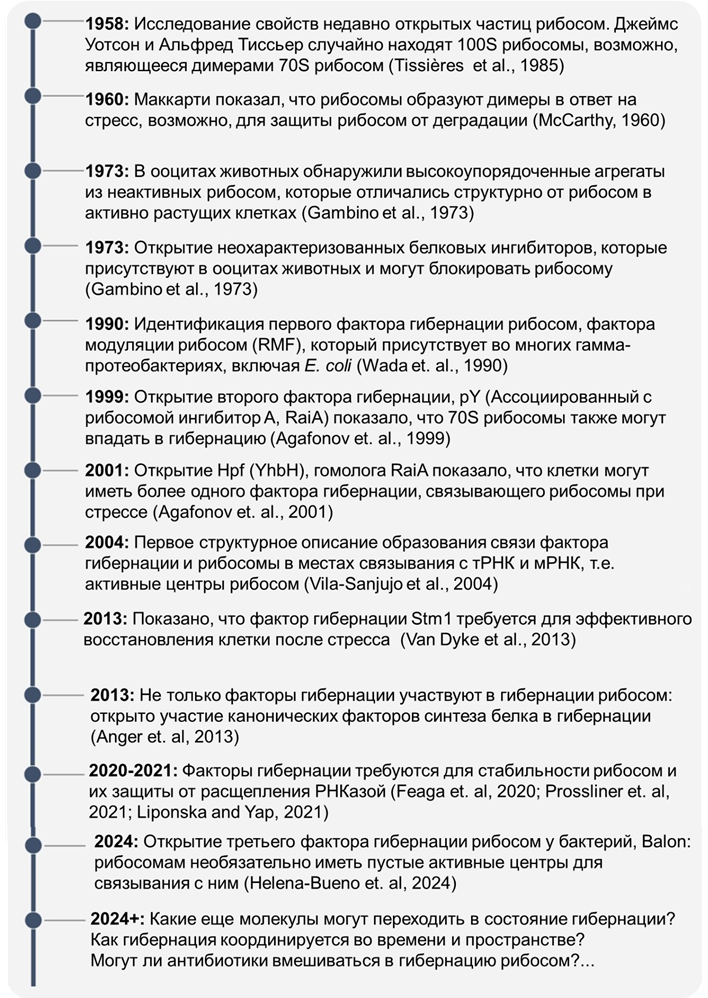
Рисунок 2. Хронология некоторых основных этапов в изучении гибернирующих молекул.
С чего начались «сны» рибосом
В 1958 году выходит статья Альфреда Тиссьера и Джеймса Уотсона (того самого, что открыл ДНК) с описанием необычных частиц в культуре Escherichia coli. Среди привычных бактериальных 70S рибосом они обнаружили и более крупные — 100S. Тогда ученые еще не подозревали, что стали первыми, кто наблюдал гибернирующие органеллы. Как выяснится позже, их предположение о том, что 100S представляют собой димеры рибосом, окажется верным [3]. Это случайное наблюдение можно считать отправной точкой в изучении гибернации рибосом (рис. 2).
Через два года Брайан Маккарти опубликовал свои исследования, доказывающие, что 100S рибосомы появляются, когда бактерия находится в стационарной фазе или испытывает нехватку питательных веществ, снижая синтез белка. И после восстановления запаса питательных веществ клетки вновь включали процесс трансляции, а крупные 100S рибосомы исчезали Маккарти первым высказал идею, что клетки способны «усыплять» свои рибосомы в ответ на стресс. Ученые всего мира только догадываются о существовании особых факторов, регулирующих этот процесс.
Белки, укладывающие рибосомы спать
Поиск неизведанного всегда тернист, и приоткрыть тайну образования «спящих» рибосом смогли Вада и его коллеги [4]. Обнаруженный белок назвали фактором модуляции рибосом (RMF). Хоть он и был крошечным, по заявлениям авторов, он запускал образование димеров рибосом, защищая их таким образом от разрушения. Это исследование показало, что почти все (или все) рибосомы в метаболически неактивных клетках связываются с особыми белками — факторами гибернации. Однако эксперименты in vitro показали, что в одиночку RMF не может формировать полноценные 100S рибосомы, а лишь их 90S предшественники [5]. То есть белок RMF подготавливает рибосомы к димеризации, но для их окончательной гибернации нужен кто-то еще. И позднее были обнаружены два гомологичных белка HPF и RaiA, которые имеют немаловажное значение в процессе гибернации рибосом. Именно фактор, способствующий гибернации (HPF) является недостающим элементом в понимании процесса образования 100S рибосом. HPF выполняет роль своеобразной «подушки» для 90S рибосом, стабилизируя их с образованием 100S формы (рис. 3). Таким образом, чтобы уложить рибосомы «спать», необходимо согласованное действие RMF и HPF, но что же делает RaiA? Внимательный читатель может подумать, что RaiA будет обладать способностью образовывать димеры, как и гомологичный ему HPF. Однако это не совсем так... Ассоциированный с рибосомой ингибитор A (RaiA), напротив, не образует димеры: он связывается с одиночными 70S-рибосомами и «усыпляет» их без объединения в пары. (рис. 3). Вероятно, обе формы гибернирующих рибосом, димеры 100S и мономеры 70S, сосуществуют в клетке [5].
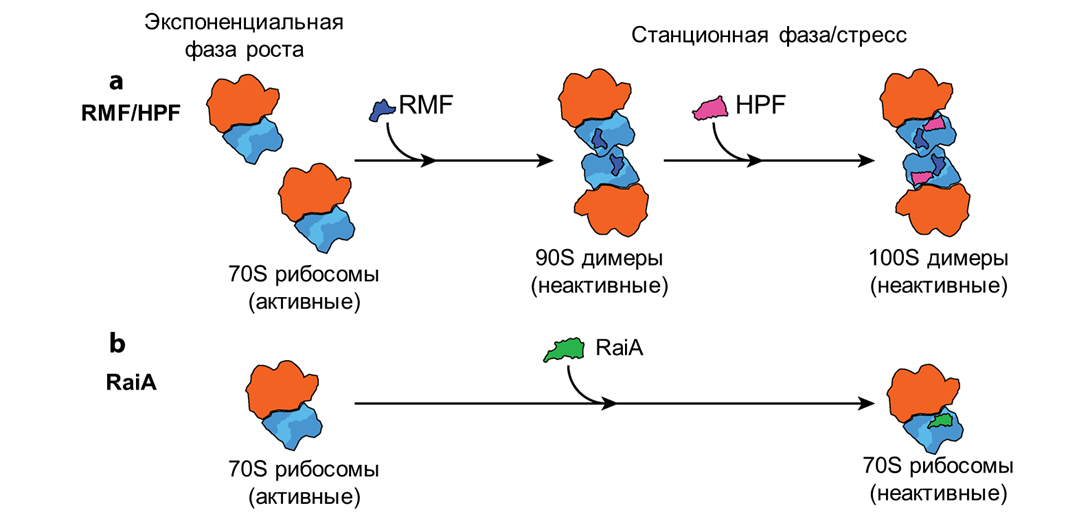
Рисунок 3. Механизм действия факторов гибернации.
Однако бактериальные клетки не ограничились только этими тремя факторами гибернации. У большинства видов бактерий найдено более одного семейства этих белков (рис. 4). Один из самых популярных для исследований организмов — E. coli — обладает целым «арсеналом», состоящим из четырех семейств факторов гибернации. Почему этих семейств так много, пока не совсем понятно. Сохраняется для них и характерная доменная специфичность, которая предполагает, что они появились вскоре после разделения бактерий и архей-эукариот. Если датировка этого эволюционного события точна, то клетки, подражая деятельности Гилберта с его рабочими, вводят рибосомы в гибернацию уже приблизительно 3,5 миллиарда лет [3].
Рибосомная гибернация — привилегия не только бактерий. Первый фактор гибернации у эукариот, белок Stm1, обнаружили в 2011 году. Он связывается практически со всеми рибосомами дрожжей S. cerevisiae в условиях внезапного голодания [6]. Позднее обнаружили, что гомолог Stm1, белок SERBP1, способен взаимодействовать с рибосомами в клетках человека и дрозофил, когда они испытывают сильный холод [7]. Последующие исследования выявили еще пять семейств факторов гибернации рибосом у эукариот (рис. 4).
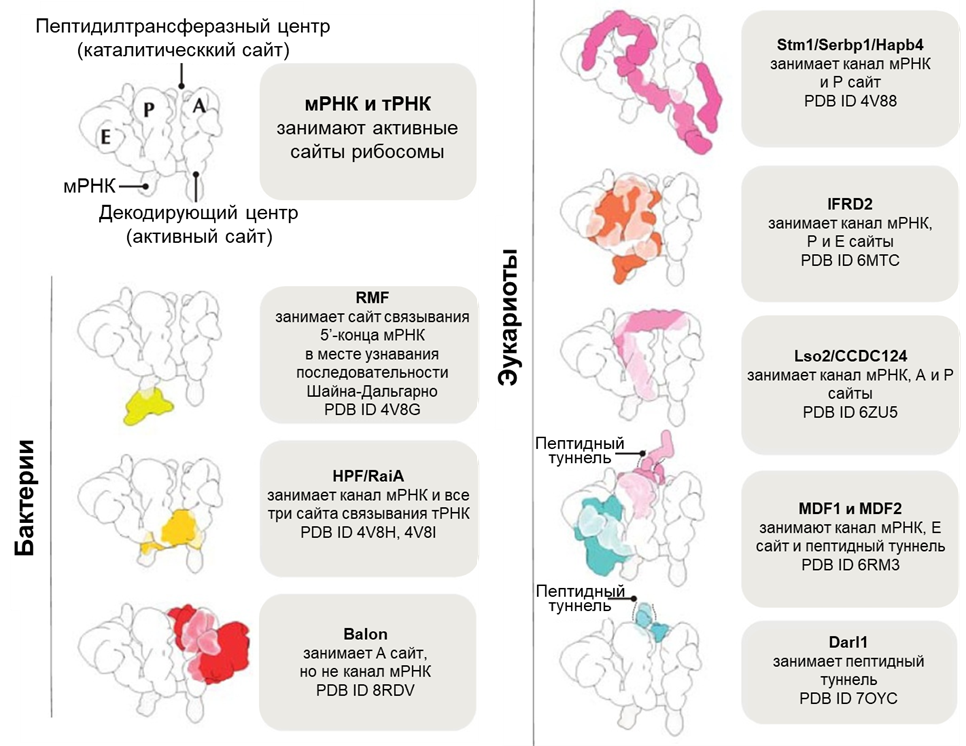
Рисунок 4. Известные в настоящее время факторы гибернации рибосом и их сайты связывания с рибосомами.
Важным шагом на пути к открытию многих факторов гибернации стало исследование Джеми Кейт и его коллег. Еще в 2004 году они структурно охарактеризовали RaiA, связанный с рибосомой, и выявили общую характеристику для всех известных факторов гибернации рибосом: они не только связываются с этими органоидами в метаболически неактивных клетках, но и занимают их активные центры, делая рибосомы недоступными для других молекул. Несмотря на наличие консервативных участков, факторы гибернации обладают высокой скоростью эволюции последовательностей по сравнению с другими связывающими рибосомы белками. Эта повышенная скорость эволюции затрудняет использование традиционных подходов поиска гомологии [3].
Однако такие трудности не останавливают исследователей рибосомального сна. И недавно вышла статья с описанием нового семейства факторов гибернации рибосом у бактерий. Выбор бактерии P. urativorans в качестве нового «испытуемого» позволил взглянуть на известные механизмы под иным углом. К удивлению самих ученых, они обнаружили, что при стрессовых условиях рибосомы этого вида бактерий связываются с новым, ранее не описанным белком. Его назвали Balon — от одной из версий испанского слова «мяч», чтобы подчеркнуть его отдаленное структурное сходство с Pelota (также испанского слова, означающего мяч), который является одним из факторов трансляции эукариот. В отличие от других факторов гибернации, Balon может взаимодействовать не только с пустыми рибосомами, но и с рибосомами, связанными с мРНК и тРНК, т.е. активно транслирующимися (рис. 5). У таких видов, как E. coli и S. aureus, которые обычно используются для изучения гибернации рибосом, гомологи Balon отсутствуют, что может объяснять, почему он не был идентифицирован ранее [8].
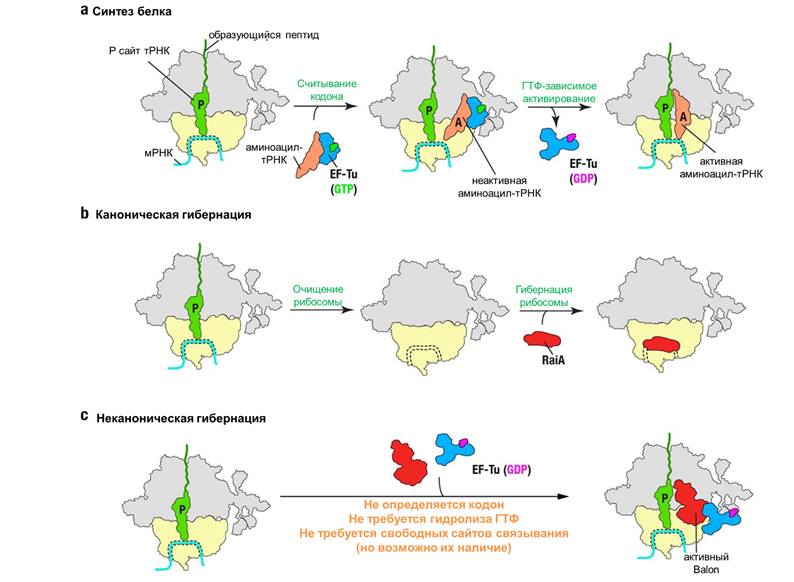
Рисунок 5. Сравнение гибернации рибосом, опосредованной Balon, с механизмами канонической гибернации рибосом.
Сон ради выживания и при чем здесь антибиотики
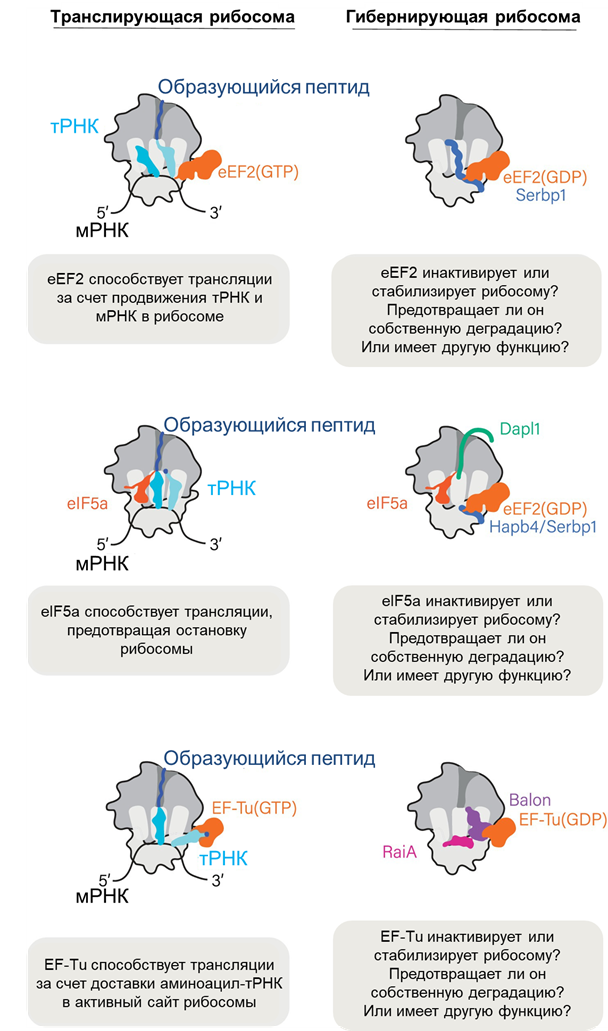
Рисунок 6. Факторы гибернации часто связывают рибосомы совместно с факторами синтеза белка.
Характерное расположение факторов гибернации в активных центрах рибосом наталкивает на мысль, что их основная функция — ингибирование трансляции при стрессе. Однако в недавних исследованиях приводится все больше доказательств того, что такая точка зрения не совсем точна. Скорее всего, связывание факторов гибернации с рибосомой и образование димеров являются следствием, а не причиной остановки синтеза белка [9]. Обсуждая Balon, мы уже затронули тот факт, что в гибернации рибосом могут участвовать еще и факторы, отвечающие за обычный синтез белка (рис. 6). Вероятно, все участники помогают защитить уязвимые участки гибернирующих рибосом от разрушающей активности ферментов.
Похоже, стресс — главная причина для гибернации рибосом, но, может быть, существуют и другие? Еще в 1972 году К. Таддеи получил микрофотографии, на которых видно, что во время зимней спячки рибосомы в ооцитах ящериц собираются в крупные кластеры, состоящие примерно из тысячи этих органоидов. Подобное скопления рибосом получило название «рибосомальные тельца» (рис. 7). С наступлением весны эти «рибосомные тельца» постепенно распадаются на отдельные рибосомы, к лету они полностью исчезают [10]. Такие кристаллоподобные тельца позволили Аде Йонат предположить возможность кристаллизации рибосом в пробирке.
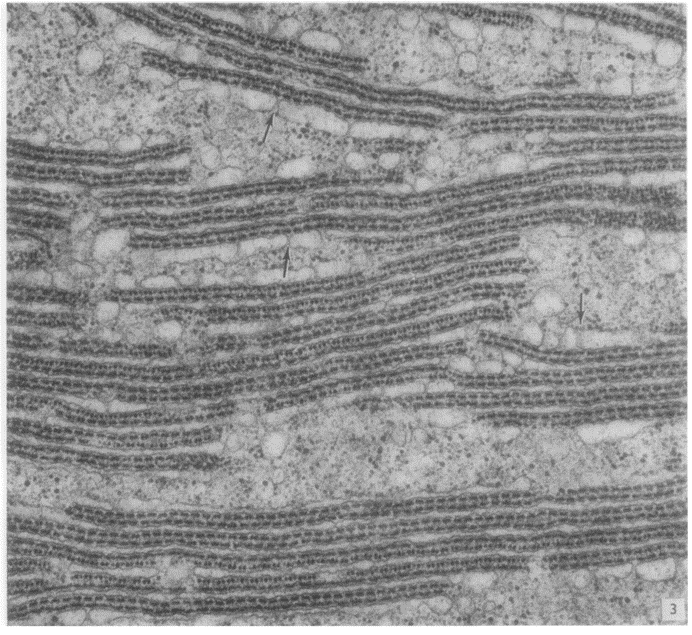
Рисунок 7. Этап процесса формирования рибосомного тельца в ооците ящерицы в ноябре. Везикулы, отмеченные стрелочками, как правило, принимают вытянутую форму, образуя цистерны с очень узким просветом; только там, где цистерны находятся на расстоянии 900 Å друг от друга, рибосомы организованы в пласты, в остальной части цитоплазмы они распределены хаотично.
К началу 1990-х гг. кристаллы Йонат уже имели вполне удовлетворительное качество, чтобы по ним установить положение каждого атома в структуре рибосом. Успехи Йонат вдохновили и других ученых-авантюристов, среди которых были Томас Стейц и Венкатраман Рамакришнан. Работа Рамакришнана раскрыла структуру малой субъединицы и объяснила, как рибосома достигает такой точности при чтении генетического кода. Оказывается, белковые машины обладают собственной «молекулярной линейкой», с помощью которой сравниваются расстояния между кодоном мРНК и антикодоном тРНК. Такая проверка обеспечивает почти идеальную точность — всего одна ошибка на 100 000 аминокислот. А большая субъединица, словно молекулярный станок, скрепляет аминокислоты между собой, образуя полипептидную цепь, да и еще с высокой скоростью — 20 звеньев в минуту! И увидеть этот процесс на промежуточной стадии очень непросто. Однако Томас Стейц нашел способ: он кристаллизовал большую субъединицу с аналогами аминокислот, и с помощью этих структур были найдены каталитические центры рибосомы и предложена схема процесса трансляции. В 2009 году Йонат, Рамакришнан и Стейц были удостоены Нобелевской премии. Исследования лауреатов позволяют понять, как простая нуклеотидная цепочка образует сложные живые системы. Эти знания легли в основу для разработки новых антибиотиков [11].
Механизм действия многих современных антибиотиков основан на блокировке ими активных центров рибосом. Но устойчивость бактерий к ним продолжает расти, и требуются новые антибиотики.
Любопытно, что воздействие антибиотиков на рибосому во многом схоже с механизмом работы героев нашей статьи — факторов гибернации. Было установлено, что RaiA и HPF перекрываются по участкам связывания с рядом антибиотиков, возможно, защищая тем самым бактерии от токсичности препаратов [12] (рис. 8). Это наблюдение поднимает вопрос о том, могут ли антибиотики, нацеленные на рибосомы, изменять работу факторов гибернации, и как их взаимодействия могут повлиять на способность бактерий выживать?
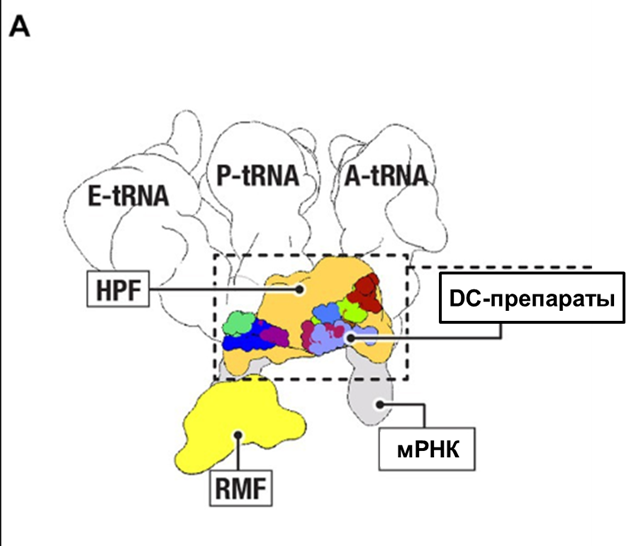
Рисунок 8. Сравнение сайтов связывания рибосом для факторов гибернации RMF и HPF, а также для тРНК (обозначенных как E, P и A), мРНК и антибиотиков (DC-препараты), нацеленных на рибосомы, которые связываются с декодирующим центром и каналом рибосомной мРНК.
До сих пор мы мало что знаем о том, как рибосома «просыпается»: как от нее диссоциируют факторы гибернации и как разделяются димеры. Единственное, что мы точно понимаем — чем дольше клетки остаются метаболически неактивными в отсутствие факторов гибернации, тем меньше вероятность того, что они восстановятся. Однако многие клетки могут годами находиться в состоянии покоя, и им критически важно уметь точно вводить рибосомы в «спячку» и выводить из этого состояния. Недавно была выдвинута гипотеза, которая пытается объяснить, как может работать такой механизм регуляции у бактерий. Как мы помним из предыдущей части статьи, белок HPF связывается с рибосомой так, что перекрывает канал для мРНК (рис. 4). Получается, что мРНК и HPF конкурируют за доступ к рибосоме — клетка балансирует между нормальной трансляцией и ее подавлением. Когда рост возобновляется или наступают благоприятные условия, клетка начинает синтезировать больше мРНК, которая «вытесняет» HPF из канала, снижая процесс димеризации и быстро возвращая рибосомы в рабочее состояние. Это и объясняет, почему в быстро растущих, т.е. транскрипционно активных клетках число димеров невелико — мРНК выигрывает в этой «дуэли» и не дает фактору гибернации блокировать синтез белка. Когда 100S рибосомы распадаются, их субъединицы сразу возвращаются в цикл трансляции, что избавляет клетку от дорогостоящего процесса сборки новых рибосом [9]. Процесс рибосомной гибернации напоминает о том, что в клетке нет ничего случайного: даже остановка ее белковых машин — это тщательно выверенная стратегия выживания в период кризиса.
Литература
- РНК у истоков жизни?;
- Jessica C. Bowman, Anton S. Petrov, Moran Frenkel-Pinter, Petar I. Penev, Loren Dean Williams. (2020). Root of the Tree: The Significance, Evolution, and Origins of the Ribosome. Chem. Rev.. 120, 4848-4878;
- Karla Helena-Bueno, Lewis I. Chan, Sergey V. Melnikov. (2024). Rippling life on a dormant planet: hibernation of ribosomes, RNA polymerases, and other essential enzymes. Front. Microbiol.. 15;
- A Wada, Y Yamazaki, N Fujita, A Ishihama. (1990). Structure and probable genetic location of a "ribosome modulation factor" associated with 100S ribosomes in stationary-phase Escherichia coli cells.. Proc. Natl. Acad. Sci. U.S.A.. 87, 2657-2661;
- Thomas Prossliner, Kristoffer Skovbo Winther, Michael Askvad Sørensen, Kenn Gerdes. (2018). Ribosome Hibernation. Annu. Rev. Genet.. 52, 321-348;
- Adam Ben-Shem, Nicolas Garreau de Loubresse, Sergey Melnikov, Lasse Jenner, Gulnara Yusupova, Marat Yusupov. (2011). The Structure of the Eukaryotic Ribosome at 3.0 Å Resolution. Science. 334, 1524-1529;
- Andreas M. Anger, Jean-Paul Armache, Otto Berninghausen, Michael Habeck, Marion Subklewe, et. al.. (2013). Structures of the human and Drosophila 80S ribosome. Nature. 497, 80-85;
- Karla Helena-Bueno, Mariia Yu. Rybak, Chinenye L. Ekemezie, Rudi Sullivan, Charlotte R. Brown, et. al.. (2024). A new family of bacterial ribosome hibernation factors. Nature. 626, 1125-1132;
- Heather A. Feaga, Jonathan Dworkin. (2021). Transcription regulates ribosome hibernation. Molecular Microbiology. 116, 663-673;
- C. Taddei. (1972). Ribosome arrangement during oogenesis of Lacerta sicula Raf. Experimental Cell Research. 70, 285-292;
- Белоксинтезирующая Нобелевская премия по химии (2009);
- Chinenye L. Ekemezie, Sergey V. Melnikov. (2024). Hibernating ribosomes as drug targets?. Front. Microbiol.. 15.







