
Российские ученые нашли новое семейство антибиотиков из группы липогликопептидов
28 июня 2021
Российские ученые нашли новое семейство антибиотиков из группы липогликопептидов
- 870
- 0
- 0
Противостояние бактерий и людей, вооруженных антибиотиками, вряд ли когда-то закончится. Но иногда мы все-таки берем вверх. Российские ученые описали новое семейство антибиотиков липоглипопептидного типа.
-
Автор
-
Редактор
В эпоху стремительно распространяющейся антибиотикорезистентности ученые всеми силами пытаются найти новые антибиотики, чтобы расширить арсенал антиинфекционных препаратов. Большой коллектив российских исследователей недавно сообщил об открытии нового семейства антибиотиков липогликопептидной природы, которые синтезирует штамм бактерии Streptomyces. Свойства двух веществ из этой группы, гауземицинов A и B, были детально изучены. Крайне необычная химическая структура позволяет надеяться на нетипичный механизм действия этих антибиотиков.
Как только не пытаются сейчас ученые создать новые антибиотики: ищут их в разнообразных природных источниках, химически модифицируют уже известные вещества, разрабатывают ингибиторы систем, обеспечивающих защиту от антибиотиков, и даже создают полностью синтетические антибиотики с помощью машинного обучения . Первый путь чаще всего заканчивается неудачей, потому что антимикробные вещества, выделенные из природных субстратов, как правило, оказываются либо уже известными антибиотиками, либо их модификациями. Но из любого правила есть исключение.
Ознакомиться с другими материалами «Биомолекулы», посвященными антибиотикам, вы можете в тематической подборке «Антибиотики».
Бульон, который получается в результате брожения, осуществляемого бактерией Streptomyces sp. INA-Ac-5812, по сути, представляет собой целый коктейль пептидных антибиотиков, как уже сообщалось в предыдущих исследованиях [1]. Вообще, антибиотики пептидной природы уже давно вошли в клиническую практику. На данный момент известны пептидные антибиотики с существенно различающимися механизмами действия. Пептидный антибиотик ванкомицин врачи используют уже много лет, и бактерии, разумеется, нашли способ, как увильнуть от его действия. Но сейчас продаются его полусинтетические аналоги (оритаванцин, телаванцин, цефилаванцин), которые c переменным успехом применяются в клинической практике. Некоторые антибиотики, представляющие собой циклические пептиды, такие как колистин и даптомицин, используются как антибиотики последнего выбора при особо опасных инфекциях, когда все прочие антибиотики оказываются неэффективными и речь идет о жизни или смерти пациента.
Авторы обсуждаемой статьи сумели из смеси антибиотиков, вырабатываемой Streptomyces sp. INA-Ac-5812, очистить ранее неизвестные липогликопептидные антибиотики, которые получили название гауземицины A и B [2]. Первоначально они были описаны как способные к флуоресценции вещества с широким спектром антибактериального действия. Как оказалось впоследствии, флуоресцентные свойства гауземицинов обусловлены наличием в них хлорированной аминокислоты 4-хлоро-L-кинуренина [3]. Ранее эту аминокислоту находили только у представителей одного семейства антибиотиков — таромицинов [4].
Вообще, структура гауземицинов оказалась удивительно необычной. Они представляют собой макроциклические пептиды из 14 аминокислот, в том числе непротеиногенных и D-аминокислот (в частности, в их состав входит D-лейцин в седьмой позиции).
Некоторые структурные мотивы, найденные в гауземицинах, чрезвычайно редки для веществ природного происхождения. Например, в природных пептидах до сих пор не находили тирозина, гликозилированного пентозой. Более того, в гауземицинах тирозин гликозилирован не чем-нибудь, а пентозой, известной как арабиноза, которая в природных гликопептидах почти не встречается. Так что гликозилирование тирозина арабинозой можно считать уникальной чертой гауземицинов среди всех веществ естественного происхождения.
Кроме того, в состав гауземицинов входит β-гидроксиглутаминовая кислота, редко встречающаяся в природных веществах, а также 3-амино-4-гидроксифенилмасляная кислота и Nε-(β-аланиноил)орнитин, которые до этого также не находили в природных соединениях. Гауземицины A и B отличаются друг от друга радикалом, прикрепленным ко второму остатку орнитина. У гауземицина A аминогруппа орнитина остается свободной, а у гауземицина B ацилирована β-аланином (рис. 1).
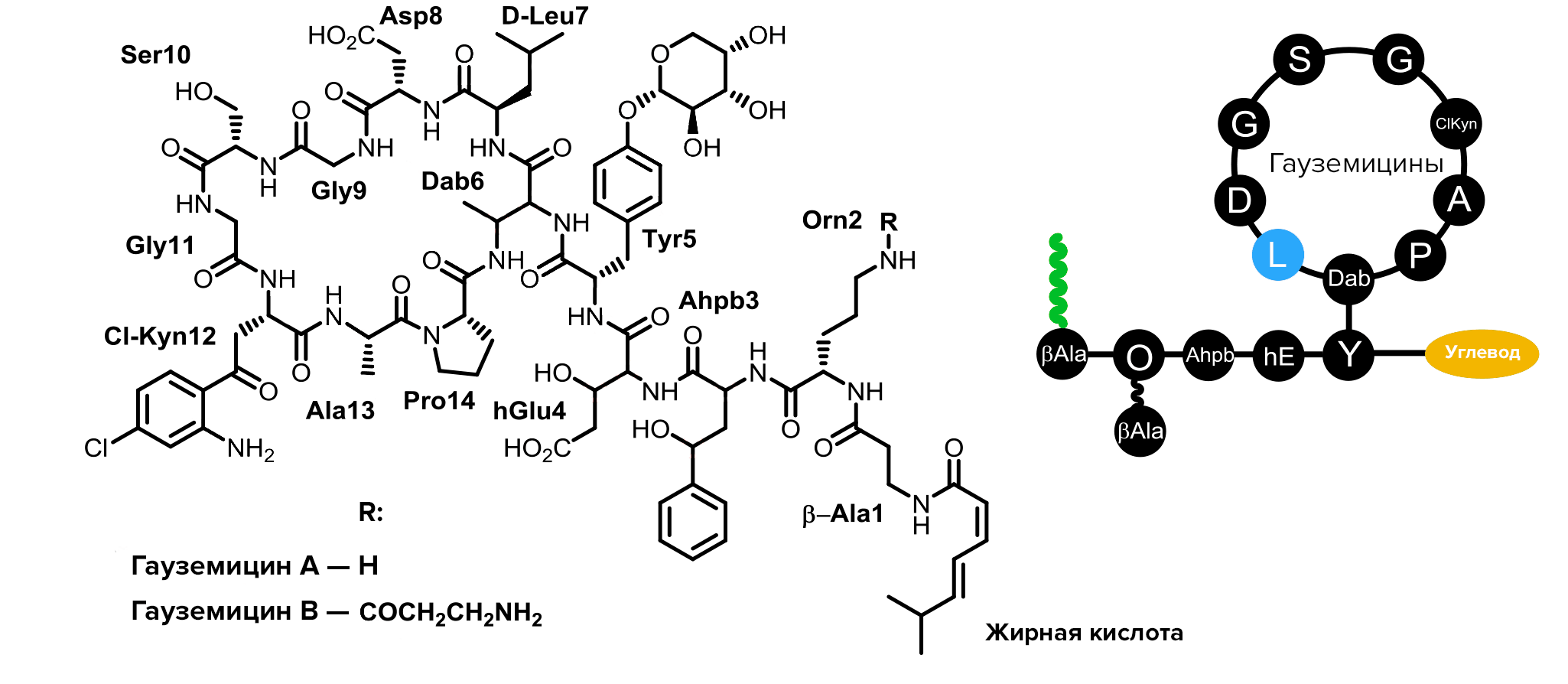
Рисунок 1. Структурные формулы и схема строения гауземицинов A и B
[2], рисунок адаптирован
Как же синтезируется столь сложная молекула? Авторы работы нашли большой биосинтетический кластер генов, состоящий из 68 открытых рамок считывания, который обеспечивает синтез гауземицинов. Среди этих рамок считывания есть синтетаза нерибосомных пептидов, содержащая 14 модулей, ответственных за включение в молекулы фрагментов с определенной аминокислотной последовательностью. Интерес представляло происхождение редких аминокислот в составе гауземицинов. Известно, что 4-хлор-L-кинуренин синтезируется из триптофана [5], а изучение биосинтеза гауземицинов позволило доказать, что ранее не известная 3-амино-4-гидроксифенилмасляная кислота синтезируется их фенилаланина. Для доказательства использовали элегантный метод: штамм-продуцент кормили фторированным фенилаланином и наблюдали включение атома фтора в состав этой уникальной аминокислоты.
Чем же гауземицины могут помочь в борьбе с антибиотикорезистентностью? Благодаря своей чрезвычайно необычной структуре они обладают рядом свойств, выделяющих их среди прочих липопептидных антибиотиков. Гауземицины не имеют классического участка связывания иона кальция, чем отличаются от анионных липопептидов, включая недавно описанные малацидины и кадазиды.
Исследователи показали, что гауземицины обладают выраженной активностью в отношении грамположительных бактерий, в том числе метициллинрезистентного золотистого стафилококка (MRSA) — одного из самых опасных штаммов бактерий, обладающего множественной лекарственной устойчивостью. А вот против энтерококков и палочки Коха (Mycobacterium tuberculosis) гауземицины оказались бессильны.
Как же гауземицины работают? Выяснилось, что они вызывают лизис клеток, причем лишь у некоторых клеток были видны повреждения мембраны, а от большинства вообще ничего не осталось. Кроме того, гауземицины не воздействуют на синтез клеточной стенки и не вызывают накопление ее предшественников.
Чтобы проверить, что гауземицины действительно вызывают постепенную пермеабилизацию мембраны, клетки Bacillus subtilis подвергли действию гауземицинов и окрасили красителем SYTOX, который красит ДНК в зеленый цвет и не проникает сквозь целые мембраны, и красителем FM 4-64, окрашивающим мембраны. Опыт подтвердил, что гауземицины повреждают мембраны и через час вызывают гибель клеток. Так что по механизму действия гауземицины близки к антибиотику даптомицину, который, как и гауземицины, медленно убивает клетки, в отличие от антибиотика низина, который вызывает очень быструю гибель бактерий (рис. 2).
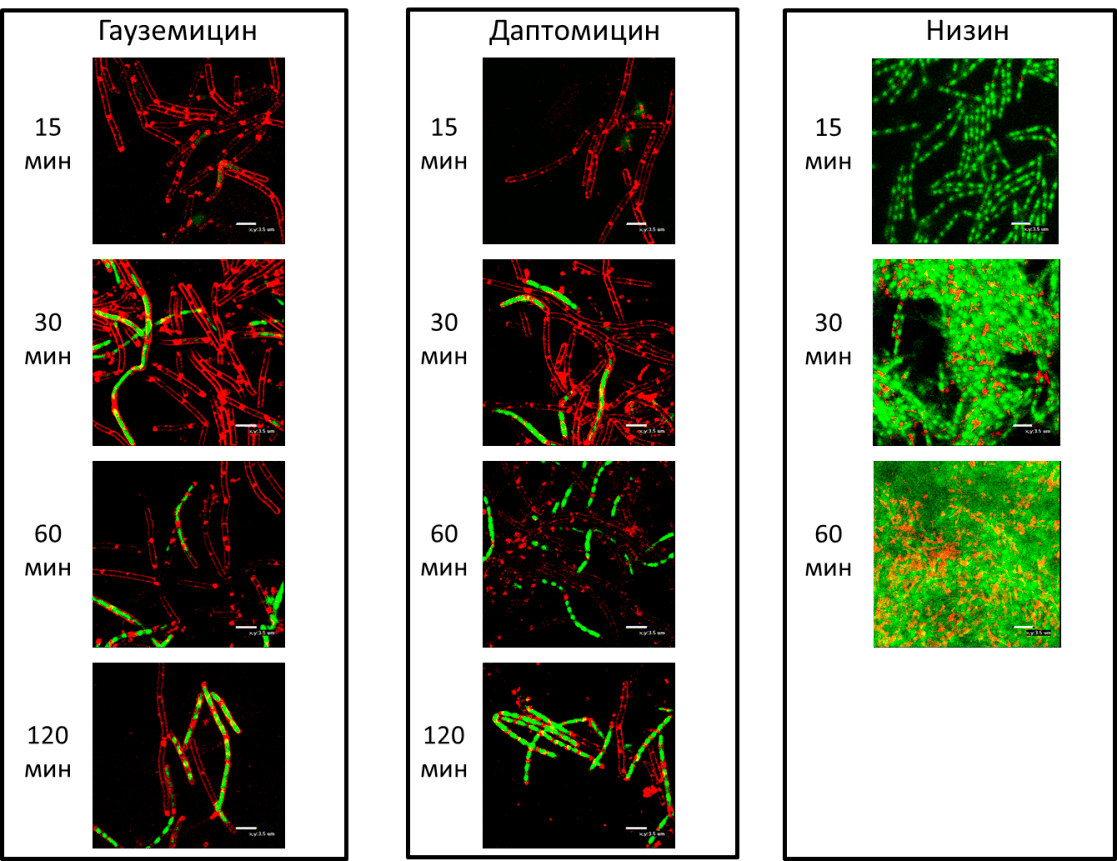
Рисунок 2. Гауземицины и даптомицин вызывают гибель клеток за счет формирования в них пор. Можно видеть, как постепенно зеленый краситель проникает в клетки и окрашивает их ДНК. В качестве контроля использовали антибиотик низин, который сразу же вызывает образование пор в клеточных мембранах и приводит к полной гибели культуры бактерий.
[2], рисунок с изменениями
Почему же гауземицины имеют такой узкий спектр действия? Многолетние исследования механизма действия даптомицина показали, что даптомицин в присутствии ионов кальция формирует комплекс с липидом фосфатидилглицерином и некоторыми предшественниками клеточной стенки, в результате чего происходит делокализация аппарата биосинтеза клеточной стенки. Даптомицин вполне эффективен и против энтерококков, мембраны которых содержат много фосфатидилглицерина, а гауземицины, как мы помним, на энтерококков не действуют. Так каков же механизм действия гауземицинов? Почему спектр бактерий, на которые они действуют, так узок? Для ответов на эти вопросы необходимы дальнейшие исследования этих необычных антибиотиков.
Мы поговорили с Верой Алферовой, сотрудницей НИИ по изысканию новых антибиотиков имени Г.Ф. Гаузе и одним из первых авторов исследования, о некоторых аспектах действия гауземицинов и их возможных перспективах в клинической практике.
Е. М.: Почему все-таки гауземицины не действуют на грамотрицательных бактерий? Ведь они же могут, теоретически, нарушать целостность и внешней мембраны, что вряд ли пойдет на пользу бактериям.
В. А.: Механизм действия гауземицина не ограничивается порообразованием. По текущим данным он, как и даптомицин, реализует сложный механизм действия, требующий выполнения ряда условий. Более конкретно о мишени пока говорить рано, но для даптомицина ключевую роль играет липидный состав мембраны, весьма вероятно, для гауземицина специфичность обусловлена тем же принципом. При этом внешняя мембрана грамотрицательных бактерий сильно отличается от мембран грамположительных бактерий, в том числе и по липидному составу. Спектр активности гауземицина узок даже среди грамположительных бактерий, по всей видимости, ему не удается ни повредить внешнюю мембрану грамотрицательных бактерий, ни преодолеть ее.
Е. М.: Каковы перспективы использования гауземицинов в клинической практике?
В. А.: Маловероятно, что сам по себе гауземицин будет использоваться в клинической практике, так как он представляет собой аналог уже прошедшего все стадии испытаний даптомицина. На текущий момент мы видим, что его спектр активности уже, чем у применяемого антибиотика. Он может представлять интерес только как отечественный аналог известного препарата, однако его внедрение требует колоссальных финансовых затрат. Гауземицин интересен в первую очередь с научной точки зрения, так как понимание механизма его действия прольет свет и на даптомицин, а также позволит с помощью химической модификации получать полусинтетические производные с оптимизированной структурой и более востребованными в современной клинической практике свойствами.
Литература
- O. A. Lapchinskaya, G. S. Katrukha, E. G. Gladkikh, V. V. Kulyaeva, P. V. Coodan, et. al.. (2016). Investigation of the complex antibiotic INA-5812. Russ J Bioorg Chem. 42, 664-671;
- Anton P. Tyurin, Vera A. Alferova, Alexander S. Paramonov, Maxim V. Shuvalov, Gulnara K. Kudryakova, et. al.. (2021). Gausemycins A,B: Cyclic Lipoglycopeptides from Streptomyces sp.**. Angew. Chem. Int. Ed.;
- Vera A. Alferova, Maxim V. Shuvalov, Taisiya A. Suchkova, Gleb V. Proskurin, Ilya O. Aparin, et. al.. (2018). 4-Chloro-l-kynurenine as fluorescent amino acid in natural peptides. Amino Acids. 50, 1697-1705;
- Kirk A Reynolds, Hanna Luhavaya, Jie Li, Samira Dahesh, Victor Nizet, et. al.. (2018). Isolation and structure elucidation of lipopeptide antibiotic taromycin B from the activated taromycin biosynthetic gene cluster. J Antibiot. 71, 333-338;
- Hanna Luhavaya, Renata Sigrist, Jonathan R. Chekan, Shaun M. K. McKinnie, Bradley S. Moore. (2019). Biosynthesis of l ‐4‐Chlorokynurenine, an Antidepressant Prodrug and a Non‐Proteinogenic Amino Acid Found in Lipopeptide Antibiotics. Angew. Chem. Int. Ed.. 58, 8394-8399.






