
SciNat за март 2024 #1: эпигенетическое редактирование генома и новое лекарство от ВИЧ
03 марта 2024
SciNat за март 2024 #1: эпигенетическое редактирование генома и новое лекарство от ВИЧ
- 871
- 1
- 1
На обложке нового выпуска журнала Nature изображены индийские макаки (Macaca radiata).
Дело в том, что одним из наиболее заметных изменений в эволюционном пути обезьян и людей является потеря хвоста — признака, который отличает человека и других человекообразных обезьян. Однако генетические изменения, лежащие в основе этого признака, остаются неясными. В выпуске этой недели Бо Ся, Джеф Буке, Итай Янаи и их коллеги рассказывают, что лишь один-единственный транспозон мог способствовать потере хвоста у обезьян и людей. Исследователи обнаружили вставку этого транспозона в некодирующую часть гена TBXT, играющего важную роль в развитии хвоста во время эмбриогенеза. В итоге такая вставка приводит к альтернативному сплайсингу гена, и когда ДНК транскрибируется в РНК, этот сплайсинг удаляет часть гена, кодирующую белок. Авторы показывают, что этот механизм может способствовать потере хвоста. — On the genetic basis of tail-loss evolution in humans and apes.
-
Автор
-
Редактор
Первый мартовский выпуск SciNat в 2024 году принес свежие вести из мира науки. Из нового дайджеста вы узнаете о том, почему болит мочевой пузырь и как клетки эндотелия вызывают фиброз. Новая вакцина от ВИЧ заставляет вирус выйти на свет. В Африке разгорается лихорадка Ласса, а биофизики научились еще точнее измерять термодинамические изменения в живых клетках. Ученые-нейробиологи стали лучше разбираться в механизме действия синаптического белка. Новым трендом в генной терапии заболеваний становятся эпигенетические вмешательства без изменения последовательности генома.
Иммунология
Разрастание нервов вызывает постоянную боль после рецидивирующей инфекции мочевого пузыря
Инфекции мочевыводящих путей (ИМП) составляют почти 25% случаев всех инфекционных заболеваний у женщин. Многие из них являются рецидивирующими (рИМП), при этом пациенты часто испытывают хроническую боль в области таза и страдают от частого мочеиспускания, несмотря на исчезновение бактерий после приема антибиотиков. Чтобы выяснить причину этих независимых от бактерий симптомов, ученые исследовали мочевой пузырь пациентов с рИМП. Они заметили значительное увеличение содержания нейропептидов в собственной пластинке слизистой мочевого пузыря и нашли там признаки усиления ноцицептивной активности. У мышей с индуцированной рИМП исследователи наблюдали прорастание сенсорных нервов, которое было связано с фактором роста нервов (NGF), продуцируемым рекрутированными моноцитами и тканевыми тучными клетками. Обработка больных мышей NGF-нейтрализующим антителом предотвращала прорастание нейронов и облегчала чувствительность таза, тогда как введение нативного NGF в мочевой пузырь контрольных мышей имитировало прорастание нервов и приводило к болевому поведению. Активация нервов, боль и частота мочеиспускания были связаны с наличием проксимальных тучных клеток. Выводы были сделаны на основе того, что дефицит тучных клеток или лечение антагонистами рецепторов, которые реагируют на продукты тучных клеток, были терапевтически эффективными. Таким образом, эти интереснейшие результаты показывают, что прорастание сенсорных нейронов, вызванное фактором NGF, в мочевом пузыре в сочетании с хронической активацией тучных клеток является основным механизмом, который приводит к независимой от бактерий боли и дефектам мочеиспускания, возникающие у пациентов с рИМП. — Recurrent infections drive persistent bladder dysfunction and pain via sensory nerve sprouting and mast cell activity.
Эндотелиальные клетки вызывают фиброз органов у мышей, индуцируя экспрессию транскрипционного фактора SOX9
Хроническое заболевание часто характеризуется фиброзом органов, но неясно, как конкретные типы клеток способствуют фиброзу. Новейшее исследование журнала Science показало, что эндотелиальные клетки являются важными факторами фиброза на моделях сердечной недостаточности, легочного фиброза и фиброза печени. Повышение регуляции транскрипционного фактора SOX9, особенно в эндотелиальных клетках, было связано с фиброзом этих органов на мышиных моделях. Модели включали систолическую сердечную недостаточность, вызванную перегрузкой с высоким давлением, диастолическую сердечную недостаточность, вызванную диетой с высоким содержанием жиров и ингибированием синтазы оксида азота, фиброз легких, вызванный лечением блеомицином, и фиброз печени из-за диеты с дефицитом холина. Чтобы проверить, была ли индукция SOX9 достаточной, чтобы вызвать заболевание, ученые создали линию мышей со специфической для эндотелиальных клеток сверхэкспрессией SOX9 , которая способствовала фиброзу во многих органах и приводила к появлению признаков сердечной недостаточности. Эндотелиальная делеция SOX9, напротив, предотвращала фиброз и дисфункцию органов в двух мышиных моделях сердечной недостаточности, а также в мышиных моделях фиброза легких и печени.
Массовое и single-cell секвенирование РНК эндотелиальных клеток мыши в нескольких сосудистых руслах показало, что SOX9 индуцирует внеклеточный матрикс, фактор роста и экспрессию провоспалительных генов, что приводит к заполнению матрикса эндотелиальными клетками. Более того, эндотелиальные клетки мыши активировали соседние фибробласты, которые затем мигрировали и откладывались в матриксе в ответ на SOX9. Этот процесс, частично опосредованный секретируемым фактором роста CCN2, является прямой мишенью SOX9. Как уже было сказано, специфичная для эндотелиальных клеток делеция SOX9 обращала эти изменения вспять. Полученные данные предполагают роль эндотелиального SOX9 как фактора, способствующего фиброзу в различных органах мышей и подразумевают, что эндотелиальные клетки являются важными регуляторами фиброза. Таким образом, у нас появилась новая мишень для лечения этого патологического состояния. — Endothelial cells drive organ fibrosis in mice by inducing expression of the transcription factor SOX9.
Индукция длительной ремиссии с помощью двойной иммунотерапии у SHIV-инфицированных макак, прошедших АРТ
Уничтожение вирусных резервуаров является главным препятствием на пути разработки клинического лечения ВИЧ-инфекции 1 типа. Скрытый вирусный резервуар является последним бастионом ВИЧ перед его полным излечением. Его трудно уничтожить, так как он невидим для иммунитета: клетки резервуара содержат вирус, который находится в неактивном состоянии, поскольку его поверхность не содержит тех белков, которые могли бы показать наличие патогена.
Исследования показали, что большую часть резервуара составляют Т-клетки памяти — часть иммунной системы, которая сохраняет информацию о предыдущих инфекциях. Эти клетки могут оставаться в организме в спящем состоянии длительное время, готовые пробудиться при следующей инфекции тем же вирусом. Таким образом, они обеспечивают идеальное убежище для ВИЧ.
В новом исследовании ученые продемонстрировали, что введение вакцины Анктива (N-803) и антител широкого нейтрализующего действия (bNAbs) приводило к устойчивому вирусному контролю после прекращения антиретровирусной терапии (АРТ) у макак-резус, инфицированных химерной версией штамма SHIV-AD8, ранее подавленной АРТ. Лечение макак вакциной, состоящей из N-803 и bNAbs, вызывало иммунную активацию и временную виремию, но ограничивалось лишь снижением клеточных резервуаров SHIV. После прекращения АРТ у всех животных произошел рецидив вируса, за которым последовал длительный контроль заболевания примерно у 70% всех макак, получавших лекарственную комбинацию N-803+bNAb. Вирусный контроль коррелировал с перепрограммированием CD8+ Т-клеток за счет синергии N-803+bNAb. Таким образом, полное уничтожение репликационно-компетентного вирусного резервуара, вероятно, не является обязательным условием для индукции устойчивой ремиссии после прекращения АРТ. — Induction of durable remission by dual immunotherapy in SHIV-infected ART-suppressed macaques, «Биомолекула»: «Когда появляется иммунологическая память?», «ВИЧ/СПИД».
Вирусология
Долго игнорируемая лихорадка Ласса стремительно набирает обороты в Западной Африке
По прогнозам, лихорадка Ласса убивает гораздо больше людей, чем Эбола — 10 000 и более в год, хотя никто не знает наверняка. Несмотря на то, что около 80% инфекций, вызванных вирусом Ласса, протекают в легкой форме или бессимптомно, от 15% до 20% случаев тяжелого заболевания заканчиваются смертельным исходом. Однако в отдельных регионах и в зависимости от штамма процент смертности может достигать 70%.
В 1969 году две медсестры-миссионерки в отдаленной деревне Ласса в штате Борно на северо-востоке Нигерии заболели загадочным лихорадочным заболеванием. Обе в итоге погибли. Третья медсестра, которую звали Пенни Пиннео, заразилась, пока ухаживала за своими погибшими коллегами. С лихорадкой, ознобом, язвами в горле и сильной слабостью, ее эвакуировали в пресвитерианскую больницу Нью-Йорка. Пережив тяжелый рецидив, Пенни пошла на поправку и смогла пережить болезнь.
Вирусолог Хорди Казальс-Ариет и его команда из исследовательского отдела арбовирусов Йельского университета проанализировали образцы крови медсестер в поисках этого нового вируса. В итоге они выделили вирус с одноцепочечной РНК, который отнесли к семейству аренавирусов, и назвали его в честь деревни, где он был обнаружен. Однако Казальс-Ариет заразился во время работы с образцами и чуть не умер; его спасло только рискованное переливание антител из крови Пиннео. Когда лаборант Казальс-Ариет, Хуан Роман, также заразился и умер, Йельский университет немедленно прекратил работу с живым вирусом и перенес его в «горячую» лабораторию, расположенную в Центрах по контролю и профилактике заболеваний США (CDC) в Атланте.
Переносчиком оказалась многососковая мышь Mastomys natalensis, названная так из-за длинных рядов сосков для выкармливания своего большого помета. Повсеместно распространенная в странах Африки к югу от Сахары, M. natalensis, часто называемая обыкновенной африканской крысой, является типичным обитателем африканских деревень. Она устраивает норы в домах и выходит из них в поисках еды, особенно в засушливый сезон, когда фермеры сжигают поля после сбора урожая. Вирус не мог выбрать лучшего хозяина. У плодовитых производителей самки рожают от 10 до 12 детенышей каждые 45 дней, а инфицированная самка передает вирус своему потомству. Сами мыши не болеют вирусом, но считается, что они переносят его и выделяют до конца своей жизни.

В банках специализированной клинической больницы Ируа в Нигерии хранятся сохранившиеся исторические образцы рода Mastomys, в том числе M. natalensis, основного хозяина вируса Ласса.
автор фото: Апочи Овойчо — фотограф-документалист, педагог и продюсер из Абуджи, Нигерия.
Прошлый год был худшим за всю историю наблюдений по лихорадке Ласса в Нигерии: было зарегистрировано 9155 подозреваемых случаев, 1270 подтвержденных случаев и 227 случаев смерти. На этот раз госпитали оказались лучше подготовлены, чем в 2018 году, но мест для всех больных все равно не хватает. Электроснабжение часто нестабильное, и порой не хватает чистого белья и даже мыла. Уже сейчас растущее количество зараженных говорит о том, что 2024 год будет еще хуже.
Никто не ожидает, что вирус Ласса вызовет глобальную пандемию — в отличие от острых респираторных вирусов, таких как SARS-CoV-2 или гриппа, которые легко передаются от одного человека к другому. Но для тех, кто изучает болезнь и лечит ее жертв, устойчивое развитие заболеваемости вызывает большую тревогу. «Лихорадка Ласса уже распространилась по всей Западной Африке», — говорит Сильванус Окогбенин. «На самом деле, это уже достаточно для объявления пандемии в рамках континента». — A deadly viral illness is exploding in West Africa. Researchers are scrambling to figure out why, «Биомолекула»: «Смертельная зараза: за что мы благодарны лихорадке Эбола и при чем тут „Спутник V“».
Нейробиология
Механизм действия синаптического белка подвергается сомнению
Синаптический белок, активирующий гуанозинтрифосфатазу Ras/Rap (GTPase) (SynGAP), играет существенную, хотя и пока неуловимую роль в синаптической функции. Данный синаптический белок привлек значительное внимание ученых благодаря своей ключевой роли в модуляции синаптической передачи, опосредованной возбуждающим нейромедиатором глутаматом и развитию нейронов, а также потому, что функциональные мутации в гене SYNGAP1 составляют до 1% всех генетически обусловленных умственных нарушений.
SynGAP состоит из двух основных функциональных доменов: домена GAP и C-концевого домена (CTD). Домен GAP отрицательно регулирует передачу сигналов малых G-белков, что может иметь решающее значение для зависимых от активности изменений синаптической силы, тогда как CTD связывается с белком постсинаптической плотности 95 (PSD95), но функциональные последствия этого связывания неясны. В новом исследовании журнала Science ученые показывают, что, вопреки распространенному мнению, активность домена GAP совершенно необязательна для многих функций целого белка SynGAP, и что CTD куда более важен для пластичности синаптической передачи. Это говорит о том, что потенциальные терапевтические средства, нацеленные на домен GAP, следует перенацелить на C-концевой домен (CDT). — Shifting rules in a brain disorder.
Биофизика
Термодинамические исследования жизни
Биологическая активность живой клетки выражается в отдаче тепла окружающей среде. Однако количественная оценка тепла и клеточной активности на наноуровне оказалась весьма непростой задачей. Недавнее развитие стохастической термодинамики открыло нам доступ к измерению энергетики и эффективности таких микроскопических систем, как клетки. Это стало возможным благодаря применению стохастической теории и экспериментальных методов высокого разрешения. В новейшем исследовании биофизики сообщают о термодинамическом ограничении, применимом к неравновесным стационарным колебаниям, и применяют его для определения тепла, рассеиваемого живыми клетками на наноуровне. Их анализ показывает неравномерное рассеивание тепла по экваториальному контуру эритроцитов. Этот подход может привести к более точным измерениям энергетического обмена клеток. Подход даст глобальное понимание энергоэффективности всей живой материи на Земле, от отдельных клеток до целых организмов. — Thermodynamic probes of life, «Биомолекула»: «Биоэнергетика».
Генетика
Эпигенетическое редактирование снижает уровень холестерина у мышей
Согласно новейшему исследованию на мышах, опубликованному в журнале Nature, другая хорошо известная альтернатива редактированию генома с CRISPR/Cas9 поможет снизить активность гена, влияющего на уровень холестерина. Вмешательство происходит без изменения последовательности ДНК — причем делает это на длительный период.
Ученые добились этого эффекта, изменив эпигеном каждого исследуемого животного. Эпигеном представляет собой набор химических меток, связанных с ДНК и влияющих на активность генов. После вмешательства активность целевого гена падала и оставалась низкой в течение 11 месяцев, пока мыши были под наблюдением.
Одобрение в 2023 году первой терапии редактирования генома, основанной на системе редактирования CRISPR-Cas9, положило начало новой форме медицины, которая предполагает внесение целевых изменений в последовательности ДНК. Однако новые результаты, опубликованные 28 февраля в журнале Nature, подкрепляют аргументы в пользу редактирования эпигенома для лечения определенных заболеваний, тем самым избегая некоторых рисков, связанных с разрывом и необратимым изменением нитей ДНК.
«Это только начало эпохи отказа от разрезания ДНК», — говорит Генриетта О’Гин, эпигенетик из Калифорнийского университета в Дэвисе. «Это поможет изменить экспрессию генов, которые участвуют в заболеваниях — и потенциально обеспечить лечение болезни — но без изменения ДНК».
По мере того, как клетки приобретают новую идентичность в ходе развития, структура химических меток на их ДНК часто меняется. Эти эпигенетические изменения могут заставить клетку вести себя как, например, клетка печени, а не как клетка мозга.
После более чем десятилетних усилий ученые придумали, как модифицировать инструменты редактирования генома, чтобы изменить некоторые эпигенетические метки. Это позволяет добавлять к ДНК метильные группы в определенных местах, например, чтобы выключить ген, или, наоборот, удалить метильные группы из нужного места в геноме, чтобы включить ген.
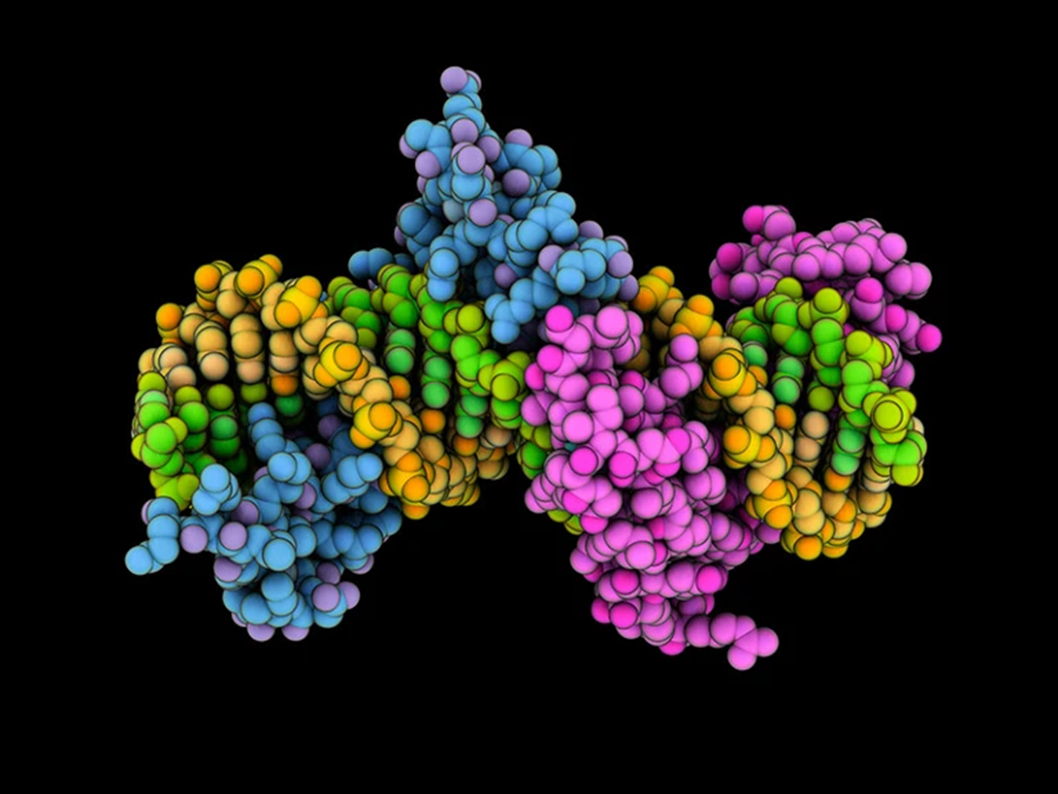
Белок с цинковыми пальцами (выделен синим и пурпурным цветом) в комплексе с ДНК (окрашен в желтый и зеленый цвета).
«Возможность применения эпигенетического редактирования в клинических условиях изначальна была неясной», — говорит эпигенетик Марианна Ротс из Университетского медицинского центра Гронингена в Нидерландах. По ее словам, исследователи были обеспокоены тем, насколько конкретным и эффективным будет этот подход и как долго продлится его эффект.
Чтобы ответить на эти вопросы, Анджело Ломбардо, исследователь генной терапии из Научного института Сан-Раффаэле в Милане, Италия, и его коллеги использовали молекулы, называемые белками «цинковых пальцев», которые, как и система CRISPR-Cas9, могут быть предназначены для связывания с определенными последовательностями в геноме. Команда разработала белок «цинковых пальцев», который может связываться с геном PCSK9. Данный ген является мишенью нескольких существующих методов лечения высокого уровня холестерина. Затем авторы объединили свои белки «цинковых пальцев» с фрагментами трех белков, участвующих в присоединении метильных групп к ДНК. Этот коктейль фрагментов был взят из набора белков, которые действуют во время эмбрионального развития, с добавлением метильных групп, чтобы гарантировать, что вирусные последовательности, скрывающиеся в геноме данной конструкции будут замалчиваться на протяжении всей жизни.
Уровень холестерина у животных снизился в течение месяца после лечения. Уровни белка PCSK9 у них также упали и оставались низкими в течение 330 дней, вплоть до самого конца наблюдений.
Эти ошеломительные результаты усилят и без того растущий интерес к эпигенетическому редактированию. По словам ученых, уже более десяти компаний занимаются разработкой методов эпигенетического редактирования. Некоторые сообщили о долгосрочном эффекте такого редактирования у обезьян, но еще не опубликовали свои результаты в рецензируемых журналах. — ‘Epigenetic’ editing cuts cholesterol in mice, «Биомолекула»: «Цинковые пальцы смерти».





