
SciNat за октябрь 2025 #3: свинец против неандертальцев, редактирование генома митохондрий и мышата от двух самцов
19 октября 2025
SciNat за октябрь 2025 #3: свинец против неандертальцев, редактирование генома митохондрий и мышата от двух самцов
- 154
- 0
- 1
Голодовка для раковых клеток. Нейробластома — высоколетальная форма рака, которая часто проявляется в детском возрасте и развивается в периферической нервной системе. Рост опухоли стимулируется биосинтезом полиаминов. Препарат дифторметилорнитин, ингибирующий биосинтез полиаминов, был одобрен в конце 2023 года для лечения нейробластомы. На обложке выпуска Nature представлена клетка нейробластомы в процессе метаболизма полиаминов. Новое исследование, которое послужило поводом для вынесения на обложку, обнаруживает интересные взаимосвязи. Исследование показало, что определенные ограничения в питании могут значительно усилить благотворное влияние вышеупомянутого препарата на мышей с нейробластомой. Исследователи обнаружили, что диета, исключающая аминокислоты пролин и аргинин, снижала количество орнитина, предшественника полиамина, доступного для синтеза раковым клеткам. Это, в свою очередь, усиливало истощение полиамина препаратом дифторметилорнитином, что перепрограммировало рост опухоли и повышало выживаемость мышей. — Reprogramming neuroblastoma by diet-enhanced polyamine depletion.
-
Автор
-
Редактор
Из нового выпуска дайджеста SciNat вы узнаете об изменении биоразнообразия рыб, а также о том, как свинец, возможно, погубил социальные связи у древних гоминидов. Новая система поиска для геномных баз данных упрощает жизнь, а нейробиологи узнали больше о нейромедиации. Также исследователи смогли подобрать ключик к редактированию митохондриального генома, а японские ученые продвинулись в лечении бесплодия и получении искусственных половых клеток in vitro. Теперь дети от однополых родителей — это реальность в обозримом будущем, как подтверждают эксперименты на мышах.
Зоология
Музейные образцы рыб, собранные во время морской экспедиции 1907 года, демонстрируют потерю генетического разнообразия на Филиппинах за последние 100 лет
В октябре 1907 года корабль ВМС США «Альбатрос» вышел из Сан-Франциско и направился на запад, к Филиппинам. 61-метровое судно, эксплуатируемое Комиссией по рыболовству США, стало первым в мире судном, специально построенным для научных исследований, и эта экспедиция стала его самой продолжительной. За три года исследователи собрали около 79 000 экземпляров рыб в заливах и на рифах Филиппин, задокументировав 117 новых видов. Образцы рыб хранились в банках с ромом — доступным алкоголем, более дешевым, чем чистый спирт.

Образцы рыб 1907 года, законсервированные на борту USS Albatross в роме.
Сейчас группа экологов и генетиков изучает эти образцы, чтобы выяснить, как изменилось морское биоразнообразие Филиппин после столетия роста объемов рыболовства и загрязнения океана. Сравнивая ДНК исторических особей с ДНК современных популяций рыб, группа обнаружила, что популяция рыб не только стала реже, но и их генетическое разнообразие сократилось на 4–6% у трех репрезентативных видов. «Это вызывает беспокойство», — говорит соруководитель проекта Малин Пински из Калифорнийского университета в Санта-Крузе, поскольку «... генетическое разнообразие создает основу для адаптации к новым условиям. Сокращение генетического разнообразия означает снижение способности адаптироваться к текущим и будущим изменениям океана».
Другое исследование выявило аналогичную закономерность для рифового кардинала (Taeniamia zosterophor). В статье, опубликованной в прошлом месяце в журнале The American Naturalist, Кайра Фиц, бывшая аспирантка Ратгерского университета, и ее коллеги сообщают, что генетическое разнообразие этого вида сократилось на 4% в проливе Себу — месте, где наблюдается сильный рыболовный прессинг, — но не на более удаленном рифе.
Сокращение численности превышает показатели, обычно наблюдаемые для видов умеренного климата. В метаанализе 140 экономически ценных видов, таких как треска, проведенном в 2014 году, обнаружили потерю разнообразия в среднем на 2%. По словам Нины Овергард Теркилдсен, специалиста по эволюционной генетике из Корнеллского университета, тот факт, что резкое сокращение численности было зафиксировано в тропическом архипелаге, не является чем-то удивительным. Прибрежные и рифовые рыбы, как правило, изначально имеют меньшие популяции, поскольку их ареалы обитания более неоднородны, а распространение зачастую более ограничено; поэтому, когда численность популяции становится опасно низкой, вероятность потери редких аллелей из генофонда возрастает. — DNA from rum-soaked fishes chronicles century of environmental change, Preservation of genetic diversity and selection over a century in a coral reef fish (Taeniamia zosterophora) in the Philippines.
Антропология
Отравление свинцом погубило неандертальцев?
Это — одна из самых сложных загадок в истории человечества: почему наш вид, Homo sapiens, продолжает существовать, в то время как близкие родственники, с которыми мы когда-то делили планету, неандертальцы и денисовцы, вымерли десятки тысяч лет назад? Одна из популярных гипотез предполагает, что современные люди были более коммуникабельны и могли устанавливать взаимовыгодные связи друг с другом, что помогало им справляться с климатическими колебаниями и другими экзистенциальными трудностями.
Свинец присутствует во многих природных средах, и предки человека могли подвергаться воздействию свинца, выпивая воду, протекающую через свинецсодержащие породы, или употребляя в пищу растения, которые поглощали свинец из почвы.
Исследование, опубликованное в журнале Science Advances, предполагает, как могло возникнуть это социальное превосходство: наш мозг был лучше защищен от токсического воздействия свинца. Этот сценарий основан на данных, полученных из ископаемых зубов, свидетельствующих о том, что отравление свинцом было широко распространено среди наших предков еще 2 миллиона лет назад. Повреждение мозга, вызванное свинцом, возможно, создало барьер для развития социального поведения гоминидов. Согласно этой смелой теории, современные люди выработали защиту от свинца, что позволило им создавать более сложные и устойчивые сообщества. Подтверждение этой идеи дают эксперименты с мини-мозгами в пробирках — органоидами, сделанными из мозговой ткани, — сконструированными так, чтобы иметь как современные, так и архаичные версии ключевых генов мозга.
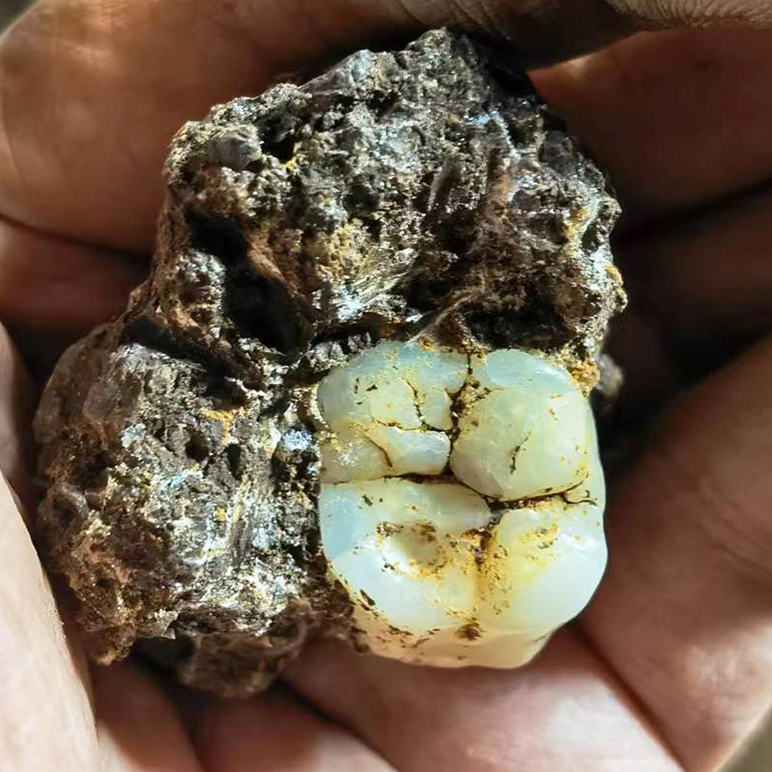
Массивный коренной зуб первобытной обезьяны Gigantopithecus blacki, содержащий следы свинца.
Ученые сосредоточились на гене NOVA1, регулирующем развитие нервной системы и активирующем сотни генов в мозге. У современных людей он замедляет созревание, способствуя усложнению организма, тогда как у человекообразных обезьян, неандертальцев и денисовцев эффект противоположный: детеныши шимпанзе будут умнее человеческого младенца, но во взрослом возрасте всё поменяется.
Исследователи предположили роль свинца в эволюции этого гена, поскольку его воздействие в детстве нарушает эмоциональную регуляцию и мозговые функции. Они обнаружили свинец в 73% окаменелых зубов древних приматов, человекообразных обезьян и различных гоминидов, включая предков человека.
В экспериментах органоиды мозга с архаичными версиями NOVA1<. (у неандертальцев и денисовцев) показали дестабилизацию нейронов с геном FOXP2 (связанным с коммуникацией), а современные человеческие органоиды остались невредимыми под воздействием малых доз свинца.
Отсюда можно сделать вывод, что природное воздействие свинца способствовало формированию у людей защитных генетических вариантов, включая NOVA1, что усилило социальную сплоченность, коммуникацию и помогло Homo sapiens пережить архаичных сородичей. — Did lead poisoning doom Neanderthals?, «Биомолекула»: «Кто все эти люди?!».
Нейробиология
«Поцелуй–сжатие–побег». Раскрыты новые подробности экзоцитоза синаптических везикул и сверхбыстрой рециркуляции
Нейроны в мозге общаются друг с другом, выбрасывая химические вещества — нейромедиаторы — из крошечных пузырьков, называемых синаптическими везикулами (СВ). Этот процесс, экзоцитоз, запускается электрическими сигналами и жизненно важен для работы мозга, но ученые долго спорили о деталях: сливаются ли при этом везикулы с пресинаптической мембраной только временно (явление известно как «поцелуй и уход») или перманентно (полное слияние)? Чтобы разобраться, исследователи создали инновационный метод — клеточную криоэлектронную томографию с временным разрешением. Она сочетает оптогенетическую стимуляцию (искусственное возбуждение клеток светом) и ультрабыстрое замораживание образцов, позволяя «сфотографировать» синапсы в моменты от 0 до 300 миллисекунд после электрического импульса с точностью до нанометров. Это помогло изучить более 1000 трехмерных изображений возбуждающих синапсов в нейронах гиппокампа крысы.
С помощью этого метода ученые обнаружили две отдельные группы синаптических везикул диаметром около 29 и 41 нанометра рядом с активными зонами нейронов. Везикулы проходят через семь состояний: от привязки к мембране (стыковка) до полуслияния и формирования открытой поры слияния. Через 4 миллисекунды после сигнала крупные везикулы «прицеливаются» (прайминг), образуя временный контакт, затем открывается пора размером около 4 нанометров, окруженная белковыми комплексами для слияния. После этого везикулы сжимаются вдвое по поверхности, закрывают пору и отсоединяются (убегают), некоторые же полностью сливаются с пресинаптической мембраной. К 70–100 миллисекундам убегающие везикулы мигрируют назад, а пресинаптическая мембрана восстанавливается через сверхбыстрый «обратный» процесс эндоцитоза.
Этот путь — «поцелуй—сжатие—побег» (kiss—shrink—run) — объединяет старые модели слияния, показывая, почему нейронная передача сигнала так эффективна и точна. Новая модель объясняет, как мозг экономно управляет ресурсами, позволяя везикулам быстро перезаряжаться для следующего «взаимодействия». Использованный в исследовании метод также открывает двери для изучения других молекулярных процессов в клетках с невероятной детализацией. — “Kiss-shrink-run” unifies mechanisms for synaptic vesicle exocytosis and hyperfast recycling, «Биомолекула»: «Кавеолы: уникальные „порталы“ клеточной мембраны».
Биоинформатика
«Google для ДНК». MetaGraph наводит порядок в больших массивах биологических данных
MetaGraph — это новая поисковая система для биологических данных, о которой рассказали в журнале Nature. Она позволяет быстро анализировать огромные объемы необработанных последовательностей ДНК, РНК и белков из публичных хранилищ, таких как Sequence Read Archive, где хранятся миллиарды букв генетического кода — больше, чем все веб-страницы в индексе Google. Аналогично тому, как поиск на YouTube находит скрытые закономерности без явных тегов, MetaGraph выявляет генетические паттерны в зашумленных данных секвенирования, куда традиционные методы не справляются из-за масштаба и отсутствия аннотаций.

MetaGraph индексирует обширные архивы последовательностей ДНК, РНК и белков. Ученые могут осуществлять поиск по архивам и отслеживать биологический контекст в больших данных.
Разработчики из ETH в Цюрихе решили проблему, используя математические графы, которые связывают перекрывающиеся фрагменты ДНК, работая как алфавитный указатель. Они интегрировали данные из семи мировых репозиториев, построив базу с 18,8 миллионами уникальных последовательностей по всем формам жизни — от вирусов до человека. Теперь пользователи могут мгновенно искать в этих сжатых архивах с помощью текстовых запросов, без необходимости предварительной обработки.
Это достижение устанавливает новый стандарт для анализа биологических данных, открывая новые возможности в исследовании регуляции генов и других областях биоинформатики. — ‘Google for DNA’ brings order to biology’s big data, «Биомолекула»: «Искусственный интеллект в биологии».
Молекулярная биология
Дефектные митохондрии вызывают смертельные заболевания: теперь их будет гораздо проще вылечить
CRISPR стал мощным инструментом редактирования генов, помогая лечить болезни вроде серповидноклеточной анемии и раскрывать генетические секреты клеток. Однако этой технологии пока не по зубам митохондрии — крошечные «энергетические станции» в клетках. Их кольцевая ДНК, отвечающая за производство клеточной энергии и другие функции, ускользает от CRISPR из-за защитных мембран. Мутации в этой ДНК вызывают тяжелые болезни у 1 из 5000 человек: проблемы со зрением, слухом, мышцами и судорогами. Эксперты считают, что точное редактирование митохондриальной ДНК может привести к прорыву в медицине, позволяя лечить эти неизлечимые недуги.
Карикатура «Ученые пытаются прорваться к митохондриальному геному».
Митохондрии, вероятно, появились 1,5 миллиарда лет назад, когда древняя клетка «проглотила» бактерию, которая стала ее частью. У людей эта органелла несет мини-геном с 37 генами, наследуемый только от матери. В отличие от ядерной ДНК, одетой в защитные белки, митохондриальная куда уязвимее: мутации в ней возникают в 10–20 раз чаще из-за окислительного стресса и слабых механизмов ремонта. При повреждении она просто выбрасывается, что усложняет редактирование — ведь инструменты вроде CRISPR полагаются на клеточные системы починки.
Исследователи искали обходные пути. Еще до CRISPR они экспериментировали с ферментами, такими как цинковые пальцы (ZFN) и TALEN, чтобы разрезать мутировавшую ДНК в митохондриях. Это заставляло органеллы отбраковывать дефектные копии, давая шанс здоровым размножаться. Метод работал в лаборатории, при моделировании болезни у животных, но не вышел за пределы экспериментов и не помогал при мутациях, присутствующих во всех копиях ДНК. Требовалось найти что-то более точное, не зависящее от направляющих РНК метода CRISPR.
Прорыв случился в 2018 году с открытием бактериального токсина DddA, который меняет буквы в ДНК. Ученые модифицировали его, разделив на части и направив с помощью белков TALEN, чтобы он корректировал только нужные участки в митохондриальной ДНК. Это позволило редактировать гены без разрезов и инъекций РНК, напрямую преобразовывая основание цитозина в тимин. Метод уже тестируется на моделях болезней, обещая безопасные и точные коррекции, которые могут избавить нас от тяжелых митохондриальных заболеваний. Это открытие — словно найти ключ к запертой двери в человеческой клетке. — Faulty mitochondria cause deadly diseases: fixing them is about to get a lot easier, «Биомолекула»: «Внимание! Разыскивается предок митохондрий!».
Эмбриология
В поисках возможности зачать детей с помощью созданных в лаборатории яйцеклеток и спермы
Японский ученый Кацухико Хаяши и его команда работают над революционной идеей: выращиванием яйцеклеток и сперматозоидов прямо в лаборатории. Это процесс, известный как гаметогенез in vitro (IVG), мог бы помочь людям с бесплодием, однополым парам завести детей от обоих партнеров и даже создать запас гамет для тестирования лекарств на предмет возможного влияния на фертильность. Пока успехи впечатляют только на мышах — Хаяши вывел мышей с двумя папами. Но до применения на людях путь долгий: эксперты не ожидают этого раньше десятилетия, а некоторые говорят, что не раньше 15 лет. Тем не менее, промежуточные результаты уже дают надежду на понимание причин бесплодия и его лечение.

У этих мышей два биологических родителя-самца. Они были получены с использованием яйцеклеток, полученных из клеток кожи самцов. Фото: Кацухико Хаяси, Университет Осаки.
Процесс выращивания гамет сложен, потому что он имитирует многолетнее развитие половых клеток в организме. Ученые используют плюрипотентные стволовые клетки (iPS), которые можно превратить в любые клетки тела, и выращивают их в искусственных средах, копирующих яичники или семенники. Это включает 3D-культуры, органоподобные структуры и даже 3D-печатные канальцы. Основной вызов для создания таких гамет — правильный мейоз (деление клеток, формирующее половину хромосом) и рекомбинация генов для их разнообразия. Некоторые команды пытаются ускорить процесс с помощью специальных белков, но мейоз часто идет неправильно, приводя к яйцеклеткам с ошибками в хромосомах.
Одна из недавних идей — «митомейоз»: замена ядра незрелой яйцеклетки на ядро из кожной клетки, чтобы пропустить часть деления. Это дало жизнеспособные яйцеклетки в 9% случаев, но они не прошли полный процесс перетасовки генов и имели аномалии. Важны и другие детали: гаметы должны проходить импринтинг — особые изменения ДНК, влияющие на работу генов. Ошибки здесь влекут за собой болезни. Кроме того, долгое выращивание (месяцы) повышает риски для здоровья клеток. Ученые проверяют результаты на нечеловекообразных приматах, но это добавляет годы к исследованиям.
Несмотря на прогресс, возникли этические вопросы. IVG может открыть двери для отбора эмбрионов с нужными генами или даже генетической модификации детей. Регуляторные органы призывают выработать правила заранее, хотя клиническое использование этой методики еще далеко. Приматы и их потомство нужно изучить на поколения вперед, чтобы убедиться в безопасности. В итоге, эта технология обещает грандиозные перемены, но требует осторожности и запас времени, чтобы не опережать этически допустимые нормы. — The quest to make babies with lab-grown eggs and sperm, «Биомолекула»: «Снежный ком проблем с плюрипотентностью».





