Шокирующее поведение белков теплового шока
05 марта 2025
Шокирующее поведение белков теплового шока
- 821
- 0
- 7
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В статье описываются различные семейства белков теплового шока (Hsp), по какому принципу их выделяют и как они помогают или не помогают другим белкам. Интерес исследователей вызывают противоречивые взаимодействия Hsp и их влияние на протекание болезней, например, нейродегенеративных. Естественно, белки теплового шока участвуют и в процессах старения организма.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Белковая составляющая любого организма работает как хорошо структурированный и сложноорганизованный оркестр. Однако даже в оркестре, состоящем из заслуженных деятелей культуры, встречаются «звезды», которые ведут себя непредсказуемо, пытаются показать свою важность и играть по-своему, не как все. К сожалению, многие белки могут иметь разнообразные и противоположные функции, чем ставят в тупик даже именитых ученых. До поры до времени, конечно: наука движется вперед, и в конце концов со всеми интриганами и манипуляторами разберется!
Такими возмутителями спокойствия являются на сегодняшний день, в частности, представители семейства белков теплового шока — Hsp (heat shock proteins). Они вырабатываются клетками в ответ на воздействие стрессовых условий. Впервые эти белки, как и следует из их названия, появились при воздействии повышенной температуры на клетки. Впрочем, сейчас известно, что Hsp также экспрессируются во время многих других стрессовых для клеток ситуаций, таких как гипоксия, ишемия, активные формы кислорода, УФ-излучение, эндотоксины. В нормальных условиях белки теплового шока составляют 5–10% от общего содержания клеточных белков. Они функционируют в разных ипостасях (как холдаза, фолдаза, секвестраза, агрегаза или дезагрегаза) и работают как сеть для поддержания протеостаза.
Теперь о грустном. Клеточное старение— это явление постоянной остановки роста клеток и выхода из клеточного цикла. Оно может возникнуть из-за теломер-зависимого репликативного стресса. Также его способны вызвать стрессовые факторы: окислительный стресс, мутагенные сигналы, разрывы ДНК, тогда через различные сигнальные пути может возникнуть так называемое преждевременное старение (рис. 1).
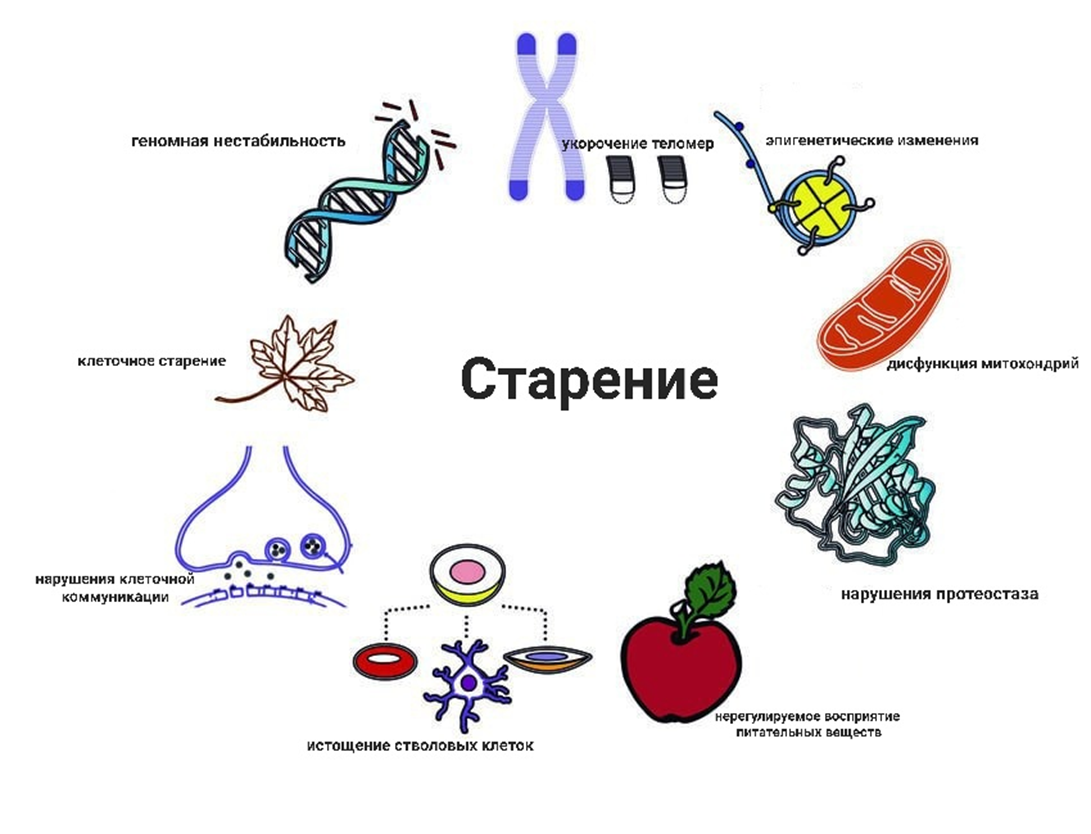
Рисунок 1. На что влияет старение.
Как понять, что клетка постарела? У нее изменяются физиология, морфология и устойчивость к сигналам апоптоза, появляются макромолекулярные повреждения, увеличивается количество активных форм кислорода внутри. Итак, поскольку ранее упомянутые белки теплового шока связаны с цитозащитой, их роль в долголетии и клеточном старении стала предметом исследовательского интереса [1].
Как тепло шокировало не только клетки, но и ученых
Как и многие другие великие открытия, обнаружились белки теплового шока случайно и из-за невнимательности экспериментаторов («И ошибка бывает полезна, пока мы молоды, лишь бы не таскать ее с собою до старости» — Иоганн Вольфганг Гёте.) В одной итальянской лаборатории в 1962 году в инкубаторе с плодовыми мушками Drosophila melanogaster (рис. 2) случайно установили слишком высокую температуру, после чего обнаружили изменения во внешнем виде политенных хромосом слюнных желез мушек.

Рисунок 2. Плодовая мушка Drosophila melanogaster.
На хромосомах появились новые пуфы-вздутия, которые говорили об изменении экспрессии генов; в последующих экспериментах они наблюдались как у прокариот, так и у эукариот в ответ на широкий спектр стрессовых для клеток факторов, про которые говорилось в начале этой статьи (рис. 3) [3].
Обнаружили, что подобное изменение экспрессии генов вызывало выработку небольшого количества белков и подавляло выработку большинства других. В последующем, гены Hsp дрозофилы стали одними из первых клонированных генов эукариот. Позднее белки теплового шока обнаружили в клетках при нормальных условиях и присудили им роль молекулярных шаперонов [2].
Такие разные структуры и циклы работы белков теплового шока
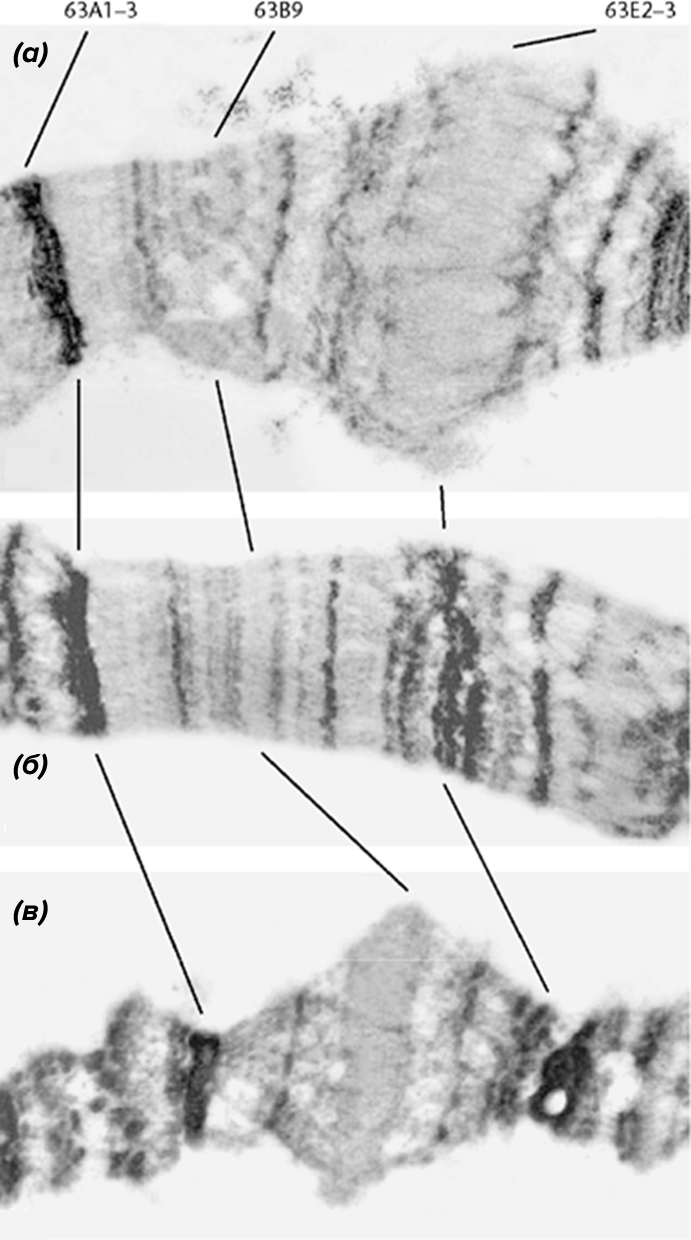
Рисунок 3. Структура политенной хромосомы. 63А1-3, 63В9, 63Е2-3 — это различные хромосомные регионы. На исходный регион 63В9 (б) воздействовали экдизоном (стимулирует линьку у насекомых) (а) и температурой (в).
Белки теплового шока столь различны меж собой, что их принято ранжировать. Классификация Hsp основана на различной молекулярной массе в кДа. Выделяют пять основных семейств белков теплового шока — Hsp110, Hsp90, Hsp70, Hsp60 и малые sHsp, Иногда в отдельные семейства выделяют их помощников, т.н. кошаперонов: Hsp40, Hsp10 и GrpE и пр., содействующих шаперонам в сворачивании белков и выполнении ряда других функций.
Шапероны нековалентно связываются с гидрофобными участками белков неправильной конформации, затем активно все исправляют, придавая белкам правильную конформацию в ходе АТФ-зависимых или АТФ-независимых циклов, либо стабилизируют денатурировавшие белки в связанном виде, либо метят их для деградации [4].
Рассказ о действии всех шаперонов стал бы слишком объемным и превратился бы в роман. Поэтому подробнее остановимся на наиболее консервативных: Hsp70 и Hsp90, об остальных — кратко.
Hsp70 (DnaK у прокариот, HSPA у человека) являются самыми консервативными — их аминокислотная последовательность наполовину совпадает у всех живых существ, кроме того, у большинства изученных видов есть множество копий генов (паралогов) этих белков.
Шаперонная активность Hsp70 основана на АТФ-зависимом изменении конформации (рис. 4) [5]. Мономер содержит концевой нуклеотид-связывающий домен NBD, который соединен с C-концевым доменом связывания субстрата SBD. Домен SBD включает два субдомена — SBDα и SBDβ, за которыми следует C-концевой хвост с последовательностью EEVD (Glu-Glu-Val-Asp), распознающий кошапероны. Основными кошаперонами, связывающимися с Hsp70, являются семейства белков домена J (JDP)/Hsp40: они распознают особенности развернутых белков, повышают активность АТФазы (чем облегчают связывание Hsp70 с субстратами), а также распознают факторы обмена нуклеотидов NEF — они опосредуют диссоциацию АДФ и повторное связывание АТФ. Высвобожденный субстрат может повторно связывать Hsp70 и подвергаться дальнейшим циклам сворачивания, пока не достигнет своей нативной конформации.
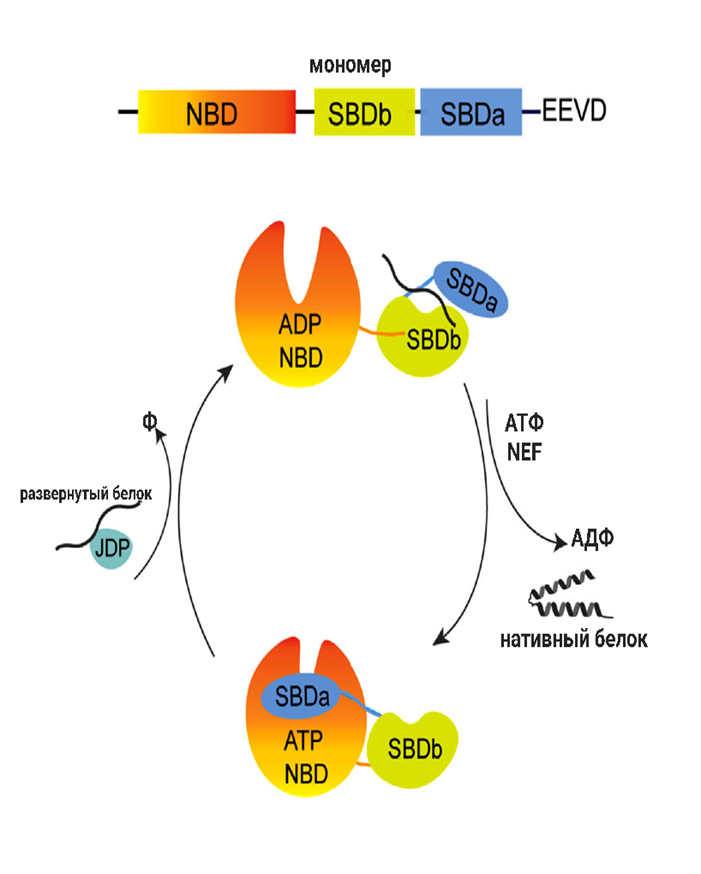
Рисунок 4. Схема доменов и конформационные циклы Hsp70.
Также высоко консервативными являются Hsp90. Мономер содержит три домена: домен связывания нуклеотидов NTD на N-конце, средний домен MD и домен C-конца CTD (рис. 5). В отличие от Hsp70, для связывания кошаперонов они имеют последовательность MEEVD (Met-Glu-Glu-Val-Asp). Без связи с АТФ Hsp90 остается в NTD-открытой конформации и образует димеры через домен CTD. Развернутые или «молодые» белки загружаются на домене MD в Hsp90, который находится открытой конформации. Связывание АТФ вызывает димеризацию NTD. Последующий гидролиз АТФ приводит к закрытому режиму Hsp90, АДФ высвобождается от Hsp90, возвращая конформацию в открытый режим. При повторении цикла белки сворачиваются и высвобождаются в нативных конформациях.
В человеческом протеоме около 10% белков являются «клиентами» Hsp90, такие как факторы транскрипции, убиквитины (которые участвуют в деградации различных белков), около 60% киназ, рецепторы стероидных гормонов, что напрямую влияет на клеточную сигнализацию и регуляцию клеточного цикла.
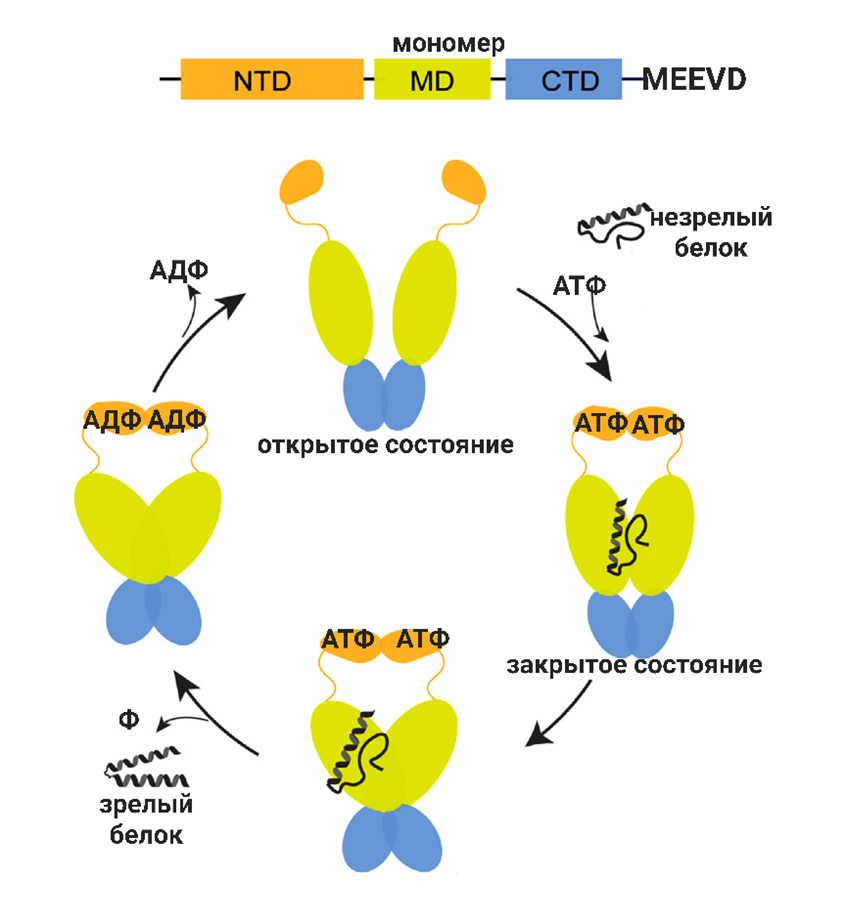
Рисунок 5. Схема доменов и конформационные циклы Hsp90 .
Строгая система Hsp70, помимо обеспечения сворачивания белков de novo после воздействия стрессовых факторов на клетку, распознает денатурированные или неправильно свернутые белки и решает их дальнейшую судьбу. Некоторые белки затем могут быть повторно свернуты в нативное состояние с помощью Hsp90. Однако необратимо неправильно свернутые белки могут подвергнуться деградации либо через путь убиквитин-протеасомы, либо через аутофагию путем связывания с несколькими кошаперонами (рис. 6) [6].
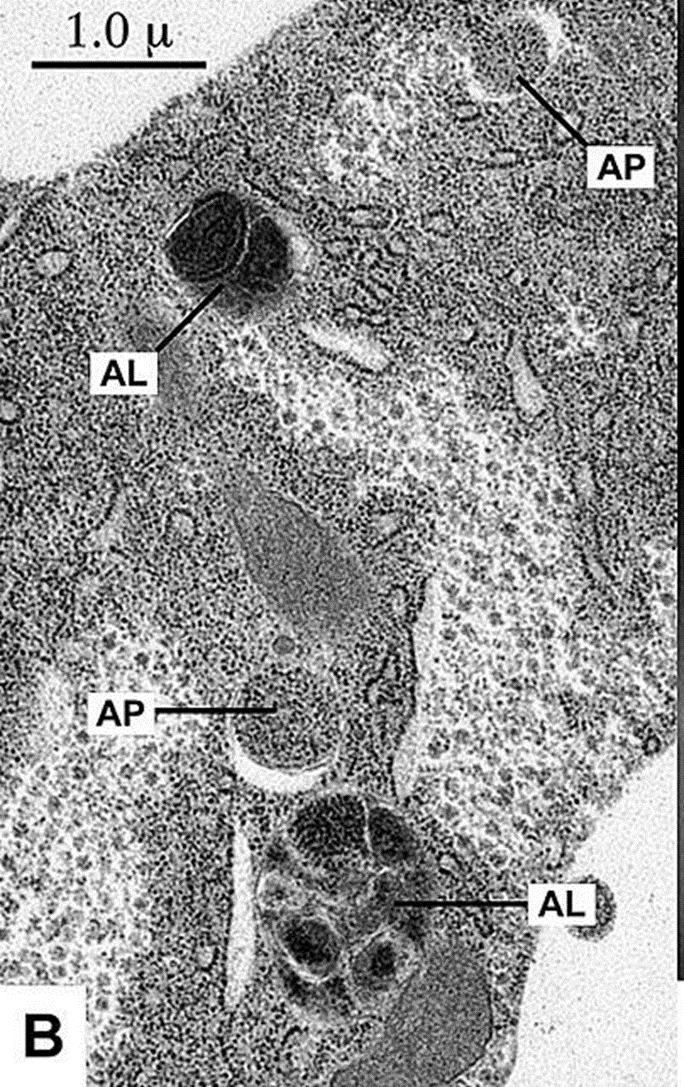
Рисунок 6. Схема образования аутофагосомы: изолирующая мембрана окружает клеточные структуры и создает аутофагосому (AP), которая сливается с лизосомой и создает аутофаголизосому (AL).
Малые белки теплового шока sHsp экспрессируются для избегания агрегации (неупорядоченного скопления и слипания) белков, быстро активируются в условиях стресса. Они часто являются кошаперонами для других белков теплового шока (рис. 7). Общей особенностью sHsp является структура из семи или восьми антипараллельных β-слоев. N- и C-концевые области (NTE и CTE) изменчивы по последовательности и длине, способствуя пластичности sHsp. In vivo sHsp образуют временные и пластичные большие олигомеры в виде полых сфер самыми разнообразными способами, поэтому эти белки динамичны и взаимозаменяемы в зависимости от стресса или температуры. Влияние повышенной температуры приводит также к ускорению метаболизма и росту количества неправильно свернутых белков, и первыми их защищать пойдут именно sHsp, распознающие нарушения конформации на ранних этапах задолго до полной потери структуры белков. Также при холодовом воздействии может возрасти экспрессия генов различных sHsp, в том числе эти белки участвуют в формировании устойчивости к пониженным температурам.
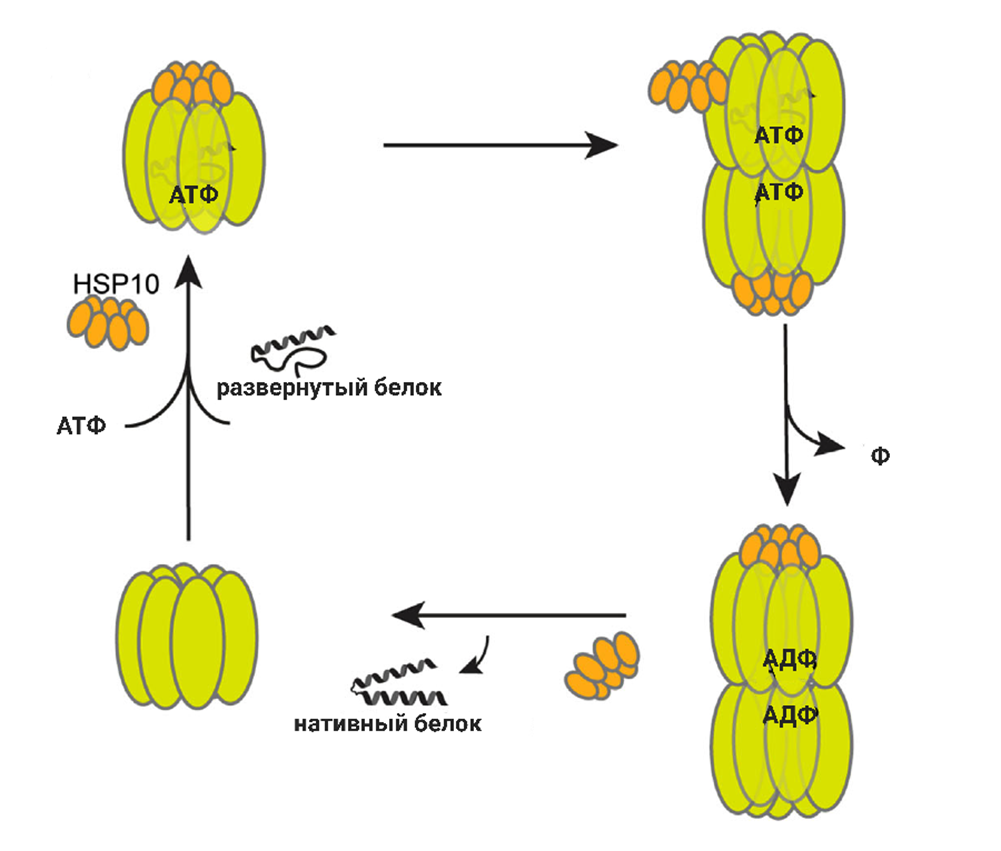
Рисунок 7. Взаимодействие Hsp60 со кошапероном Hsp10 (sHsp).
Высокомолекулярные Hsp110 и Grp170 эволюционно консервативны и гомологичны (то есть родственны) семейству Hsp70, поэтому их часто относят к членам так называемого «суперсемейства Hsp70». Они также работают против агрегации белков, в присутствии АТФ объединяются в кольцеобразные гомогексамеры с центральной порой, через которую протягивается субстрат.
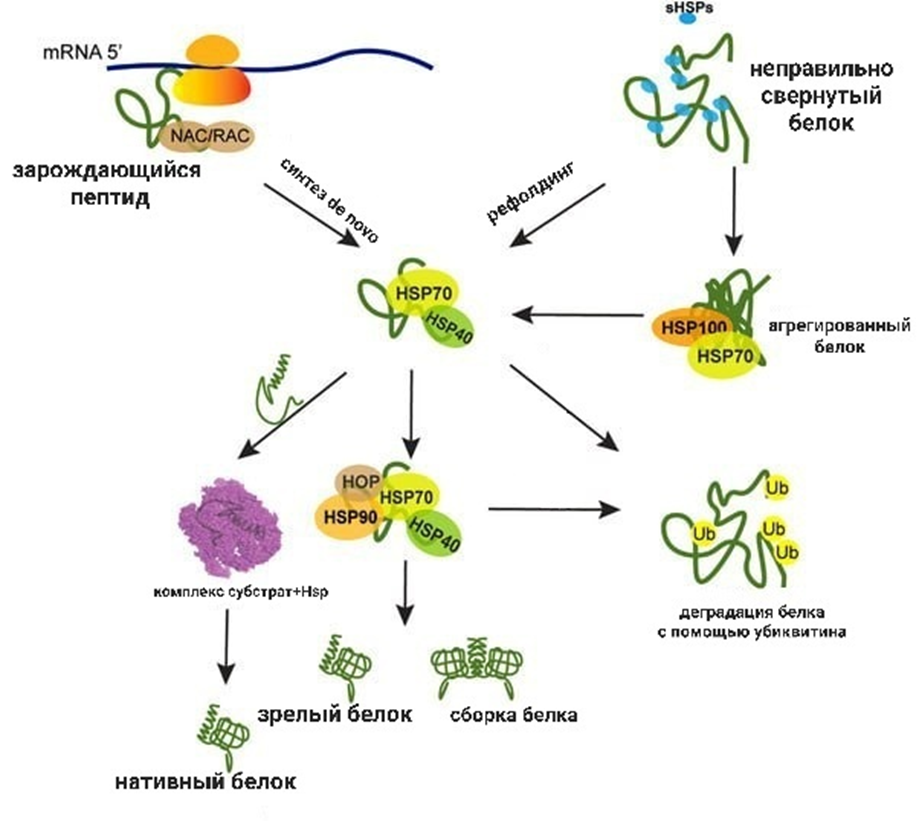
Рисунок 8. Белки теплового шока и кошапероны контролируют структуру белка и отвечают за его судьбу.
Hsp работают не только как добрые и хорошие белки, которые защищают целостность клеток — они играют двойную роль в регуляции апоптоза [7] клеток со сложными механизмами. Так, в ходе различных сигнальных путей одни и те же белки могут как ослаблять апоптоз, так и проявлять способность к проапотозу, тем самым являясь причиной различных заболеваний [5].
Шокирующие и противоречивые роли белков теплового шока при заболеваниях
При прогрессировании нейродегенеративных заболеваний в головном мозге накапливаются и агрегируются неправильно свернутые белки. Естественно, тут не без участия белков теплового шока — они пролезут куда угодно и будут стараться все исправить (или не исправить). Нейродегенеративные расстройства классифицируются как «протеинопатии», а неправильно свернутые белки часто являются биомаркерами заболевания. Сбой многих механизмов клеточного контроля можеь привести к патогенным условиям, в ходе чего некоторые белки теплового шока могут работать не как друзья, а как злейшие враги организма.
Болезнь Альцгеймера является наиболее распространенным нейродегенеративным заболеванием, в ходе которого в клетках мозга накапливаются гиперфосфорилированный тау-белок и бета-амилоидные бляшки, образуются отчетливо видимые нейрофибриллярные клубки. С развитием болезни происходит потеря долговременной памяти, возникают нарушения речи и когнитивных функций (рис. 9). Как правило, болезнь обнаруживается у людей старше 65 лет, амилоидные бляшки откладываются в основном в височных долях головного мозга [8], [9]. У людей, страдающих болезнью Альцгеймера, в нейронах головного мозга часто создается дисбаланс между окислительными и антиоксидантными механизмами из-за дисфункции митохондрий и накопления тау-белков и бета-амилоидных бляшек (рис. 11). Склонность бета-амилоида образовывать токсичные олигомерные разновидности определяется его последовательностью. Возникающие активные формы кислорода негативно воздействуют на все биологические молекулы и повышают экспрессию генов, ответственных за кодирование Hsp. Белки теплового шока спешат в синапсы, чтобы всех спасти и ингибировать агрегацию амилоидогенных белков. Общий эффект разных семейств белков теплового шока приводил к уменьшению образования свободных радикалов — они либо талантливо и АТФ-независимо связывают неправильно свернутый амилоид и предотвращают его агрегацию, либо гениально и АТФ-зависимо меняют конформацию амилоида, чтобы он больше не хулиганил и не агрегировал.
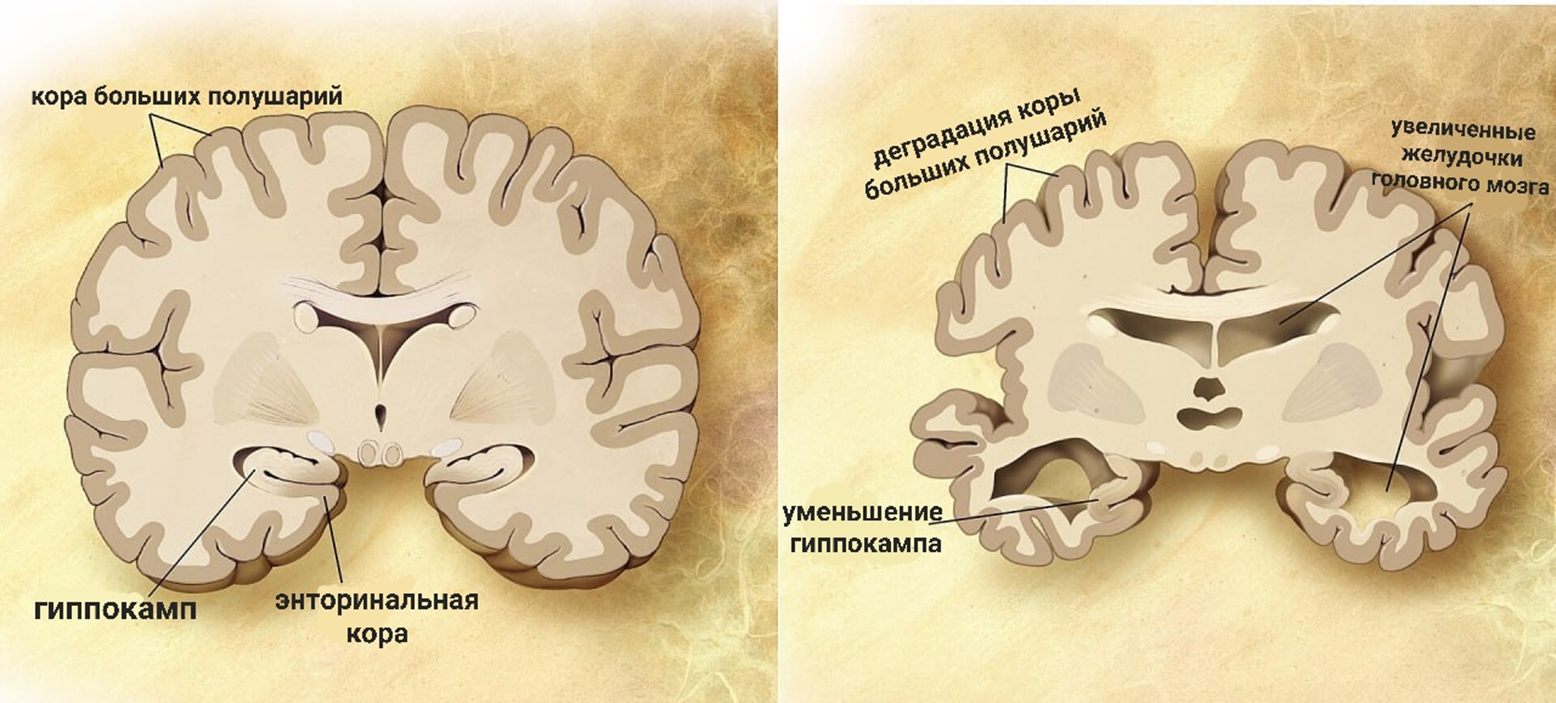
Рисунок 9. Мозг пожилого человека в норме (слева) и при болезни Альцгеймера (справа).
И вот тут и начинаются загадки и приключения, так как роль некоторых отдельных белков в развитии болезни Альцгеймера мало изучена. Болезнь может сопровождаться другими заболеваниями, развитие которых также может быть связано с белками теплового шока.
Многие данные свидетельствуют о том, что Hsp60 играет нейропротекторную роль и ингибирует агрегацию бета-амилоидов (рис. 10) [10]. Однако есть исследования, в которых Hsp60 опосредовал перемещение белка-предшественника амилоида в митохондрии, что приводило к дисфункции этой органеллы.
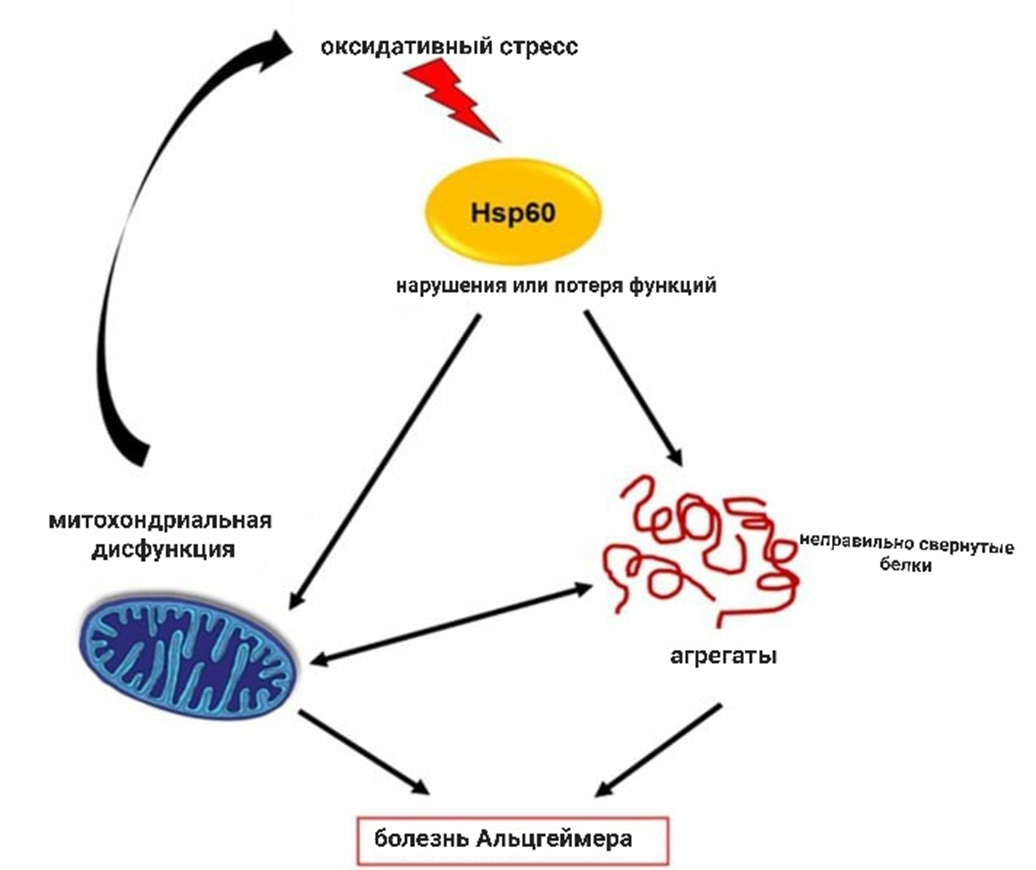
Рисунок 10. Hsp60 и болезнь Альцгеймера. Окислительный стресс может вызывать структурные изменения Hsp60, что приводит к неправильному сворачиванию и отложению белка в головном мозге.
Hsp70 может связываться с белком-предшественником амилоида и влиять на его секреторный путь, снижая образование бета-амилоида, еще он может разрушать олигомеры тау-белков и бета-амилоидов через протеасомную систему. Так, в китайской медицине использовали экстракт листьев Гинкго Двулопастного, который увеличивал в организме содержание Hsp70 [10]. И вот как будто бы все хорошо, и Hsp70 молодец, но в то же время он способен через сигнальные каскады запустить неограниченный рост клеток, связать белки-супрессоры опухолей и повышенную устойчивость к химиотерапии при раке молочной железы.
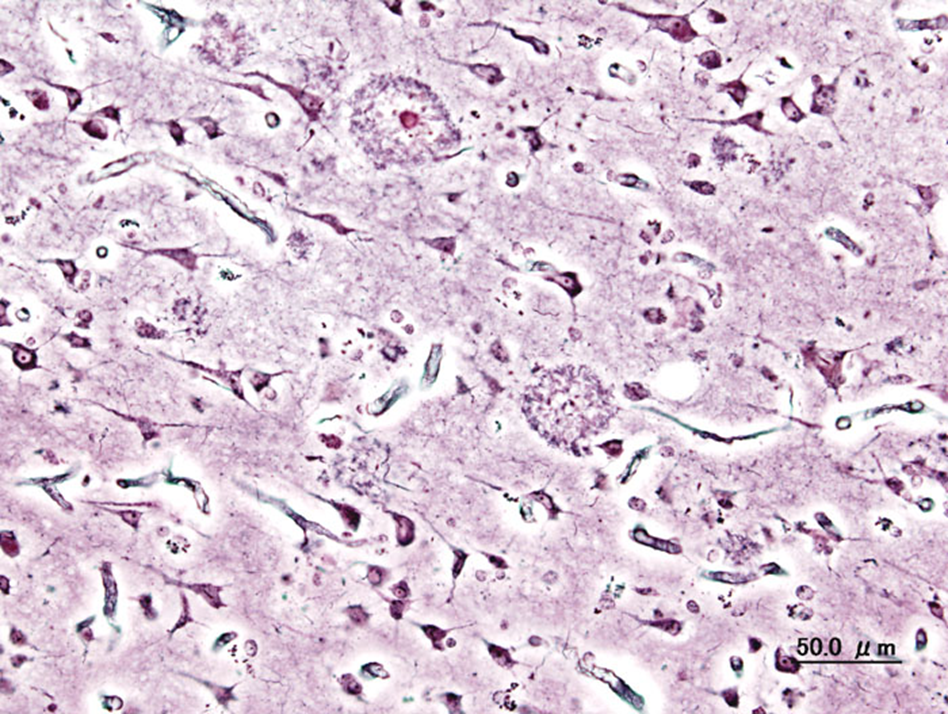
Рисунок 11. Гистопатологический образец участка коры головного мозга с бета-амилоидными бляшками.
Исследования показали, что Hsp90 определяет активацию микроглиального фагоцитоза, который стимулирует деградацию бета-амилоидных бляшек. И в это же время есть исследования, в ходе которых снижение фосфорилирования тау-белка, снижение нейротоксичности бета-амилоидов и ускорение роста аксонов происходило именно при ингибировании Hsp90. Кроме того, Hsp90 активно экспрессируется в нескольких типах лейкемии, к сожалению, устойчивых к терапии, также участвует в активной работе онкогенных белков. Его активная экспрессия коррелирует с низкой выживаемостью пациентов с раком легких.
Повышенная концентрация Hsp27 в глии и нейронах коррелируют с патогенным отложением неправильно свернутых белков и при этом одновременно демонстрирует защитные эффекты в нейрональных клетках. Одно исследование показало, что Hsp27 при болезни Альцгеймера участвует в выведении тау-белка из мозга. А несколько исследований на животных моделях выявили потенциальное участие Hsp27 в повреждениях периферических нервов. Голова уже давно пошла кругом от таких многочисленных противоречий, но дополним, что повреждение периферических нервов может быть не совсем плохим и участвовать в избирательной потере поврежденных нейронов [11].
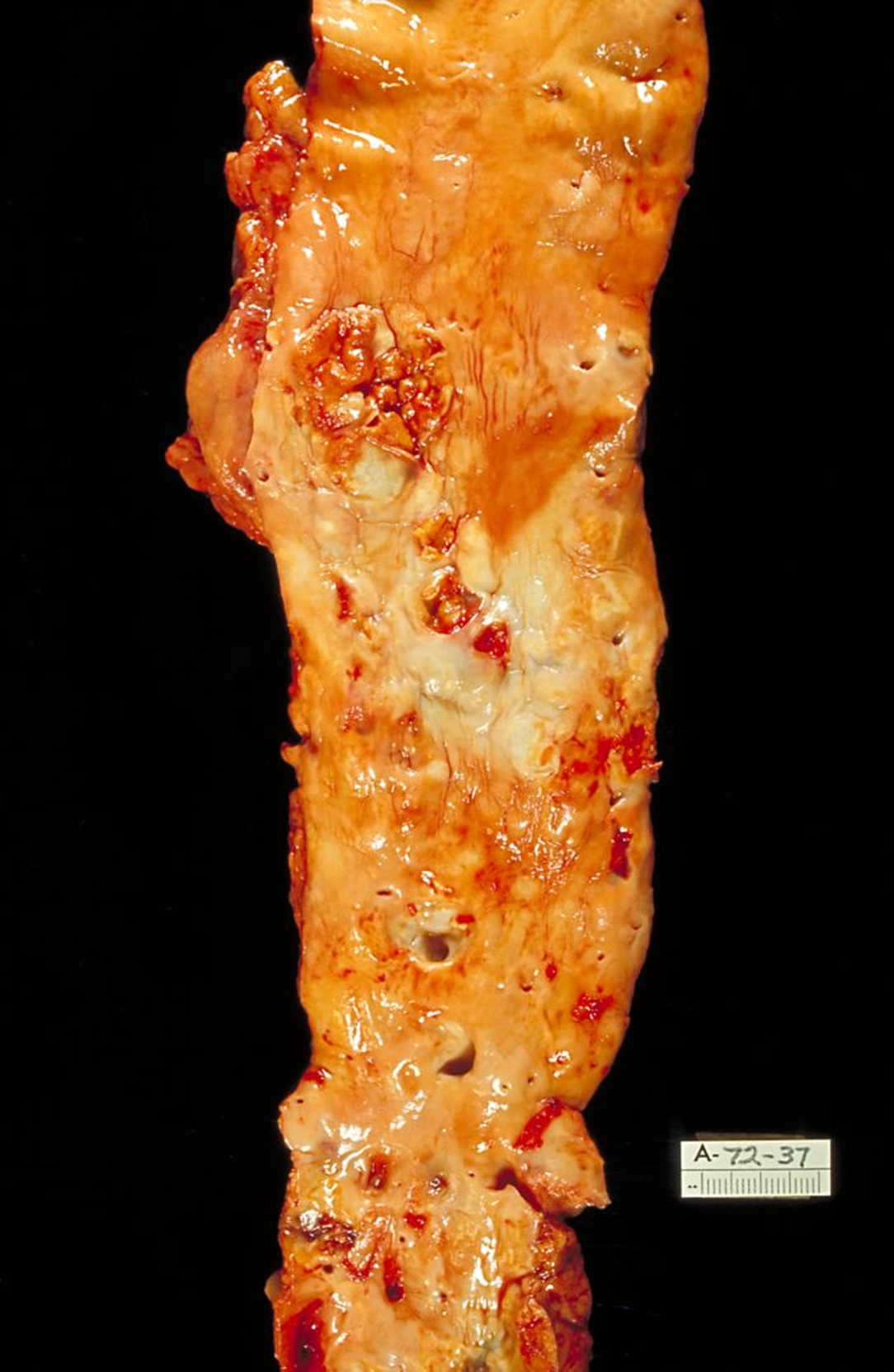
Рисунок 12. Поражение аорты при атеросклерозе.
При сердечно-сосудистых заболеваниях белки теплового шока вновь представляют собой палку о двух концах. Различные белки Hsp оказывают противоположное действие на развитие или ингибирование сердечно-сосудистых заболеваний, а также связанных с ними симптомов. В одних исследованиях повышенная экспрессия Hsp70 в культуре клеток кардиомиоцитов оказывала защитное действие, повышала выживаемость клеток, способствовала синтезу гликогена. В других исследованиях совокупность Hsp60 и стресс-индуцированного Hsp70 активно участвовала развитии атеросклероза и аутоиммунных реакций. Ключевым элементом для адаптации стареющего сердца к тепловому стрессу считается Hsp27, так как при повышении температуры резко снижается именно его концентрация [12].
Жил старик со своею старухой и с белками теплового шока
Стареющие клетки секретируют повышенное количество провоспалительных веществ, которые разрушают клеточный матрикс и при старении вызывают слабость, сердечно-сосудистые и дегенеративные заболевания. Естественно, белки теплового шока не дремлют в сторонке.
Hsp предотвращают перемещение проапоптотических белков из цитоплазмы в митохондрии, что подавляет действие проапоптотических молекул. Ученые обнаружили, что повышенная экспрессия Hsp27 в первичных макрофагах человека способствует их более длительному выживанию. При подавлении Hsp70 также подавляется апоптоз. Более того, физические упражнения приводят к снижению уровня Hsp70 в лимфоцитах, а также абсолютного количества клеток, склонных к старению, в крови пожилых женщин. Хотя о внутриклеточном Hsp70 известно много, о циркулирующем Hsp70 в контексте старения данных пока что мало и их роль активно изучается, однако известно, что Hsp70 в крови снижается с возрастом в нормальной популяции. Считается, что более высокие уровни Hsp70 связаны с воспалением и слабостью у пожилых пациентов. Воспалительная патология у пожилых пациентов сопровождается более высокими уровнями Hsp70. Подобные исследования звучат интригующе [1], [13].
Поскольку гомеостаз белков важен для целостности клеток, выживания и метаболизма, нарушение контроля качества белков с помощью шаперонов приводит к возникновению и развитию различных заболеваний.
Молодые, целеустремленные и полные сил нейроны могут передавать в окружающую их глию везикулы с различными белками теплового шока, тем самым защищая другие нейроны от связанного со старением функционального спада. Этот механизм может представлять собой процесс, лежащий в основе защиты нейронов за пределами старения: когда происходит стресс или повреждение, подгруппа нейронов может реагировать на стимуляцию, активируя окружающую глию, а активация глии может, в свою очередь, защищать другие нейроны и предотвращать каскадное повреждение мозга.
Белки теплового шока являются компонентами путей развернутого белкового ответа — UPR. Этот путь можно считать консервативным, так как он найден у разных организмов (его изучали на кольчатых червях и млекопитающих). Hsp4 регулирует один из таких путей — IRE1-XBP1, отвечающий за сворачивание или деградацию белков — он запускается в стареющих клетках и не запускается в молодых клетках (рис. 13).
В ответ на старение нейронов, нейрональные белки теплового шока активируют глиальный путь UPR. Этот самый путь UPR в глии регулирует синтез хондроитина, тем самым обеспечивая защиту от старения нейронов. Хондроитин — гликозаминогликан, линейный полисахарид из повторяющихся дисахаридных единиц. Он содержится во внеклеточном матриксе, взаимодействует с водой, ионами, определенными химическими веществами или белками, и облегчает локальную сигнализацию в микросреде. Это необходимо для деления клеток формирования тканей [14].
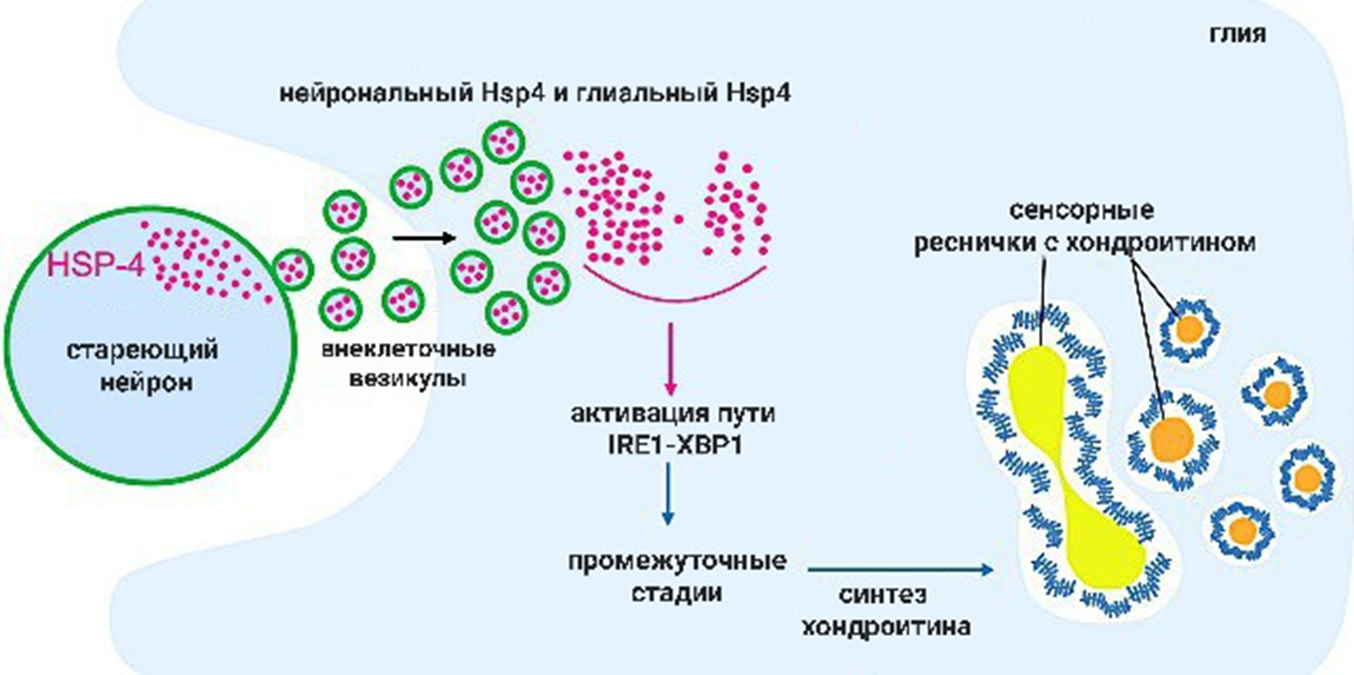
Рисунок 13. Участие белков теплового шока в синтезе хондроитина у кольчатых червей.
Заключительное слово о том, какие белки теплового шока молодцы
Думаю, за время прочтения этой статьи, которая отражает лишь немногие грани функционирования белков теплового шока, вы убедились, насколько Hsp талантливые ребята. С момента открытия теплового шока в 1962 году было достигнуто более глубокое понимание структур, функций Hsp и их взаимодействий друг с другом и с другими молекулами. Эти белки играют важную роль в целостности и метаболизме как одной клетки, так и целого организма. Истощение запасов Hsp приводит к усилению процессов клеточного старения и нарушению структуры многих белковых молекул. Множество исследований показали, что Hsp влияют на развитие многих заболеваний, в том числе и тех, которые ассоциируются со старением, такие как нейродегенеративные или сердечно-сосудистые заболевания. Сейчас ведется активная разработка лекарственных препаратов, усиливающих или снижающих действие Hsp, поэтому изучение этих белков становится с каждой минутой все актуальнее и интереснее.
Таким образом, если вдруг вы будете чувствовать себя перегретым или очень стрессовать, помните, что вы не одни и что белки теплового шока всегда поддержат вас и в настоящее время, и в глубокой старости.
Литература
- Mariam Hebishy, Cabirou Mounchili Shintouo, Ines Dufait, Florence Debacq-Chainiaux, Ivan Bautmans, Rose Njemini. (2023). Heat shock proteins and cellular senescence in humans: A systematic review. Archives of Gerontology and Geriatrics. 113, 105057;
- Никитин К.Д. (2008). Белки теплового шока: биологические функции и перспективы применения. Клиническая онкогематология. 1, 125–130;
- Igor F Zhimulev, Dmitry E Koryakov. (2009). Polytene Chromosomes. Encyclopedia of Life Sciences;
- Harm H. Kampinga, Jurre Hageman, Michel J. Vos, Hiroshi Kubota, Robert M. Tanguay, et. al.. (2009). Guidelines for the nomenclature of the human heat shock proteins. Cell Stress and Chaperones. 14, 105-111;
- Chen Hu, Jing Yang, Ziping Qi, Hong Wu, Beilei Wang, et. al.. (2022). Heat shock proteins: Biological functions, pathological roles, and therapeutic opportunities. MedComm. 3;
- Gabor Juhasz, Thomas P Neufeld. (2006). Autophagy: A Forty-Year Search for a Missing Membrane Source. PLoS Biol. 4, e36;
- Апоптоз, или Путь самурая;
- R Brookmeyer, S Gray, C Kawas. (1998). Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset.. Am J Public Health. 88, 1337-1342;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Claudia Campanella, Andrea Pace, Celeste Caruso Bavisotto, Paola Marzullo, Antonella Marino Gammazza, et. al.. (2018). Heat Shock Proteins in Alzheimer’s Disease: Role and Targeting. IJMS. 19, 2603;
- Qingbo Xu. (2002). Role of Heat Shock Proteins in Atherosclerosis. ATVB. 22, 1547-1559;
- Cecilia Björkdahl, Magnus J. Sjögren, Xinwen Zhou, Hernan Concha, Jesus Avila, et. al.. (2008). Small heat shock proteins Hsp27 or αB‐crystallin and the protein components of neurofibrillary tangles: Tau and neurofilaments. J of Neuroscience Research. 86, 1343-1352;
- Rose Njemini, Ivan Bautmans, Oscar O Onyema, Katrien Van Puyvelde, Christian Demanet, Tony Mets. (2011). Circulating Heat Shock Protein 70 in Health, Aging and Disease. BMC Immunol. 12;
- Jieyu Wu, Olivia Jiaming Yang, Erik J. Soderblom, Dong Yan Heat Shock Proteins Function as Signaling Molecules to Mediate Neuron-Glia Communication During Aging — Cold Spring Harbor Laboratory.