Синдром МакКьюна—Олбрайта—Брайцева: генетическая рулетка клинических признаков
18 марта 2025
Синдром МакКьюна—Олбрайта—Брайцева: генетическая рулетка клинических признаков
- 1722
- 0
- 4
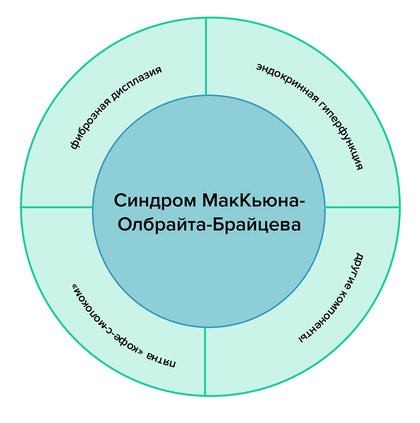
Синдром МакКьюна—Олбрайта—Брайцева, синдром МОБ, — мультисистемное заболевание, для которого характерны три компонента: фиброзная дисплазия, пятна цвета «кофе-с-молоком» и гиперфункция эндокринных железы. Каждому человеку с этим диагнозом выпадает свой набор компонентов: может быть только два из трех, или все три, или все три и еще другие компоненты. У болезни настолько вариабельное течение, что два человека с синдромом МОБ могут иметь очень разные проявления и качество жизни.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Синдром МакКьюна—Олбрайта—Брайцева, синдром МОБ, — болезнь, которая может полностью изменить жизнь человека или никак не повлиять на нее. У одного она проявляется пятнами на коже, незначительными изменениями в костях и эндокринными нарушениями, у другого — деформирует весь скелет, извращает работу множества внутренних органов и приводит к инвалидности. В статье объясню, почему так происходит, покажу спектр проявлений и расскажу, где могут помочь людям с синдромом МОБ.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Кто в игре: ген GNAS и его белок
В основе болезни — активирующая мутация в гене GNAS. Этот ген кодирует сразу несколько белков, но самый функционально важный его продукт — субъединица G-белка [1], [2].
G-белки
G-белки — это внутриклеточные посредники передачи информации. Они принимают сигнал от молекул, которые не могут попасть в клетку, и передают его в клеточное ядро [3], [4].
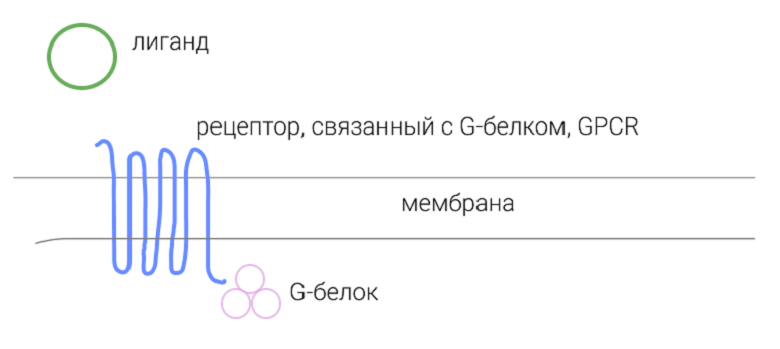
Рисунок 1. На функцию клетки могут влиять множество активных молекул. Какие-то из них могут проникать в клетку, а какие-то — нет. Те, что не могут попасть внутрь, действуют через трансмембранные рецепторы. Рецепторы называют GCPR, G-coupled protein receptor, потому что внутренний конец такого рецептора сопряжен с G-белком. Внешний конец выступает из клетки и готов к встрече со своей активной молекулой, лигандом.
иллюстрация автора
G-белки влияют на функциональное состояние клеток, в которых находятся. Когда рецептор, связанный с G-белком, соединяется со своим лигандом, G-белок активируется и запускает каскад передачи сигнала от мембраны до клеточного ядра [3]. В ядре меняется экспрессия генов, в клетке — функциональная активность [5].
Стимулирующая альфа-субъединица G-белка
G-белок состоит из трех субъединиц: альфа, бета и гамма. Альфа-субъединица определяет, от каких рецепторов и каким образом G-белок будет передавать сигнал [3].
Различают четыре типа альфа-субъединицы G-белка:
- Gaq,
- Gai,
- Ga12/13,
- Gas, она же — стимулирующая альфа-субъединица [3].
Стимулирующая альфа-субъединица связана с рецепторами к нейромедиаторам и десятку гормонов [3].
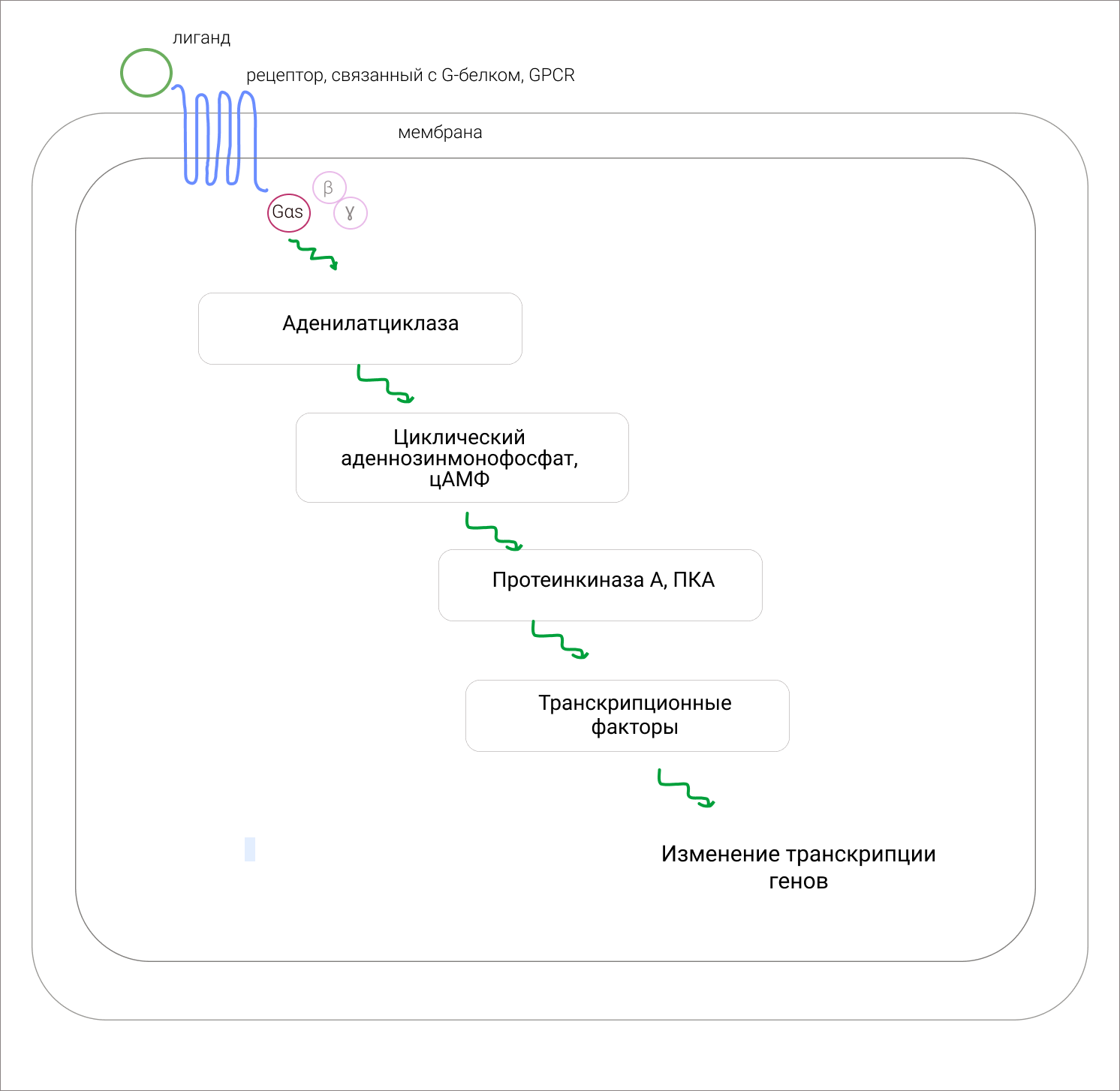
Рисунок 2. Схема передачи сигнала от трансмембранного белка, GCPR, в клетку через Gas. Когда лиганд связывается с рецептором, Gas активируется и запускает каскад передачи сигнала от рецептора к клеточному ядру. В итоге изменяется экспрессия генов и увеличивается функциональная активность клетки [3].
иллюстрация автора
Активирующая мутация в гене GNAS
Информация о Gas закодирована в гене GNAS. Если с GNAS все в порядке, то и Gas нормальная. Если в гене случилась значимая мутация, то и белок Gas будет с дефектом. Активирующая мутация в GNAS приводит к тому, что Gas получается патологически активной. В таком случае Gas становится неважно, связался ли с ее рецептором лиганд или нет: она передает в клетку сигнал, даже когда ее об этом никто не просит [6]. Клетки с такими гиперактивными Gas работают в патологически усиленном режиме. Даже если в органе только некоторые клетки содержат дефектный Gas, этого может быть достаточно, чтобы нарушить работу всего органа или целой системы [6].
Gas важна для работы множества органов и систем. Через Gas передают сигнал гормоны, которые активируют функции щитовидной железы, половых желез, надпочечников, меланоцитов, клеток костной ткани и клеток, вырабатывающих гормон роста [5]. Еще с Gas связаны β2-адренорецепторы [7]. Вообще, сложно найти орган, в клетках которого не было бы рецепторов, ассоциированных с Gas [2]. Поэтому нарушение ее активности приводит к мультисистемным заболеваниям. Мультисистемное заболевание, которое развивается из-за гиперактивности Gas, называется синдромом МакКьюна—Олбрайта—Брайцева, МОБ [1].
Основные секторы болезни: скелет, кожа, эндокринная система
Для синдрома МакКьюна—Олбрайта—Брайцева характерны три компонента: фиброзная дисплазия, пятна «кофе-с-молоком», гиперфункция эндокринных желез. Диагноз ставится, если есть два из этих трех компонентов [1].
Фиброзная дисплазия, ФД
Фиброзная дисплазия — патология скелета, при которой нормальная костная ткань замещается фиброзной массой [1].
У фиброзной массы три особенности:
- «Мягкость». Фиброзные массы не способны выдерживать нагрузки, которые приходятся на скелет, из-за чего кости искривляются [1].
- Прогрессия. Фиброзные массы могут расти и деформировать скелет. В таких случаях очаги ФД в ногах начинают мешать ходьбе, очаги в позвоночнике — нарушать осанку, очаги в черепе — изменять черты лица и влиять на зрение, слух и зубы [1], [11].
- Болезненность. Болеть может даже единственный очаг ФД. По ощущениям боль может быть незначительной или интенсивной. В одном исследовании очаги ФД в ногах и ребрах вызывали более сильную боль, чем в черепе и руках [12]. В то же время, боль от очагов ФД в черепе может быть такой сильной и частой, что ухудшает качество жизни [13].
Прогрессирующая ФД с болевым синдромом и деформациями скелета — это вариант, а не обязательная перспектива. Фиброзная дисплазия может быть представлена очагами, о которых человек не догадывается, пока не сделает рентгенографию или компьютерную томографию по другому поводу [1], [14].
Мальчик 8 лет ушиб ногу, ему сделали рентгенографию стопы и обнаружили признаки фиброзной дисплазии. До этого он жаловался на боль в ноге, но она была не сильной, жить не мешала, и врачи интерпретировали ее как боль роста [15].
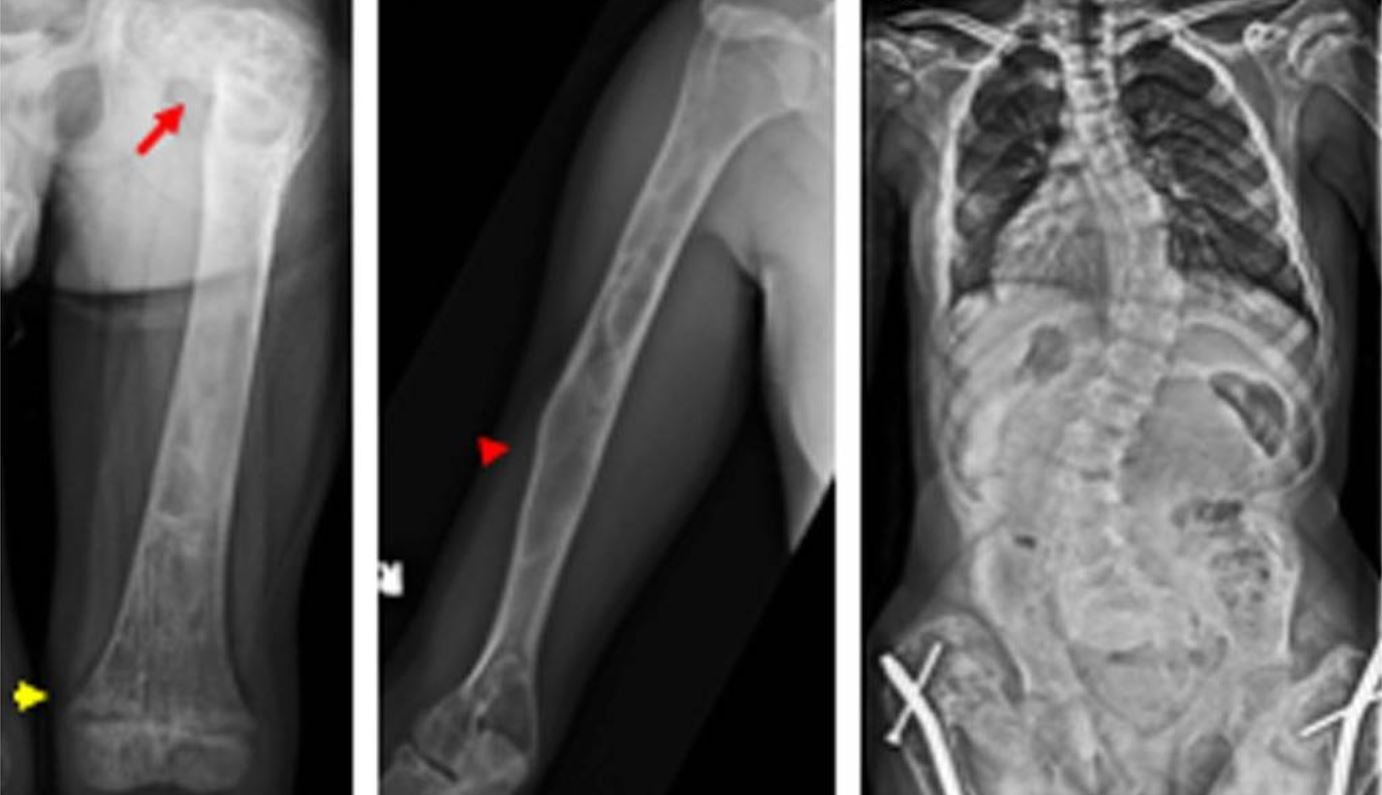
Рисунок 3. Рентгенограммы костей скелета с очагами ФД. Красные стрелки указывают на очаги ФД. На рентгенограммах они выглядят как более «прозрачные» участки по сравнению с нормальной костной тканью. На правой рентгенограмме — искривленный позвоночник с обширными очагами ФД.
Пятна «кофе-с-молоком»
Пятна — очаги гиперпигментации кожи с неровными «географическими» краями, от едва заметных до охватывающих большую часть тела. Эти пятна заметны при рождении или появляются чуть позднее [16]. Пятна располагаются по линиям Блашко. Так называются линии, которые соответствуют путям миграции клеток кожи в ходе эмбриогенеза [17]. Обычно их не видно, но при синдроме МОБ эти линии проступают в виде пятен.
Пятна при синдроме МОБ:
- Не коррелируют с тяжестью болезни [14], [16]. Это значит, что пятна могут быть большими, а другие компоненты синдрома при этом выражены минимально.
- Не связаны с локализацией других проявлений. Пятна могут быть на одной стороне тела, а очаги фиброзной дисплазии — на другой, или пятна могут быть едва заметными, зато другие проявления синдрома — очень активными [14].
Гиперфункция эндокринных желез
При синдроме МОБ может быть гиперактивность половых желез, щитовидной железы, коры надпочечников и тех клеток гипофиза, которые вырабатывают гормон роста [1].
Периферическое преждевременное половое развитие (пППР) — самая частая эндокринная гиперфункция при синдроме МОБ, которая развивается из-за повышенной активности половых желез [16].
У девочек пППР при синдроме МОБ проявляется эпизодами кровянистых выделений из влагалища, увеличением молочных желез и ускорением роста [14], [16]. Возникают эти признаки волнами: эпизод кровотечений, увеличение молочных желез и скачок роста, а затем опять все в порядке, и даже молочные железы исчезают. Если во время такого эпизода сделать УЗИ яичников, то можно увидеть в нем кисту. Киста вырабатывает эстроген, из-за которого и появляются признаки пППР. Кисты — временное явление: они появляются и исчезают. Как только киста исчезает, вместе с ней исчезают и проявления пППР, но потом возникает новая киста и вместе с ней снова появляются признаки полового развития. Или новые кисты могут больше не возникать.
| У одной девочки первый эпизод пППР проявился кровянистыми выделениями и увеличением молочных желез. По УЗИ в это время отмечалась киста яичника. Потом она исчезла, но спустя несколько месяцев возникла новая киста. Эстроген-секретирующие кисты возникают по несколько раз в год и продолжают появляться уже во взрослом возрасте, нарушая менструальный цикл и препятствуя зачатию. Из других проявлений при этом — небольшой очаг ФД и пятна кофе-с-молоком [14]. | У другой девочки пППР проявилось увеличением молочных желез и кровянистыми выделениями. Потом все прошло и больше синдром никак себя не проявлял. Девочка выросла, родила ребёнка и вообще забыла о синдроме МОБ. Вспомнила только, когда на рентгенограмме грудной клетки обратили внимание на очаг фиброзной дисплазии в ребре. Он никак себя не проявлял и не мешал жить. |
У мальчиков при синдроме МОБ яички увеличиваются в размерах и меньше уже не становятся. Такое состояние называют макроорхидизмом. Еще яички могут начать вырабатывать тестостерон, и тогда у мальчика будут все признаки преждевременного полового развития: пенис будет увеличиваться, появится половое оволосение и ускорится рост [14], [16].
Врожденный гиперкортицизм — одно из самых редких, но опасных для жизни эндокринных проявлений синдрома МОБ [16]. Гиперкортицизм — это состояние, при котором надпочечники вырабатывают повышенное количество кортизола. Избыток кортизола ведет к синдрому Кушинга.
У младенцев с синдромом Кушинга:
- низкий вес при рождении;
- медленная скорость роста и недобор веса;
- округлое лицо или большие щеки, похожие на щеки бурундука;
- избыточный рост волос на лице, спине, животе;
- частые и тяжелые инфекционные болезни;
- повышенное артериальное давление;
- повышенный сахар крови;
- нефрокальциноз;
- нарушенная работа печени [14], [16], [18].
Могут бы все признаки синдрома Кушинга или только некоторые.
Синдром Кушинга при синдроме МОБ — всегда врожденное состояние. Он развивается только внутриутробно, проявляется при рождении или в первые месяцы жизни [16]. Это не значит, что на первом году у ребенка с синдромом МОБ либо только гиперкортицизм, либо никаких проявлений. Любой другой компонент синдрома может заявить о себе в первые месяцы жизни [14], [16].

Рисунок 5. Компоненты, которые стали причиной обращения к врачу у 55 детей с синдромом МОБ. У всех детей на момент первого визита были пятна цвета «кофе-с-молоком», но не они стали причиной обследования, поэтому пятен в таблице нет.
данные из исследования, которое мы проводили в ФГБУ НМИЦ эндокринологии [14]
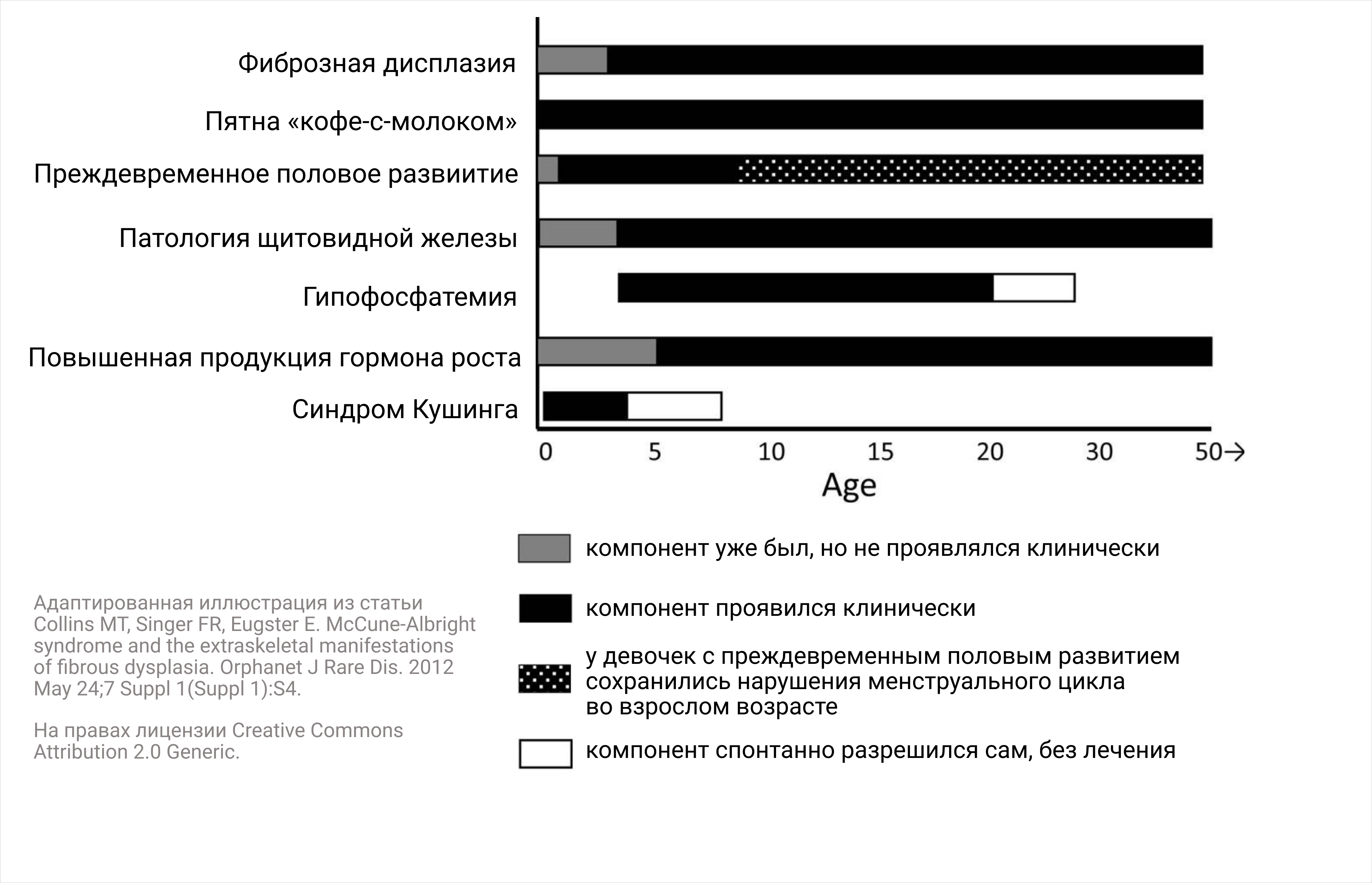
Рисунок 6. Данные 140 пациентов из исследования Collins M. T. et al., 2012. Пятна «кофе-с-молоком» отмечались с рождения, как и проявления синдрома Кушинга. Преждевременное половое развитие манифестировало в течение первого года жизни. До пяти лет проявлялась фиброзная дисплазия, гипофосфатемия и патология щитовидной железы, а после пяти лет диагностировали гиперпродукцию гормона роста.
Гиперфункция щитовидной железы может проявляться двумя вариантами:
- изменением структуры щитовидной железы,
- сочетанием структурных изменений с повышенной продукцией гормонов щитовидной железы [14], [16].
Изменения структуры щитовидной железы на УЗИ часто выглядят как швейцарский сыр — железа вся «в дырках». На самом деле дырок нет, а есть полости, наполненные жидкостью — кисты [16]. Еще щитовидная железа может увеличиваться в объеме. Когда увеличивается вся щитовидная железа, говорят о диффузной гиперплазии щитовидной железы. Если формируются очаги измененной ткани, то их называют узлами. При синдроме МОБ эти узлы увеличиваются в размерах, но при этом, как правило, остаются доброкачественными [14], [16].
Повышенная продукция гормонов щитовидной железы приводит к тиреотоксикозу. Гормоны щитовидной железы — трийодтиронин и тироксин. Они действуют на организм как стимуляторы: разгоняют обмен веществ, увеличивают частоту сердцебиений и давление, ускоряют работу желудочно-кишечного тракта, влияют на сон и психологическое равновесие. При тиреотоксикозе у человека будут проявления избытка этих эффектов: учащенный пульс, раздражительность, неусидчивость, плохой сон, склонность к диарее, потеря веса [19]. Может быть весь набор проявлений или только некоторые симптомы.
Повышенная секреция гормона роста. Другое название гормона роста — соматотропный гормон, СТГ. Somatos по гречески означает «тело», а tropos — направление, так что дословно получаем «гормон, направленный на тело», а по сути — гормон, стимулирующий тело. СТГ повышает продукцию факторов роста и приводит к росту скелета, хрящей и внутренних органов, а еще может повышать сахар крови и артериальное давление [20–22]. У детей в скелете зоны роста открыты, поэтому при избытке СТГ дети начинают ускоряться в росте [20], [21]. При синдроме МОБ избыток СТГ осложняет течение фиброзной дисплазии: он стимулирует прогрессию очагов в черепе, которая может привести к потере зрения [23].
Дополнительные варианты: другие компоненты синдрома МОБ
Фиброзная дисплазия, пятна «кофе-с-молоком» и эндокринная гиперфункция — это классическая триада признаков синдрома МОБ, но могут быть и другие проявления.
Патология желудочно-кишечного тракта и новообразования
При синдроме МОБ могут быть:
- миксомы,
- неонатальный холестаз,
- опухоли поджелудочной железы,
- гепатоцеллюлярные аденомы,
- кисты желчного протока,
- рак молочной железы,
- опухоли яичников и яичек,
- рак щитовидной железы,
- злокачественные опухоли костной ткани [1].
Возможность новообразований при синдроме МОБ не удивляет, так как GNAS — онкоген. Мутации в нем находят в опухолях разных органов и тканей [1], [24].
Тахикардия
Тахикардия — учащенное сердцебиение. При синдроме МОБ она может быть проявлением тиреотоксикоза, а может встречаться и при нормальной функции щитовидной железы.
Есть два возможных объяснения тахикардии при синдроме МОБ:
- Активация Gas, которая в норме проводит сигнал от бета2-адренорецепторов. Эти рецепторы есть в клетках сердечной мышцы. И вот, эти клетки начинают работать так, как будто на них действует адреналин, хотя все дело в неадекватной Gas [16].
- Компенсаторная реакция сердечно-сосудистой системы на тяжелую фиброзную дисплазию. Очаги ФД полны кровеносных сосудов, которые «забирают» много крови. Поэтому сердцу требуется больше усилий, чтобы поставлять достаточно крови ко всем органам и системам [16].
Гипофосфатемический рахит
Гипофосфатемический рахит — не столько проявление синдрома МОБ, сколько фиброзной дисплазии. Клетки фиброзных масс вырабатывают FGF23 [1]. FGF23 — это гормон, который отвечает за то, чтобы фосфора в крови не было слишком много. Избыток FGF23 приводит к усиленному выведению фосфора с мочой и снижению его уровня в крови [25]. Из-за дефицита фосфора в крови уменьшается мышечная сила, потому что фосфор — участник энергообмена в клетках [26]. Чтобы компенсировать этот дефицит, фосфор начинает выходить из своего депо — костной ткани. Из-за дефицита фосфора в костях, кости становятся «мягче», и это может стать дополнительной причиной для искривления ног [25].

Рисунок 7. Частота фиброзной дисплазии, пятен «кофе-с-молоком», гиперактивности эндокринных желез и других компонентов у 55 детей с синдромом МОБ. Если каких-то компонентов нет в таблице, это не значит, что их не может быть при синдроме МОБ. Это значит, что у 55 детей на момент обследования других компонентов мы не обнаружили [14].
данные исследования, которое мы проводили в ФГБУ НМИЦ эндокринологии [14]
Ставки: от легкого течения до тотального поражения
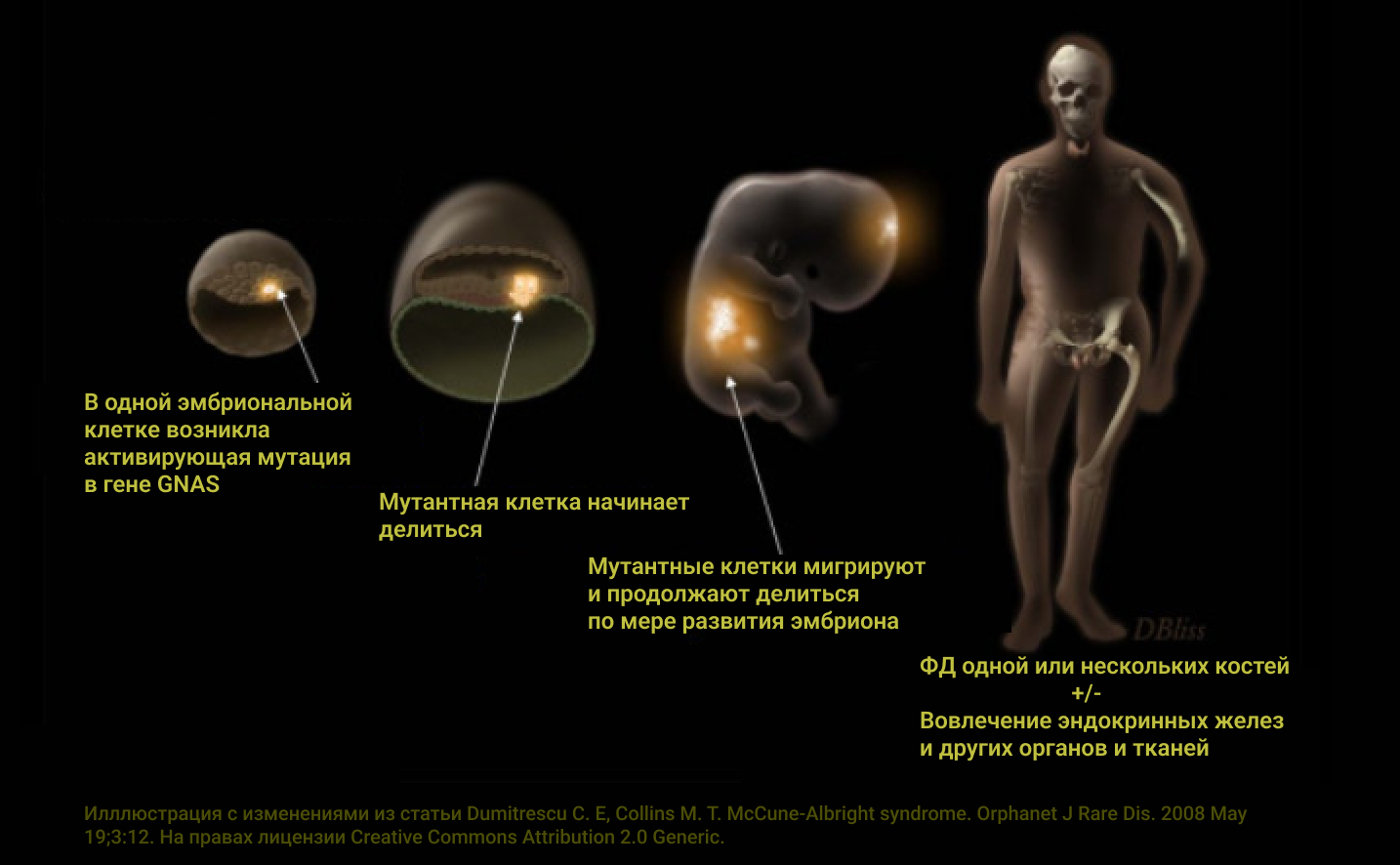
Количество и тяжесть проявлений синдрома МОБ может быть любой [1], [14]. Фиброзная дисплазия может ограничиться одной костью или распространиться на весь скелет. Гиперфункция яичников может проявиться парой эпизодов кровянистых выделений в детстве или постоянно нарушать менструальный цикл и мешать зачатию. Изменения в щитовидной железе могут быть едва заметны при УЗИ или мешать так сильно, что щитовидную железу приходится удалять. Пятна «кофе-с-молоком» могут быть маленькими или занимать большую площадь поверхности тела. И так далее. Сколько будет проявлений и насколько тяжелыми они будут зависит от того, когда появилась мутация в гене GNAS.
Синдром МОБ возникает из-за соматической мутации в GNAS. «Соматическая» означает, что мутация не была унаследована от матери или отца вместе с половой клеткой, а возникла недолго после образования зиготы, в одной какой-то клетке. Чем раньше возникла мутация, тем в большее количество органов попадут потомки мутантной клетки, тем больше будет проявлений синдрома [1].
Из-за того, что мутация — соматическая, у синдрома МОБ есть несколько особенностей:
- Вариабельность клинических проявлений. Чем в большем количестве органов есть мутантные клетки, тем больше компонентов синдрома. Чем больше мутантных клеток в органе, тем интенсивнее проявление.
- Сложность молекулярно-генетической диагностики. Если взять образец крови, выделить из клеток крови ДНК и поискать там мутацию в GNAS, то вряд ли она найдется. Больше шансов, если выделять ДНК из пораженного участка органа, например, очага фиброзной дисплазии. Но в практике в молекулярно-генетической диагностике нужды нет: клинических проявлений достаточно, чтобы поставить диагноз [1], [14].
- Ненаследуемость. Человек с синдромом МОБ не передаст свою мутацию ребенку [1]. Вероятность того, что источником генетического материала станет половая клетка с мутацией очень мала, ведь при синдроме МОБ в яичниках и яичках не все половые клетки — мутантные. Но если половая клетка все-таки несет в себе активирующую мутацию GNAS, то у зиготы вряд ли есть шансы на развитие: настолько важны продукты гена GNAS для формирования и функционирования органов и тканей [28].
Риски и прогнозы: редкий синдром, непредсказуемое течение
Синдром МОБ — редкая патология, поэтому вероятность столкнуться с ним низкая. Он встречается от 1 случая на 100 000 до 1 случая на 1 000 000 человек [27], [29]. Разброс связан с тем, что распространенность синдрома смотрели только в некоторых странах и в них получали такие данные.
Спрогнозировать, как будет протекать болезнь практически невозможно. Можно предполагать, что чем раньше и больше компонентов появилось в раннем детстве, тем тяжелее будет синдром. Еще можно сделать несколько прогнозов по ФД, но по другим компонентам — нет.
Большинство признаков синдрома МОБ развиваются еще в детстве [16]. Тяжелая фиброзная дисплазия возникает в первые годы жизни, примерно до 5 лет. После 5 лет очаги тоже могут появиться, но вряд ли эти «поздние» очаги буду значимыми для качества жизни и здоровья [1], [30]. Очаги ФД в костях рук и ног прогрессируют чаще всего до окончания периода детства. Пик патологических переломов приходится на период от 6 до 10 лет и стихает к окончанию подросткового периода [31].
Итоги: как заподозрить синдром МОБ и куда обратиться
Синдром МакКьюна—Олбрайта—Брайцева ставят, когда есть два критерия из трех:
- пятна «кофе-с-молоком»,
- фиброзная дисплазия,
- проявление эндокринной гиперфункции.
Компоненты могут манифестировать уже на первом году жизни. Пятна «кофе-с-молоком» заметны, как правило, с рождения, но если нет других жалоб и намеков на синдром МОБ, то они — не повод для обследования, так как встречаются и у здоровых людей [32]. Фиброзная дисплазия может обнаружить себя патологическим переломом, изменением походки, болью в костях. Или она может никак не проявляться и тогда ее выявляют случайно. Эндокринных гиперфункций может быть несколько, из них самое частое первое проявление — периферическое преждевременное половое развитие [1], [14].
Первое, что делают люди, узнав диагноз, — идут гуглить. Это естественно, но проблема в том, что в поиске выпадают публикации самых тяжелых случаев, и такие варианты развития событий люди начинают прикладывать на себя. Не надо так. При синдроме МОБ невозможно предсказать, сколько компонентов будет у конкретного человека и насколько они повлияют на качество жизни и внешний вид. Поэтому заниматься самопрогнозированием не стоит, лучше принести все свои вопросы и тревоги специалисту.
Обращаться стоит к тем врачам, которые уже сталкивались с этим редким синдромом или готовы вникать в заболевание. Основные врачи при синдроме МОБ — детский эндокринолог и хирург-специалист по ФД. В зависимости от расположения очагов ФД лечащим хирургом может быть ортопед, или челюстно-лицевой хирург, или нейрохирург. Еще могут понадобиться консультации гинеколога, офтальмолога, оториноларинголога, стоматолога, гастроэнтеролога, онколога — все зависит от количества и тяжести компонентов.
Один из центров, специализирующихся на синдроме МОБ — ФГБУ «НМИЦ эндокринологии»: там могут подтвердить диагноз и определить тактику ведения по эндокринным компонентам. Специалист по фиброзной дисплазии конечностей — детский хирург-ортопед Михаил Анатольевич Петров, на момент публикации статьи работает в Ильинской больнице. Опыт лечения фиброзной дисплазии черепа есть у врачей во ФГАУ «НМИЦ нейрохирургии им. Н. Н. Бурденко» и в ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии».
Тактика ведения при синдроме МОБ может быть разной. Кому-то понадобиться лечиться и наблюдаться в течение жизни, а кто-то столкнется с проявлениями в детстве и потом думать забудет о своем состоянии. В любом случае, синдром этот редкий и вероятность встретиться с ним в качестве пациента мала. Но если это случилось, то надеюсь, что статья была вам полезна. А если вы врач и специализируетесь на этом синдроме, то напишите в комментариях: давайте знакомиться и вместе решать задачи людей с синдромом МОБ.
Литература
- Alison M Boyce, Michael T Collins. (2020). Fibrous Dysplasia/McCune-Albright Syndrome: A Rare, Mosaic Disease of Gα s Activation. Endocrine Reviews. 41, 345-370;
- Lee S. Weinstein, Jie Liu, Akio Sakamoto, Tao Xie, Min Chen. (2004). Minireview: GNAS: Normal and Abnormal Functions. Endocrinology. 145, 5459-5464;
- Viktoriya Syrovatkina, Kamela O. Alegre, Raja Dey, Xin-Yun Huang. (2016). Regulation, Signaling, and Physiological Functions of G-Proteins. Journal of Molecular Biology. 428, 3850-3868;
- Mingyang Zhang, Ting Chen, Xun Lu, Xiaobing Lan, Ziqiang Chen, Shaoyong Lu. (2024). G protein-coupled receptors (GPCRs): advances in structures, mechanisms and drug discovery. Sig Transduct Target Ther. 9;
- Lee S. Weinstein, Shuhua Yu, Dennis R. Warner, Jie Liu. (2001). Endocrine Manifestations of Stimulatory G Protein α-Subunit Mutations and the Role of Genomic Imprinting. Endocrine Reviews. 22, 675-705;
- Lee S. Weinstein, Andrew Shenker, Pablo V. Gejman, Maria J. Merino, Eitan Friedman, Allen M. Spiegel. (1991). Activating Mutations of the Stimulatory G Protein in the McCune–Albright Syndrome. N Engl J Med. 325, 1688-1695;
- Ronald C. Rubenstein, Maurine E. Linder, Elliott M. Ross. (1991). Selectivity of the .beta.-adrenergic receptor among Gs, Gi's, and Go: assay using recombinant .alpha. subunits in reconstituted phospholipid vesicles. Biochemistry. 30, 10769-10777;
- McCune D.J. (1936). Osteitis fibrosa cystica: the case of a nine year old girl who also exhibits precocious puberty, multiple pigmentation of the skin and hyperthyroidism. Am. J. Dis. Child. 52, 743–747;
- Albright F., Butler A., Hampton A. O., Smith P. (1937). Syndrome Characterized by Osteitis Fibrosa Disseminata, Areas of Pigmentation and Endocrine Dysfunction, with Precocious Puberty in Females. N. Engl. J. Med. 216, 727–746;
- Брайцев Б.Р. (1928). Osteodystrophia fibrosa localisata. «Вестник хирургии и пограничных областей». 301–315;
- AB Burke, MT Collins, AM Boyce. (2017). Fibrous dysplasia of bone: craniofacial and dental implications. Oral Diseases. 23, 697-708;
- Bas C J Majoor, Eva Traunmueller, Werner Maurer-Ertl, Natasha M Appelman-Dijkstra, Andrea Fink, et. al.. (2019). Pain in fibrous dysplasia: relationship with anatomical and clinical features. Acta Orthopaedica. 90, 401-405;
- Camryn Berry, Alison M. Boyce, Leonard B. Kaban, Zachary S. Peacock, Michael Mannstadt, et. al.. (2025). Identifying Pain Subtypes in Patients With Craniofacial Lesions of Fibrous Dysplasia/McCune-Albright Syndrome. Journal of Oral and Maxillofacial Surgery. 83, 366-373;
- Маказан Н.В. Роль нарушений пострецепторного сигналинга в развитии мультигормональной резистентности и автономной гиперфункции эндокринных желез у детей: дисс. ... канд. мед. наук. — Москва, 2017. — 158 с.;
- Muhammad Kassim Javaid, Alison Boyce, Natasha Appelman-Dijkstra, Juling Ong, Patrizia Defabianis, et. al.. (2019). Best practice management guidelines for fibrous dysplasia/McCune-Albright syndrome: a consensus statement from the FD/MAS international consortium. Orphanet J Rare Dis. 14;
- Michael T Collins, Frederick R Singer, Erica Eugster. (2012). McCune-Albright syndrome and the extraskeletal manifestations of fibrous dysplasia. Orphanet Journal of Rare Diseases. 7, S4;
- Vered Molho-Pessach, Julie V. Schaffer. (2011). Blaschko lines and other patterns of cutaneous mosaicism. Clinics in Dermatology. 29, 205-225;
- Rebecca J. Brown, Marilyn H. Kelly, Michael T. Collins. (2010). Cushing Syndrome in the McCune-Albright Syndrome. The Journal of Clinical Endocrinology & Metabolism. 95, 1508-1515;
- Simone De Leo, Sun Y Lee, Lewis E Braverman. (2016). Hyperthyroidism. The Lancet. 388, 906-918;
- L Mizera. (2018). Cardiovascular Complications Of Acromegaly. Acta Endo (Buc). 14, 365-374;
- Bello M.O., Garla V.V. Gigantism and Acromegaly. StatPearls. Treasure Island (FL): StatPearls Publishing, 2024;
- Sajjad Ali Khan, Nanik Ram, Muhammad Q Masood. (2021). Patterns of Abnormal Glucose Metabolism in Acromegaly and Impact of Treatment Modalities on Glucose Metabolism. Cureus;
- Carolee M. Cutler, Janice S. Lee, John A. Butman, Edmond J. FitzGibbon, Marilyn H. Kelly, et. al.. (2006). LONG-TERM OUTCOME OF OPTIC NERVE ENCASEMENT AND OPTIC NERVE DECOMPRESSION IN PATIENTS WITH FIBROUS DYSPLASIA. Neurosurgery. 59, 1011-1018;
- Morgan O'Hayre, José Vázquez-Prado, Irina Kufareva, Eric W. Stawiski, Tracy M. Handel, et. al.. (2013). The emerging mutational landscape of G proteins and G-protein-coupled receptors in cancer. Nat Rev Cancer. 13, 412-424;
- Imel E.A., Econs M.J. (2007). Fibrous dysplasia, phosphate wasting and fibroblast growth factor 23. Pediatr. Endocrinol. Rev.. 4, 434–439;
- Dominik H. Pesta, Dimitrios N. Tsirigotis, Douglas E. Befroy, Daniel Caballero, Michael J. Jurczak, et. al.. (2016). Hypophosphatemia promotes lower rates of muscle ATP synthesis. FASEB j.. 30, 3378-3387;
- Claudia E Dumitrescu, Michael T Collins. (2008). McCune-Albright syndrome. Orphanet J Rare Dis. 3;
- R. Happle. (1986). The McCune‐Albright syndrome: a lethal gene surviving by mosaicism. Clinical Genetics. 29, 321-324;
- Maartje E Meier, Emese Vágó, Bo Abrahamsen, Olaf M Dekkers, Erzsébet Horváth-Puhó, et. al.. (2024). Incidence and Prevalence of Fibrous Dysplasia/McCune-Albright Syndrome: A Nationwide Registry-Based Study in Denmark. The Journal of Clinical Endocrinology & Metabolism. 109, 1423-1432;
- Elizabeth S Hart, Marilyn H Kelly, Beth Brillante, Clara C Chen, Navid Ziran, et. al.. (2007). Onset, Progression, and Plateau of Skeletal Lesions in Fibrous Dysplasia and the Relationship to Functional Outcome. Journal of Bone and Mineral Research. 22, 1468-1474;
- Arabella I Leet, Caroline Chebli, Harvey Kushner, Clara C Chen, Marilyn H Kelly, et. al.. (2004). Fracture Incidence in Polyostotic Fibrous Dysplasia and the McCune-Albright Syndrome. Journal of Bone and Mineral Research. 19, 571-577;
- Jha S.K., Mendez M.D. Cafe Au Lait Macules. StatPearls. Treasure Island (FL): StatPearls Publishing, 2025.