Сказ о том, как протеинкиназа память создавала
01 апреля 2024
Сказ о том, как протеинкиназа память создавала
- 923
- 0
- 6
Снятся ли лабораторным мышам лабиринты?
Рисунок в полном размере.
иллюстрация автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Всего 20 лет назад ученые открыли «молекулу памяти». Ее обнаружили не только у человека, но и у виноградных улиток, мышей — и даже у мух дрозофил. Найденный белок PKMζ помогает создавать воспоминания, которые сохраняются на десятки лет. Также, помимо запоминания, был изучен процесс стирания памяти. В этой статье вы узнаете, как молекула белковой природы может долгие годы поддерживать свое существование и можем ли мы теперь стирать ненужные воспоминания, как это делали спецагенты в популярном фантастическом фильме из 90-х «Люди в черном».
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»

Рисунок 1. PKMζ хранит воспоминание о местоположении награды в лабиринте, но кто-то может помешать ей. ZIP (Zeta Inhibitory Peptide) — пептид, который в нашей истории является такой преградой.
рисунок автора
Однозначно ответить на вопрос, что такое память, нельзя, но если рассматривать ее на молекулярно-клеточном уровне, то мы окажемся перед структурами под названием нервные синапсы [1]. Синапс — это место соединения нейронов, через которое происходит передача сигналов. Относительно способа передачи сигнала синапсы бывают электрическими и химическими. Нам будут наиболее интересны химические синапсы, потому что их подавляющее количество в нашей нервной системе, и в их строении имеются белковые рецепторы. В более ранней статье на «Биомолекуле» — «Как происходит выделение нейромедиатора» [1] — вы можете подробнее ознакомиться со строением синапса и передачей сигнала через него.
После осознания существования рецепторов на мембранах нейронов уже можно подойти к их специализации. В контексте памяти для нас наиболее интересны AMPA- и NMDA-рецепторы. Их работа заключается в восприятии чего-либо и в дальнейшей передаче информации об этом событии. В реальности так и есть: AMPA и NMDA воспринимают глутамат, а по совместительству являются еще и ионными каналами. От количества этих рецепторов зависит сила синапса, а увеличение этой силы называется долговременной потенциацией [2].
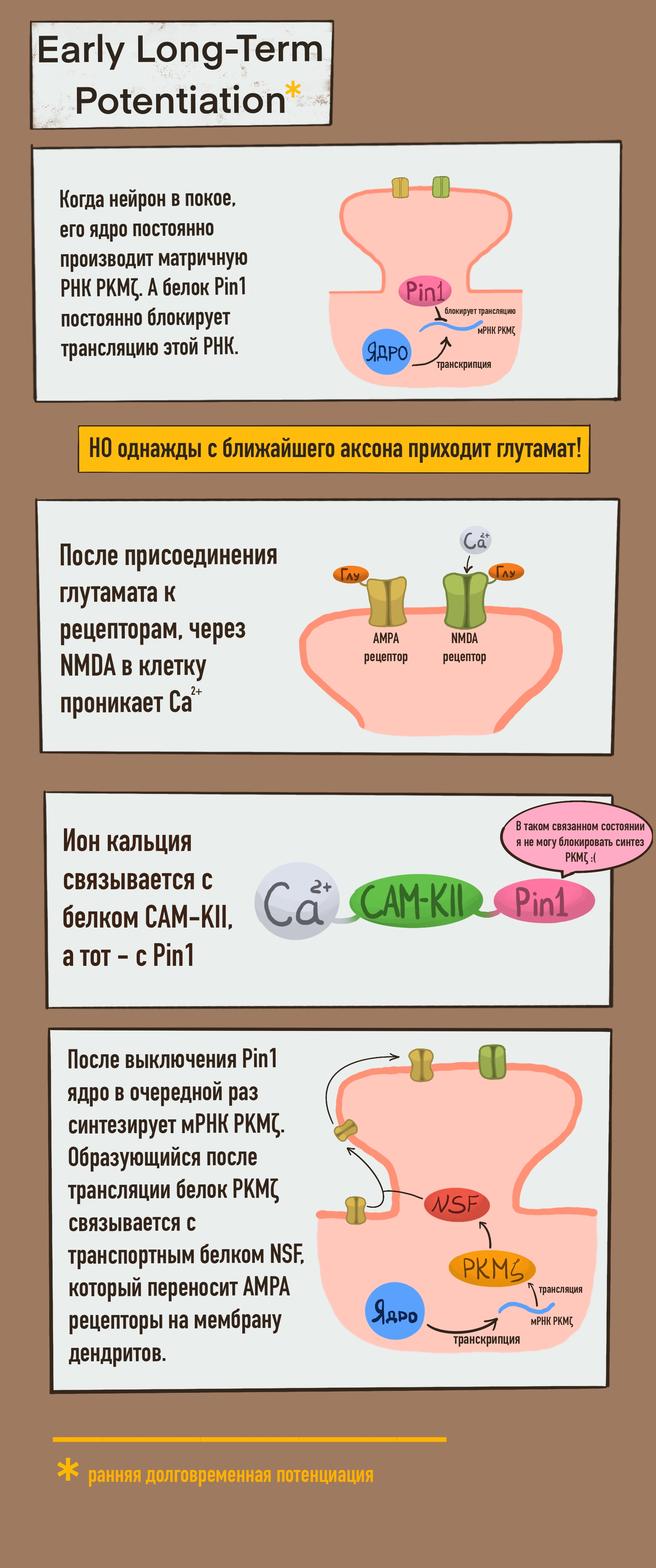
Долгое время ученые считали, что процесс долговременной потенциации (LTP, Long Term Potentiation) довольно прост. Позже стало известно, что LTP состоит более чем из одной стадии [3]. В настоящее время в ней выделяется два этапа:
- Ранняя долговременная потенциация (Early LTP, рис. 2А): выделение медиатора, активация рецепторов (NMDA), прохождение ионов внутрь нейрона, активация внутриклеточных ферментов и движение дополнительных рецепторов AMPA к постсинаптической мембране. Последнее из перечисленных действий происходит благодаря гвоздю нашей программы — протеинкиназе М-зета (далее — PKMζ).
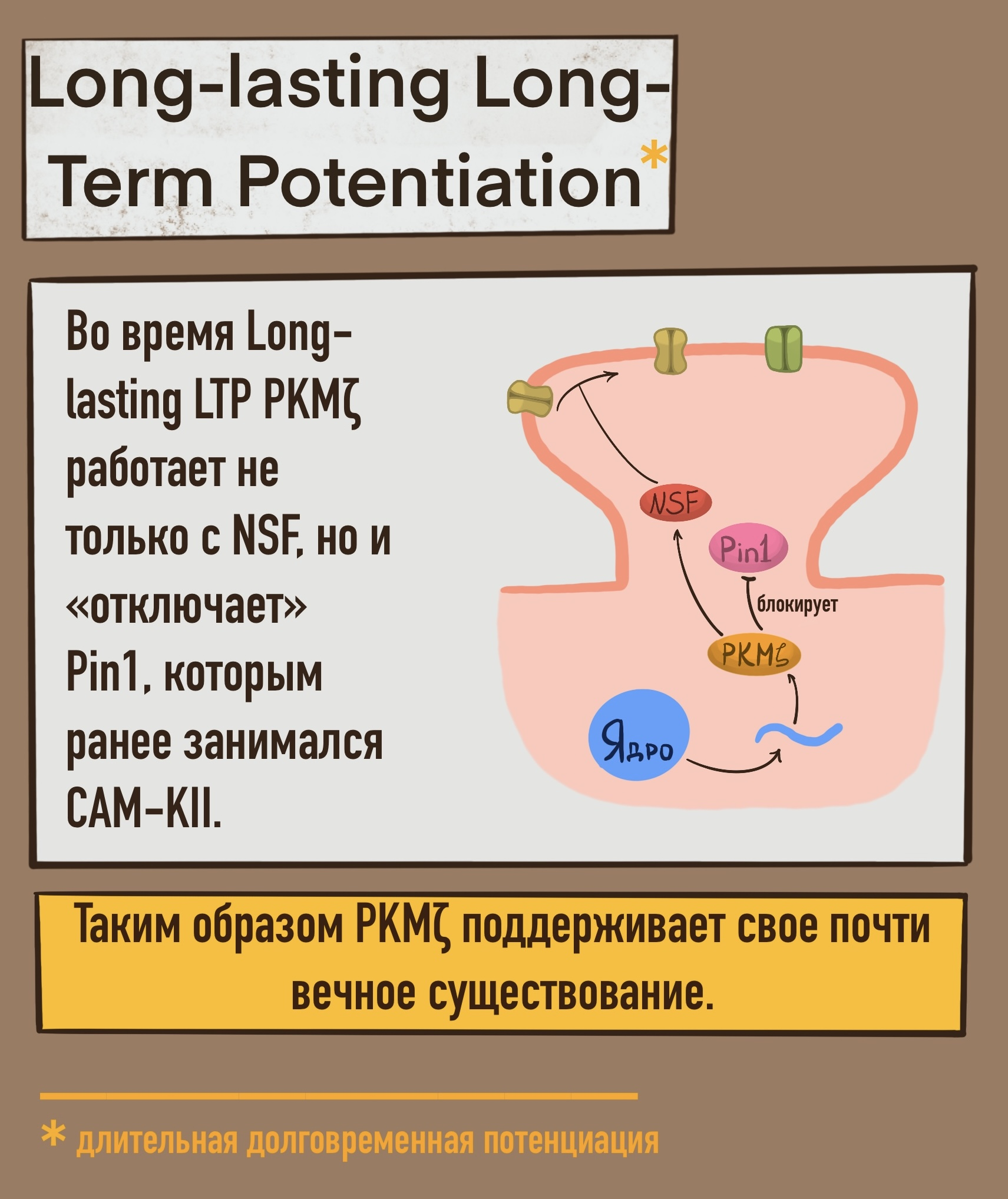
- Длительная долговременная потенциация (Long-lasting LTP, рис. 2Б) — стадия, длящаяся дольше нескольких часов. Здесь происходит постоянный синтез «молекулы памяти».
Как видно из рисунка 2А, функцией Pin1 является «выключение» трансляции белка PKMζ путем блокировки матричной РНК PKMζ. Когда эта проблема оказывается решенной, PKMζ после трансляции связывается с транспортным белком NSF, функцией которого в общем смысле является работа с клеточными мембранами. В нашем случае NSF, связавшись с PKMζ, переносит AMPA рецепторы на постсинаптическую мембрану дендритов. Так повышается восприимчивость нейрона к глутамат-сигналам, то есть его синаптическая сила. Благодаря этому наша крыса способна ближайшие пару часов помнить, как она прошла лабиринт.
Если на первом этапе долговременной потенциации белок Pin1, регулирующий трансляцию PKMζ, связывался в молекулярном каскаде, то что делать позже, когда в нейроне синтезируется свеженькая молекула Pin1, охотно желающая прервать наши воспоминания? Эта проблема решается на этапе длительной долговременной потенциации (Long-lasting Long-Term Potentiation, рис. 2Б). Дело в том, что PKMζ способна связываться не только с NSF, но и с Pin1. И — вуаля! «Молекула памяти» становится практически вечной. Крыса сможет пройти лабиринт быстрее во второй раз, а если пройдет его несколько раз, то запомнит надолго.
Теперь, когда мы разобрали возможный механизм памяти, вы спросите, с чего ученые решили, что весь мир должен крутиться именно вокруг PKMζ? Ведь уже в 1970-1980-х гг. эксперименты на таких беспозвоночных, как морской заяц (Aplysia californica) и плодовая муха (Drosophila melanogaster) показали, что в процессах памяти участвует множество белков из класса протеинкиназ [4], [5].
Но значение PKMζ было установлено, когда удалось остановить каскад, в котором она участвует, и затем — оценить последствия. В 2007 году Тодд Сактор (рис. 3) из Центра нейронных и поведенческих наук и его израильские коллеги из Института им. Вейцмана опубликовали прорывную статью [6], где рассказали об экспериментах по «ингибированию» PKMζ у крыс с помощью молекулы ZIP (Zeta inhibitory peptide). Они показали — ничего, кроме памяти, при использовании ZIP не нарушается. Тогда считалось, что ZIP воздействует напрямую на протеинкиназу, но в свете последних исследований известно, что они выполняют противоположную друг другу работу. Если PKMζ управляет механизмом по перемещению рецепторов на дендрит, то ZIP — по их удалению с дендрита.

Рисунок 3. Тодд Сактор в своей лаборатории в Бруклине, Нью-Йорк.
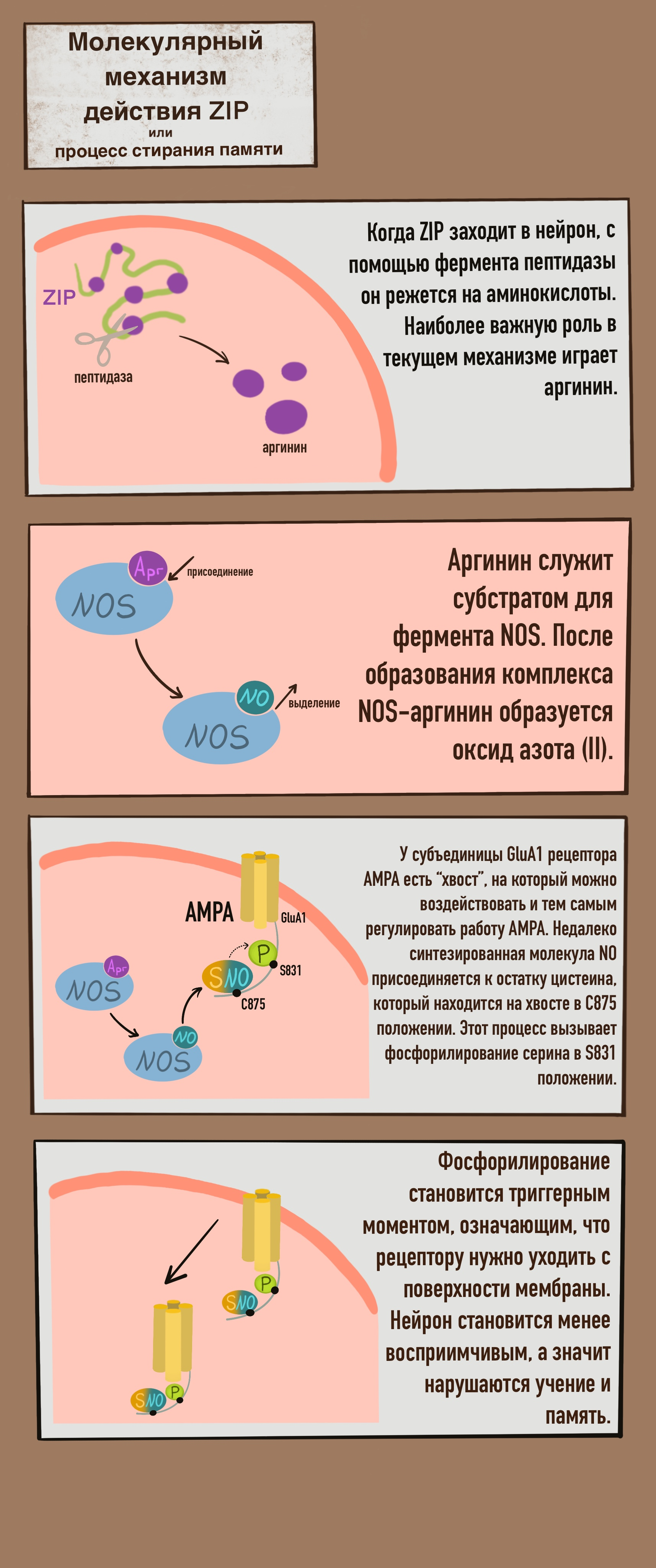
Рисунок 4. Молекулярный механизм действия ZIP. NOS — синтаза оксида азота (nitric oxide synthase), NO — оксид азота (II), SNO — соединение из остатка цистеина и оксида азота (II), P — фосфатная группа.
рисунок автора
В 2020 году израильские и британские ученые вместе опубликовали статью [7], где был разобран молекулярный механизм действия ZIP (рис. 4). Актуальность данной работы заключается не только в предоставлении возможной схемы молекулярных превращений, но и в объяснении, как именно в этом процессе задействован оксид азота (II). Ранее было известно лишь, что химические свойства NO позволяют как подавлять функцию белков, так и активировать синтез новых [8].
Теперь же открылись новые подробности. При прохождении в клетку ZIP миристилируется, то есть к N-концу полипептида присоединяется остаток миристиновой кислоты. В клетке полипептид подвергается нарезке ферментом пептидазой. Далее главную роль из ZIP-нарезки будет играть аргинин, который является субстратом для синтазы оксида азота (NOS, nitric oxide synthase). После образования фермент-субстратного комплекса (NOS-аргинин) в клетке синтезируется оксид азота (II). AMPA рецептор состоит из четырех субъединиц и может содержать их в разных комбинациях, вот их названия: GluA1, GluA2, GluA3 и GluA4. GluA1 содержит цитоплазматический хвост, нам важны два участка этого хвоста: C875 и S831. Только что синтезированная молекула NO присоединяется к остатку цистеина в C875 положении, данная реакция называется S-нитрозилированием. Нитрозилирование вызывает фосфорилирование (присоединение фосфатной группы) к остатку серина в S831 положении. Вообще, фосфорилирование белков является одной из самых распространенных реакций, это позволяет включать или выключать функции белков. Донором фосфатной группы является АТФ. После отдачи фосфата АТФ переходит в АДФ. Фосфорилирование приводит к эндоцитозу AMPA-рецептора. При уменьшении количества рецепторов на мембране нейрона уменьшается синаптическая сила и его долговременная потенциация.
Критика открытия
При всей важности открытия, стоит упомянуть, почему мы все еще не умеем по щелчку пальцев стирать воспоминания. С одной стороны, мы стали лучше понимать, как поддерживается долговременная потенциация и как можно на нее воздействовать. С другой стороны, в 2013 году были опубликованы результаты исследований, где мыши без гена PKCζ (а почему нет гена PKMζ, можно прочитать здесь [9]) все равно могли запоминать информацию [10], [11]. Тогда ученые сделали два вывода:
- PKMζ не является единственной «молекулой памяти»;
- ZIP не так уж избирателен и вмешивается не только в процесс с участием PKMζ.
В то же время, 2015 год показал, что предыдущие новости были не такими уж и разочаровывающими: тогда стало известно, что ZIP вовсе эксайтотоксичен по отношению к нейронам [12]. Эксайтотоксичность — это свойство нейромедиаторов, которые могут гиперактивировать AMPA и NMDA рецепторы и тем самым повреждать и убивать нервные клетки. Естественно, память после применения ZIP стиралась, но ценой жизни клеток, поэтому пока что использование данного пептида в качестве инструмента для стирания памяти сомнительно.
Литература
- Как происходит выделение нейромедиатора;
- «Элементы»: «Какой же вклад протеинкиназа М-дзета вносит в формирование памяти?»;
- Emily P Huang. (1998). Synaptic plasticity: Going through phases with LTP. Current Biology. 8, R350-R352;
- Sandybel Ángeles-Durán, Laura E. Ramos-Languren, Martha L. Escobar. (2012). PKMζ inhibition prevents the metaplastic change induced by conditioned taste aversion on insular cortex long-term potentiation in vivo. Reviews in the Neurosciences. 23;
- Todd C. Sacktor. (2011). How does PKMζ maintain long-term memory?. Nat Rev Neurosci. 12, 9-15;
- Reut Shema, Todd Charlton Sacktor, Yadin Dudai. (2007). Rapid Erasure of Long-Term Memory Associations in the Cortex by an Inhibitor of PKMζ. Science. 317, 951-953;
- Alexey Bingor, Tomer Haham, Claire Thornton, Yael Stern-Bach, Rami Yaka. (2020). Zeta Inhibitory Peptide attenuates learning and memory by inducing NO-mediated downregulation of AMPA receptors. Nat Commun. 11;
- Balaban P., Korshunova T. (2011). Network, cellular and molecular mechanisms of plasticity in simple nervous systems. Advances in physiological sciences. 42, 3–19;
- «Элементы»: «Протеинкиназа М-дзета „закрыта“?»;
- Anna M. Lee, Benjamin R. Kanter, Dan Wang, Jana P. Lim, Mimi E. Zou, et. al.. (2013). Prkcz null mice show normal learning and memory. Nature. 493, 416-419;
- Lenora J. Volk, Julia L. Bachman, Richard Johnson, Yilin Yu, Richard L. Huganir. (2013). PKM-ζ is not required for hippocampal synaptic plasticity, learning and memory. Nature. 493, 420-423;
- N. Sadeh, S. Verbitsky, Y. Dudai, M. Segal. (2015). Zeta Inhibitory Peptide, a Candidate Inhibitor of Protein Kinase M , Is Excitotoxic to Cultured Hippocampal Neurons. Journal of Neuroscience. 35, 12404-12411.