
Следы полимеразы alpha
07 марта 2015
Следы полимеразы alpha
- 959
- 0
- 1
ДНК-связывающие белки мешают устранять последствия халатности полимеразы альфа, в итоге стыки фрагментов Оказаки оказываются самыми «МУтабельными».
Рисунок в полном размере.
коллаж автора
-
Автор
-
Редактор
Удвоение генетического материала перед делением клетки — очень точный процесс. Но мутации в геноме не перестают накапливаться, что приводит как к болезням, так и к появлению нового материала для эволюции. Оказывается, одним из механизмов сохранения мутаций может служить связывание белков — полимераз и транскрипционных факторов — с ДНК. Они создают помеху для «выщепления» ошибочных последовательностей, синтезированных неточной ДНК-полимеразой α.
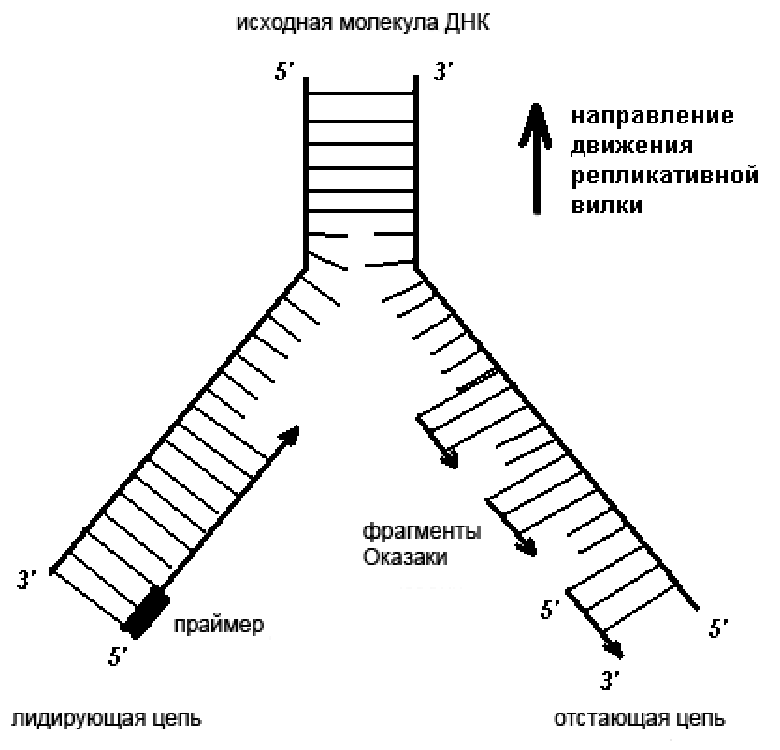
Рисунок 1. Схема репликативной вилки. Новая цепь синтезируется на матрице старой в направлении от 5’- к 3’-концу. При этом одна из цепей может расти непрерывно, а другая — нет (очередное праймирование происходит по мере расплетения ДНК).
с сайта topreferat.znate.ru
Перед тем как поделиться, клетке нужно дублировать свой генетический материал. Процесс удвоения молекул ДНК называется репликацией. Репликация осуществляется и регулируется многими белками. Она должна быть максимально точной, чтобы избежать появления мутаций в ДНК. Механизм удвоения генетического материала у прокариот и эукариот полуконсервативный. То есть после репликации одной двуцепочечной молекулы ДНК получаются две, в каждой из которых одна цепь будет старой (материнской), а другая новой (дочерней) [1]. Образовавшиеся молекулы ДНК почти идентичные. Но их минорные отличия могут играть важную роль в судьбе организма [2], [3].
Немного о ДНК-полимеразах
Ключевыми белками репликации являются ДНК-полимеразы — ферменты, читающие цепочку нуклеотидов и использующие ее как матрицу для синтеза дочерней молекулы ДНК. Важно отметить, что ДНК-полимеразы могут присоединять новый нуклеотид только к предыдущему, потому им всегда нужна «затравка» (праймер). Такие затравки во время репликации синтезирует другой фермент — праймаза. Издержки такого разделения труда заключаются в том, что первым компонентом дочерней цепи становятся рибонуклеотиды, то есть короткие цепочки РНК. К ним полимераза уже может присоединить дезоксирибонуклеотиды. Это делает ДНК-полимераза α. Она удлиняет РНК-затравку, синтезируя небольшую цепочку ДНК (примерно 20 нуклеотидов). Так как репликация должна быть очень точной, то неудивительно, что некоторые ДНК-полимеразы умеют исправлять ошибки своей работы. В первую очередь это касается ферментов, синтезирующих длинные участки цепей. Полимераза α такой редактирующей способностью не обладает, поэтому включает новые нуклеотиды, не «оглядываясь» назад и оставляя много ошибок.
Каждая цепь ДНК имеет направление: у нее есть 3’- и 5’-концы. Важно отметить, что новая молекула ДНК может удлиняться только в одну сторону, так как ДНК-полимеразы умеют добавлять нуклеотиды только к 3’-концу. В начале репликации две цепи материнской ДНК расплетаются в определенном месте, и на их матрицах строятся дочерние цепи в двух направлениях. В одну сторону синтез идет непрерывно, а в другую — с помощью коротких фрагментов, как показано на рисунке 1. Такой механизм обеспечивает удлинение дочерних цепей только от 5’-конца к 3’-концу [4], [5]. Цепь, синтез которой идет короткими фрагментами — фрагментами Оказаки, называется отстающей.
У эукариот синтез всего фрагмента Оказаки от уже продленной полимеразой α затравки осуществляет полимераза δ. Она очень точная и умеет исправлять свои ошибки. Получается, что в начале каждого фрагмента Оказаки есть небольшой фрагмент РНК и участок, синтезированный «малограмотной» полимеразой α. Всё это нужно удалить и застроить заново полимеразой δ, так как ни РНК, ни ошибок в дочерней цепи быть не должно (рис. 2). Поле такого редактирования фрагменты Оказаки сшиваются ДНК-лигазой, образуя непрерывную цепь [6], [7]. Но, несмотря на исправление ошибок, некоторые из них все-таки остаются, и возникают мутации.
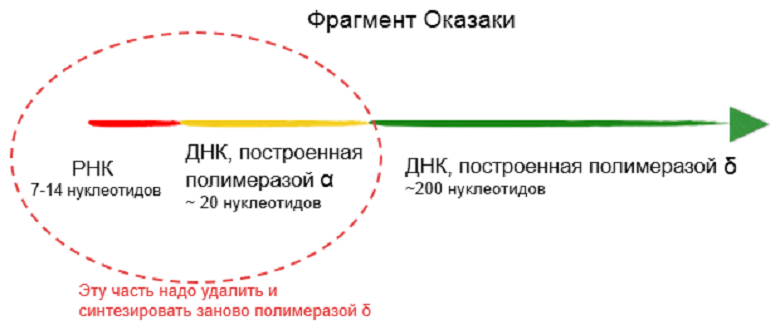
Рисунок 2. Структура фрагмента Оказаки. В начале фрагмента есть часть, которая особенно нуждается в редактировании (ограничена пунктиром). В клетке для этого имеются специальные механизмы. Но если с ДНК быстро свяжется белок, то ошибки в 5’-концевых участках фрагментов Оказаки могут остаться неисправленными.
Возможный механизм сохранения мутаций после репликации
Показано, что мутации в геноме происходят неравномерно [8]. Их распределение зависит от многих факторов, в том числе и от деятельности ДНК-связывающих белков. Авторы недавнего исследования сопоставили распределение мутаций в геноме и участков «стыка» фрагментов Оказаки (рис. 3а). Получилось, что на центр нуклеосомной ДНК приходится как пик мутаций, так и максимальное количество концов фрагментов Оказаки [9].
Такая корреляция была обнаружена и в зонах связывания транскрипционных факторов (рис. 3b). Правда, непосредственно специфические сайты посадки белков мутируют редко. Это, видимо, связано с давлением отбора: если сайт связывания транскрипционного фактора будет поврежден, то может сбиться регуляция важных процессов, что в свою очередь с высокой вероятностью приведет к гибели клетки.
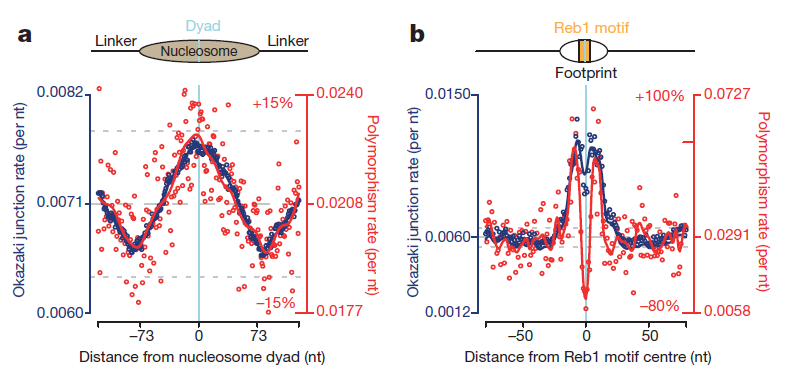
Рисунок 3. Сорреляция нуклеотидного полиморфизма (числа мутаций) и количества стыков фрагментов Оказаки в местах посадки белков (нуклеосомных — слева, транскрипционных регуляторов — справа) на ДНК дрожжей S. cerevisiae.
Синтез фрагментов Оказаки имеет направление. Если мутации связаны с этим процессом, то их распределение тоже должно иметь направление. Выявили, что количество мутаций резко возрастает сразу после окончания фрагмента Оказаки. Особенно в местах связывания белков, служащих барьером для полимеразы δ [10].
Авторы показали, что совпадение мест стыка фрагментов Оказаки и повышенного уровня мутаций является следствием именно того, что в этих участках с ДНК связываются белки. Последовательности ДНК в таких регионах всегда разные, поэтому не имеют прямого отношения к наблюдаемой закономерности.
Как было сказано выше, фрагменты Оказаки синтезируются полимеразами α и δ. Ранее полагали, что в ходе этого процесса большинство нуклеотидов (если не все), синтезированных полимеразой α, удаляются [11], [12]. Это было бы полезно, потому что у полимеразы α нет возможности исправления ошибок. Но авторы исследования предполагают, что «следы» полимеразы α будут оставаться, если с ДНК быстро свяжется белок (рис. 4).
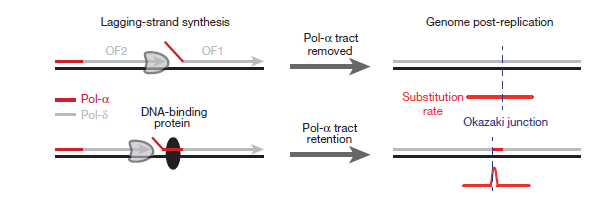
Рисунок 4. Модель закрепления ошибок репликации из-за белка, связанного с началом фрагмента Оказаки.
В подтверждение этой гипотезы ученые показали, что ДНК, синтезированная полимеразой α, остается в геноме и после завершения репликации, а не исключается целиком. Мало того, она составляет 1,5% генома.
Интересно, что найденные закономерности характерны не только для дрожжей, но и для человека. Часто вокруг типичных сайтов связывания белков в ДНК накапливаются мутации. Авторы исследования связывают это именно с активностью полимеразы α.
Литература
- M. Meselson, F. W. Stahl. (1958). The replication of DNA in Escherichia coli. Proceedings of the National Academy of Sciences. 44, 671-682;
- Генная терапия против рака;
- Союз голубоглазых;
- LELAND H. JOHNSTON, KIM A. NASMYTH. (1978). Saccharomyces cerevisiae cell cycle mutant cdc9 is defective in DNA ligase. Nature. 274, 891-893;
- R Okazaki, T Okazaki, K Sakabe, K Sugimoto, A Sugino. (1968). Mechanism of DNA chain growth. I. Possible discontinuity and unusual secondary structure of newly synthesized chains.. Proc. Natl. Acad. Sci. U.S.A.. 59, 598-605;
- L. Balakrishnan, R. A. Bambara. (2013). Okazaki Fragment Metabolism. Cold Spring Harbor Perspectives in Biology. 5, a010173-a010173;
- L. Zheng, B. Shen. (2011). Okazaki fragment maturation: nucleases take centre stage. Journal of Molecular Cell Biology. 3, 23-30;
- Kenneth H. Wolfe, Paul M. Sharp, Wen-Hsiung Li. (1989). Mutation rates differ among regions of the mammalian genome. Nature. 337, 283-285;
- Martin A. M. Reijns, Harriet Kemp, James Ding, Sophie Marion de Procé, Andrew P. Jackson, Martin S. Taylor. (2015). Lagging-strand replication shapes the mutational landscape of the genome. Nature. 518, 502-506;
- Duncan J. Smith, Iestyn Whitehouse. (2012). Intrinsic coupling of lagging-strand synthesis to chromatin assembly. Nature. 483, 434-438;
- Rajika L Perera, Rubben Torella, Sebastian Klinge, Mairi L Kilkenny, Joseph D Maman, Luca Pellegrini. (2013). Mechanism for priming DNA synthesis by yeast DNA Polymerase α. eLife. 2;
- Walsh E. and Eckert K.A. Eukaryotic replicative DNA Polymerases. In: Murakami K. and Trakselis M.A. (Eds.), Nucleic Acid Polymerases. Springer-Verlag Berlin Heidelberg, 2014. 30, 17–41. ISBN 978-3-642-39795-0..





