
Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен
13 декабря 2015
Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен
- 3505
- 1
- 11
Социальная реклама от Ассоциации болезни Альцгеймера (Alzheimer’s association).
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Возможно, всякий мир чем-то сродни слепцу, попавшему в гигантскую паутину. Чем дальше мир двигается, тем больше запутывается в эластичных, клейких ниточках пространства-времени. Эти ниточки влияют на происходящие события, иногда они растягиваются, иногда рвутся или переплетаются, создавая новые формы и образы. А может, мы всё переусложняем. Известный философ Дидактилос выразил альтернативную гипотезу следующей ёмкой фразой: «Да какого чёрта, события просто случаются!»
Болезнь Альцгеймера, загадочная и опасная. Мы не знаем ее причин и лишь предлагаем гипотезы. Переусложняем ли мы всё или слишком упрощаем для удобства работы? Почему бета-амилоидная гипотеза должна уйти, узнаем в этом обзоре.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Перед тем, как человек умрет, вся жизнь
действительно проносится у него перед глазами.
Собственно, этот процесс и называется жизнью.
Терри Пратчетт. Последний континент
(Introitus)
Этот рассказ — о памяти. И кое-что можно сразу припомнить...
«„Но могут ли существовать черепаха в десять тысяч миль длиной и слоны высотой более чем в две тысячи миль?“ — удивляются люди. Это их удивление еще раз доказывает, что человеческий мозг плохо приспособлен для мыслительных процессов — скорее всего, изначально он был предназначен для охлаждения проходящей через него крови. Первым делом человеческий мозг изумляют размеры. Тогда как в размерах нет ничего удивительного. Куда больше поражают сами черепахи, да и слоны — крайне замечательные звери. А тот факт, что где-то во вселенной живет очень большая черепаха, куда менее примечателен, чем факт существования самой обычной черепашки» [1].
А наш разговор, конечно, пойдет о мозге, уютно покоящемся в черепной коробке. В этой озаренной электрическими импульсами комнате хранятся «жизнеизмерители». Клетка за клеткой, они сплетаются в запутанные сети, формируют строгие колонки и рисуют сложнейшие карты. Эти клетки — нейроны, — по сути, повторяют жизненный путь всего человека: они рождаются, несколько раз делятся еще во время эмбрионального развития (хотя из любого правила есть исключения), а дальше «остаются в нас до исполненья [мечты] или до смерти — это всё равно», жертвуя возможностью давать потомков ради создания прочной и надежной сети связей. И пускай наш мозг надежно защищен стеной гематоэнцефалического барьера, укрыт прочными костями черепа и избалован относительно бережным отношением к себе «организма-носителя», чего зачастую не хватает другим органам, нейроны неизбежно накапливают повреждения (в частности, в структуре митохондрий) и погибают достойной смертью на своем посту.
Старение человека всегда сопровождается медленной гибелью нейронов. Но зачастую они могут гибнуть и быстрее — целыми звездными скоплениями уходя в черную пустыню, под покров бескрайней ночи, оставляя разрывы и мертвые участки в некогда отлично работавшей нейронной сети. Подобный процесс ведет к тяжелым повреждениям памяти и нарушениям поведения. Такие ситуации называют нейродегенеративными заболеваниями — от словосочетания «дегенерация нейронов». И если речь в статье заходит о гибели нейронов, почти наверняка хотя бы раз в ней упомянут болезнь Альцгеймера.
(Kyrie)
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, проявляющееся в позднем возрасте. Подобной фразой начинается большинство статей об этой болезни. Впервые описана она была в 1907 году немецким врачом Алоисом Альцгеймером [2] (а в 1995-м даже была заботливо опубликована статья с переводом оригинального сообщения на английский язык [3]). При этом первопричина заболевания до сих пор не ясна. По сути, подходы к терапии болезни основывались на обнаруженных молекулярных патологиях. Сначала оказалось, что при БА нарушена работа холинергической системы мозга. Была выдвинута холинергическая гипотеза развития БА, но методы лечения, основанные на компенсации недостатка ацетилхолина, победить болезнь не позволили. Потом внимание обратили на токсические свойства белка бета-амилоида (Aβ), скопления которого у больных обнаружил еще Альцгеймер. Была выдвинута амилоидная гипотеза (рис. 1) [4], наиболее известная и распространенная по сей день. И что любопытно, методы терапии — в том числе основанные на очистке мозга от амилоида — значимых результатов тоже не дали, однако в этот раз мировое сообщество решило не отказываться от гипотезы, а идти по пути ее усложнения. Сначала «главным врагом» были объявлены не крупные бета-амилоидные фибриллы и бляшки, а небольшие растворимые олигомерные его скопления [5], а сейчас вообще обсуждается уже не токсическая, а скорее сигнальная роль амилоида в патогенезе [6].
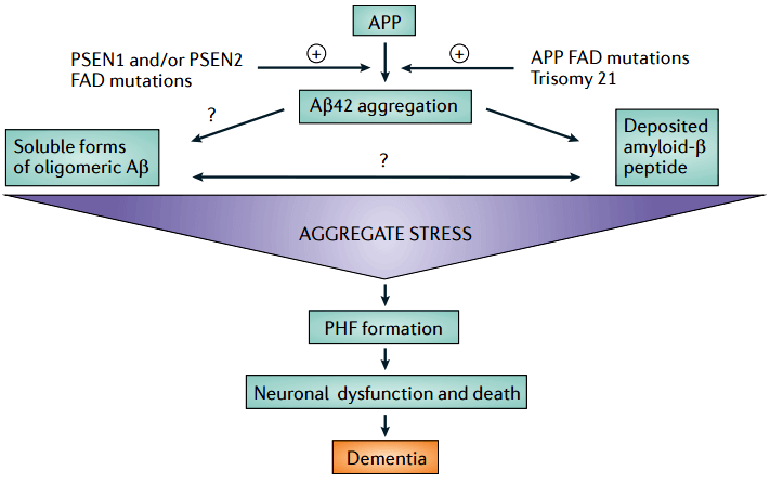
Рисунок 1. Общая схема развития заболевания согласно бета-амилоидной гипотезе. Белок — предшественник амилоида (АПП) разрезается по «амилоидогенному» пути с образованием молекул Aβ длиной 42 аминокислоты. Этот процесс может усиливаться при наличии мутаций, связанных с этим разрезанием или увеличением числа молекул АПП. Скопления амилоида в виде бляшек либо растворимых некрупных скоплений приводят к состоянию окислительного стресса, образованию фибрилл тау-белка и гибели нейронов. Обратите внимание на знаки вопроса.
(Tract)
«Очень важно знать, откуда мы пришли, потому что если не знаешь, откуда ты, то не знаешь, где ты, а если не знаешь, где ты, то не знаешь и куда идёшь. А если ты не знаешь, куда идёшь, то, скорее всего, идёшь не туда» [7]. Поэтому давайте поподробнее рассмотрим все молекулярные симптомы, связанные с болезнью Альцгеймера, — с тем чтобы постараться определить возможную отправную точку в патогенезе болезни. Симптомы эти весьма разнообразны: помимо упомянутых скоплений Aβ и нарушений в работе холинергической системы, чаще всего упоминаются внутриклеточные фибриллы тау-белка и состояние окислительного стресса, в котором находятся нейроны при БА; реже, хотя и несправедливо, заходит речь о нарушениях в метаболизме ионов металлов (железа, цинка и меди), повреждении структуры митохондрий, накоплении липофусцина в клеточных везикулах и патологическом возвращении отдельных нейронов в клеточный цикл.
(Sequence)
Всё где-то начинается, хотя большинство ученых-физиков с этим не согласны. Вопрос о начале всегда бередил людские умы. «Вот, к примеру, — задаемся вопросом мы, — как водитель трактора, расчищающего снег, попадает на работу?» Или: «Откуда составители всевозможных словарей знают, что данное слово пишется именно так, а не иначе?» Нас преследует непреодолимое желание найти точку в переплетающихся, крайне запутанных нитях пространства-времени, в которую можно ткнуть метафорическим пальцем и воскликнуть: ага, именно здесь-то всё и началось [8]! Восклицание авторов бета-амилоидной гипотезы 1992 года было услышано, и следующие 20 лет ученые со всего мира тщательно изучали свойства Aβ. В ходе исследований обнаружилось, например, что примерно у 5% больных заболевание вызвано мутацией в одном из нескольких генов (APP, PS1 и PS2), тесно связанных с продукцией амилоида (это, кстати, не слишком характерно для исследований заболеваний человека: чаще вначале описывают моногенную форму болезни, которая и указывает на главный патологический фактор у всех больных). Весомое подтверждение гипотезы. Вдобавок, введение амилоида Aβ мышам и вправду вызывало у них когнитивные нарушения и проблемы со здоровьем, похожие на человеческую болезнь Альцгеймера. Более того, чрезмерная (овер-) экспрессия белка — предшественника амилоида (АПП) и у мышей, и даже у плодовых мушек дрозофил приводила к нейродегенерации (по понятным причинам — чем больше АПП, тем чаще он будет разрезаться с образованием бета-амилоида).
Еще Aβ оказался токсичным для нейронов, амилоидные скопления гораздо чаще встречались у больных БА, а изоформа АпоЕ4 знаменитого белка АпоЕ (носительство аллели APOЕ4 говорит о повышенном риске заболеть БА) с транспортом амилоида из мозга справляется заметно хуже, чем ее «нормальная» сестрица — АпоЕ3 [12].
Казалось бы, всё здесь понятно. Однако всё больше авторов с подобным подходом не согласны. Разберемся, с чем это связано. Благо, как было верно подмечено в статье Карла Эррапа (Karl Herrup, [13], за ссылками на бόльшую часть фактов из ближайших трех абзацев можно обратиться к ней), бета-амилоидная гипотеза, как любая хорошая гипотеза, выдвигает четкие и проверяемые тезисы. Вкратце, гипотеза постулирует, что:
- введение амилоида здоровым людям вызовет у них развитие болезни Альцгеймера;
- очистка мозга больных от бета-амилоида развитие болезни если и не обратит, то остановит.
И введение амилоида мышам болезнь действительно вызывает; более того, если этот амилоид потом убрать, болезнь полностью отступает (что логично). Проблема заключается в том, что у здоровых пожилых людей скопления амилоида зачастую есть (Хор: «Бляшки предшествуют развитию симптомов»). А еще — в том, что если от амилоида избавиться (а методов осуществления этого накопилось уже достаточно, включая любопытный метод иммунизации с получением антител к Aβ [14]), то ни улучшения состояния больных, ни полной остановки болезни не происходит (тем самым бета-амилоидную гипотезу формально уже можно считать опровергнутой).
Но посмотрим еще. Второй вопрос к гипотезе — плохая корреляция между местонахождением бляшек и зонами гибели нейронов. Бляшки, пока их не так много, находятся в основном в участках коры головного мозга, тогда как повреждения при болезни Альцгеймера развиваются прежде всего в гиппокампе (Хор: «При наследственной форме, которая точно связана с амилоидом, всё то же самое»). В качестве ответа на этот вопрос оригинальная амилоидная гипотеза в 2008-м была уточнена: авторы объявили главным злом небольшие олигомерные скопления амилоида, которые плавают по мозгу и творят хаос, а потом слипаются в бляшки. Уточним: получается, что названное причиной болезни событие начинается за добрые 20 лет до проявления симптомов, успевает достичь своего пика и выйти на плато (значительных изменений числа бляшек и концентрации амилоида в мозге на поздних стадиях болезни не наблюдается), а болезнь только начинает развиваться. Причем, как уже говорилось, не у всех (Хор: «Тогда это не прямая нейротоксичность амилоида, а его влияние на сигнальные механизмы»). (Это замечание не является четким аргументом против бета-амилоидной гипотезы — можно представить себе, что начавшиеся много лет назад процессы приводят к заметным проявлениям только десятилетия спустя, — но пока нет абсолютной уверенности в «первородности» Aβ, логичнее обратиться к более коррелирующим со стадиями болезни симптомам.) Так дело и движется — вместо решительного отказа от гипотезы она постепенно всё усложняется и модифицируется, а первопричиной по-прежнему остается бета-амилоид.
И это самое главное, суть гипотезы. «В начале было ничто, которое взорвалось» [15]. Интересное с точки зрения физики наблюдение, которое в биологии обычно к верным выводам не приводит. Многочисленные авторы во введении к своим работам мимоходом описывают молекулярные механизмы образования Aβ и приступают к разбору его участия в очередном взаимодействии. Главный же вопрос — каким образом без каких-либо причин и поводов АПП вдруг массово и резко начинает разрезаться «неправильно»? А точнее, зачем организму закладывать часовую бомбу в виде сразу нескольких механизмов продукции сугубо токсичного бета-амилоида? И при каких условиях они срабатывают? Забавно, но авторы иногда даже оговариваются, что причины этого действительно неясны, что, возможно, это вызвано окислительным стрессом, гипоксией, воспалением или чем-то еще. Это, несомненно, может быть, однако и автоматически означает, что амилоид ПЕРВОПРИЧИНОЙ болезни не является. Более того, и воспаление, и окислительный стресс, и гипоксия — состояния весьма разнообразные и индивидуальные. Болезнь Альцгеймера же проявляется у огромного количества людей (по сути, у каждого третьего американца в возрасте свыше 85 лет и у каждого девятого старше 65 лет [16]) абсолютно одинаково в виде целого набора патологий — то есть первопричина, скорее всего, должна быть одна. И лежит она выше, чем бета-амилоид. Более того, всё чаще обсуждается антиоксидантная функция амилоида [17]. Тогда активация β-секретазы при снижении pH (читать как «при окислительном стрессе») выглядит весьма логичной, как и неудачи попыток лечения болезни путем полного избавления от амилоида. Что интересно, даже в случаях, когда при терапии удавалось избавиться от амилоидных бляшек, все когнитивные нарушения и прочие характерные для БА симптомы сохранялись [13].
(Offertorium)
К чему это всё? А к тому, что от самых красивых гипотез нужно уметь отказываться, если они не работают. Это утверждение, раньше робко читаемое между строк или упоминаемое с постоянными оговорками («Мы ни в коем случае не отрицаем амилоидную гипотезу, но вот в этом случае, возможно, она объясняет не всё»), дошло до заголовков в Nature Neuroscience (The case for rejecting the amyloid cascade hypothesis [13]) и других журналах: Compounding artefacts with uncertainty, and an amyloid cascade hypothesis that is ‘too big to fail’ [18], Moving away from amyloid beta to move on in Alzheimer research [19]. Пока большинство исследований остаются направленными на поиск способа борьбы с амилоидом (который, возможно, вообще играет антиоксидантную или иную защитную роль и не так плох, как кажется), а в клинические испытания входят всё новые препараты, которые не трогают первопричину и (как, к сожалению, пока выходит) не сильно облегчают симптомы, мы практически стоим на месте.

Рисунок 3. Иллюстрация художника Марка Симонетти (Marc Simonetti) к книге Т. Пратчетта «Мелкие боги». Люди начинают с веры в Бога и заканчивают верой в систему. И даже самые всемогущие существа, Великие Боги, могут исчезнуть и сгинуть в забытье, когда в них никто больше не верит. Как и гипотезы.
(Agnus Dei)
А что взамен?
Вспомним про скопления тау-белка внутри нейронов — второй самый заметный патологический признак. Если насчет физиологической функции бета-амилоида ведутся споры, то с тау-белком таких вопросов нет — он очень хороший и полезный [20]. Например, он стабилизирует микротрубочки, что особенно важно для нейронов с их длинными отростками [21]. Регулируются функции тау-белка любимым клеткой способом — фосфорилированием тех или иных участков его молекулы, которых у тау-белка около пятидесяти. Активно фосфорилируется он, например, при подготовке клетки к делению — что стόит запомнить. И при болезни Альцгеймера его молекулы также гиперфосфорилируются, отходят от клеточного скелета и слипаются друг с другом, приводя к разборке микротрубочек и нарушениям процессов клеточного транспорта. Появление скоплений тау-белка по времени и своему положению в мозге очень хорошо коррелирует с развитием болезни Альцгеймера [22]. Конечно же, была предложена тау-гипотеза развития болезни [23]. Но будем справедливы, к ней тоже есть вопросы. Например, существует целый спектр таупатий — болезней, связанных с гиперфосфорилированием тау-белка, — и для всех из них, кроме болезни Альцгеймера, не характерно появление амилоидных скоплений и других патологий. Кроме того, имеются многочисленные данные о том, что бета-амилоид тем или иным способом стимулирует фосфорилирование тау-белка [24], [25]. Данный факт, во-первых, подвергает сомнению первичную роль тау-белка в патогенезе, а во-вторых, указывает на важность амилоида для этого процесса.
Кстати, в нейронах, содержащих фибриллы тау-белка, наблюдается еще одна любопытная вещь — эти клетки содержат целый набор маркеров, характерных для готовящихся к делению клеток (напомню, что способность к делению — мягко говоря, не сильная сторона нейронов) [26]. Более того, в таких клетках даже происходит удвоение (репликация) ДНК, хотя потом, конечно, они всё же застревают перед самым митозом. Вполне вероятно, что амилоид стимулирует возвращение нейронов в клеточный цикл [27] — и этому может быть физиологическое объяснение. Но об этом в другой раз.
(Communio)
Что же мы получаем в итоге? Что бета-амилоид, конечно, один из ключевых участников развития болезни Альцгеймера — но участник (возможно невольный, убивающий в попытке защитить), вовлеченный в процесс на более поздних стадиях. Что же могло быть в начале? Например, повреждение структуры митохондрий и накопление мутаций в их ДНК [28], [29], что происходит и при «нормальном» старении (а болезнь Альцгеймера, напомню, четко ассоциирована с возрастом, в большинстве случаев она проявляется после 65 лет). Подобное нарушение ведет к усиленной продукции токсичных для клетки радикалов и возникновению условий окислительного стресса. При этом, несмотря на то, что мутации в мтДНК появляются случайно, практически все они ведут к нарушениям в работе электрон-транспортной цепи митохондрий. Результат этого всегда одинаков: усиление продукции токсичных радикалов и снижение — АТФ. Это неплохо объясняет однообразие набора патологий у многочисленных больных. Митохондриальная гипотеза болезни Альцгеймера подробно разобрана в статьях Рассела Свердлова [30]. Образование амилоида в этом случае можно было бы объяснить чрезмерной активацией защитных механизмов — и хороший, полезный антиоксидант-амилоид, по аналогии с витамином Е, в избыточных концентрациях становится мощным окислителем. Однако в любом случае всегда нужно помнить, что нельзя останавливаться на одной гипотезе. Бета-амилоидная гипотеза дала стимул многим крайне важным для науки и для нашего понимания болезни Альцгеймера исследованиям . Теперь, пожалуй, настало время идти дальше.
И понимания других загадочных недугов тоже. Детальное изучение «родственных связей» неинфекционных амилоидов и их инфекционных коллег — прионов — проведено автором статьи «Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?» [31]. — Ред.
(In paradisum)
Эту статью я пишу в память о сэре Терри Пратчетте, который скончался от болезни Альцгеймера 12 марта 2015 года. «Терри взял Смерть за руку и прошел с ним через двери в черную пустыню под покровом бескрайней ночи» [32]. Конец.
Литература
- Пратчетт Т. Роковая музыка. М.: Эксмо, 2006. — 480 с.;
- Alzheimer A. (1907). Uber eine eigenartige Erkrankung der Hirnrinde. Allgemeine Zeitschrift fur Psychiatrie und phychish-Gerichtliche Medizin. 64, 146-148;
- Alzheimer A., Stelzmann R.A., Schnitzlein H.N., Murtagh F.R. (1995). An English translation of Alzheimer’s 1907 paper, «Uber eine eigenartige Erkrankung der Hirnrinde». Clin. Anat. 8, 429-431;
- Hardy J.A. and Higgins G.A. (1992). Alzheimer’s disease: the amyloid cascade hypothesis. Science. 256, 184-185;
- Selkoe D.J. (2008). Soluble oligomers of the amyloid beta-protein impair synaptic plasticity and behavior. Behav. Brain. Res. 192, 106–113;
- Musiek E.S. and Holtzman D.M. (2015). Three dimensions of the amyloid hypothesis: time, space and ‘wingmen’. Nat. Neurosci. 18, 800-806;
- Pratchett Т. I shall wear midnight (Я надену платье цвета ночи). London: HarperCollins, 2011. — 368 p.;
- Пратчетт Т. Санта-Хрякус. М.: Эксмо, 2007. — 480 с.;
- Kuhn P.H., Wang H., Dislich B., Colombo A., Zeitschel U., Ellwart J.W. et al. (2010). ADAM10 is the physiologically relevant, constitutive a-secretase of the amyloid precursor protein in primary neurons. EMBO J. 29, 3020–3032;
- Bien J., Jefferson T., Causević M., Jumpertz T., Munter L., Multhaup G. et al. (2012). The metalloprotease meprin β generates amino terminal-truncated amyloid β peptide species. J. Biol. Chem. 287, 33304-33313;
- Tamagno E., Bardini P., Obbili A., Vitali A., Borghi R., Zaccheo D. et al. (2002). Oxidative stress increases expression and activity of BACE in NT2 neurons. Neurobiol. Dis. 10, 279-288;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Herrup K. (2015). The case for rejecting the amyloid cascade hypothesis. Nat. Neurosci. 18, 794-799;
- Schenk D., Barbour R., Dunn W., Gordon G., Grajeda H., Guido T. et al. (1999). Immunization with amyloid-β attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature. 400, 173-177;
- Пратчетт Т. Дамы и господа. М.: Эксмо, 2006. — 448 с.;
- 2015 Alzheimer’s Statistics. Сайт Alzheimers.net;;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Castellani R.J. and Smith M.A. (2011). Compounding artefacts with uncertainty, and an amyloid cascade hypothesis that is «too big to fail». J. Pathol. 224, 147-152;
- Moreno-Treviño M.G., Castillo-López J., Meester I. (2015). Moving away from amyloid beta to move on in Alzheimer research. Front. Aging Neurosci. 7, 2;
- Википедия: «Tau protein» (англ.);
- Maccioni R.B. and Cambiazo V. (1995). Role of microtubule-associated proteins in the control of microtubule assembly. Physiol. Rev. 75, 835-864;
- Ghoshal N., García-Sierra F., Wuu J., Leurgans S., Bennett D.A., Berry R.W., Binder L.I. (2002). Tau conformational changes correspond to impairments of episodic memory in mild cognitive impairment and Alzheimer’s disease. Exp. Neurol. 177, 475-493;
- Maccioni R.B., Farías G., Morales I., Navarrete L. (2010). The revitalized tau hypothesis on Alzheimer’s disease. Arch. Med. Res. 41, 226-231;
- Элементы: «Стала немного ясней взаимосвязь между тау-белком и бета-амилоидом»;
- Vossel K.A., Zhang K., Brodbeck J., Daub A.C., Sharma P., Finkbeiner S. et al. (2010). Tau reduction prevents Aβ-induced defects in axonal transport. Science. 330, 198;
- Jordan-Sciutto K.L., Morgan K., Bowser R. (1999). Increased cyclin G1 immunoreactivity during Alzheimer’s disease. J. Alzheimers Dis. 1, 409–417;
- Varvel N.H., Bhaskar K., Patil A.R., Pimplikar S.W., Herrup K., Lamb B.T. (2008). Aβ oligomers induce neuronal cell cycle events in Alzheimer’s disease. J. Neurosci. 28, 10786-10793;
- Correia-Melo C. and Passos J.F. (2015). Mitochondria: are they causal players in cellular senescence? Biochim. Biophys. Acta. 1847, 1373-1379;
- Трое в лодке: о легализации замены митохондрий;
- Swerdlow R.H., Burns J.M., Khan S.M. (2010). The Alzheimer’s disease mitochondrial cascade hypothesis. J. Alzheimers Dis. 20, 265–279;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- Sampat R. (2015). How did Terry Pratchett tweet after his death? BBC News;
- Karran E., Mercken M., De Strooper B. (2011). The amyloid cascade hypothesis for Alzheimer’s disease: an appraisal for the development of therapeutics. Nat. Rev. Drug Discov. 10, 698-712;
- Zhang Y.W., Thompson R., Zhang H., Xu H. (2011). APP processing in Alzheimer’s disease. Mol. Brain. 4, 3..







