Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?
25 ноября 2015
Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?
- 2785
- 0
- 6
Помимо шуток про «нейродегенерацию у дрожжей», дрожжевая модель изучения нейродегенеративных заболеваний человека вносит весомый вклад в развитие этой области науки, позволяя выявить биохимические закономерности, общие для высших и низших эукариот. Дрожжи, несущие в себе прион [PSI+], не особо от него страдают — но могут помочь нам в изучении тех прионных болезней, от которых страдаем мы.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: На протяжении многих лет «конформационные» болезни человека — нейродегенеративные патологии, связанные с изменением конформаций некоторых белков из мономерной растворимой в полимерную фибриллярную — было принято условно делить на два класса: прионные и амилоидные. Однако в последнее время накопилось множество свидетельств некоторой иллюзорности границы между ними и применимости прионной концепции к большинству патологических амилоидов нервной системы человека. Изучая ненаследуемые амилоиды в дрожжах Saccharomyces cerevisiae, мы можем найти ответ на вопрос: существует ли принципиальная разница в строении инфекционных и неинфекционных амилоидных полимеров?
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Прионы vs. амилоиды
Начиная разговор о прионах и амилоидах, я думаю, следует внести ясность в терминологию. Итак, согласно современным традициям употребления этого термина, прионы — это самовоспроизводящиеся белковые изоформы, обладающие свойством инфекционности: способностью передаваться от клетки к клетке. На самом деле, под это определение попадают белковые изоформы разной природы, однако объединяет их одно: все они проявляются как некие черты фенотипа — иногда губительные для клеток, иногда, наоборот, полезные — которые могут распространяться между клетками без участия закодированной с помощью ДНК/РНК наследственной информации.
Амилоиды — особый способ укладки белка, при котором отдельные, амилоидогенные, участки образуют фибриллярные полимеры с кросс-β-структурой (то есть, состоящие из β-слоев, направленных перпендикулярно оси фибриллы) (рис. 1) [1]. Отличить амилоидные полимеры от других форм белковой агрегации (например, аморфных белковых агрегатов, образующихся при тепловом шоке) можно по нескольким признакам, помимо уже упомянутого:
- амилоидные агрегаты не распадаются при инкубации с высокими концентрациями детергентов (таких как ДСН) при комнатной температуре;
- амилоиды связываются с рядом красителей — в частности, с тиофлавином и конго красным (последний используют врачи для обнаружения амилоидных отложений в тканях больных; рис. 2);
- амилоидные полимеры могут самовоспроизводиться по автокаталитическому механизму: взаимодействуя с мономерами амилоидогенного белка в «нормальной», растворимой конформации, они «наводят» на них собственную, амилоидную форму укладки. Такие преобразованные мономеры присоединяются к концу фибриллы, за счет чего фибрилла растет;
- в отличие от образования актиновых филаментов и микротрубочек, полимеризация белка в амилоидную фибриллу происходит без участия молекул АТФ и ГТФ. По этой причине амилоидные фибриллы могут собираться «самопроизвольно» — причем как в клетке, так и в пробирке (in vitro).
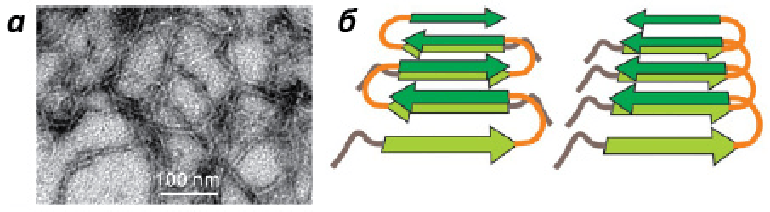
Рисунок 1. Фибриллы Aβ-амилоида под электронным микроскопом (a) и схематическое изображение параллельной и антипараллельной кросс-β-структур амилоидной фибриллы (б).
Способность тех или иных участков белка укладываться в амилоид зависит от их аминокислотного состава и последовательности. Известны случаи, когда мутации в амилоидном домене белка существенно уменьшали его склонность переходить в фибриллярную форму [2].

Рисунок 2. Амилоидные отложения по периферии клеток, наблюдаемые по двойному лучепреломлению при окрашивании красителем конго красным.
рисунок с сайта Leaders in Pharmaceutical Business Intelligence
Большинство известных на данный момент прионов имеют амилоидную природу: амилоидные фибриллы являются тем самым инфекционным агентом, который переносится от клетки к клетке и определяет их прионный фенотип. Однако известны и другие случаи самокопирующихся белковых состояний, с амилоидностью никак не связанные. Например, дрожжевой прион β представляет собой цепной процесс активации протеиназ: активированная форма протеиназы Prb1 активирует другие молекулы Prb1, откусывая у них N-концевой пептид (блокирующий их протеиназную активность). Те, в свою очередь, принимаются за следующую порцию еще не активных протеиназ... и так далее. Выходит, не только бешеные животные могут передавать свое состояние другим с помощью укусов...
Самые известные, и наиболее пугающие общественность прионы — инфекционные агенты, вызывающие и передающие болезни Крейцфельдта-Якоба, куру, скрейпи овец и некоторые другие — представляют собой ни что иное, как проявления различных штаммовых вариантов амилоида, состоящего из одного и того же белка (про открытие прионов белка PrP, а также про разработку прионной концепции можно прочитать в недавней статье на биомолекуле [3]). Мембранный белок PrP, который есть у всех млекопитающих, а также у птиц и у рыб, в норме выполняет в клетках полезные функции . При патологии PrP сворачивается в амилоидную форму, которая вызывает гибель нейронов и заражает другие клетки (а иногда и другие организмы). Что интересно, PrP может укладываться в амилоид по-разному, образуя фибриллы с различными конформациями — и эти конформации, по-разному влияя на взаимодействие амилоида с его клеточным окружением, лежат в основе разных прионных штаммов. В конечном счете, разница в конформациях амилоидов приводит к разному течению вызываемых ими прионных заболеваний.
Которые в некоторых статьях не очень грамотно приписывают приону — в то время, как выполняет их как раз-таки неприонная форма белка — Прим. авт.
Амилоиды нейродегенеративных заболеваний человека
Помимо болезней, традиционно рассматриваемых как прионные, в число «конформационных» заболеваний человека входит также множество других патологий нервной системы, развивающихся, как правило, с возрастом — болезни Паркинсона и Альцгеймера [4], [5], хорея Хантингтона [6] и многие другие. Их развитие также подразумевает агрегацию собственных белков клетки (Aβ-пептид, α-синуклеин, хантингтин и др.) в амилоидные фибриллы, которые, слипаясь друг с другом, в конечном счете могут образовывать губительные для клеток вне- и внутриклеточные амилоидные агрегаты. Известно также, что промежуточная (на пути превращения от растворимого мономера в фибриллу) форма укладки Aβ-пептида, уже содержащая в своей структуре β-тяжи, тоже обладает токсическим действием на клетки [7].
Подобные болезни ранее не рассматривались с точки зрения прионной концепции: считалась, что такие амилоиды образуются в каждой нервной клетке автономно и не могут передаваться «горизонтально» — то есть, являются неинфекционными. Однако в последнее время накапливается множество свидетельств типично прионного характера распространения амилоидов внутри нервной ткани больных, а также перекрестного «затравления» разными амилоидными белками человека полимеризации друг друга [8]. Подобные свидетельства заставляют ученых взглянуть на эти болезни по-другому — и сейчас в научной печати появляется все больше и больше работ, в которых обсуждаются прионные (или «прионоподобные», prion-like) свойства амилоидов, вызывающих «возрастные» нейродегенеративные патологии.
Можно сказать, что в наши дни соотношение между понятиями «амилоид» и «прион» меняется (рис. 3). И хотя этот переход иногда происходит больше в терминологической, нежели в экспериментальной плоскости, тем не менее, особую важность приобретает вопрос: существуют ли какие-либо принципиальные различия в молекулярной архитектуре фибрилл инфекционных и неинфекционных амилоидов? Существуют ли конформации, более других подходящие для «горизонтального» и «вертикального» распространения от клетки к клетке — и, наоборот, конформации, которые не в состоянии никого «заразить»? Как разные конформации амилоидов различаются по восприимчивости к лекарствам? (Да-да, у некоторых прионных амилоидов, как и у бактерий, тоже обнаружена способность вырабатывать резистентность к используемым против них лекарствам.)
Как модельный объект, для поиска ответов на подобные вопросы хорошо подходят амилоиды дрожжей.
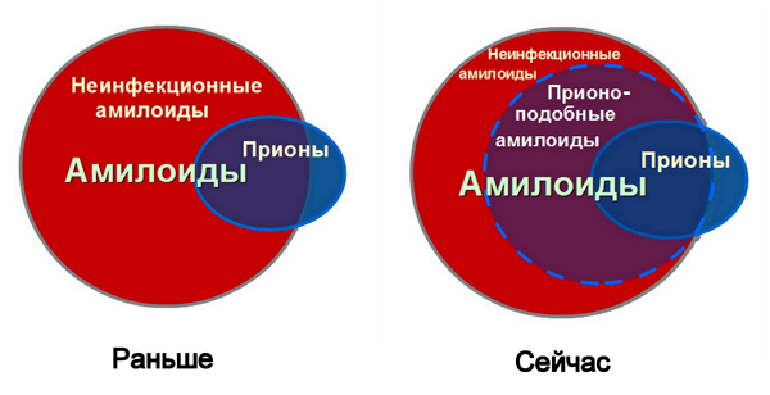
Рисунок 3. Соотношение понятий «амилоид» и «прион» со временем довольно сильно изменилось: в последние годы все большее количество амилоидов обретают «прионоподобный» статус.
Прионы и амилоиды дрожжей
На протяжении долгого времени пекарские дрожжи Saccharomyces cerevisiae были (и остаются) полезным инструментом в руках не только пищевой промышленности, но и ученых — биохимиков, молекулярных биологов, генетиков. Высокая степень изученности дрожжей (их генов, белков, физиологических процессов), высокая скорость роста, удобство культивирования — всё это делает их удобным объектом для моделирования и изучения разнообразных процессов и явлений, от эндоцитоза до возникновения многоклеточности. Дрожжи — весьма популярный модельный объект и среди ученых, занимающихся «конформационными» болезнями (подробнее про это можно почитать в статье [9]). Используя дрожжи, мы можем намного быстрее и проще изучать участвующие в нейродегенерации молекулярные механизмы, общие (или, по крайней мере, схожие) у дрожжей и у человека.
Особое обстоятельство, которое расширяет наши возможности по части изучения амилоидной тематики в дрожжах — это наличие у дрожжей их собственных прионов, большинство из которых имеет амилоидную природу. Таким образом, мы можем изучать не только человеческие амилоиды и прионы, привнесенные в дрожжевую клетку (что, при всей несомненной полезности таких исследований, всё же немного искусственно), но и дрожжевые прионы в их естественной «среде обитания». На данный момент известно больше десятка принципиально разных (вовлекающих разные белки) дрожжевых прионов, а некоторые из них к тому же имеют разные штаммовые варианты (то есть, по-разному проявляющие себя амилоидные конформации одного и того же белка) [10].
Важным отличием прионов дрожжей от прионов млекопитающих является куда более «дружелюбное» отношение к организму-хозяину. Если полимеризация белка PrP приводит к развитию болезни и, пусть не очень скорой, но неотвратимой гибели носителя, то значительная часть дрожжевых прионов не особо вредит клеткам (разве что несколько замедляет их рост), а в некоторых ситуациях даже выполняет в них жизненно важные функции. Другое отличие — у прионов млекопитающих инфекционность заключается в «перепрыгивании» от клетки к клетке («горизонтальном» распространении), тогда как дрожжевые прионы передаются «вертикально», то есть — наследуются дочерними клетками при делении, переносясь в них с цитоплазмой. Стабильно передаваясь в линии дрожжевых клеток (как в лабораторных, так и, в некоторых случаях, в «диких» дрожжах) и влияя на клеточный фенотип, дрожжевые прионы представляют собой новую, белковую форму гена, отступление от одного из правил центральной догмы молекулярной биологии (или дополнение к ней, тут уж кому как нравится...). Если сравнивать дрожжевой прион с гéном, то штаммовые варианты приона можно сравнить с аллелями этого гена. Только разница у таких «аллелей» не в последовательности мономеров носителя (в данном случае — белка), а в его пространственной укладке.
Всё это делает возможным изучение генетических (внезапно!) свойств амилоидных полимеров в дрожжах — того, как они передаются, и как их пространственная структура выполняет свою миссию носителя информации, сообщая новые черты клеточному фенотипу. Если вспомнить, в свое время ответы на подобные вопросы стали одними из самых фундаментальных открытий в исследованиях «классического», ДНК-ового гена. Многие вопросы в генетике дрожжевых прионов сейчас уже довольно хорошо изучены, но не исключено, что важные открытия в этой области еще будут.
Лаборатория молекулярной генетики Института биохимии им. А. Н. Баха (заведующий — член-корр. Михаил Давидович Тер-Аванесян), в которой я сейчас работаю, издавна изучала процесс терминации трансляции у дрожжей — однако в 90-х годах, после открытия дрожжевых прионов, занялась изучением и этого феномена. Излюбленным объектом лаборатории является прион [PSI+] — наследуемый признак, в основе которого лежит амилоидная форма белка Sup35 (дрожжевого фактора терминации трансляции). В клетках с генами, «поломанными» некоторыми типами мутаций, [PSI+] помогает восстанавливать работу этих генов (рис. 4), в определенных условиях превращаясь в жизненно необходимый для дрожжей признак [11].

Рисунок 4. Метафора, объясняющая механизм работы приона [PSI+] как полезного для дрожжей признака. Белок Sup35 в норме прерывает трансляцию мРНК → белок, останавливая рибосому на стоп-кодонах. «Коррумпированный» полицейский (символизирующий прионную форму белка Sup35) перестает выполнять свою работу, позволяя машине-рибосоме пройти сквозь «запрещенный участок» (преждевременный стоп-кодон) и синтезировать полноразмерный продукт гена Ade1(фермент пути синтеза аденина). Благодаря этому клетка восстанавливает способность синтезировать аденин, потерянную из-за мутации.
В наши дни [PSI+] — один из наиболее изученных прионов, для которого описано большое количество штаммовых вариантов. Их принято условно делить на «сильные» — те, которые более эффективно связывают мономерную форму Sup35 в амилоид, и «слабые» — те, которые полимеризуют Sup35 менее эффективно, оставляя в клетке больше растворимой формы этого белка. Известно, что эффективность полимеризации Sup35 зависит от того, насколько хорошо идет фрагментация его фибрилл (рис. 5). Изучая амилоидные фибриллы, «выращенные» из белка Sup35 в пробирке, ученые наметили следующую тенденцию: амилоидное ядро фибриллы (англ. amyloid core) — плотно уложенная, богатая β-слоями центральная часть фибриллы — у «сильных» вариантов имеет меньший размер, чем у «слабых». В результате фибриллы, соответствующие «сильной» конформации, оказываются более ломкими и лучше фрагментируются, образуя большее количество «свободных концов» для полимеризации и тем самым повышают ее скорость.
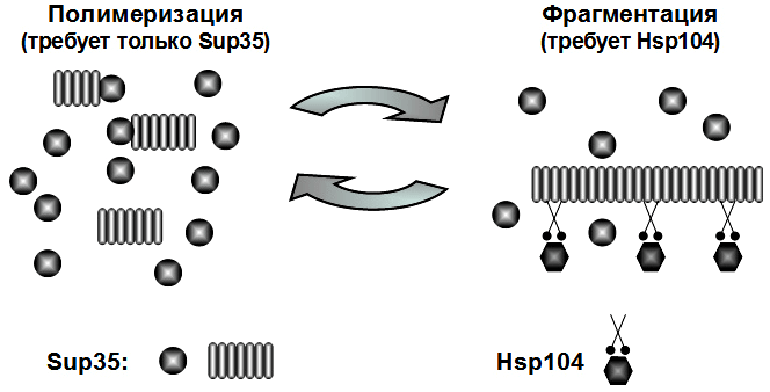
Рисунок 5. «Жизненный цикл» приона [PSI+] в дрожжах. Полимеризация мономеров белка Sup35 в фибриллы и фрагментация фибрилл шапероном Hsp104 — взаимосвязанные процессы: чем лучше фрагментация, тем больше свободных концов фибрилл высвобождается для полимеризации растворимой формы белка. Кроме того, маленькие, нарезанные шапероном фибриллы лучше передаются дочерним клеткам.
Помимо приона [PSI+], белок Sup35 может образовать также и ненаследуемый амилоид, который был впервые описан 10 лет назад в нашей лаборатории [12]. Мы знаем, что этот амилоид массово образуется в клетках при сверхпродукции белка Sup35, что он не может стабильно поддерживаться в клеточной линии — однако не знаем, в чем заключается его отличие от прионных амилоидов из этого же самого белка. Почему одни амилоиды хорошо наследуются, а другие — нет, возникая в каждой дрожжевой клетке автономно? Многие сопутствующие обстоятельства подталкивали нас к мысли, что ненаследуемый амилоид должен иметь какую-то особую конформацию и, по всей видимости, особенно большой размер амилоидного ядра. Что делает этот амилоид еще более слабым полимеризатором растворимого Sup35, чем даже самый наислабейший штамм приона [PSI+]. К проверке этой рабочей гипотезы я и приступил в своем исследовании, которое проводил под руководством доктора биологических наук Виталия Владимировича Кушнирова.
Изучение ненаследуемого амилоида Sup35
Амилоидное ядро устойчиво к действию протеаз, а потому мы можем определить его размер, расщепив протеиназой К все боковые, более «мягкие» части амилоидной фибриллы (рис. 6).
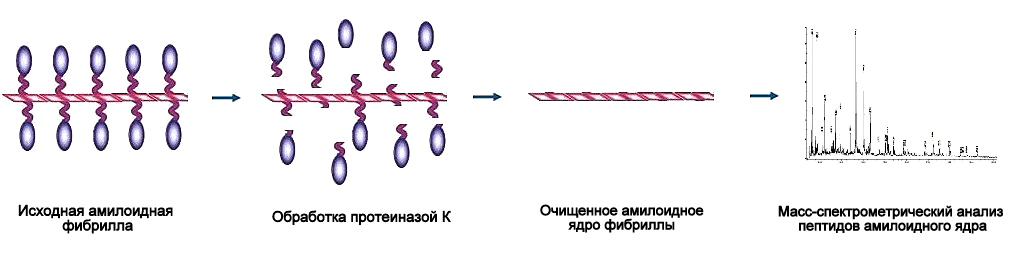
Рисунок 6. Схема эксперимента по определению размера амилоидного ядра фибриллы.
Изучая прионы дрожжей, ученые вынужденно применяют этот подход в основном к фибриллам, выращенным в пробирке. Мы же, однако, сумели преодолеть ряд технических ограничений метода и применить его к амилоидным полимерам, выделенным непосредственно из дрожжей (ex vivo). Сравнив размер амилоидных ядер в препаратах с ненаследуемым амилоидом, а также с разными штаммовыми вариантами приона, мы были вынуждены отбросить первоначальную гипотезу (рис. 7).
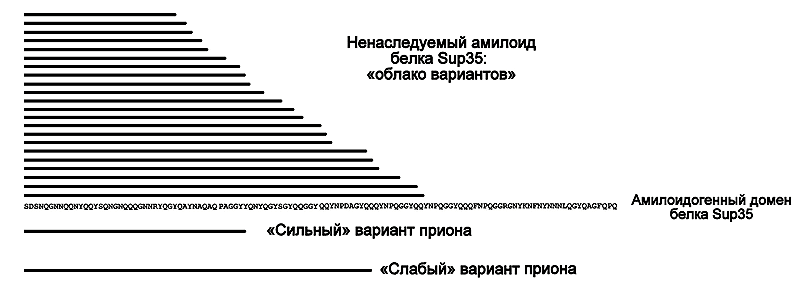
Рисунок 7. Сравнение размеров амилоидного ядра ненаследуемого амилоида белка Sup35 и вариантов приона [PSI+]. Линии над (и под) последовательностью амилоидогенного домена Sup35 обозначают размеры участков белка, уложенных в амилоидное ядро.
Общая закономерность, касающаяся взаимных различий «сильного» и «слабого» вариантов приона, в нашем эксперименте подтвердилась: амилоидное ядро «сильного» варианта менее обширно. Что же до ненаследуемого амилоида, то его препарат содержал самый что ни на есть широкий набор разнообразных амилоидных ядер — от очень маленьких, до достаточно больших (но всё равно не таких больших, как мы ожидали исходно). Таким образом, содержимое этого препарата соответствовало своеобразному «облаку вариантов»: разношерстной смеси самых разных амилоидных конформаций, фибрилл с различной степенью ломкости — похожих на фибриллы «сильного» и «слабого» приона, а также промежуточных между ними прионных вариантов.
Очевидно, этот результат сам по себе не позволял нам ответить на вопрос: существует ли изображенное на картинке «облако вариантов» во всех клетках, из которых был выделен препарат амилоида — или же каждая клетка несет в себе какую-то одну индивидуальную укладку (в каждой клетке — разную), и гетерогенная популяция таких клеток в сумме дает популяцию укладок?
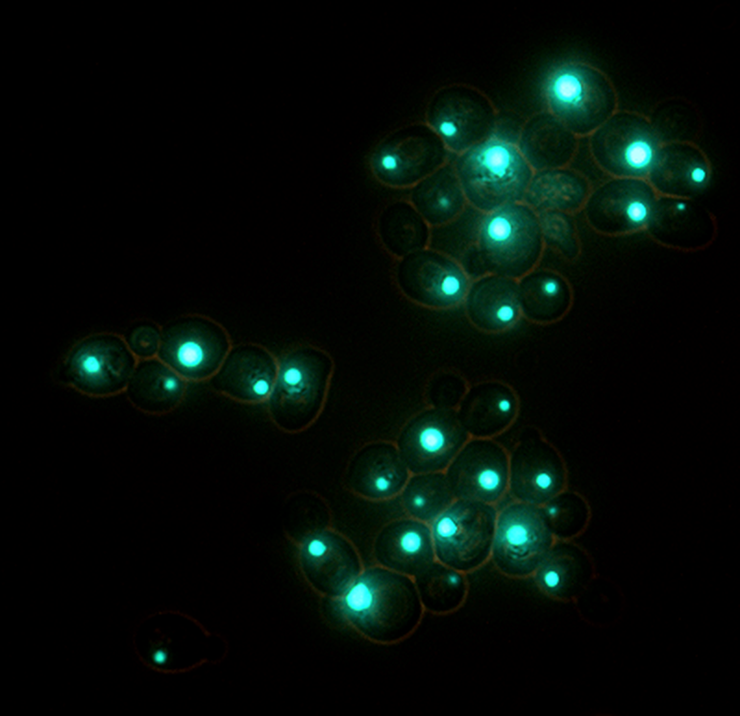
Последний вариант мы отвергли с помощью ряда генетических тестов, которые продемонстрировали лабильность ненаследуемого амилоида (его способность подстраиваться под изменчивые условия окружающей среды) в индивидуальных клетках. В частности, мы выращивали дрожжи в условиях дефицита аденина в среде, что подталкивало их к уменьшению количества мономерной формы Sup35 в клетке (о связи полимеризации Sup35 с метаболизмом аденина у дрожжей можно вспомнить с помощью рис. 4). Большинство клеток смогли переключиться в состояние, когда Sup35 полимеризуется в амилоид более эффективно. Это можно увидеть, например, по способу сборки фибрилл в макроскопические агрегаты: в нормальных условиях клетки несут в себе один амилоидный «комок» или «тяж», тогда как при дефиците аденина большинство клеток содержат множество центров агрегации фибрилл (рис. 8). В клетках с многочисленными мелкими агрегатами преобладают более ломкие конформации фибрилл, эффективно полимеризующие белок, а в клетках с единичными, более крупными агрегатами — более прочные и инертные фибриллы. Количественное соотношение разных конформаций в «облаке» сместилось в сторону тех из них, которые соответствуют «сильным» вариантам приона. Сама возможность такого смещения в значительной части клеток свидетельствует о присутствии в каждой из них полноценного «облака» конформаций, внутри которого можно проводить селекцию. Кстати, это смещение оказалось еще и обратимым: добавив в среду нормальное количество аденина, селекцию амилоидных конформаций можно повернуть в противоположную сторону.
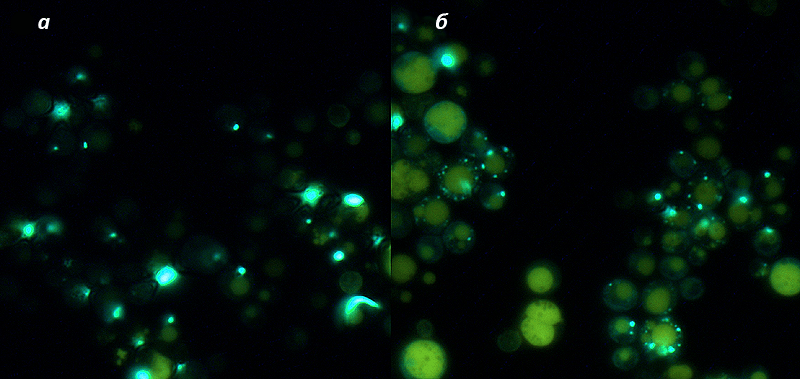
Рисунок 8. Форма макроскопической агрегации амилоида — один из способов наблюдать изменение его свойств под действием факторов окружающей среды. В дрожжах, выращенных в жидкой среде с нормальным (а) и минимальным (б) количеством аденина, паттерны агрегации заметно отличаются. Циановым цветом светятся амилоидные агрегаты из белка Sup35-GFP, желто-зеленый цвет — автофлуоресценция клеток.
Заключение и перспективы
Таким образом, мы узнали, что изучаемое нами вещество очень гетерогенно в плане конформаций составляющих его фибрилл и может менять свойства под действием окружающей среды. Помимо картирования амилоидного ядра с помощью протеиназы, безусловно, существуют и другие способы изучать укладку белка в амилоид — однако, что-то мне подсказывает, что с ненаследуемым амилоидом они дадут довольно смазанный результат. Если причина неинфекционности нашего амилоида заключается не в однородно-большом амилоидном ядре, как мы предполагали раньше — то, возможно, его конформация и вовсе не играет в данном вопросе решающей роли. Быть может, основной вклад в неинфекционные свойства амилоида вносит какой-то другой фактор — и, кто знает, не воспользуемся ли мы этим фактором в будущем для борьбы с прионными болезнями, делая их менее заразными? Если похожее «облако вариантов» обнаружится и у человеческих амилоидов — не сможем ли мы действовать на него таким образом, чтобы свести на нет то вредоносное воздействие, которое амилоидные агрегаты оказывают на клетки мозга? Сможем ли мы найти такие лекарства, которые блокировали бы полимеризацию всех штаммовых вариантов в «облаке» (не позволяя отдельным из них проявить резистентность к лекарствам и свести эффективность всего лечения на нет)? Открытие, сделанное на одноклеточных и совсем не страдающих от нейродегенерации организмах, может положить начало большим свершениям.
Литература
- Robert Tycko, Reed B. Wickner. (2013). Molecular Structures of Amyloid and Prion Fibrils: Consensus versus Controversy. Acc. Chem. Res.. 46, 1487-1496;
- Мутация, защищающая от всех известных прионных болезней;
- Разоблачитель белков-убийц;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Michel Goedert. (2015). Alzheimer’s and Parkinson’s diseases: The prion concept in relation to assembled Aβ, tau, and α-synuclein. Science. 349;
- Vikram Khurana, Susan Lindquist. (2010). Modelling neurodegeneration in Saccharomyces cerevisiae: why cook with baker's yeast?. Nat Rev Neurosci. 11, 436-449;
- Элементы: «10 фактов о прионах и амилоидах»;
- Susan W Liebman, Yury O Chernoff. (2012). Prions in Yeast. Genetics. 191, 1041-1072;
- Aleksandra B. Salnikova, Dmitry S. Kryndushkin, Vladimir N. Smirnov, Vitaly V. Kushnirov, Michael D. Ter-Avanesyan. (2005). Nonsense Suppression in Yeast Cells Overproducing Sup35 (eRF3) Is Caused by Its Non-heritable Amyloids. Journal of Biological Chemistry. 280, 8808-8812.