
Такие же, только другие. Новые открытия в изучении расстройств аутистического спектра
18 марта 2024
Такие же, только другие. Новые открытия в изучении расстройств аутистического спектра
- 1616
- 0
- 8
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Расстройство аутистического спектра (РАС) представляет собой набор расстройств нервного развития, относящихся к одной из наиболее тяжелых групп болезней с точки зрения распространенности, заболеваемости и воздействия на общество. Расстройство характеризуется сложным поведенческим проявлением и дефицитом как социальных, так и когнитивных функций [1]. Хотя точная причина РАС до сих пор не известна, основные результаты подчеркивают роль генетических факторов в развитии аутистического поведения. Многие симптомы расстройства сейчас активно изучаются с позиций генетики. Для части симптомов известны молекулярные механизмы, для части только морфологические изменения органов и клеток, а некоторая симптоматика изучена только в части внешних проявлений, например, изменений поведения [2].
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла второе место в номинации «Школьная» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла второе место в номинации «Школьная» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В этом обзоре рассматриваются некоторые из основных симптомов и самые последние исследования по их изучению. Важное замечание: несмотря на широкое использование мышиных моделей в биомедицинских исследованиях, генетические различия между мышами и людьми еще не до конца изучены. Несомненно, лабораторная мышь разделяет большинство кодирующих генов с человеком, однако эти два млекопитающих существенно различаются. Если сравнить геном мыши и геном человека, то окажется, что сами гены довольно консервативны, а вот регулирующие их области значительно отличаются. А главное — человеческая социальность сильно отличается от мышиной, и поэтому экстраполировать результаты, полученные на мышиных моделях, на РАС у человека, можно только с большой натяжкой. Моделирование аутизма на мышах используется исключительно за неимением возможности постановки экспериментов на моделях более приближенных по функционированию к человеческим из-за этических соображений.
Сенсорная, световая и звуковая гиперчувствительность являются очень распространенными симптомами расстройств аутистического спектра и часто приводят к тактильной защите, избеганию телесных контактов. Исследователи описали молекулярные механизмы световой и звуковой чувствительности людей с аутизмом. Для объяснения этих явлений авторы сформулировали гипотезу, заключающуюся в том, что фактически, нейроны не могут привыкнуть вообще ни к какому воздействию и каждый раз гиперболизируют его. Это связано с двумя белками.
Первый белок — FMRP. Он кодируется геном FMR1. Уже более двух десятилетий FMRP известен как белок, подавляющий синтез других важных молекул. Для нормальной работы нейрона необходимо угнетать синтез молекул нейромедиаторов до появления триггерного воздействия — сигнала, который необходимо передать соседним нейронам. Это нужно для предотвращения внезапной выработки излишнего количества нейромедиатора и, как следствие, рандомных нейронных возбуждений. Возбуждаться нейрон должен только при конкретном воздействии на него. Таким образом, белок FMRP необходим для того, чтобы сдерживать случайные всплески образования нейромедиаторов в отсутствие триггерного сигнала; нарушения регуляции синтеза в нейронах (а именно это и произойдет при неработающем гене FMR1, неспособном синтезировать белок FMRP) приводят к чрезмерному синтезу нейромедиаторов [4].
Второй белок, рассматриваемый учеными в другой статье — Shank3. Это белок, который отвечает за работу тормозных нейронов. При нарушении работы гена, этот важный белок вырабатывается в крайне малых количествах. Из-за этого тормозные нейроны не реагируют, а значит каждый сигнал не тормозится, и вследствие этого мозг получает чересчур яркую и сильную картинку окружающей действительности [5].
Как оказалось, у мышей с отключенным геном Shank3 или FMR1 проявляются многие черты, связанные с аутизмом, в том числе избегание социального взаимодействия и навязчивое, повторяющееся поведение. Поэтому для проверки своих теорий ученые использовали мышей, у которых была нарушена функция одного из генов. Предположение было следующее: нарушение работы генов FMR1 и Shank3 вызывает сенсорную гиперчувствительность, а, значит, мыши с дефектом в одном из этих генов будут более чувствительными при прикосновении к их усам, чем генетически нормальные.
В эксперименте с отключенным FMR1 мыши были зафиксированы в специальной установке, которая по функционированию очень похожа на нашу с вами беговую дорожку. В данном случае бег мышей по дорожке приравнивается к навязчивому поведению у людей с РАС. Результаты оказались следующими: молодые мыши с нокаутированным (неработающим) FMR1 реагировали (бежали по «дорожке») на стимуляцию усов гораздо сильнее, чем молодые мыши с работающим FMR1. Нокаутированный FMR1 не тормозит синтез нейромедиаторов, и при триггерном сигнале их количество гораздо больше, чем должно было быть. Соответственно, и реакция на такое количество молекул будет сильнее, чем на нормальное. Что касается взрослых мышей с нокаутированным FMR1, то они активно избегали стимулов, которые были безобидны для контрольной группы, что является признаком тактильной защиты (Рис.1).
В эксперименте с неработающим Shank3 ученые провели похожий эксперимент и обнаружили, что мыши, с отсутствующим Shank3, точно реагировали на очень незначительные отклонения, которые не были замечены нормальными грызунами. Также им был выполнен анализ нейронной активности. Оказалось, мыши с нарушенным синтезом Shank3 имели сверхактивные возбуждающие нейроны в соматосенсорной коре — области мозга, отвечающей за сенсорную чувствительность. Выяснилось, что, пониженная активность тормозных нейронов ведет к тому, что возбуждающие нейроны не контролируются тормозными. И такое поведение возбуждающих нейронов обязательно приводит к сенсорной гиперчувствительности.
Таким образом, при нарушенной работе обоих белков, передача сигнала между нейронами будет крайне неурегулирована. Это, в свою очередь, приведет к гиперчувствительности, а также может стать причиной эпилепсии и нарушения памяти.
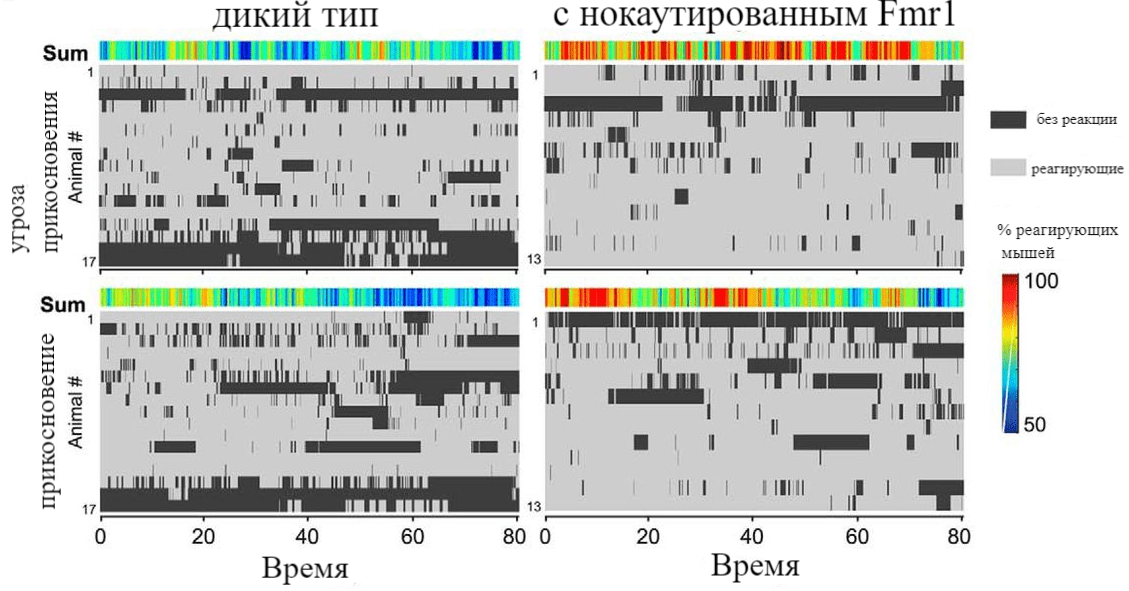
Рисунок 1. Взрослые мыши с нокаутированным Fmr1 демонстрируют тактильную защиту во время повторной стимуляции усов.
[4], рисунок адаптирован
Более того, параллельно с этим экспериментом ученые, проводившие эксперимент с белком FMRP, сделали еще одно важное открытие. Еще раньше при аутизме была выявлена особенность, наблюдаемая в коре головного мозга пациентов: наличие дендритных шипов аномальной формы. Дендритные шипики представляют собой небольшие выступы мембраны, которые выходят из отростка нейрона и образуют синапс с другим нейроном. Предполагалось, что аномалии нейрона, обнаруженные при аутизме, лежат в основе функциональных дефектов, вызывающих заболевание. Таким образом, нокаут гена FMR1 у мышей продемонстрировал участие этого гена в формировании нормальных нейронов путем воспроизведения аномальных дендритных шипиков, а также ряда поведенческих аномалий (включая гиперактивность, дефицит обучения и памяти). Получается, что сенсорная гиперчувствительность при РАС — это невозможность уменьшить силу сигнала (не важно, нужен он для корректной работы организма или нет). То есть реакция на прикосновение каждый раз будет одинаково сильной и к этому практически нельзя привыкнуть из-за молекулярной составляющей проблемы.
Ярким симптомом расстройств аутистического спектра можно назвать нежелание смотреть в глаза собеседникам. Как выяснилось, у аутистов при зрительном контакте снижается активность задней части теменной коры [6]. Несмотря на то, что поддержание зрительного контакта является неотъемлемой частью социального взаимодействия, изучение этого процесса было крайне затруднено, так как не было подходящих методов. Наконец, новая технология позволила исследователям из Йельского университета (США) сделать это. Благодаря новому методу у ученых получилось определить области мозга, связанные с социальной симптоматикой аутизма. Участвовали 36 испытуемых. Эксперимент проходил следующим образом: пара взрослых людей (один здоровый испытуемый и один с расстройством аутического спектра) приглашались в комнату. Анализ активности мозга проводился в течение непродолжительного разговора. Для анализа ученые пользовались функциональной спектроскопией в ближней инфракрасной области. Это неинвазивный метод оптической нейровизуализации. Суть его заключается в установке большого количества датчиков на всей площади черепа и эти датчики излучают инфракрасный свет в мозг испытуемым. Ученые же регистрируют смену сигналов во время зрительного контакта.
На основании полученных результатов ученые создали схему (рис. 2), показывающую контрастное сравнение активированных участков мозга в процессе реального зрительного контакта участников с типичным развитием по сравнению с участниками с расстройством аутистического спектра (РАС). Участники с типичным развитием (красные участки) демонстрируют сравнительно большую активацию задней теменной коры. Важно помнить, что задняя теменная кора является центром обработки информации сразу от трех систем: зрительной, слуховой и сенсорной. Информация, обработанная в задней теменной коре, поступает в двигательную кору — она контролирует в том числе и глазное поле. Все эти результаты логично объясняют трудности в процессе зрительного контакта пациентов с РАС. Кроме того, это подтверждают сделанные ранее исследования, в ходе которых было выяснено, что повреждение задней теменной коры могут вызвать различные нарушения, в том числе и дефицит восприятия и памяти, контроля движения глаз, а также внимания.
На данный момент, ученые полагают, что реакции этой области мозга на человеческое лицо и зрительный контакт могут служить маркером для диагностики РАС и повысить эффективность лечения подобных расстройств.
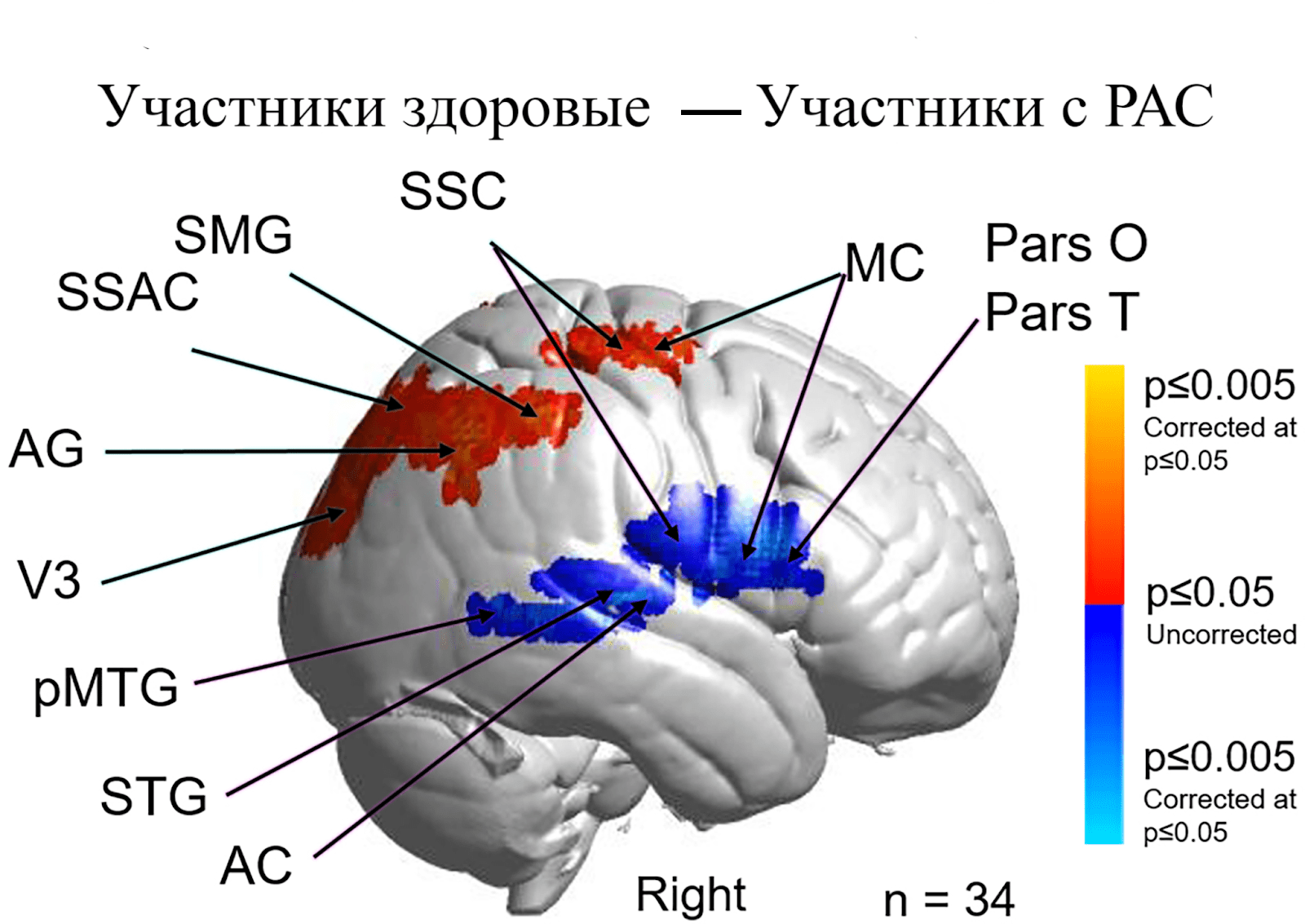
Рисунок 2. Контрастное сравнение участников с типичным развитием по сравнению с участниками с расстройством аутистического спектра (РАС). Участники с типичным развитием (красные кластеры) демонстрируют сравнительно большую активацию дорсальной соматосенсорной коры (SSC); супрамаргинальной извилины (SМG); угловой извилины (АG); пре- и дополнительной моторной коры (MC); и экстрастриарной зрительной коры (V3), тогда как повышенная активность наблюдалась у участников с РАС (синие кластеры) в относительно вентральной MC; SSC; задней средней височной извилине (pMTG); верхней височной извилине (STG); и слуховой коре (АС).
[6], рисунок адаптирован
Известно, что в развитии РАС вносят вклад множество генов, однако их идентификация затруднена из-за высокой гетерогенности заболеваний. Однако недавно ученые идентифицировали новый ген KDM5A. Функционирование этого гена нарушается у пациентов с РАС с отсутствием речи. Кроме того, KDM5A участвует в развитии и функционировании мозга. Поэтому ученые использовали несколько подходов к мышам с дефектными KDM5A — изучали продуцируемый белок, вокализацию и проводили морфологическое исследование нейронов [7].
Было исследовано 3 группы мышей: мыши с полностью нерабочим геном KDM5A, с частично неработающим KDM5A и полностью работающим KDM5A.
Анализ количества белка кортикальной ткани мозга мышей каждой из групп показал, что в случае с частичным нокаутом, как и предполагалось, количество белка уменьшается на 50% и целиком теряется при полном нокауте (в сравнении с мышами с нормально работающим KDM5A).
Что касается поведения мышей, то у животных с полным нокаутом наблюдается серьезное снижение максимальной пиковой частоты и количества ультразвуковых вокализаций (вокализация является важным средством передачи социальных сигналов у млекопитающих, особенно у грызунов, вокализации которых, вызванные различными эмоциональными состояниями, считаются в значительной степени врожденными [8]). Таким образом, потеря KDM5A приводит к аномальным вокализациям.
Изменения этого гена также отражаются на морфологических особенностях строения нейронов (рис. 3). Так, у мышей с дефектным геном KDM5A наблюдается снижение дендритной сложности корковых нейронов (красный) по сравнению с однопометными животными с функциональным геном (черный). Тоже самое можно сказать и о плотности расположения и длине шипов дендритов.
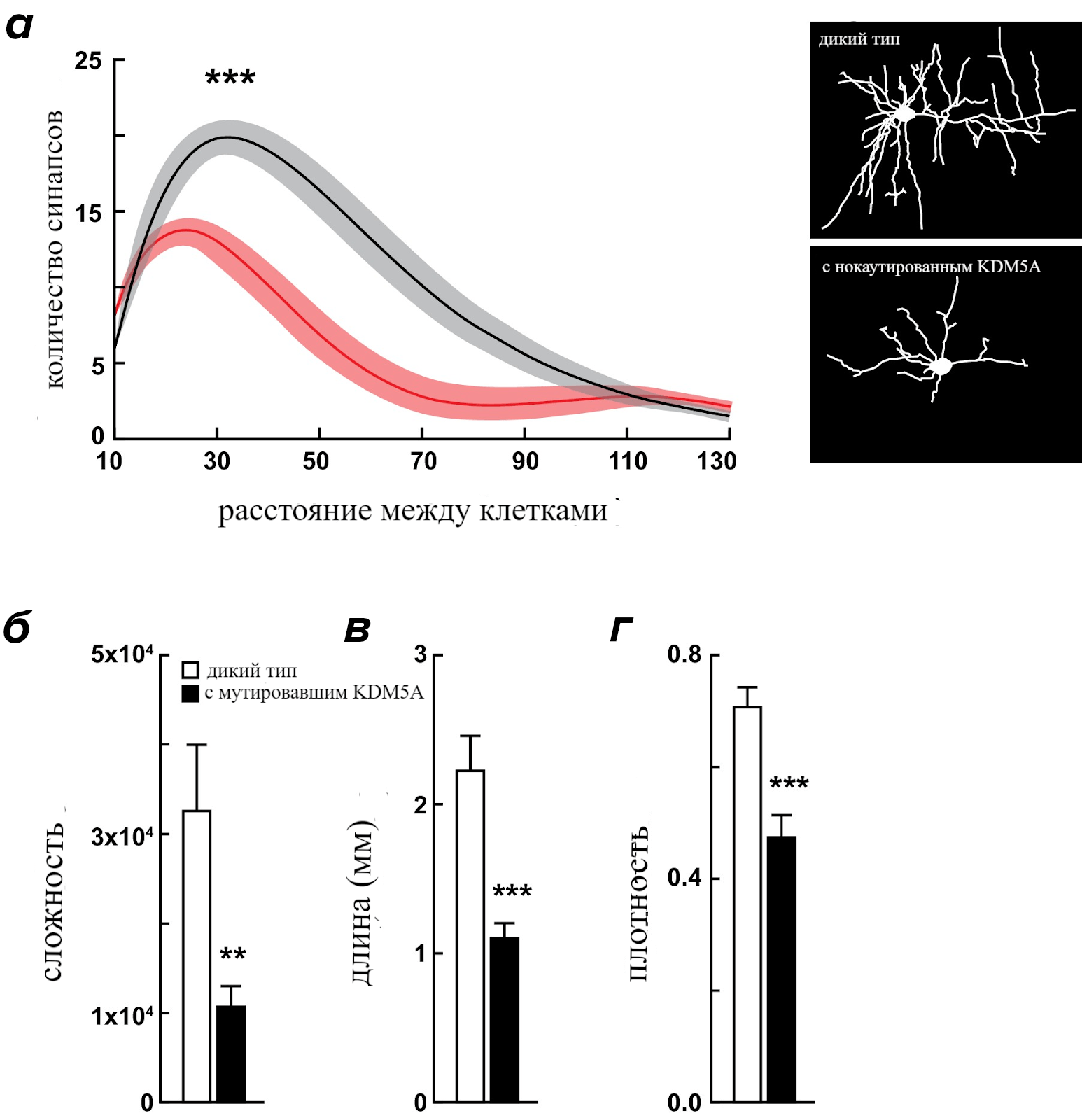
Рисунок 3. (а) Анализ нейронов, выявил снижение дендритной сложности корковых нейронов мышей с мутированным KDM5A (красный) по сравнению с однопометными животными дикого типа (черный). Окрашивание показало значительное снижение сложности дендритов (б, **p=0,0066), длины (в, ***p<0,0001) и плотности шипов (г, ***p<0,0001) корковых нейронов мышей с нокаутированным KDM5A по сравнению с однопометниками дикого типа. Данные были получены из базальных дендритов нейронов кортикального слоя мышей в возрасте 14–16 недель.
[6], рисунок адаптирован
В дальнейшем исследователи планируют использовать методы прямой генетики (в методах прямой генетики исходный интерес представляет фенотип, а эксперимент производится для обнаружения генетических факторов, влияющих на проявление фенотипа) для обнаружения мутаций, ассоциированных с РАС. Полученные к настоящему времени результаты могут быть использованы в молекулярной диагностике для более точной идентификации РАС.
Литература
- Marc Fakhoury. (2015). Autistic spectrum disorders: A review of clinical features, theories and diagnosis. Intl J of Devlp Neuroscience. 43, 70-77;
- Pratibha Singhi, Prahbhjot Malhi. (2023). Early Diagnosis of Autism Spectrum Disorder: What the Pediatricians Should Know. Indian J Pediatr. 90, 364-368;
- Feng Yue, The Mouse ENCODE Consortium, Yong Cheng, Alessandra Breschi, Jeff Vierstra, et. al.. (2014). A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515, 355-364;
- Cynthia X. He, Daniel A. Cantu, Shilpa S. Mantri, William A. Zeiger, Anubhuti Goel, Carlos Portera-Cailliau. (2017). Tactile Defensiveness and Impaired Adaptation of Neuronal Activity in the Fmr1 Knock-Out Mouse Model of Autism. J. Neurosci.. 37, 6475-6487;
- Qian Chen, Christopher A. Deister, Xian Gao, Baolin Guo, Taylor Lynn-Jones, et. al.. (2020). Dysfunction of cortical GABAergic neurons leads to sensory hyper-reactivity in a Shank3 mouse model of ASD. Nat Neurosci. 23, 520-532;
- Joy Hirsch, Xian Zhang, J. Adam Noah, Swethasri Dravida, Adam Naples, et. al.. (2022). Neural correlates of eye contact and social function in autism spectrum disorder. PLoS ONE. 17, e0265798;
- Lauretta El Hayek, Islam Oguz Tuncay, Nadine Nijem, Jamie Russell, Sara Ludwig, et. al.. (2020). KDM5A mutations identified in autism spectrum disorder using forward genetics. eLife. 9;
- Huihui Qi, Li Luo, Caijing Lu, Runze Chen, Xianyao Zhou, et. al.. (2023). TCF7L2 acts as a molecular switch in midbrain to control mammal vocalization through its DNA binding domain but not transcription activation domain. Mol Psychiatry. 28, 1703-1717.







