Твои кости знают, что ты пропустил тренировку
31 марта 2025
Твои кости знают, что ты пропустил тренировку
- 761
- 0
- 4
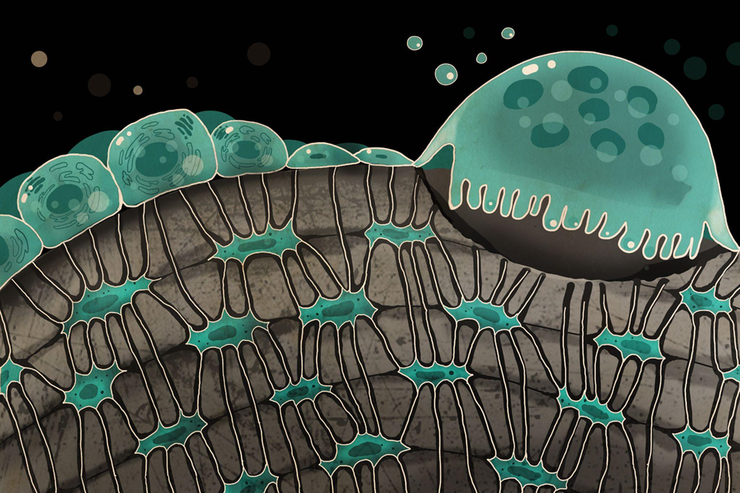
Художественное изображение пластинчатой костной ткани.
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Костная ткань перестраивается на протяжении всей жизни организма, адаптируясь к условиям среды. Определенные клетки костной ткани способны воспринимать механические нагрузки и преобразовывать их в биохимические сигналы, запуская процессы анаболизма.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Скелетная кость — шедевр биоархитектуры. Этот «Тадж-Махал» многоклеточной цивилизации построен не только из замысловатого органического каркаса, который инкрустирован минеральными кристаллами, но также состоит он из клеток, которые все это великолепие создают. Глядя на твердую и прочную кость, трудно избавиться от мысли о законченности, но костная ткань на протяжении жизни постоянно ремоделируется — то есть перестраивается. Причем, даже во взрослом организме. Немецкий профессор медицины Юлиус Вольф в конце XIX века вывел закон: «Кость здорового человека или животного адаптируется к нагрузкам, которым подвергается». И действительно, кости тяжелоатлета в ответ на тренировки становятся плотнее и крепче, а кости космонавта, работающего в невесомости, наоборот, стремительно теряют плотность. Ремоделирование, помимо плотности, затрагивает также архитектуру внутреннего строения костной ткани, а под влиянием занятий спортом изменяется даже морфология костей: они становятся массивнее и толще, а выступы, гребни — более выражены (изменения костей скелета зависят непосредственно от вида спорта). Так, путем постоянной перестройки, достигается наиболее эффективное и ресурсно-выгодное строение костной ткани в соответствии с постоянно изменяющимися запросами среды.
Но каким же образом твердые кости могут перестраиваться? Как «узнают» потребности организма и «ощущают» нагрузку? И кто это там ябедничает, что вы пропустили тренировку?
Созидатели и разрушители
Кость, как и любая другая система организма — это уникальный мир со своими обитателями, коммуникацией, правилами и законами. В костной ткани живут и трудятся две различные линии клеток (или два дифферона). Одна линия отвечает за созидание, вторая — за разрушение, что в целом как раз и отражает процесс постоянной перестройки костей на клеточно-молекулярном уровне. Строители кости происходят от стромальной стволовой клетки (от греч. στρῶμα — подстилка), которая также является «прародительницей» линий хрящевых, мышечных, жировых и других клеток. А вот разрушители костной ткани — это потомки стволовой клетки крови и относятся к фагоцитам, то есть пожирателям. Они представляют специфическую разновидность макрофагов [1].
По-гречески кость — osteon. Потому «остео-» нередко является частью сложных слов, связанных с костной тканью — остеотомия, остеохондроз и т.д. Клетки, которые отвечают за постройку и ремоделирование костей, тоже гордо носят «фамилию», указывающую на их принадлежность: остеобласт, остеоцит, остеокласт (рис. 1).
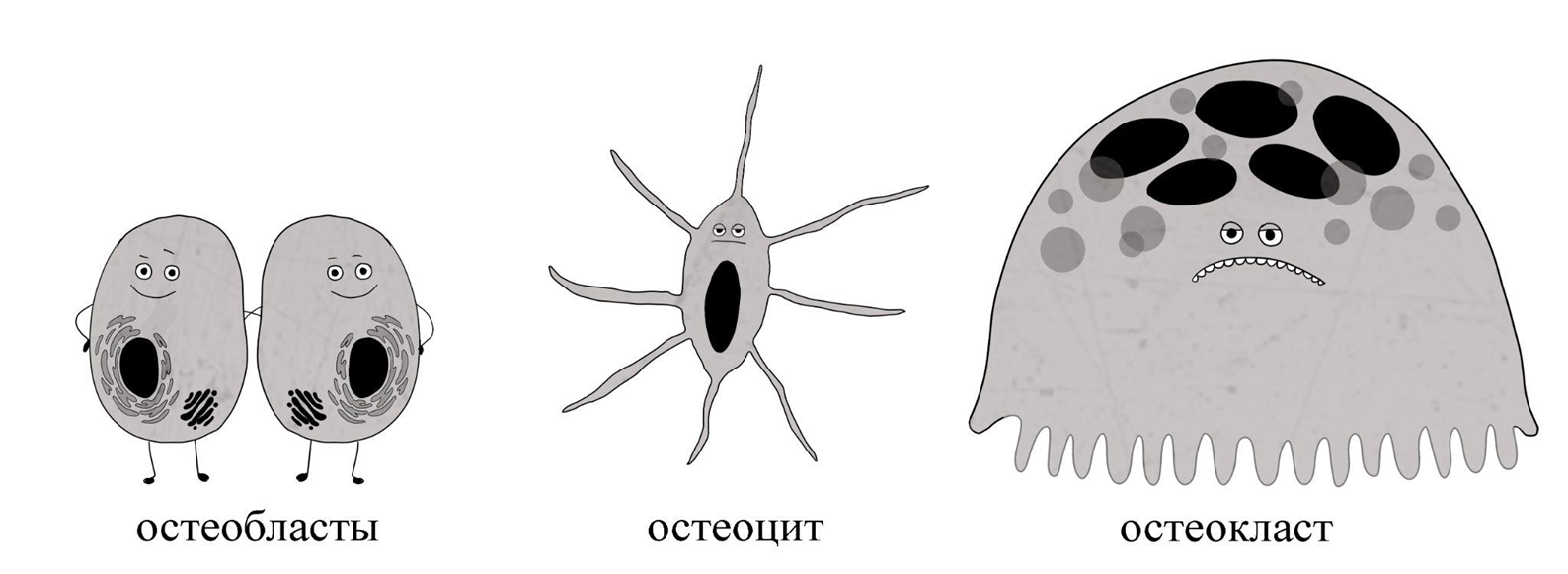
Рисунок 1. Справа налево: остеобласты, остеоцит, остеокласт.
иллюстрация автора
У каждого вида костных клеток свой круг прав и обязанностей, между ними налажена сложная коммуникация, а вместе они формируют эффективный строительный коллектив. Если упростить, устройство костной ткани по принципу похоже на железобетонную конструкцию, в которой органический (белковый) каркас служит гибкой арматурой, а минеральные компоненты — бетоном. Потому первый этап создания костного объекта — это всегда сборка органического каркаса, а уже после — его «бетонирование». Обе эти функции берут на себя бравые молодые остеобласты, которые организуют изначальную архитектуру костных объектов.
Микро-архитектор, или как строить, если «у тебя лапки»
Остеобласт — клетка работящая и подвижная. «-Бласт» в его фамилии говорит о том, что он еще не потерял способность делиться и, если понадобится, для дела может создать себе клона-помощника (замечательная способность, согласитесь). А эксперименты показывают, что остеобласт способен к направленной миграции в область важных для него молекулярных сигналов: например, он умеет медленно (но верно) ползти в сторону живой костной ткани [2]. Внутри остеобласт оснащен крупной фабрикой по производству белков на экспорт и цехом по сборке сложносоставных молекулярных агрегатов (иными словами, у этой клетки прекрасно развиты гранулярная эндоплазматическая сеть и комплекс Гольджи). Всё это «оборудование» снабжается энергией, которую обеспечивают многочисленные митохондрии (энергетические органеллы клетки) [1].
Благодаря такому «оснащению» остеобласт способен в больших количествах производить белковые молекулы разной степени сложности, которые станут стройматериалами для будущей кости. Но может ли клетка из этих стройматериалов что-то сложное построить? У нее же ни рук, ни топорёнка! Может. Вот только из-за микроскопических размеров и ограниченных физических возможностей подход к строительству в микромире принципиально иной. Мы, люди, преимущественно строим «из» материалов, а клетки не только «из», но и «с помощью». Основан этот принцип на разнообразных химических и биохимических взаимодействиях, которые позволяют осуществлять строительство путем самосборки (и саморазборки). В общем, клетке для зодчества не нужны руки: достаточно «умных» стройматериалов, которые всё сделают сами.

Рисунок 2. Двое из Ларца готовы сделать всю работу за Вовку, прямо как строительные молекулы за остеобласта.
кадр из мультфильма «Вовка в тридевятом царстве»
«Умные» стройматериалы
Биохимическая эволюция тщательно отбирала органические молекулы, способные не только самоупорядочиваться в определенную функциональную конфигурацию, но также имеющие возможность спонтанной самосборки молекулярных единиц в более крупные агрегаты. В итоге получился эдакий биохимический конструктор на максималках. Самосборка молекулярных агрегатов может проходить как с затратой энергии в виде АТФ, так и без — путем других взаимодействий (ковалентные сшивки, водородные связи и т.д.). А на запуск или скорость самосборки (и саморазборки) могут влиять температура, рН, ферменты (катализаторы) и другие условия. А раз уж «умные» стройматериалы активно участвуют в зодчестве костей и без них безруким строителям вообще никак, то стоит приглядеться к ним пристальней.
Коллаген
Коллаген — фибриллярный (нитчатый) белок, который составляет основу соединительных тканей организма животных. У растений и грибов технологий изготовления коллагена нет, они в строительстве обходятся другими типами биоконструкторов (например, целлюлозой или хитином). Производство коллагена — процесс сложный и очень энергозатратный, но именно этот белок позволил создать скелет и предоставил животным возможность здорово увеличиться в размерах.
Для создания «арматуры» костной ткани используется фибриллярный коллаген 1 типа — самый распространенный в организме (он входит также в состав мягких тканей, кожи, стенок артерий и т.д.). Сборка структурных единиц коллагена, как и всех белковых молекул, начинается в гранулярной эндоплазматической сети клетки. На рибосомах происходит синтез белковых цепей по инструкции генетического кода организма, которые вследствие чередования определенных аминокислотных остатков принимают форму левозакрученных спиралей. Три такие спиральные цепочки соединяется водородными связями в одну прочную правозакрученную суперспираль — так получается молекула проколлагена, будущая составляющая единица коллагеновых фибрилл.
Проколлаген как стройматериал еще не активен. Он имеет специальные хвосты на обоих концах молекулы — эдакую защиту, которая предотвращает спонтанную самосборку отдельных единиц в более крупные агрегаты. И это крайне важно: никакому строителю не понравится, если кирпичи начнут самосборку здания внутри него. Так что стройматериалы, какими бы «умными» они ни были, нужно обязательно сначала выдворить из клетки: синтезированный проколлаген перемещается в аппарат Гольджи, где упаковывается в пузырьки (секреторные везикулы) и экспортируется из остеобласта во внеклеточный матрикс. Снаружи клетки новенькие стройматериалы встречают специальные протеолитические ферменты, задача которых «срезать» защитные концы молекул, превратив проколлаген в тропоколлаген (рис. 3). Тропоколлаген — это уже активная составляющая единица биоконструктора. При самосборке из него получаются прочные микрофибриллы, которые могут соединяться далее в фибриллы, а потом — в толстые коллагеновые волокна, диаметром 1–12 мкм.
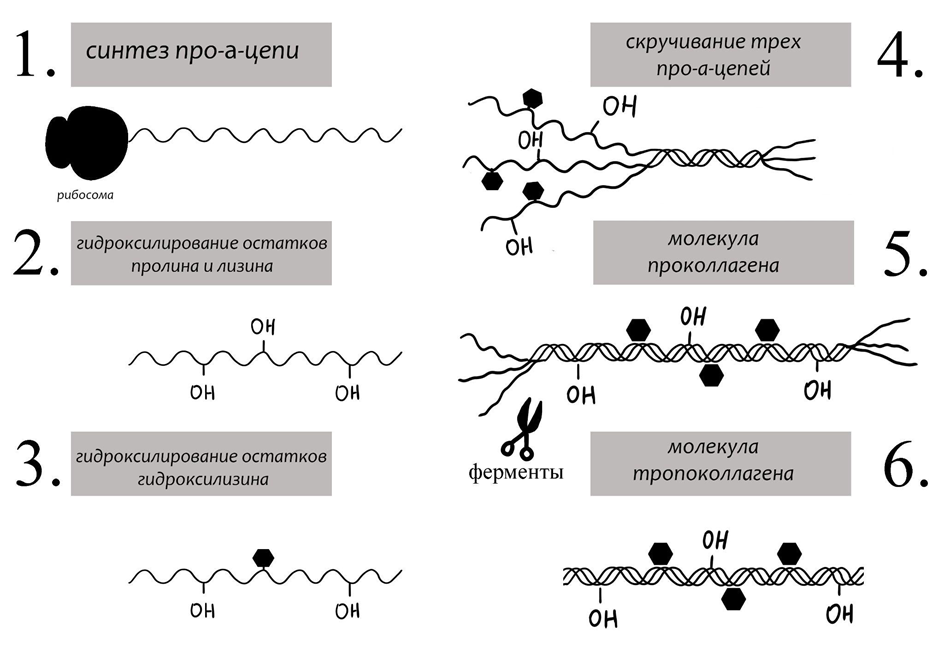
Рисунок 3. Синтез и образование молекулы тропоколлагена.
иллюстрация автора
Процесс образования и сборки коллагеновых фибрилл не только сложный и энергозатратный, он также требует достаточного количества необходимых «ингредиентов», а нехватка чего-то на одном из промежуточных этапов может привести к серьезным последствиям для всего организма. Например, при образования тройной спирали коллагена для ее химической стабилизации необходима аскорбиновая кислота в качестве кофермента, в противном случае молекула получится непрочной, а постройки из такого «бракованного кирпича» будут в буквальном смысле разваливаться. Кровоточивость дёсен — один из признаков нехватки аскорбиновой кислоты (и как следствие — потери прочности тканей). А в крайнем случае такой нестабильный коллаген может привести к развитию всем известной цинги.
Остеонектин
Кроме синтеза коллагена, в задачи остеобластов входит производство других важных молекулярных компонентов костного матрикса — протеогликанов и гликопротеинов. Молекулы протеогликанов, состоящие из белкового компонента и длинных разветвленных цепей полисахаридов, хорошо связывают и удерживают воду. Они в основном необходимы для придания вязко-эластичности ткани и обеспечивают дополнительную устойчивость ее к компрессии [4].
Гликопротеины — это как протеогликаны, только наоборот: если в молекуле протеогликана преобладающим компонентом являются сахариды, то в гликопротеине это белок. Гликопротеины не зря называются мультиадгезивными белками (от лат. adhaesio — прилипание). Их строение позволяет соединять различные по свойствам структуры не хуже биохимического двустороннего скотча. Важнейшим гликопротеином костной ткани является остеонектин, который как раз и производят остеобласты. Через свою «сахарную» часть молекула остеонектина способна соединиться с коллагеном, а на белковой части у нее находятся участки для связывания ионов кальция. Так, с помощью остеонектина на фибриллах органической матрицы образуются центры кристаллизации, необходимые для минерализации костей (рис. 4).
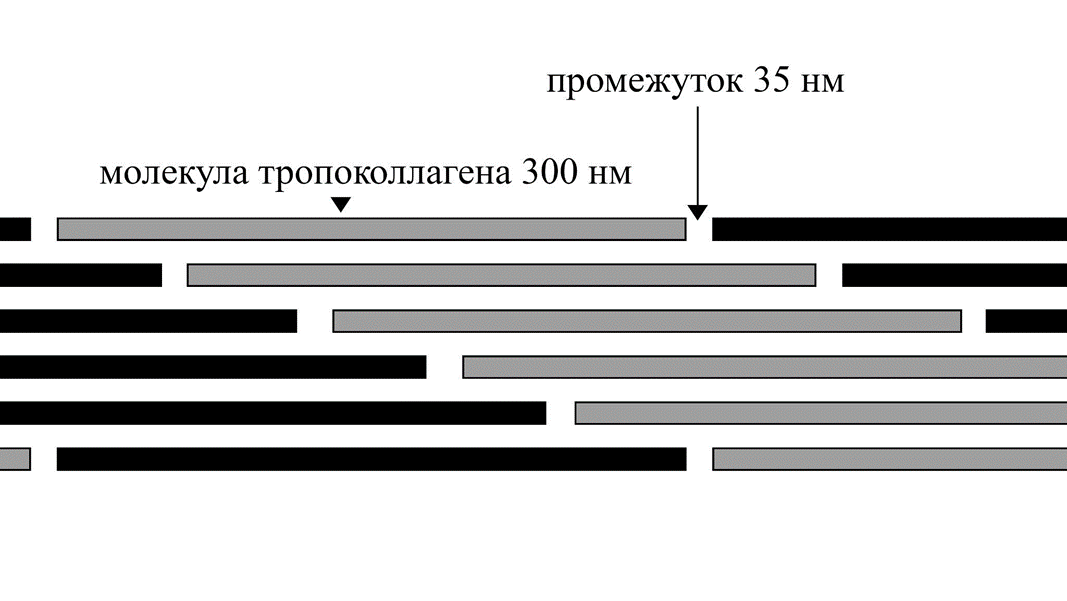
Рисунок 4. При самосборке коллагеновых фибрилл молекулы тропоколлагена соединяются не стык в стык, а с небольшим промежутком. В эти промежутки встраивается остеонектин, на котором начинается рост минеральных кристаллов.
иллюстрация автора
Однако уютно устроившийся в промежутках между молекулами тропоколлагена остеонектин еще не обеспечивает минерализацию. Для формирования кристаллов нужна особая среда, иначе следующий этап строительства — «бетонирование арматуры» — окажется невозможным [5].
Щелочная фосфатаза и остеокальцин
Чтобы начался процесс минерализации коллагенового матрикса, необходимы определенные условия, а именно, повышенная концентрация фосфора и кальция. Каждый остеобласт создает такую среду вокруг себя при помощи щелочной фосфатазы и остеокальцина. Щелочная фосфатаза — это фермент, который участвует в реакции отщепления фосфора от определенных органических веществ. А белок остеокальцин связывает и удерживает кальций, поступающий из крови. Таким образом, при помощи щелочной фосфатазы и остеокальцина внеклеточная среда вокруг остеобласта обогащается кальцием и фосфором, что способствует спонтанному осаждению фосфатов кальция и росту минеральных кристаллов на «прилипшем» к коллагеновой матрице остеонектине [5].
Минералы
Минеральная часть зрелого костного матрикса состоит из гидроксиапатита кальция. Это кристаллы, основными элементами которых являются кальций и фосфор с включением карбоната: Са10(Р04)6(ОН)2. Кристаллы гидроксиапатита костного матрикса имеют очень небольшие размеры (~200°А) по сравнению с природными [5]. Это, плюс наличие карбоната в составе, делает их более растворимыми, что очень важно для возможности дальнейшей перестройки костных объектов. Также в состав кристаллов включаются ионы магния и других металлов — подробный состав зависит от окружающих условий. Питание, состав воды, загрязненность окружающей среды солями тяжелых металлов, прием некоторых лекарств — всё это влияет на минеральный состав костей. А способность костей скелета связывать некоторые токсины и ионы металлов, по-видимому, имеет значение в минимизации их токсического воздействия на клетки других органов [5].
Но без строителя всё же никак
В целом, задачи маленьких строителей можно свести к двум основным: это производство «умных» строительных материалов и создание вокруг себя среды, способствующей минерализации органического матрикса. Хотя этим функции остеобласта как строителя не ограничиваются. Да, экспериментально проверено, что «умные» стройматериалы действительно способны к самосборке в пробирке сами по себе (без участия клеток), но таким путем можно получить постройку типа «сарай». А кость, особенно зрелая — это никак не меньше, чем «дворец». Так что клетки не только производители стройматериалов, но также опытные прорабы, которые контролируют и упорядочивают процесс самосборки молекулярного конструктора путем каскада сложных биохимических взаимодействий. Без остеобластов никакого шедевра архитектуры не получилось бы [3].
А еще в работе остеобластов присутствует один интересный нюанс. Проколлаген и другие стройматериалы секретируются практически через всю поверхность клетки, что дает остеобласту возможность окружить себя костным матриксом со всех сторон. Потому, если процесс строительства и «бетонирования» идет как надо, остеобласты, как Волк в известной серии «Ну, погоди!», постепенно замуровывают сами себя в собственных «железобетонных» конструкциях.

Рисунок 5. Кадры из 10 выпуска «Ну, погоди!». Спасаясь от бегемота, волк замуровал себя в строящемся доме.
мультфильм «Ну, погоди!»
Дежурный ремонтник
Волк в мультфильме закладывает сам себя кирпичами по ошибке, а остеобласт делает это по плану. Так и должно быть: замурованный остеобласт становится неотъемлемой частью костной постройки. Он подвергается окончательной дифференцировке (специализации) и приобретает фенотип остеоцита. Замена «-бласт» на «-цит» намекает на то, что клетка больше не способна делиться и «окончательно повзрослела». Так активный молодой архитектор превращается в сидячего ремонтника средних лет. Он уменьшается в размерах, существенно снижает свой метаболизм и синтетические способности: содержать такие продвинутые фабрики, как у остеобласта, становится нецелесообразным, и потому промышленные комплексы расформировываются – остается лишь небольшая мастерская в гараже.
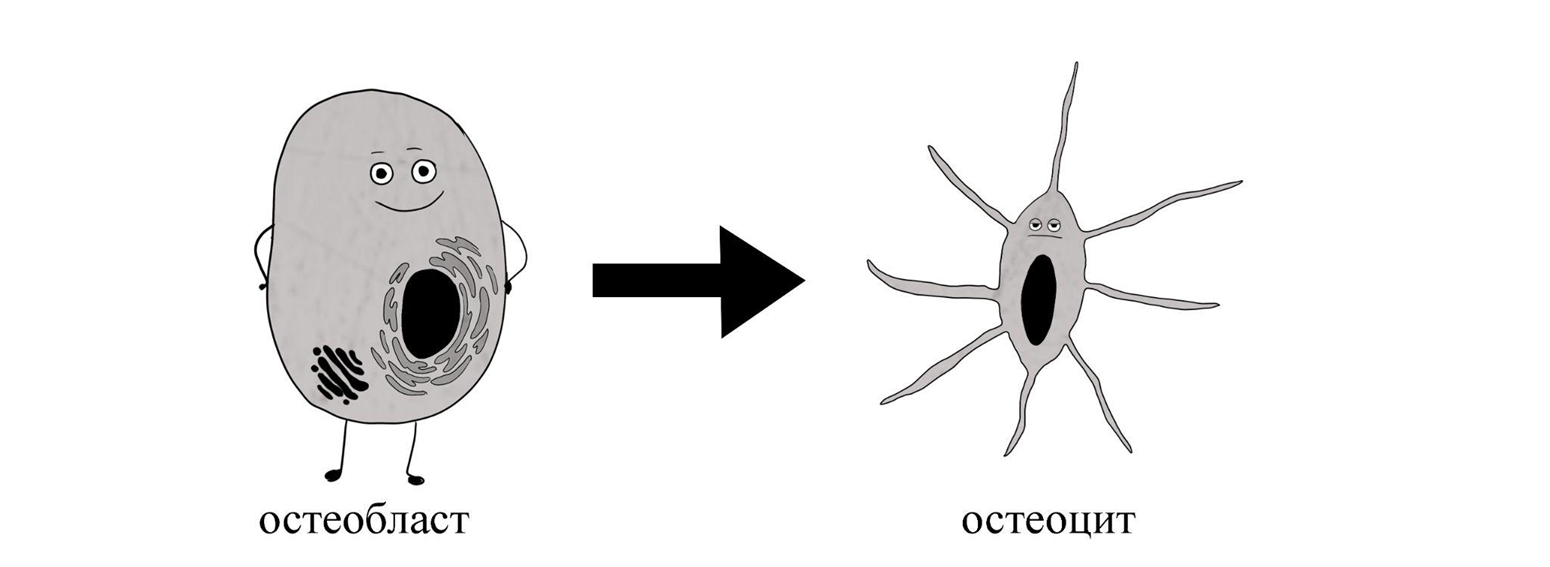
Рисунок 6. Дифференцировка остеобласта в остеоцит.
иллюстрация автора
Скромная полость, в которой остается жить остеоцит, называется костной лакуной. Лакуны не полностью изолированы: в зрелой кости они сообщаются с другими такими же «квартирами» при помощи тонких канальцев. В канальцах постоянно циркулирует тканевая жидкость, благодаря чему поддерживается диффузия метаболитов и обмен между лакунами и кровеносными сосудами. Таким образом затворники могут дышать, питаться и удалять продукты жизнедеятельности. В дополнение к этому, замурованные остеоциты протягивают в канальцы длинные отростки и соединяются между собой в клеточную сеть. Через каналы контактов осуществляется дружеский обмен ионами и молекулами соседних клеток: так замурованные ремонтники могут дополнительно делиться друг с другом необходимыми веществами, а также информацией [1]. В общем, остеоциты, хоть и не могут ходить друг к другу в гости, но имеют возможность передавать сплетни, занимать у соседа соль или сахар и т.д.
Если основная задача остеобластов — это строительство кости буквально «с нуля», то обязанность остеоцитов скромнее — им положено сидеть в лакунах, следить за обстановкой и участвовать в процессе ремоделирования уже отстроенной кости. Но это не умаляет их важности: на основании исследований были сделаны выводы, что остеоциты способны как укреплять стенки лакуны вокруг себя, так и расширять свои пещерки — то есть частично растворять костный матрикс, подстраиваясь под запросы среды и организма [6]. А поскольку площадь поверхности лакуно-канальцевой системы остеоцитов внутри кости на несколько порядков больше площади ее поверхности, деятельность этих ребят оказывает значительное влияние на метаболизм и качество костной ткани [6]. Так что, хоть остеоцит мал, да удал.
Но уж если речь пошла о разрушении, остеоциты ни в какое сравнение не идут с бригадами, для которых уничтожение кости является основной профессией.
Дробитель кости
Возникает уместный вопрос: а зачем нужно разрушать то, что уже качественно построено? Поводов несколько, они все в основном связаны с адаптацией и гомеостазом (об этом будет ниже). Но также частичное разрушение бывает необходимо при травмах и переломах кости. Ведь чтобы качественно отремонтировать постройку, порой нужно уничтожить то, что пришло в негодность.
Остеокласт, или «дробитель кости» (греч.: clao — раздроблять) — даже звучит уважительно. А если вы позвали бригаду костных разрушителей, но на вызов приполз всего один остеокласт — не спешите возмущаться. Один остеокласт — это и есть целая бригада клеток! Дело в том, что для создания остеокласта несколько (иногда десятки) предшественников макрофагов (моноцитов) сливаются друг с другом, образуя симпласт: гигантскую многоядерную клетку (рис. 7).
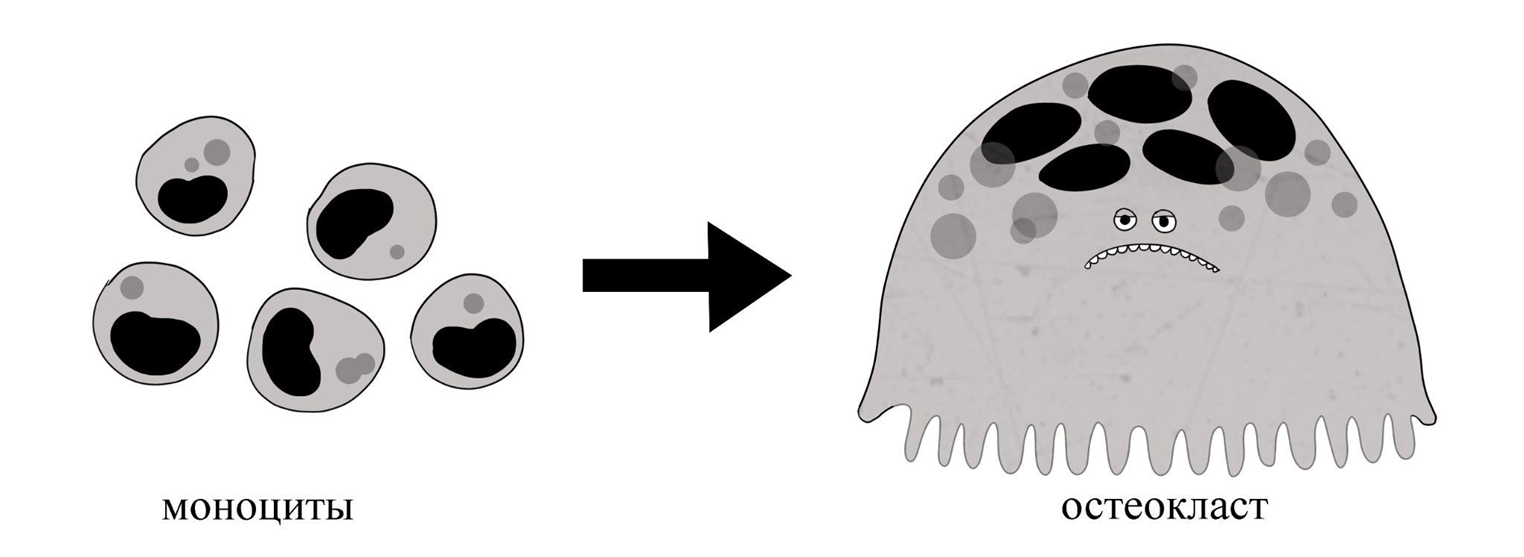
Рисунок 7. Моноциты преобразуются в многоядерный симпласт — остеокласт.
иллюстрация автора
Для сравнения: если один остеобласт или среднестатистический макрофаг крови (довольно крупная клетка!) имеет размер 15–20 мкм, то остеокласт — это громила до 100 мкм и более [1]. Но, несмотря на внушительные размеры, остеокласт, конечно же, не крушит костные балки, бодая их с разгона своей тушкой. Для качественного разрушения ему нужна не физическая сила, а ... «юбка» (рис. 8).

Рисунок 8. Остеокласт и его «юбка».
иллюстрация автора
Остеокласты — симпласты с очень любопытной структурной организацией. В базальной зоне у остеокласта, помимо десятков ядер (по одному от каждой соединившейся в симпласт клетки), находится обычный для пожирателей набор органелл. А так как одна из основных функций фагоцитов — утилизация и экологичная переработка всякого мусора, то это прежде всего лизосомы с ферментами (какой же пожиратель без многочисленных «желудков»?). Но есть также у остеокласта структура, которая характерна только для него. Остеокласт — клетка полярная, у него, в отличие от обычного макрофага, можно выделить «нижнюю» часть, которой он всегда направлен к поверхности кости. Эта сторона клетки устроена по-особому, в виде многочисленных складок цитоплазмы, и называется «гофрированная каемка» [1].
Когда остеокласту нужно разрушить костную ткань, вокруг гофрированной каемки у него вырастает кольцо подосом — выростов цитоплазмы. Эту структуру называют светлой зоной. Она не содержит органелл, но богата на белки адгезии, необходимые для сцепления. Такой временный «липучий» кольцевой вырост в виде «юбки» нужен для того, чтобы плотно прикрепиться к матриксу и сформировать непроницаемый барьер между гофрированной каемкой и поверхностью кости. Работы по разрушению будут вестись именно здесь, под «юбкой», в герметично закрытом пространстве — лакуне Хаушипа (в честь британского врача-хирурга) [1].
Остеокласт работает очень аккуратно. После того, как он прикрепился «юбкой» к объекту, его гофрированная каемка (подъюбник?) начинает выделять ионы Н+ и Cl-, образуя в замкнутом пространстве кислую среду. Собственно, для этого и нужны складки и сборки: они увеличивают площадь поверхности и дают возможность разместить большее количество помп и каналов, с помощью которых в лакуну Хаушипа закачиваются ионы. Так, между остекластом и поверхностью кости образуется соляная кислота. Технология производства соляной кислоты остеокластом — «изобретение» не уникальное, по тому же принципу кислота образуется клетками в желудке. Соляная кислота разъедает (деминерализует) матрикс — очищает органическую арматуру от гидроксиапатита и делает ее доступной для протеолитических ферментов. Из «желудков»-лизосом ферменты также щедро «выплескиваются» в лакуну. Можно сказать, остеокласт использует эдакий вариант «внешнего пищеварения» (кислая среда, пищеварительные ферменты — всё, как положено). А образовавшиеся в лакуне Хаушипа продукты распада костной ткани далее попадают внутрь клетки путем эндоцитоза, проходят внутри более детальную переработку на запчасти и, наконец, выделяются в межклеточное пространство. Аминокислоты растворенного коллагена могут быть захвачены другими костными клетками и снова включатся в постройку (или ремонт) матрикса. Или же вместе с кальцием попадают в кровяное русло, где их используют другие клетки организма.
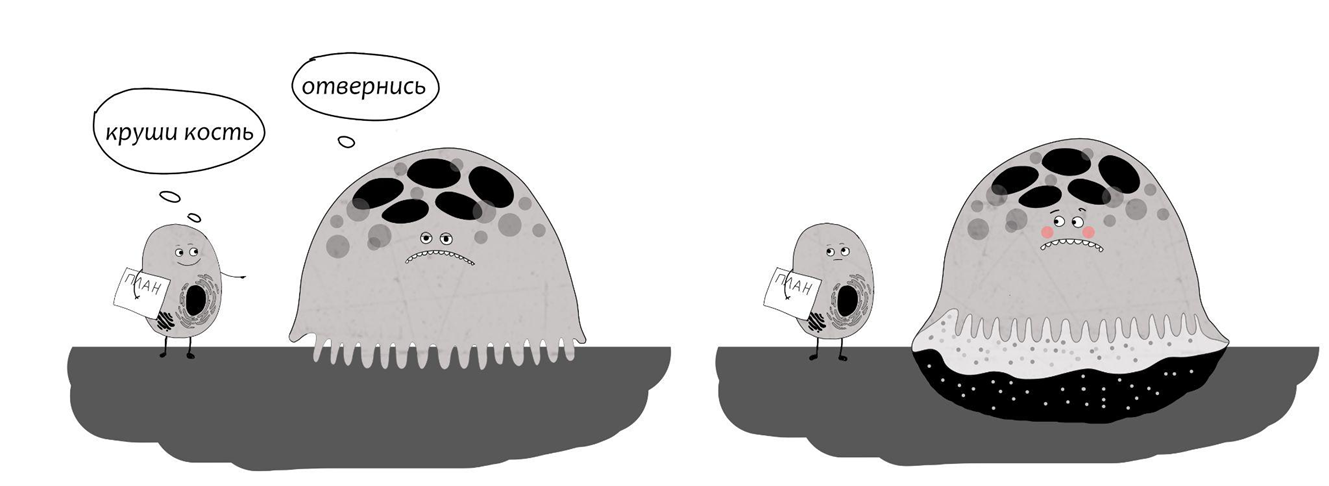
Рисунок 9. Остеокласт за работой.
иллюстрация автора
Активность остеокласта циклическая — периоды работы сменяются периодами покоя. Закончив работу, остеокласт подбирает «юбку» (выросты светлой каемки исчезают) и перемещается на новый объект [1].
Другие клетки
Рассказ о специфических обитателях костного царства-государства будет неполным, если не упомянуть клетки выстилки костной ткани. Архитектор-остеобласт может стать не только замурованным остеоцитом. Порой он остается на поверхности, сделавшись клеткой выстилки: это плоские, малоактивные веретенообразные клетки, покрывающие костные поверхности. Сегодня мало что известно о функционировании этих клеток, но при определенных условиях (например, травма) они способны дифференцироваться обратно в остеобласты [1].
От сарая ко дворцу
Строительство костной ткани может происходить на двух разных основах и разделяется на прямой и непрямой остеогенез. «Непрямой» остеогенез, конечно, не означает «кривой», просто в первом случае кость строится «с нуля» на основе мезенхимы (зародышевой соединительной ткани). А во втором — на основе уже отстроенной хрящевой модели, которую любезно сваяли хрящевые клетки. Непрямой остеогенез — это ни что иное, как окостенение: последовательное замещение гиалиновой хрящевой ткани костной.
Независимо от того, строится кость на основе мезенхимы или модели из гиалинового хряща, она может быть двух типов: грубоволокнистой (или незрелой) и пластинчатой (зрелой). В грубоволокнистой костной ткани коллагеновые волокна расположены хаотично, разнонаправленно, в ней меньшее содержание минерального компонента и выше скорость метаболических процессов. Она проста в устройстве, ее можно довольно быстро отстроить, потому грубоволокнистая ткань хороша для временных построек. Этого типа костной ткани образуется много в эмбриональный период, а во взрослом организме ее почти нет, она в основном вся со временем замещается более сложной и прочной пластинчатой костной тканью. Но на протяжении жизни человека грубоволокнистая костная ткань формируется в ответ на повреждение (например, при переломах), в результате инвазивных медицинских процедур.
Зрелая, или пластинчатая костная ткань устроена куда мудреней. Волокна коллагена в ней строго упорядочены в одном направлении (параллельны друг другу), и образуют пластины — слои, чем-то схожие с листами бумаги. Такие «листы» накладываются один на другой, причем так, чтобы волокна коллагена одной пластины были повернуты под углом к другой, что придает образованной структуре большую прочность. Пластинки, конечно, собраны не идеально: они могут расслаиваться, фибриллы одной часто продолжаются в соседние, создавая единую волокнистую основу. Кроме того, вся архитектура пронизана отдельными волокнами, ориентированными перпендикулярно костным пластинкам, благодаря чему достигается еще большая прочность. А в плотных стыках между костными пластинами залегают наши дежурные остеоциты в своих лакунах (рис. 10).
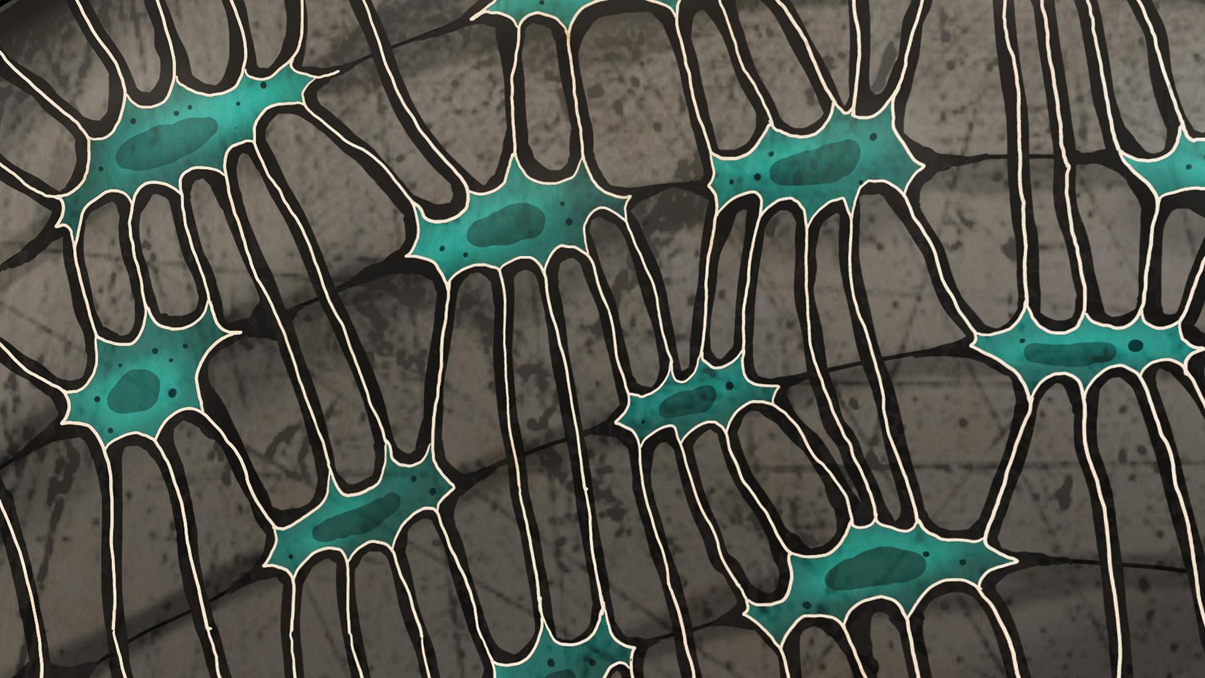
Рисунок 10. Остеоциты между костных пластинок, поперечный срез. Пропорции и цвета не соблюдены.
иллюстрация автора
На более высоком уровне организации костные пластины образуют многослойные цилиндры, как бы вставленные друг в друга. Эти цилиндры называются остеонами и считаются структурной единицей костной ткани (рис. 11). Остеоны располагаются вокруг кровеносных сосудов, питающих кость, и по укладке чем-то напоминают наросты годовых колец дерева. В центре остеона находится гаверсов канал (по имени английского анатома К. Гаверса), заполненный рыхлой волокнистой соединительной тканью с кровеносными сосудами и нервными волокнами. А связывают каналы остеонов между собой перпендикулярно проходящие каналы Фолькмана (в честь немецкого физиолога и анатома), которые имеют выход к сосудам и нервам надкостницы.
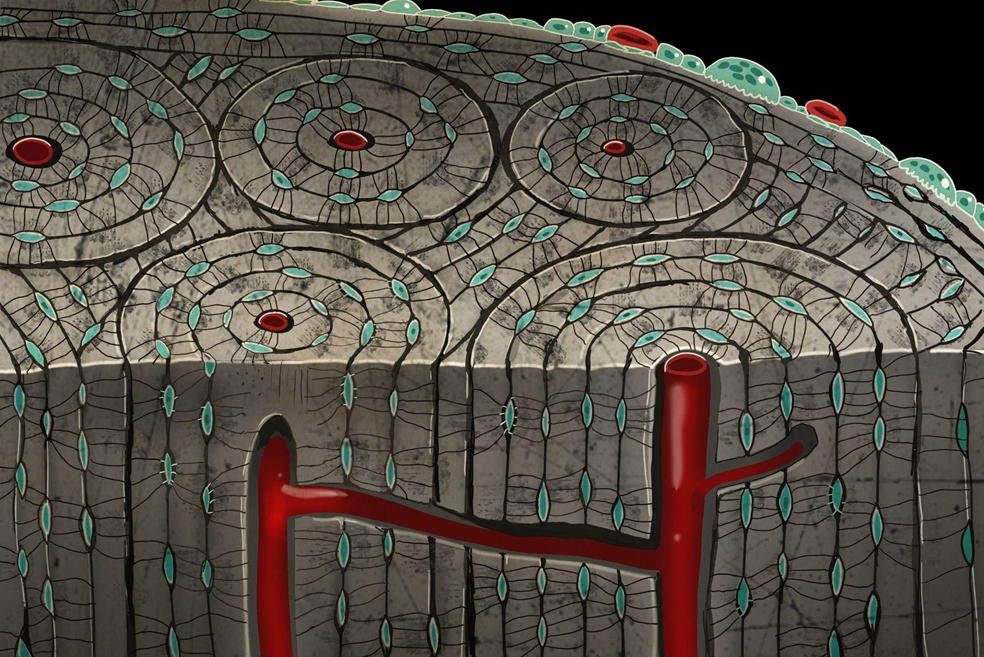
Рисунок 11. Художественное исполнение остеонов пластинчатой костной ткани в разрезе. Пропорции и цвета не соблюдены.
иллюстрация автора
Диаметр остеона составляет не более 0,4 мм и определяет расстояние, на которое эффективно диффундируют вещества к самым дальним остеоцитам из центрально расположенного кровеносного сосуда. Так что снабжение у ремонтников-остеоцитов, несмотря на их затворничество, вполне себе порядочное.
Если перейти на еще более высокий уровень организации, который становится вполне видимым для нашего невооруженного глаза, пластинчатая костная ткань делится на плотную и губчатую. Слово «плотная» говорит само за себя, из этого вида ткани обычно состоит внешняя оболочка костного объекта. А губчатую конфигурацию пластинчатая костная ткань принимает внутри полых костей. Структурной единицей губчатой костной ткани является трабекула. Трабекулы, которые соединяются между собой как своды или балки, делают кость легче по весу без особой потери прочности, и здорово упрощают снабжение необходимыми веществами. Самые толстые и мощные трабекулы располагаются в направлении наибольших механических нагрузок. Например, в губчатой кости тела позвонка трабекулы преимущественно ориентированы в вертикальной и горизонтальной плоскостях [3].
А поговорить? Коммуникация и регуляция
В организме никто ничего просто так не строит и не переделывает, иначе это был бы не организм, а бардак. Зодчие кости (как и все порядочные клетки многоклеточных) непрерывно общаются друг с другом и с командными центрами нервной системы. Они посылают и принимают множество различных сигналов: гормонов, факторов роста, цитокинов, и таким образом активно участвуют в поддержании гомеостаза. Каждая клетка постоянно мониторит обстановку, сверяется с «мнением» окружающих и «принимает решения»: это сложнейший процесс, в котором нужно взвесить не только количество, но и важность приходящих сигналов, которые зачастую конкурируют между собой.
Участие костной ткани в гомеостазе организма является критически важным: помимо всем известной опорной функции, кость также является буфером кальция. Уровень кальция в крови — это один из самых стабильных показателей в организме, что говорит о его исключительной важности. Его малейшее отклонение от нормы может привести к серьезным последствиям, потому что ионы кальция входят в группу универсальных регуляторов жизнедеятельности каждой живой клетки. Это, конечно, не кислород, но и без кальция клетка тоже не сможет нормально функционировать (хоть и продержится немного дольше). Как же организм поддерживает оптимальный уровень кальция?
Паратиреоидный гормон
В случае, если уровень кальция в крови падает (например, недостаточно его поступает с пищей), организм посылает запрос на высвобождение этого ценного иона из костей. Сообщение костным клеткам приходит в виде паратиреоидного гормона (ПТГ). Казалось бы, этот сигнал должны принимать непосредственно разрушители — остеокласты. Но нет, рецепторами (приёмниками) к ПТГ обладают только клетки остеобластического ряда. ПТГ является сигналом к приостановке строительной деятельности остеобластов и остеоцитов, и предписывает первым «вызывать» на работу бригады дежурных костных дробителей (а если необходимо — стимулировать дифференцировку новых). Остеобласты стимулируют к работе остеокласты, выделяя лиганд RANKL в ответ на ПТГ. Так, только через посредничество остеобластов, костедробители получают сигнал к резорбции костного матрикса и высвобождению кальция. Общим результатом действия ПТГ является повышение концентрации кальция в плазме крови и снижение содержания кальция в костях [7].
С ПТГ, однако, не всё так однозначно. В настоящее время установлено, что прерывистое применение низких доз ПТГ оказывает анаболический (укрепляющий) эффект на костную ткань. Эта его способность используется для лечения выраженного остеопороза как у женщин, так и у мужчин [3]. Деятельность остеокластов, нужно отметить, нельзя назвать исключительно катаболической. По принципу «мы разрушили, а отстраивать кто теперь будет?» громилы в процессе разрушения кости выделяют молекулярные сигналы, которые привлекают к местам резорбции остеобласты [3].
Кальцитонин
Если есть сигнал на разрушение кости в виде паратиреоидного гормона, то по принципу единства и борьбы противоположностей должен существовать и его антагонист. И действительно: функциональным антагонистом ПТГ является кальцитонин. Кальцитонин стимулирует остеобласты к выработке остеопротегерина, который блокирует их же сигнал RANKL (делает молекулу неактивной). Помимо этого, к кальцитонину есть рецепторы у самих остеокластов. Этот гормон «выключает» рабочую активность костных дробителей: они подбирают свои «юбки» и уходят на обеденный перерыв. Кстати, и RANKL, и остеопротегерин обнаруживаются в крови в свободной форме, их концентрация измеряется в диагностических целях для мониторинга заболеваний костей [6].
Синтез остеопротегерина, который блокирует сигнал RANKL, стимулируют также эстрогены. По этой причине у женщин в постменопаузе, когда резко снижается уровень женских половых гормонов, остеокласты могут излишне активироваться, что часто приводит к остеопорозу [6].
Другие сигналы
Помимо паратиреоидного гормона и кальцитонина, организм регулирует состояние костной ткани с помощью соматотропина (гормон роста), инсулиноподобного фактора роста, гормонов щитовидной железы, пролактина, а также эстрогенов и андрогенов, которые способствуют увеличению костной массы во время полового созревания и помогают поддерживать гомеостаз костной ткани в дальнейшем. Как уже упоминалось, дефицит витамина С вызывает нарушение формирования и роста костей из-за сбоя синтеза коллагена и гликозаминогликанов. А при недостатке витамина Д затрудняется кальцификация органического каркаса кости, что приводит к размягчению костей (остеомаляция). В итоге состояние костей ткани здорового человека зависит от множества факторов: нормальной коммуникации между организмом и костными клетками, питания, состояния желудочно-кишечной и выделительной систем, от возраста, пола и т.д. [7], [8].
Сбой в коммуникации, или когда бетонируют там, где не надо
В норме процесс образования костного матрикса и его минерализация происходят исключительно в костной ткани. Но бывает, что-то идет не так, и «окостенение» происходит в других местах. Коллаген первого типа, как уже упоминалось, самый распространенный в организме. Он синтезируется клетками в мягких тканях, в коже, роговице глаза, в склере, в стенке артерий, из него состоят связки и сухожилия. Патологическое накопление гидроксиапатита на коллагене 1 типа в мягких тканях называется кальцификацией. В результате кальцификации ткань теряет эластичность, становится более хрупкой и утрачивает свои функции. Кальцификации при определенных условиях подвержены сухожилия и связки суставов, ткани поджелудочной железы, молочных желез и т.д.
Одним из самых известных и распространенных видов кальцификации является атеросклероз и медиасклероз. Сосуды (кроме капилляров) состоят обычно из нескольких слоев разных по назначению клеток, а также из строительных белков эластина и коллагена, которые выступают прокладками между слоями и создают плотный «кожух» вокруг сосудистой трубки. При атеросклерозе минерализованная бляшка образуется в просвете сосуда, а при медиасклерозе происходит кальцификация его внутренних коллагеновых оболочек [9].
Раньше кальцификацию сосудов при медиасклерозе считали пассивным процессом — спонтанным осаждением гидроксиапатитов при нарушениях обмена веществ и старении. Но позже выяснилось, что это активный процесс, и запускается он, когда мезенхимные стволовые клетки в сосудах вместо того, чтобы пополнять ряды работников, характерных для этого органа, начинают дифференцироваться в клетки костного ряда. Иными словами, становятся костными строителями, которым в сосудах не место.
Во вступлении на путь остеогенной дифференцировки были замечены не только стволовые, но и гладкомышечные клетки сосудов [9]. Костные клетки, которые оказываются там, где не надо, способны натворить дел. При кальцификации внутренней оболочки сосуда не просто накапливаются минеральные вещества, а происходит настоящее окостенение: и по структуре, и по биохимическому составу образовавшаяся минеральная пластинка напоминает кость и даже может содержать костный мозг [9]. Конкретные причины, запускающие такой поворот событий, пока досконально неизвестны. Но их последствия проявляются в сбое сигнальных путей, ведь стволовая мезенхимная прародительница в норме «решает» стать той или иной клеткой не просто так, а в зависимости от сигналов, которые она получает от окружения. Регуляторные изменения, чрезмерная активность одних сигнальных путей и подавление других могут приводить к минерализации там, где не нужно. И в этом свете интересно, что риск развития атеросклероза и медиасклероза возрастает при системных заболеваниях, связанных с нарушением обмена веществ. Это:
- диабет второго типа,
- хроническая почечная недостаточность (заболевание, при котором нарушается функция почек и выведение метаболитов),
- дислипидемия (характеризуется повышенным содержанием липопротеина низкой плотности, холестерина).
Рост содержания глюкозы в крови при диабете, повышение концентраций фосфатов при хронической почечной недостаточности, холестерина при дислипидемии или метаболических нарушениях, приводят к разбалансировке углеводного, жирового и минерального обменов и повышают риск сосудистой кальцификации. Также этому может способствовать оксидативный стресс, связанный с повреждающим воздействием свободных радикалов и активных форм кислорода, воспаление, избыток витамина Д и биохимические изменения при старении [9].
С коммуникацией немного разобрались, но как во всем этом биохимическом «общении» может принимать участие физическая нагрузка?
Механический стресс и вопросы жилплощади
Данные обследований космонавтов после полетов (длительность 5–7 мес. и 10–14 мес.), добровольцев в условиях длительного постельного режима (30–370 сут.), а также данные экспериментов с животными и клеточными культурами костной ткани, экспонированными в космосе, убедительно показали — в отсутствие механических воздействий на скелет происходит потеря костной массы. Особенно от этого страдают кости, которые в нормальных условиях у человека и животных подвергаются большим весовым нагрузкам. У человека это нижние позвонки поясничного сегмента позвоночника, большеберцовая кость [10].
В то же время спортсмены единоборств, силовых и игровых видов спорта отличаются более высоким уровнем минеральной плотности кости даже по сравнению с представителями велоспорта, плавания, гребли, триатлона и бега на длинные дистанции [11].
Каким же образом кости «ощущают» нагрузку или её отсутствие?
Кость, несмотря на твердость, которую ей придает минерализация, обладает определенной упругостью и даже гибкостью — ее обеспечивает органический матрикс. Нагрузки вызывают деформации кости, которые мы с вами не замечаем, но вот для клеток, вследствие их микроскопических размеров, это довольно существенные изменения. Сжатия-скручивания окружающего матрикса, к которому дежурные остеоциты прикреплены с помощью адгезивных белков, изменяют натяжение самих белков и передают через них механические импульсы на микротрубочки цитоскелета клетки. Помимо этого, механический стресс костной ткани деформирует оболочки клеток, меняя конфигурации и активность встроенных в мембрану ионных каналов. Всё это запускает каскады биохимических реакций, которые приводят к синтезу ряда веществ, анаболически влияющих на костную ткань [6].
Кроме того, вязкая тканевая жидкость, которая заполняет лакуны и канальцы, при механических деформациях кости приходит в движение. Такой ток жидкости называется напряжением сдвига. Вмурованные в костную ткань остеоциты воспринимают деформации не только через изменение натяжения собственных структур, также они улавливают ток жидкости вокруг себя с помощью древнейшей органеллы эукариотических клеток — первичной реснички. Эта своеобразная чувствительная «антенна» реагирует на собственный изгиб запуском определенных внутренних реакций в клетке [6].
Так, с помощью реснички и деформаций клеточных структур механические сигналы преобразуются в остеоцитах в биохимические. Стимулируются процессы синтеза оксида азота, АТФ и белков, которые предотвращают апоптоз (программируемую гибель) костных клеток. Также усиливается выделение простагландина, который анаболически влияет на костную ткань [6], [12].
Получается такая картина: остеоциты вместе с остеобластами, остеокластами и матриксом кости образуют целостную информационную сеть. Основная функция этой сети — реагирование на механические импульсы. Затворникам-остеоцитам тут принадлежит сенсорная роль: они принимают механические сигналы от внешней среды, «переводят» их на общий язык биохимии и передают уже понятную информацию другим клеткам (рис. 12).
Вот они, ябеды.
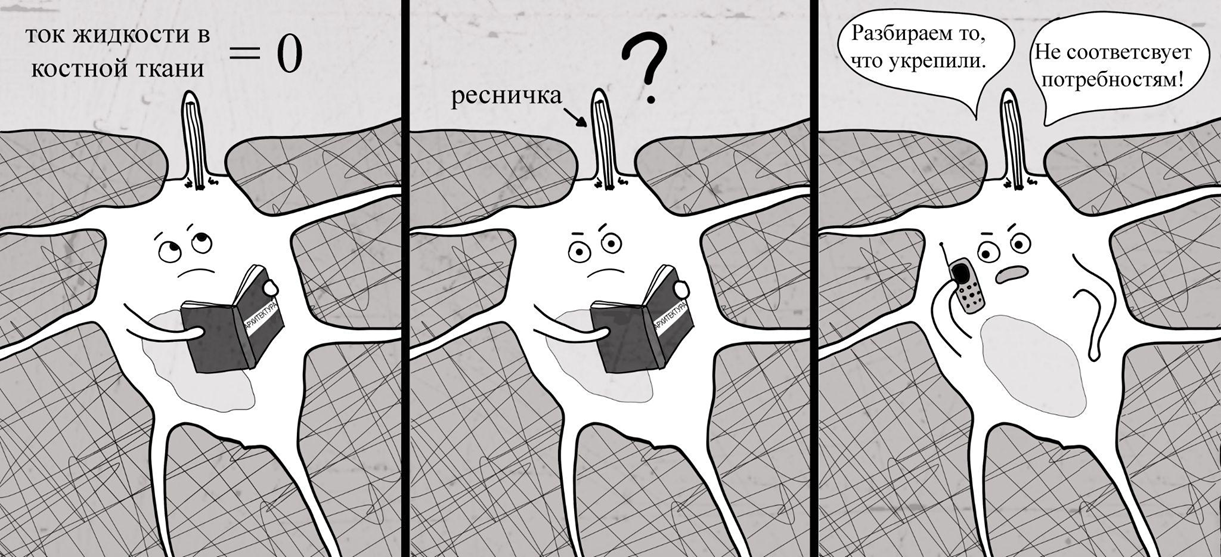
Рисунок 12. Остеоцит сообщает другим клеткам, что кто-то пропустил тренировки.
иллюстрация автора
Но остеоциты не только трезвонят собратьям о делах механических, сами остеоциты также изменяют свое поведение в ответ на нагрузку или ее отсутствие. При механических стрессах они активнее синтезируют стройматериалы и укрепляют стенки своих лакун (что логично, ведь никому не хочется, чтобы в квартире потолок обвалился). А вот в отсутствие механических деформаций остеоциты стремятся расширить собственную жилплощадь. Повышенный комфорт, похоже, любят все живые существа без исключения. Только вот хозяину скелета это может оказаться не по нраву, потому что хоромы блаженствующих остеоцитов делают кости излишне «дырявыми» и хрупкими [6].
Ну а самой наглядным примером деградации костной ткани без механических стрессов является резорбция кости челюсти. При потере зуба кость в этом месте перестает получать необходимые нагрузки и просто... тает, как леденец. А зачем содержать то, что не используется, и тратить на это ресурсы? Так что, если вам удалили постоянный зуб, то не стоит затягивать с протезированием. Потом это будет сделать гораздо сложнее, а «тающая» кость может потянуть за собой десну, оголяя шейки ближайших зубов. К потере костной массы челюсти также может привести отсутствие в рационе жесткой пищи или неправильный прикус, который влечет за собой неравномерное распределение нагрузки.
Из полезного: ортодонты виртуозно используют свойство ремоделирования кости в ответ на механический стресс в техниках исправления прикуса различными видами брекетов. Так что, если бы кость была бы постоянной, а не ремоделируемой конструкцией, и не откликалась на нагрузки, прикус исправить не представлялось бы возможным.
Еще один строитель, про которого забыли
Костная ткань — немыслимо сложная, многокомпонентная и слаженно функционирующая подсистема организма, которая чутко реагирует на внешние и внутренние изменения, непрерывно перестраиваясь под их запросы. Помимо опорной и защитной функций, кость — это важнейший стратегический запас кальция и относительно безопасное хранилище для некоторых вредных организму веществ. А обусловливает качество костей множество факторов: генетика, питание, гормональный фон, пол, возраст, экология, физическая активность, стрессы. Всё это как прямо, так и косвенно влияет и на бравые остеобласты, и на затворников остеоцитов. И на микроскопических громил в юбках, которые способны переваривать костные конструкции.
Выходит, что создают скелет не только клетки, но косвенно и мы сами — своим образом жизни. И наш вклад в непрекращающееся строительство этого уникального «Тадж-Махала» может оказаться как положительным, так и отрицательным. Умеренные физические нагрузки, сбалансированное питание и достаточное время на восстановление — это вполне доступные методы управления своими внутренними строительными работами. А обвести вокруг пальца микроскопических строителей вряд ли удастся: они все равно узнают, что вы пропустили тренировку. И всем об этом расскажут.
Литература
- Соловьев В.А., Шинкаренко Т.В. (2011). Происхождение, дифференцировка и морфофункциональная характеристика клеток костной ткани. Верхневолжский медицинский журнал. 9, 49–54;
- Деев Р. В., Цупкина Г. Н. В., Пинаев Г.Л. (2006). Направленный рост и миграция стромальных клеток костного мозга в культуре in vitro. Гены и клетки. 4, 52–54;
- Потекаев Н. Н., Борзых О. Б., Шнайдер Н. А., Петрова М. М., Карпова Е. И. (2022). Синтез коллагена в коже: генетические и эпигенетические аспекты. Бюллетень сибирской медицины. 21, 217–226;
- Алексеева Л.И. (2007). Хондроитин сульфат в лечении остеоартроза. РМЖ. 8, 642;
- Потекаев Н. Н., Борзых О. Б., Шнайдер Н. А., Петрова М. М., Карпова Е. И. (2022). Строение и функции костной ткани в норме и при патологии. Бюллетень сибирской медицины. 18, 9–25;
- Lynda F Bonewald. (2011). The amazing osteocyte. Journal of Bone and Mineral Research. 26, 229-238;
- Павлов С.Б. (2013). Участие паратиреоидного гормона и кальцитонина в регуляции метаболизма костной ткани при моделировании его нарушений. Вестник проблем биологии и медицины. 2;
- Alexandr M. Miromanov, Kirill A. Gusev. (2021). Osteogenesis Hormonal Regulation: Review. Traumatology and Orthopedics of Russia. 27, 120-130;
- D. A. Kostina, V. E. Uspensky, D. S. Semenova, A. S. Kostina, N. V. Boyarskaya, et. al.. (2020). Role of calcification in aortic degeneration. Transl. med. (Print). 7, 6-21;
- V S OGANOV, A V BAKULIN, V E NOVIKOV, L M MURAShKO, O E KABITsKAYa. (2005). IZMENENIYa KOSTNOY TKANI ChELOVEKAV KOSMIChESKOM POLETE: O VOZMOZhNYKh MEKhANIZMAKh OSTEOPENII. Osteopor Bone Dis. 8, 2-7;
- K. I. Nikitina, I. T. Vykhodets, T. F. Abramova, T. M. Nikitina. (2024). Influence of professional sports activities on bone mineral density (<i>literature review</i>). Rossijskij osteopaticheskij zhurnal. 106-117;
- Липинский П. В., Скороглядов А. В., Ивков А. В., Сиротин И. В., Мотылев Е. Н. (2012). Влияние простагландина е 1 на процессы формирования костной мозоли при моделировании перелома длинных костей конечностей. Вестник Российского государственного медицинского университета..