Ты не пройдешь: в поисках идеальной системы для доклинического тестирования противоопухолевых препаратов
11 марта 2021
Ты не пройдешь: в поисках идеальной системы для доклинического тестирования противоопухолевых препаратов
- 1707
- 0
- 2
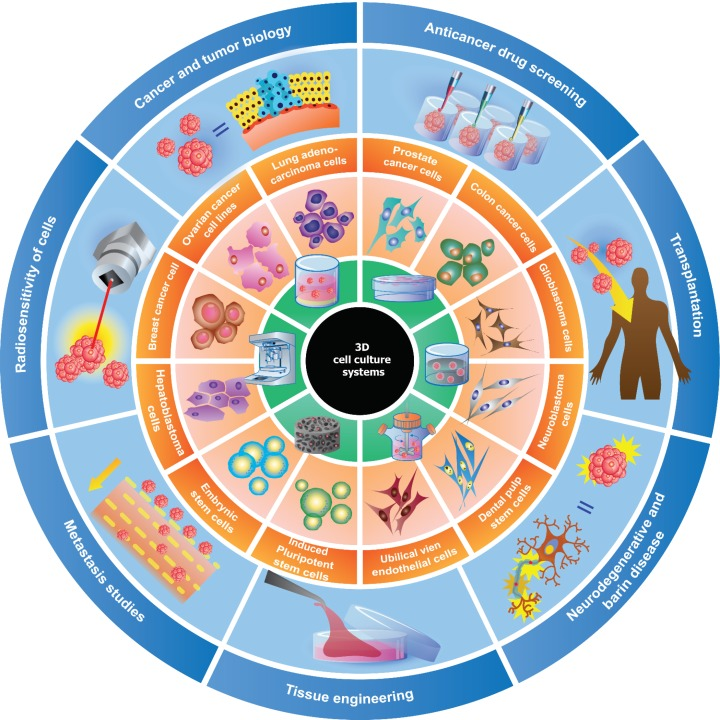
Возможности применения трехмерных клеточных систем.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: За окном XXI век. Человечеству удалось победить многие болезни и изобрести такое количество препаратов, которое невозможно было вообразить еще 100 лет назад. Наука и медицина шагают вперед и порой достигают невероятных успехов; человек позволил себе мечтать об исцелении от всех болезней и даже о бессмертной жизни. Но давайте взглянем правде в глаза. На сегодняшний день рак является второй по количеству причиной смертности среди взрослого населения — после сердечно-сосудистых заболеваний. Именно рак занимает умы ученых и врачей по всему миру, а также одно из центральных мест в генетике вот уже несколько десятков лет. Может возникнуть вопрос: почему при всей мощи науки, техники, безграничных возможностей человеческого мозга и бесконечных экспериментов в этой области «волшебная пилюля» от рака до сих пор не найдена? Попытка ответить на этот вопрос может привести ко множеству вариантов ответа, но одно и первых мест среди них займет, безусловно, отсутствие универсальных тест-систем, на которых препарат доказал (или же опроверг) бы свою эффективность. Об этом пойдет речь в нашей статье.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
От пробирки до организма
Ежегодно в лабораториях по всему миру разрабатываются тысячи противоопухолевых препаратов различных механизмов действия. Давайте отправимся в небольшое путешествие вместе с новоизобретенным препаратом, которое он совершает от лабораторного ламинара, где был разработан, до попадания в кровь первого пациента, где сможет выполнить свое предназначение.
Все начинается с доклинических исследований. Это, вероятно, одна из самых важных стадий тестирования. На этой стадии среди множества противоопухолевых препаратов выбирают лишь несколько наиболее эффективных, которые продолжат дальнейшие испытания. Как правило, первую фазу доклинических исследований проводят на культурах опухолевых клеток человека. От того, насколько действенным препарат покажет себя на этой, самой первой стадии, зависит дальнейшая его возможность прохождения испытаний на животных (как правило, мышах и далее — кроликах). И только потом, при успешном прохождении этой стадии, активные препараты допускаются до трех фаз клинических испытаний .
Подробнее о том, что такое клинические испытания, как их проводят и с какими трудностями сталкиваются, подробно рассказано в спецпроекте «Биомолекулы» «Клинические исследования».
Кажется, гуманность и рациональность использования в качестве теста для нового препарата опухолевых клеток человека ни у кого не вызывает сомнений. Но часто именно на этой стадии у предполагаемо успешного препарата возникают проблемы.
Давайте зададим себе вопрос: каким свойствам должна соответствовать модель, на которой мы хотим протестировать лекарство? Очевидно, она должна быть, во-первых, доступной и простой в использовании; во-вторых, максимально приближенной по своим свойствам к раковой опухоли человека. Ведь использование рациональной тест-системы поможет избежать огромного количества денежных (и временных) расходов на проверку и перепроверку препарата. Клеточные культуры, на первый взгляд, отвечают этим требованиям. Однако по многим признакам они все же отличаются от настоящей раковой опухоли, находящейся в организме. Чем же?
Идеальная тест-система — какая она?
Для того, чтобы ответить на этот вопрос, давайте проведем небольшой экскурс прямо внутрь раковой опухоли (более подробно эта тема освещена в статье «Биомолекулы» «Опухолевые разговоры» [1]. Раковая опухоль — это не просто сгусток раковых клеток. Это целая комплексная система, состоящая из множества элементов: различных типов клеток (иммуноциты, опухоль-ассоциированные фибробласты, адипоциты, мезенхимальные стромальные клетки), внеклеточных молекул (молекулы адгезии; хемокины — цитокины, участвующие в усилении миграции опухолевых клеток в отдаленные ткани; другие медиаторы, гормоны, ферменты и метаболиты, являющиеся регуляторами воспаления), а также межклеточного вещества [2], [3]. Не стоит недооценивать его роль в развитии опухоли: иногда, просто изменив свое положение в пространстве, клетка может приобрести новый фенотип, стать более или менее устойчивой к факторам среды. В этой системе ни один элемент не находится изолированно. Клетки «общаются» между собой, передавая сигнальные молекулы, и посредством такого «общения» влияют друг на друга. Более того, межклеточное вещество может так же сильно влиять на клетки, как и они на него. Каждый фактор играет свою особую роль: и плотность клеток, и их расположение в пространстве, и множество молекул, которыми они обмениваются, и состав межклеточного матрикса. В таком раковом «клеточном сообществе» все клетки, — не только раковые, — приобретают аномальный фенотип (то есть ведут себя не так, как должны вести себя клетки данной линии в здоровом организме) [4]. Даже те, которые, казалось бы, должны защищать наш организм от напасти, могут «перейти на сторону зла» и содействовать распространению опухоли. Да, иммунные клетки, находясь в опухолевой среде, с помощью выделяемых ими сигнальных молекул коварно поддерживают рост опухоли, участвуют во внедрении опухолевых клеток в здоровые ткани, появлении лекарственной устойчивости [5]. В качестве примера межклеточного влияния можно привести метастазирование. Раковые клетки выделяют особые сигнальные молекулы, которые распространяются в организме и готовят ниши для метастазов. Метастазы — основная причина смертей среди больных онкологией. Но не только раковые клетки влияют на микросреду; сама микросреда заставляет раковые клетки приобретать новые свойства, накапливать мутации. Часто лечение становится неэффективным потому, что терапия нацелена на определенный тип клеток и не рассчитана на мутантные раковые клетки, появляющиеся в ходе развития заболевания.
Помимо общеизвестных радио- и химиотерапии (уничтожающих не только раковые клетки, но и здоровые), а также хирургического удаления (очевидным недостатком которого является невозможность удалить все элементы опухоли хирургическим путем), существуют относительно новые и перспективные методы в противоопухолевой терапии, например, генная терапия и иммунотерапия, развившаяся на базе генной [6], [7]. Сейчас одним из самых эффективных подходов доставки противоопухолевых веществ, используемых как при химиотерапии, так и при иммунотерапии, является таргетированная (целенаправленная) доставка противоопухолевых веществ к раковым клеткам. Преимуществом такого вида терапии является то, что она не должна нанести вред здоровым клеткам организма [8].
Каждый метод имеет свои особенности в применении к каждому типу опухоли, которых существует более 100 — как доброкачественных, так и злокачественных [9]. Злокачественные опухоли, разумеются, имеют ряд общих признаков. Например, для них характерно метастазирование [10]. Но при этом существует ряд особенностей, характерных для каждого конкретного типа опухоли. И каждый тип опухоли формирует свою собственную микросреду, более устойчивую к одним, но менее устойчивую к другим видам терапии. «Чудодейственное» средство не разработано, как и пару десятков лет назад. Человечество находится в поиске как препарата, так и идеальной тест-системы для выявления этого препарата среди других, не таких эффективных.
Как же сегодня проходит испытание новоиспечённого препарата? Сначала опухолевые клетки человека культивируются (выращиваются) in vitro. Затем к полученной культуре добавляется противоопухолевый препарат. Клетки инкубируют, то есть дают им время провзаимодействовать с препаратом, и далее определяют, в какой степени он обладает противоопухолевым действием (и обладает ли) с помощью известных биологических методов, которые определяют жизнеспособность клеток (например, МТС-теста или МТТ-теста).
Вещества, противоопухолевая активность которых оказалась высокой, переходят к следующему этапу доклинических исследований. В противоположном случае, как правило, отказываются от дальнейшего скрининга препарата ввиду его неэффективности. Кто знает, может быть, человечество «побросало лопаты» и отказалось от верного пути тогда, когда до желаемого «клада» оставалось совсем немного. Могло ли это произойти?
Сначала Земля была плоской...
Двумерные монокультуры
Вернемся на три десятилетия назад. В 1990 году Национальный Институт Рака принимает современный протокол медицинского скрининга [12]. Описанный в нем метод и по сей день является наиболее часто используемым. Он подразумевает тестирование препарата на панели из 60 клеточных линий человека опухолевого происхождения (типы опухолей действительно очень разнообразны по своему происхождению и многим другим признакам). Воспользуемся термином «монокультура» — клеточная культура, состоящая только из одного типа клеток. Итак, наиболее часто в качестве доклинического скрининга используются монокультуры на плоской поверхности. Насколько это рационально?
Несмотря на то, что данному протоколу в этом году исполнилось 30 лет, а за прошедшие десятилетия ученые разработали более совершенные тест-системы, панель опухолевых клеточных линий имеет свои преимущества. Каждая из 60 линий формирует свой специфический ответ на исследуемое вещество, который сравнивается с уже имеющейся базой данных и подлежит дальнейшему изучению, чтобы потом сделать предположение о механизме действия того или иного препарата [13]. Если же биологический эффект от тестируемого препарата отличается от всех ранее занесенных в базу данных, можно предположить, что препарат имеет принципиально иной механизм действия. Панель опухолевых клеточных линий помогает определить, есть ли у того или иного препарата или химического соединения противоопухолевая активность по отношению к разным группам онкологических заболеваний [14]. Только представьте, каждый год подобным образом тестируются свыше 2500 препаратов! И только 2% из них достигают такого уровня эффективности, при котором их допускают к следующему уровню испытаний, — на животных.
Но даже эти препараты часто показывают низкую эффективность in vivo, потому что в организме происходит взаимодействие препарата не только с раковыми клетками, но и с компонентами опухолевого микроокружения – и это в трехмерной пространственной структуре, что не учитывается в модели плоских монокультур [15–17]. Достоверность результатов доклинического скрининга препарата можно было бы сделать выше, используя несколько типов клеток и/или конструируя опухоль в пробирке так, чтобы она имела трехмерную структуру.
Псевдодвумерные системы
Следующим шагом на пути к усовершенствованию клеточных тест-систем стало добавление аналога внутриклеточного матрикса. Интересное поведение демонстрировали клетки нейробластомы, которые культивировались совместно с мезенхимными стромальными клетками на тонком слое матрикса (рис. 2). В данных условиях клетки самостоятельно организовывались в системы, напоминавшие блюдечки: по центру «блюдца» располагались мезенхимные стромальные клетки, а по краям – опухолевые [18]. О чем это говорит? Такие системы могут быть очень похожи на те, что появляются в организме во время метастазирования [19]. Чтобы продемонстрировать роль влияния клеток друг на друга, достаточно «разлучить» их. Те же самые опухолевые клетки на том же самом матриксе растут в разы медленнее, чем «в компании» с мезенхимальными стромальными клетками. Это далеко не единственная работа, показывающая, что:
- одна голова хорошо, а две лучше: две клеточные линии (опухолевая и стволовая) проявляют большую жизнеспособность в состоянии стресса, находясь в ко-культуре;
- жизнеспособность опухолевых клеток в трехмерной структуре значительно выше, чем в двумерной [20], [21]. Можно предположить, что сходным поведением обладают клетки настоящей раковой опухоли.
Несмотря на то, что данная модель шагнула дальше протокола 1990 года, у нее по-прежнему есть недостатки, например, небольшое количество клеточных линий. Всего две, в то время как раковая опухоль in vivo отличается куда большим разнообразием.
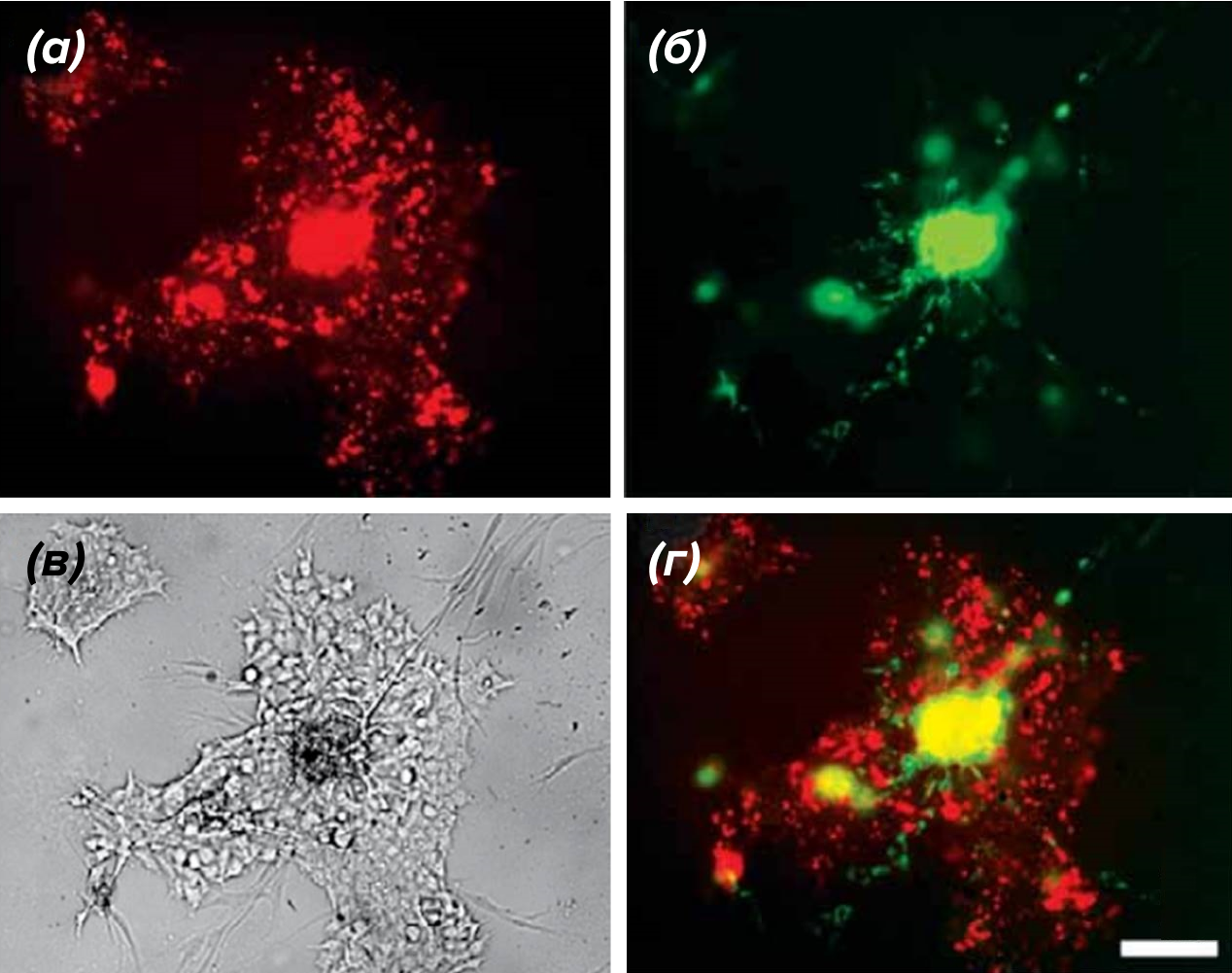
Рисунок 2. Конгломерат, формирующийся при совместном культивировании мезенхимных стромальных клеток (МСК) и клеток нейробластомы SH-SY5Y на аналоге внеклеточного матрикса (Матригеле).
(а) — SH-SY5Y, меченные красной флуоресцентной меткой;
(б) — МСК, меченные зеленой флуоресцентной меткой;
(в) — культура при фазово-контрастной световой микроскопии;
(г) — совмещение изображений панелей А и B.
Масштабный отрезок — 100 мкм.
Мир 3D
Трехмерные модели
Последним «писком моды» являются трехмерные модели опухоли. По своим свойствам они напоминают действительные раковые опухоли, причем не только ученым, но, что самое главное, противоопухолевым препаратам. При их введении в подобную модель, препараты сталкиваются с теми же трудностями и барьерами, с которыми столкнулись бы в организме [17].
Существует несколько основных моделей многоклеточных структур.
Одна из них — многоклеточные сфероиды. Их архитектура интересна сама по себе. Во-первых, клетки не «распластываются» по плоской поверхности, как в двумерных структурах [22]. «Растекшаяся» форма вообще не характерна для раковых клеток; хотя бы по этому признаку данная модель уже находится в выигрыше по сравнению с панелью. По своей конструкции сфероид напоминает планету с ядром, мантией и земной корой. В самом центре таких сфероидов расположены мертвые клетки; их покрывают живые, но покоящиеся клетки. На поверхности расположены активно делящиеся клетки [23]. Вообразим себе опухоль в условиях организма: питательным веществам и кислороду трудно попасть вглубь тканей, а продуктам метаболизма — выйти наружу; вполне естественно, что клетки внутри опухоли зачастую гибнут. По этому свойству модель сфероида также напоминает опухоль in vivo. Кстати, внеклеточный матрикс, контакты между клетками и с матриксом вполне схожи с настоящей опухолью [24]. Клетки в сфероиде расходуют энергию и питательные вещества более экономно, чем в монослое, что увеличивает их выживаемость. Межклеточное «общение» тут происходит более интенсивно. Чем не идеальная тест-система? Тем более что и на противоопухолевые препараты она действительно реагирует отлично от монокультуры, проявляя большую устойчивость [25], [26].
Но у этой модели есть свои недостатки: она не полностью соответствует ткани in vivo. Например, в сфероиде не наблюдается разрастания кровеносных сосудов, что так характерно для «организменной» раковой опухоли, стремящейся себя прокормить и потому увеличивающей приток крови [24]. Нет также и иммунного ответа.
Одним из относительно недавно заявленных способов стало, наконец, создание трехмерной структуры с использованием матрикса, имитирующего межклеточную архитектуру [27]. Ведь внеклеточный матрикс является очень важным компонентом окружения всех клеток, не только раковых: помимо структурной поддержки, в зависимости от его состава, матрикс может выполнять и другие важные функции, например, регулировать межклеточные взаимодействия [14], [28]. Данную модель уже можно считать многокомпонентной тест-системой, поскольку она содержит различные клеточные линии (и опухолевые, и иммунные, и стромальные клетки, которые ко-культивируют совместно). В ходе эксперимента можно регулировать как состав, так и плотность матричной системы. Получается, что данная система является более универсальной, так как для каждого конкретного типа клеток можно подобрать свои параметры и максимально имитировать естественную для клеток среду. На основе компонентов природного внеклеточного матрикса были созданы гидрогели, которые довольно точно воссоздают микроокружение клеток [29]. Но нужно понимать, что природный матрикс — очень сложная и многокомпонентная среда, с которой иногда возникают трудности при использовании в системах in vitro [28]. Некоторые компоненты природного матрикса вовсе не являются стандартными для использования в различных искусственно созданных системах. Потому их воздействие трудно предугадать и изучить, а сам гидрогель — назвать универсальным. Вслед за гидрогелем появились синтетические матриксы, заменившие его в трехмерных моделях in vitro [30], [31]. Привлекательность синтетических матриксов заключается в том, что они являются химически чистыми, т.е. не содержат неохарактеризованных веществ. Значит, результаты, полученные в искусственной системе с использованием данного матрикса in vitro, достаточно просто соотнести с результатами, полученными in vivo. Недостатком же использования синтетических матриксов является отсутствие именно тех сигнальных молекул, которые секретируются конкретной системой in vivo.
Культуры, состоящие из нескольких клеточных линий и выращенные с помощью матрикса, на данный момент являются наиболее «продвинутыми»: они сохраняют преимущества «чистых» культур, но при скрининге препарата учитывают важнейший компонент раковой опухоли — взаимодействие клеток между собой и с внеклеточным матриксом [33].
Что касается экспериментов, проведенных с известными противоопухолевыми препаратами и данными тест-системами, то их результаты действительно отличаются от экспериментов, проведенных с монокультурами и теми же препаратами.
Например, противоопухолевый препарат цисплатин меньше действует на клетки многокомпонентной культуры, чем на клетки монокультуры (рис. 3) [34]. То есть в ко-культуре (как, вероятно, и в опухоли человека) клетки оказываются более жизнеспособными и устойчивыми к препарату. Результат можно объяснить тем, что стромальные клетки играют вспомогательную роль в опухолеобразовании, вызывая рост сосудов, питающих опухоль, и секретируя вещества, поддерживающие рост и химиорезистентность опухоли. «Помогают» опухоли и иммунные клетки, вырабатывая вещества, способствующие инвазии и метастазированию опухолевых клеток [35].
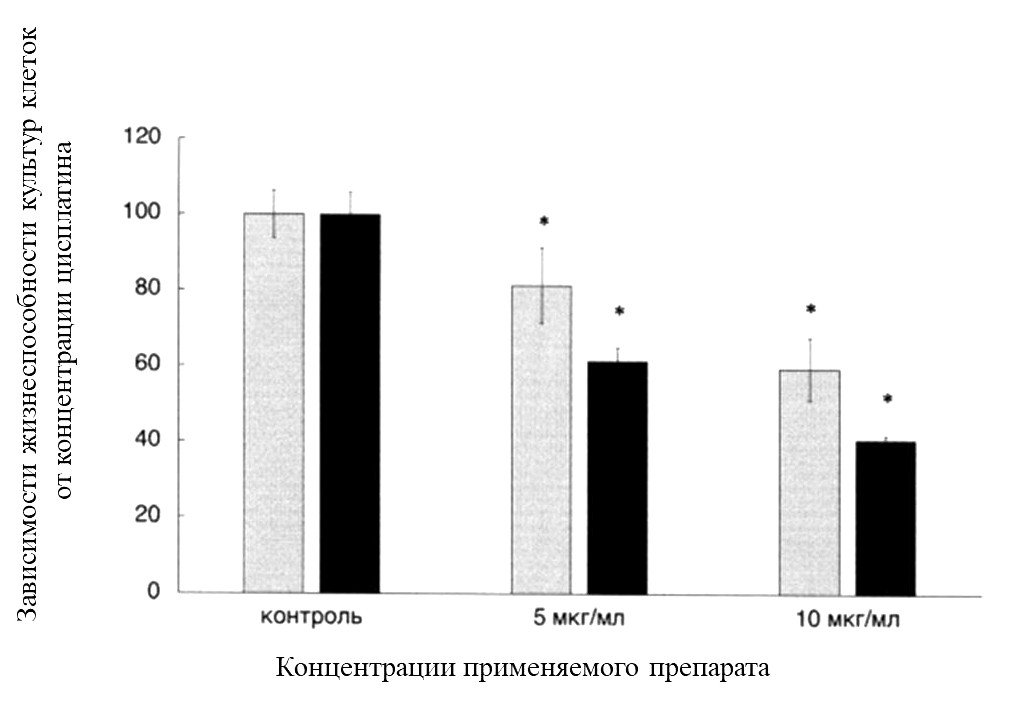
Рисунок 3. График зависимости жизнеспособности клеток ко-культуры от концентрации противоопухолевого препарата цисплатина.
Серые столбцы — жизнеспособность клеток ко-культуры в процентном соотношении по сравнению с контрольными клетками, не обработанными цисплатином.
Черные столбцы — данные зависимости жизнеспособности монокультуры опухолевых клеток от концентрации цисплатина, приведены в качестве сравнения. Данные получены с помощью MTS-теста.
Исследование было проведено и с другими противоопухолевыми препаратами, например, доксорубицином (рис. 4) [34]. Данный препарат, наоборот, стимулировал иммунные реакции, направленные на уничтожение опухолевых клеток. То есть клетки опухоли подвергались «атаке» не только со стороны самого препарата, но и со стороны иммунных клеток, что, конечно же, отразилось на их выживаемости.

Рисунок 4. График зависимости жизнеспособности клеток ко-культуры от концентрации противоопухолевого препарата доксорубицина.
Серые столбцы — жизнеспособность клеток ко-культуры в процентном соотношении по сравнению с контрольными клетками, не обработанными доксорубицином.
Черные столбцы — данные зависимости жизнеспособности монокультуры опухолевых клеток от концентрации доксорубицина, приведены в качестве сравнения. Данные получены с помощью MTS-теста.
Из результатов различных опытов и экспериментов можно сделать вывод о том, что трехмерные многокомпонентные тест-системы позволяют нам оценить влияние препарата наиболее полно: влияние и на раковые клетки, и на другие типы клеток в культуре, и на межклеточные взаимодействия.
Прежде чем человечество выполнит важнейшую задачу, — научится лечить рак, — ему предстоит совершить длинный путь, одна из самых первых, но очень важных стадий которого — поиск идеальной тест-системы для отбора противоопухолевого препарата в доклинических исследованиях. Мы попробовали проанализировать, как они постепенно менялись и совершенствовались от простых двумерных монокультур до сложных трехмерных структур, включающих в себя несколько типов клеток. И все же ни одна из разработанных на данный момент тест систем не имитирует опухоль in vitro на 100%. Используя для тестирования противоопухолевых препаратов один из способов, мы не имеем полного понимания того, как тот или иной препарат поведет себя в организме. Это значит, что цель пока не достигнута; поиски должны продолжаться.
Литература
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Daniela F Quail, Johanna A Joyce. (2013). Microenvironmental regulation of tumor progression and metastasis. Nat Med. 19, 1423-1437;
- T L Whiteside. (2008). The tumor microenvironment and its role in promoting tumor growth. Oncogene. 27, 5904-5912;
- Maonan Wang, Jingzhou Zhao, Lishen Zhang, Fang Wei, Yu Lian, et. al.. (2017). Role of tumor microenvironment in tumorigenesis. J. Cancer. 8, 761-773;
- Douglas Hanahan, Lisa M. Coussens. (2012). Accessories to the Crime: Functions of Cells Recruited to the Tumor Microenvironment. Cancer Cell. 21, 309-322;
- DEAN W. FELSHER. (2008). Tumor dormancy and oncogene addiction. APMIS. 116, 629-637;
- Prem Seth. (2005). Vector-mediated cancer gene therapy: An overview. Cancer Biology & Therapy. 4, 512-517;
- Verena Russ, Ernst Wagner. (2007). Cell and Tissue Targeting of Nucleic Acids for Cancer Gene Therapy. Pharm Res. 24, 1047-1057;
- E. D. Sverdlov. (2009). Not gene therapy, but genetic surgery—the right strategy to attack cancer. Mol. Genet. Microbiol. Virol.. 24, 93-113;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Иксанова А.Г. Методы исследования цитотоксичности при скрининге лекарственных препаратов. // Учебно-методическое пособие к практическим занятиям по курсу «Методы скрининга физиологически активных веществ» / Иксанова А.Г., Бондарь О.В., Балакин К.В. Казань: Казанский университет, 2016. — 40 с.;
- Robert H. Shoemaker. (2006). The NCI60 human tumour cell line anticancer drug screen. Nat Rev Cancer. 6, 813-823;
- K. D. Paull, R. H. Shoemaker, L. Hodes, A. Monks, D. A. Scudiero, et. al.. (1989). Display and Analysis of Patterns of Differential Activity of Drugs Against Human Tumor Cell Lines: Development of Mean Graph and COMPARE Algorithm. JNCI Journal of the National Cancer Institute. 81, 1088-1092;
- Julian Adams. (2002). Development of the Proteasome Inhibitor PS‐341. The Oncologist. 7, 9-16;
- J I Johnson, S Decker, D Zaharevitz, L V Rubinstein, J M Venditti, et. al.. (2001). Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials. Br J Cancer. 84, 1424-1431;
- J.K. Peterson, P.J. Houghton. (2004). Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. European Journal of Cancer. 40, 837-844;
- Nelita T. Elliott, Fan Yuan. (2011). A Review of Three-Dimensional In Vitro Tissue Models for Drug Discovery and Transport Studies. Journal of Pharmaceutical Sciences. 100, 59-74;
- Albert A. Rizvanov, Mehmet E. Yalvaç, Aygul K. Shafigullina, Ilnur I. Salafutdinov, Nataliya L. Blatt, et. al.. (2010). Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76, 253-259;
- Rosandra N. Kaplan, Rebecca D. Riba, Stergios Zacharoulis, Anna H. Bramley, Loïc Vincent, et. al.. (2005). VEGFR1-positive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature. 438, 820-827;
- Amy Evenson, Peter Mowschenson, Helen Wang, James Connolly, Savvas Mendrinos, et. al.. (2007). Hyalinizing trabecular adenoma—an uncommon thyroid tumor frequently misdiagnosed as papillary or medullary thyroid carcinoma. The American Journal of Surgery. 193, 707-712;
- J Padron. (2000). The multilayered postconfluent cell culture as a model for drug screening. Critical Reviews in Oncology/Hematology. 36, 141-157;
- Chantal Feder-Mengus, Sourabh Ghosh, Anca Reschner, Ivan Martin, Giulio C. Spagnoli. (2008). New dimensions in tumor immunology: what does 3D culture reveal?. Trends in Molecular Medicine. 14, 333-340;
- Ruei-Zhen Lin, Hwan-You Chang. (2008). Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol. J.. 3, 1172-1184;
- Russell P., Jackson P., Kingsley E. Prostate cancer methods and protocols. Randwick Humana Press, 2003. — Р. 71–81.;
- Jong Bin Kim, Robert Stein, Mike J. O'Hare. (2004). Three-dimensional in vitro tissue culture models of breast cancer — a review. Breast Cancer Res Treat. 85, 281-291;
- Yi-Chung Tung, Amy Y. Hsiao, Steven G. Allen, Yu-suke Torisawa, Mitchell Ho, Shuichi Takayama. (2011). High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. Analyst. 136, 473-478;
- Ye Fang, Richard M. Eglen. (2017). Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS DISCOVERY: Advancing the Science of Drug Discovery. 22, 456-472;
- Hannu Järveläinen, Annele Sainio, Markku Koulu, Thomas N. Wight, Risto Penttinen. (2009). Extracellular Matrix Molecules: Potential Targets in Pharmacotherapy. Pharmacol Rev. 61, 198-223;
- Mark W. Tibbitt, Kristi S. Anseth. (2009). Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol. Bioeng.. 103, 655-663;
- Glenn D. Prestwich, Yanchun Liu, Bolan Yu, Xiao Zheng Shu, Anna Scott. (2007). 3-D culture in synthetic extracellular matrices: New tissue models for drug toxicology and cancer drug discovery. Advances in Enzyme Regulation. 47, 196-207;
- Xiao Zheng Shu, Shama Ahmad, Yanchun Liu, Glenn D. Prestwich. (2006). Synthesis and evaluation of injectable, in situ crosslinkable synthetic extracellular matrices for tissue engineering. J. Biomed. Mater. Res.. 79A, 902-912;
- Lisa A. Gurski, Nicholas J. Petrelli, Xinqiao Jia, Mary C. Farach-Carson. (2010). 3D Matrices for Anti-Cancer Drug Testing and Development. Oncology Issues. 25, 20-25;
- Leoni A. Kunz-Schughart, James P. Freyer, Ferdinand Hofstaedter, Reinhard Ebner. (2004). The Use of 3-D Cultures for High-Throughput Screening: The Multicellular Spheroid Model. J Biomol Screen. 9, 273-285;
- Kristina V. Kitaeva, Catrin S. Rutland, Albert A. Rizvanov, Valeriya V. Solovyeva. (2020). Cell Culture Based in vitro Test Systems for Anticancer Drug Screening. Front. Bioeng. Biotechnol.. 8;
- Shang-Hung Chen, Jang-Yang Chang. (2019). New Insights into Mechanisms of Cisplatin Resistance: From Tumor Cell to Microenvironment. IJMS. 20, 4136;
- Nipha Chaicharoenaudomrung, Phongsakorn Kunhorm, Parinya Noisa. (2019). Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. WJSC. 11, 1065-1083;
- Mingaleeva R.N. Soloveva V.V., Blatt N.L., Rizvanov A.A. (2013). Application of cell and tissue cultures for potential anti-cancer/oncology drugs screening in vitro. Cell transplantology. 8, 20–28.