В объятиях Железной Няньки
09 ноября 2023
В объятиях Железной Няньки
- 2562
- 1
- 7
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Если вы еще не знакомы с уважаемым макрофагом, почетным представителем вашего министерства обороны из подразделения врожденного иммунитета, — вам точно стоит с ним познакомиться. На первый взгляд макрофаг вас не впечатлит: в световой микроскоп он выглядит так, будто кто-то плюнул, и это нечто очень медленно шевелится. Но для клеток вашего организма макрофаг — амебообразный гигант с несколькими внушительными желудками-лизосомами, который всем своим видом (и поведением) оправдывает почетное звание большого пожирателя (греч. macrós — большой, phágos — пожиратель). Большой пожиратель — грозный воин, командир, сыщик, неутомимый сборщик утиля и опытный управляющий. Его уважают воины врожденного и приобретенного иммунитета, беспрекословно слушаются мирные граждане-клетки, а у бактерий-захватчиков при виде объятий макрофага трясутся фимбрии и отказывают двигаться жгутики. Но есть у грозного пожирателя одна мало кому известная и довольно милая сторона. Об этом и будет рассказ.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Макрофаги
Макрофаги — первая линия обороны организма. Они способны распознавать патогенов при помощи так называемых образ-распознающих рецепторов (PRR). Такие рецепторы определяют некоторые высококонсервативные структуры большинства микроорганизмов. Например, это молекулы, входящие в обязательный состав клеточной стенки бактерий, или белок бактериального жгутика. Благодаря эволюционно древним рецепторам PRR макрофаги хорошо знают всех старых врагов. А вот новейшие разработки микробов вояки идентифицировать не в состоянии, и по этой причине все найденные антигены они подают на проверку другим специалистам. Это называется презентация антигена, и данное действо — также важнейшая функция макрофагов.
Сразу стоит оговориться, что макрофаги бывают разные, порой они не похожи друг на друга. Резидентные долгоживущие макрофаги — домоседы. Они заселяют различные органы еще во время формирования плода (это клетки Купфера в печени, клетки Лангерганса в эпителии, микроглия мозга и другие). Пожиратели-резиденты обычно занимают положение среди клеток определенного органа, растянув между ними свои многочисленные псевдоподии. Кстати, «подия» по-гречески означает «что-то, похожее на ногу», но лучше бы тут подошло «что-то, похожее на руку», ну да ладно. Резиденты не склонны ползать и следят за порядком, обычно не сходя с места годами. Относительная неподвижность, нужно заметить, не мешает таким макрофагам ловить своими псевдоногами все, что плохо лежит или куда-то не туда бежит, демонстрировать молекулярные остатки (останки?) другим клеткам-специалистам и запускать иммунный ответ.
Помимо долгоживущих резидентных макрофагов, есть моноцитарные макрофаги, или макрофаги крови. Они являются выходцами из эволюционно нового отдела кроветворения — красного костного мозга. Моноцитарные макрофаги живут недолго, но способны к активному амебообразному движению. Они, наоборот, любители путешествовать: в виде моноцита из костного мозга эти клетки заступают на дежурство в кровоток, а затем мигрируют из сосудов в ткани и таким образом расселяются во все уголки своей необъятной родины [1]. Вот они-то нам и нужны.
М2 — сборщик утиля
Моноцитарные макрофаги обладают способностью быстро менять свой «облик и таланты» — помогает в этом открытый хроматин: зоны хромосом, которые свободны от нуклеосом и потому находятся в постоянной «боеготовности». Открытый хроматин позволяет макрофагу проворно переключать гены в ответ на различные молекулярные сигналы, которые улавливаются клеткой, тем самым подстраивая свой фенотип (физическое проявление генотипа) под требования обстановки.
Например, если в организме все спокойно (нет воспалений, травм, следов жизнедеятельности захватчиков), макрофаг принимает облик М2 (рис. 1). Такой тип пожирателей хаотично бродит в тканях, обвешавшись рецепторами-мусорщиками (scavenger receptor). Этими чудными молекулярными устройствами сборщик отходов распознает свернувшиеся белки, окисленные жиры и даже негодные клетки или остатки апоптоза [1].
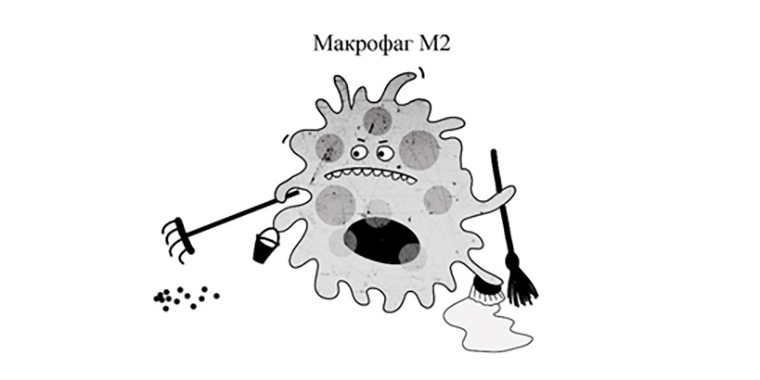
Рисунок 1. Макрофаг М2.
рисунок автора
Все обнаруженное добро прилежно съедается (по-научному — фагоцитируется) и попадает в многочисленные желудки-лизосомы, где утиль расщепляется специально подготовленными ферментами. Получившиеся молекулярные запчасти потом используются повторно — самим макрофагом или окружающими клетками. Можно сказать, что М2 — непритязательные биомашины по вторичной переработке мусора. И если бы не они, клетки попросту утонули бы в отходах, потому как вывоз определенных категорий мусора из тканей, как вы понимаете, дело весьма затруднительное. А если вы порежете палец, устроив чрезвычайную ситуацию, они будут в числе клеток, которые поспешат к месту происшествия и займутся не только очисткой раны для возможности осуществления ремонтно-строительных работ, но также будут непосредственно руководить процессом воспаления, репарации и даже ангиогенеза (образования новых сосудов), выделяя различные информационные молекулы — цитокины [1].
М1 — воин-защитник
Если в организме объявлено военное положение или наш макрофаг улавливает след знакомого нарушителя, то он меняет фенотип с М2 на М1 — на эпигенетическом уровне трансформируется из мирного уборщика в опасного убийцу (рис. 2).
В отличие от типа М2, который обычно бродит беспорядочно, мирно побрякивая рецепторами-мусорщиками, М1 всегда идет целенаправленно по следу, вытягивая свои псевдоподии, захватывает и пожирает патогенов. Макрофаг-вояка имеет дело с коварными существами — это вам не мусор глотать. Не все враги согласятся просто так взять и перевариться: они могут в пожирателе даже поселиться — тепло, светло, мухи не кусают. Потому М2 сокращает количество «желудков», и вместо них образует везикулы (пузырьки) с различными химическими веществами, превращаясь из машины по переработке отходов в полевую военную лабораторию. Боевой макрофаг, прежде чем кого-то переварить, устраивает внутри себя респираторный взрыв, резко повысив синтез активных форм кислорода: ионов, свободных радикалов либо перекисей. Мощным химическим «Бада-бумом» умница пожиратель предусмотрительно дезинфицирует все проглоченное [2]. Если и этого мало, грозный вояка образует высокотоксичное соединение на основе оксида азота — пероксинитрит. Пероксинитрит может подпортить и самого макрофага, потому этим химоружием М1 предусмотрительно оприходует врага, который находится поблизости. А уж потом его поедает. Естественно, это не всегда безопасно для окружающих гражданских, но благо организма для М1 всегда важнее блага одной клетки [2].
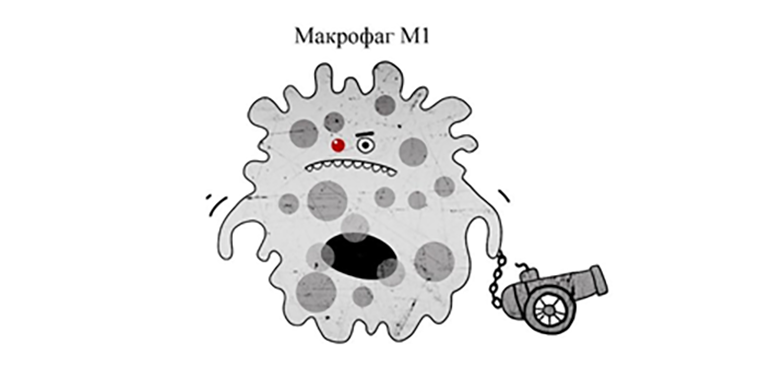
Рисунок 2. Макрофаг М1.
рисунок автора
Количество фенотипов макрофагов не ограничивается двумя. Выявлено множество промежуточных подтипов, часто уникальных — сформированных «по запросу» окружения [1]. Иными словами: «На смену четкому подразделению активированных макрофагов на М1- и М2-подтипы пришло представление о наличии непрерывного фенотипического континуума, в которых М1- или М2-состояния являются крайними точками» [3]. То есть где-то бродит вояка-уборщик, а где-то — уборщик-вояка со шваброй наперевес.
В общем, большой пожиратель — суровый парень. Кто еще может пообедать мусором или взорвать врага в своем собственном желудке?
Макрофаги на подработке
Давайте покинем ткани и заглянем в центральный отдел кроветворения. Закладка красного костного мозга у млекопитающих начинается с 12 недели развития эмбриона, а после рождения костный мозг становится центральным кроветворным органом, обеспечивающим организм клетками крови на протяжении всей жизни. В красном костном мозге — постоянная суета. Там, в специальном микроокружении, в так называемых клеточных нишах, обитают очень ценные граждане организма — мультипотентные стволовые клетки-прародительницы [4]. Они дают начало колониям различных клеточных линий крови: лимфоцитам, лейкоцитам, макрофагам, эритроцитам и даже мегакариоцитам (клеткам, которые обеспечивают кровь тромбоцитами). Созревшие клетки разных направлений из красного костного мозга либо отправляются на дальнейшее обучение в «вуз» (Т-лимфоциты в тимус, В-лимфоциты в лимфоидные органы), либо обретают все необходимые профессиональные функции, не покидая кроветворные ткани. А уж потом заступают на дежурство в организм, используя кровеносную систему как транспорт [5].
В красном костном мозге, помимо обыкновенных снабжающих капилляров, которые пропускают воду, ионы и некоторые молекулы, расположены капилляры синусоидные. Они необычны тем, что имеют довольно широкие «двери»: зазоры в эндотелии, в которые может протиснуться зрелая клетка крови. Очень удобно — через синусы можно выходить из костного мозга прямо в кровяное русло. Так обычно и поступают все созревшие клетки крови, и наши макрофаги в том числе: на стадии моноцита они выходят в кровоток через синусы, а из крови мигрируют в ткани на работу, где уже окончательно «взрослеют»: набирают грозность вместе с тучностью.
Но стоп! Возле синусоидов мы увидим не только юных моноцитов, но и удобно распластавшихся зрелых макрофагов. А в их объятиях... Нет, не мусор и не враги-интервенты. В объятиях они держат десятки кругленьких розовощеких клеток. И не для того, чтобы их съесть, ошпарив кислородным взрывом, отнюдь. Эти малыши — созревающие эритроциты, которым огромный грозный макрофажище приходится... нянечкой.
Эритроциты
Что мы обычно знаем об эритроците? Клетка крови в виде двояковогнутого диска, содержит гемоглобин, транспортирует кислород и углекислый газ. Эдакий грузовой контейнер, уже даже и не клетка, а так называемая постклеточная структура. Просто и немного скучно. А между тем, эритроциты обладают интересной судьбой. Начинается жизнь будущего эритроцита, когда стволовая клетка крови делится, и одна из получившихся копий впоследствии образует колонию эритроидных клеток, которым предстоит пройти несколько стадий развития. Во время этих стадий (которые называются дифференцировками) универсальная стволовая «заготовка» обретает физиологию и функции «взрослого» специализированного работника организма.
Немного эволюции
Мы привыкли, что «взросление» обычно сопровождается ростом, а тут — наоборот: в процессе созревания будущие эритроциты не увеличиваются, а уменьшаются в размерах более чем в два раза [5]. Уменьшение размеров связано не только с тем, что красной клетке придется протискиваться в узкие капилляры; в первую очередь «измельчание» — один из способов увеличить суммарную поверхность клеток и таким образом повысить полезную площадь взаимодействия с газами.
Если проследить эволюцию эритроцитов, то мы заметим очевидную тенденцию использовать любые подходящие варианты, которые ведут к увеличению газотранспортной эффективности — неудивительно, ведь с усложнением организмов, а тем более с их выходом на сушу потребности в кислороде растут. Так, у костистых рыб, по сравнению с более «древними» хрящевыми, эритроциты мельче в 2–3 раза [6]. А эритроциты млекопитающих как минимум в три раза мельче, чем у земноводных [5].
Помимо тенденции к уменьшению размера, идет борьба за место внутри клетки. Размер ядер эритроцитов у костных рыб в сравнении с хрящевыми уменьшился в 5–9 раз [6] — чтобы в клетку влезло побольше гемоглобина. Эритроциты млекопитающих в вопросе, кто больше вместит в себя дыхательного пигмента, пошли еще дальше — они с этой целью разрушают почти все внутренние органеллы и даже выталкивают из себя ядро на одной из последних стадий зрелости. Естественно, все это увеличивает газотранспортную эффективность клетки, но такая специализация одновременно делает ее неспособной качественно себя обслуживать. Судите сами: эритроциты рыб и лягушек — вполне самостоятельные ребята, они замечены в амебоидном движении, могут отрастить псевдоподии и даже сожрать обидчика, так как не потеряли способность к фагоцитозу [7]. А эритроциты млекопитающих остаются «без рук, без ног». И даже без необходимых инструкций своей крохотной «ДНК-соображалки»! (рис. 3) Исходя из этого, логично предположить, что таких клеток, пока они зреют, лучше дополнительно обслуживать — мало ли что... Возможно, поэтому к эритроидным клеткам в процессе эволюции «приблудилась» нянька.
Рисунок 3. Эритроциты.
рисунок автора
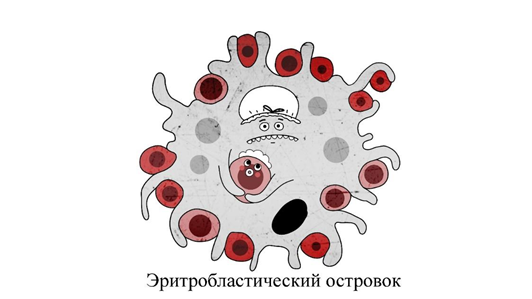
Эритробластический островок
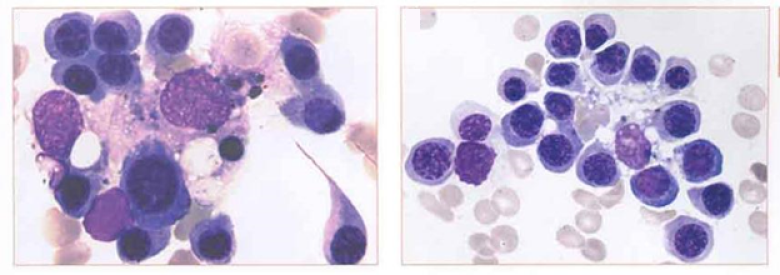
В 1956 году французские исследователи М. Клод Бесси и Дж. Брентон-Гориус при изучении костного мозга больных хронической железодефицитной анемией обнаружили странные структуры. Группы эритроидных клеток на разных стадиях созревания кольцом (или несколькими) окружали распластавшегося макрофага (рис. 4). При этом более зрелые клетки располагались дальше от центра, а сам макрофаг контактировал с каждой из них своими псевдоподиями, крепко удерживая «малышню» с помощью молекул межклеточной адгезии (адгезивные белки обеспечивают фиксацию клеток в межклеточном матриксе). Такие «детсадовские» группы во главе с центральным макрофагом были названы эритробластическими островками и позднее получили статус морфофункциональной единицы системы красной крови. Многочисленные работы подтвердили существование такого способа организации эритроидной ткани в костном мозге у многих видов млекопитающих [8].
Кровавая поэзия
Система крови — один из интереснейших примеров динамически равновесных биологических систем. Это сложная иерархическая саморегулирующаяся структура, чутко реагирующая на изменения среды и запросы организма. Наверное, неспроста созревание клеток крови называется гемопоэз (от греч. poiesis — «творить»).
Созревание конкретно красных кровяных клеток имеет название эритропоэз, а контролируется эритропоэз преимущественно гормоном эритропоэтином. За концентрацию эритропоэтина в крови ответственны в основном клетки почек, в которых есть «сенсоры», чутко определяющие содержание кислорода в организме. В ответ на гипоксию продукция эритропоэтина увеличивается, так что кислородное голодание ваше тело чувствует отнюдь не легкими, а почками. Почему именно почки, каким боком они впутались в процесс? Связано это, скорее всего, с тем, что почки изначально выполняли не только выделительную, но и кроветворную функцию. У рыб почки по сей день является одним из центральных органов кроветворения [5].
Если приключилась гипоксия, значит, по какой-то причине случилась нехватка грузоперевозчиков-эритроцитов. Выпали они в мир иной при кровотечении, или просто организм в виде человека решил заняться бегом, — неважно. Эритропоэтин, выделенный клетками почек, стимулирует деление стволовых клеток (эритроидных предшественниц) в костном мозге. Также эритропоэтин усиливает синтез гемоглобина, ускоряет процесс созревания самих красных клеток — программу они сдают «экстерном» и заступают на работу, даже не отрастив усы. Но гормон, попадающий в кровоток, как выяснилось, — это сигнал общей тревоги, а эритропоэз в большей степени регулируется в костном мозге местными органами управления [9].
Заботливые объятия
Центральные макрофаги регулируют эритропоэз более «тонко», создавая для своих подопечных в костном мозге особую микросреду. Они умеют выделять эритропоэтин, а еще интерлейкин-3, который также является регулятором эритропоэза [8], [9]. И, судя по всему, центральные макрофаги островков реагируют не только на эритропоэтиновый приказ, идущий от почек: они тщательно «взвешивают» самые разные сигналы «за» и «против», и лишь на этом основании «принимают решение» замедлить или подстегнуть развитие эритроцитов. Например, количество выделяемого эритропоэтина большим нянем зависит от числа клеток, с которыми тот связан. И даже от их степени зрелости! Выяснили это на клеточных культурах крыс путем подселения к модели кроветворной ткани эритробластов на разных стадиях созревания [9]. Подселение более «юных» клеток стимулирует выделение гормона макрофагами, а более «взрослых» — угнетает. Также макрофаги не спешат выделять эритропоэтин при слишком большой концентрации эритроцитов [9]. Полагают, что возраст и количество клеток центральный макрофаг «определяет» по секреторным пузырькам, которые те выделяют: в экзосомах созревающих эритроцитов были обнаружены разные регуляторные микроРНК, которые могут служить определенными стимулами или посланиями и для макрофага [9].
А если в модель добавить побольше макрофагов? Такие исследования проводились на культуре клеток костного мозга человека [10], и вот результат: количество макрофагов от 1 до 10% от общего числа клеток в культуре (костный мозг в норме содержит 1% макрофагов) стимулирует эритропоэз, а более 15% — угнетает. Связывают угнетение с продукцией иммунными клетками определенного количества провоспалительных цитокинов: фактора некроза опухоли, интерлейкина-1 альфа и других [8]. Выходит, чем больше макрофагов, тем выше воспалительный фон, а повышенный воспалительный фон неблагоприятно сказывается на эритропоэзе. Влиянием провоспалительных цитокинов, в частности, объясняют патогенез сопутствующей анемии у больных ревматоидным артритом и опухолевыми заболеваниями [8].
Эритроцитов по ядрам считают, или макрофажья математика
Вот еще любопытный момент. Как уже было упомянуто выше, предшественники эритроцитов млекопитающих выталкивают из себя ядро на последней стадии зрелости. Думаю, вы уже догадались, куда эти ядра потом деваются? Конечно, няньки их прилежно фагоцитируют — странно, если было бы иначе: наш макрофаг — чистюля, и отходы мимо себя не пропустит (вполне возможно, кстати, что уборка ядер за эритроцитами как раз и привела макрофагов в профессию воспитателя). Но в данном случае «чистоплотность» пожирателя приносит еще одну неочевидную пользу.
Профессор Ю. М. Захаров со своим учеником профессором А.Г. Рассохиным и командой специалистов в течение 20 лет изучали эритропоэз в эритробластических островках и накопили множество экспериментального, а также клинического материала [8]. Исследователи заподозрили в процессе фагоцитоза клеточных ядер возможную связь с поддержанием гомеостаза крови. Ученые — те еще затейники: подопытным животным в костный мозг они вводили суспензию ядер эритроцитов, которые в больших количествах фагоцитировались центральными макрофагами [8]. А затем наблюдали любопытную картину: в ответ появлялись вещества-ингибиторы эритропоэза! Считать ядра, конечно, няньки не умеют, но повышение «проглоченного» их количества каким-то образом означает для них увеличение количества созревших воспитанников. И это является сигналом притормозить стимуляцию эритропоэза, чтобы красных клеток не оказалось слишком много. Ведь кому нужна тесная толчея вместо нормальной крови?
Как видим, работы у няньки полно: свериться с сигналами из почек и другими гуморальными факторами, «определить» всех подопечных по возрасту, «сосчитать» выпускников по съеденным «соображалкам» и принять важное решение. А именно: в стимуляции или в угнетении эритропоэза нуждается организм? И если по каким-то патологическим причинам почки перестают секретировать достаточное количество эритропоэтина, макрофаги островков продолжают поддерживать нормальный эритропоэз сами, несмотря на неадекватно низкий уровень гормона в крови. Это все показывает, что именно большие пожиратели островков, «общаясь» непосредственно с эритроидными клетками и их стволовыми прародительницами, обеспечивают адекватный ответ на кислородный запрос организма [5].
Железный прикорм
Тонкая регуляция эритропоэза — далеко не единственная функция нянечек. Будущим эритроцитам, как известно, нужно железо. Много железа для производства гемоглобина. Ежедневно с пищей и водой в организме всасывается 1–2 мг железа, а для эритропоэза нужно 20–30 мг. Проблема разрешается созданием запасов в некоторых клетках и так называемой рециркуляцией железа — неоднократным его повторным использованием [11].
Малыши-эритробласты поглощают железо прямо из кровотока: ионы этого металла цитотоксичны, потому путешествуют в плазме в связке со специальным белком трансферрином. Этот комплекс не входит в клетку пассивно — нужны специальные трансмембранные рецепторы, которые созревающие эритроциты экспрессируют в больших количествах [5]. Но железо нужно не только им, а практически всем клеткам (хоть и в меньших количествах) для синтеза ДНК (некоторые ферменты, необходимые для репликации ДНК эукариот, содержат железосерный кластер 4Fe4S) и производства других железосодержащих ферментов, так что железо — продукт популярный. Для нормального эритропоэза крайне важно постоянно поддерживать определенную пороговую концентрацию трансферрина в плазме, и эта ответственность лежит на печени: ее клетки не только хранят запасы данного металла, но и производят необходимый белок-переносчик для его трансфера. Соответственно, при неполадках с печенью уровень железа, связанного с трансферрином, в крови падает. Мало того, железо является важным веществом практически для всех живых организмов, потому во время инфекции хозяева и патогены вступают в конкурентную борьбу за этот металл, что приводит к серьезным изменениям в метаболизме железа у хозяина [12].
И тут, похоже, снова выручают большие няньки: залежи железа в виде ферритина запасливо припрятаны у них под полой. Центральные макрофаги отправляют ферритин в тонкую прослойку межклеточной жидкости между собой и будущими эритроцитами. Те, в свою очередь, микропиноцитозом (поглощением мелких пузырьков жидкости) всасывают его внутрь и включают освободившиеся ионы железа в процесс синтеза гемоглобина [8]. Так макрофаги активно подкармливают своих воспитанников, чтобы те, независимо от обстоятельств, росли (простите, уменьшались!) здоровыми и крепкими. Кстати, дефектные клетки не смогут выбраться из костного мозга в просвет синусоидного капилляра и будут ликвидированы. Няньке придется их попросту... съесть. Это называется неэффективным эритропоэзом, он составляет 5–10 % от нормального и является частью физиологически обусловленного механизма регуляции [5].
Возвращаясь в заботливые псевдоподии
Когда малыш созревает, наливается гемоглобиновым румянцем и гордо выплевывает ядро, макрофаг «расшнуровывает» объятия и отпускает воспитанника на работу в кровоток.
Эритроцит, избавляясь от ядра ради повышения эффективности профессиональной деятельности, жертвует продолжительностью своей жизни. Красная клетка крови с ядром у тех же рыб функционирует более года, а безъядерный эритроцит человека — всего около 120 дней. Без инструкций по сборке белков, которые были прописаны в генах, он не может обновляться — банально ремонтировать самого себя. Круглосуточная работа с кислородом (известным окислителем) и железом (цитотоксичным металлом) быстро изнашивает клетку. Запасы защитных антиоксидантов трудяги со временем истощаются, липиды и белки окисляются, оболочка «обтрепывается»: теряет эластичность и способность принимать дисковидную форму. На ней появляются вздутия. Эритроцит принимает форму пупырчатого шара — эхиноцита [5].
Такой пупырчатый дедушка-эхиноцит может в любой момент не выдержать нагрузки и развалиться прямо на рабочем месте. Но гемоглобин, который возят эритроциты — груз повышенной опасности, и лучше ему в кровоток лишний раз не попадать: в большой концентрации он может закупорить нефроны почек и вызвать острую почечную недостаточность, не говоря уже о том, что может натворить свободное железо. Престарелые клетки, пока они не лопнули, предусмотрительно обнаруживают и захватывают из кровотока резидентные макрофаги селезенки, клетки Купфера в печени и особенно наши няньки из костного мозга. Макрофаги, обитающие со своим детсадом возле синусов, одними псевдоподиями нянчат малышей, а другие предусмотрительно выставляют в просветы капилляров. Ими они нащупывают потрепанных жизнью эритроцитов, проплывающих мимо, отлавливают их и фагоцитируют — это дело всего нескольких минут. Вот откуда у наших нянек постоянные запасы железа в закромах.
Каждый день примерно чайная ложка эритроцитов разрушается внутри макрофагов, и столько же новых работников выходит в кровь. В объятиях макрофага каждый эритроцит «развивается», трудится на благо организма 24/7, и, «постарев» за три месяца, возвращается обратно в заботливые псевдоподии, где становится частью новых розовощеких собратьев. Под надежным присмотром железной няньки эритробласты зреют 7 суток [5]. Один центральный макрофаг за цикл «выращивает» и «вскармливает» около 30 эритроцитов [8]. При кровопотере нагрузки возрастают: срок созревания укорачивается, а количество детсадовцев в группе увеличивается до 60 при той же зарплате [8]. И если родина скажет: «Нужно!», большого няня после первого цикла не отправят на пенсию, а запрягут заново, и он образует новый островок [8].
Эпилог
Хотелось рассказать про малоизвестную сторону грозного макрофага, а получилась история про альтруизм, ответственность и взаимопомощь. Кто-то скажет, что герои рассказа получились излишне очеловеченными. Возможно. Конечно, ни макрофаг, ни эритроцит не способны к чувствам. У них нет понятий добра или зла — они просто делают свое дело, выполняют сложную биологическую программу по совместному выживанию, ведь в долгосрочной перспективе побеждает, вопреки упрощенному пониманию, не сильнейший, а тот, кто освоил командную работу и взаимовыручку: даже у бактерий наблюдается биологический альтруизм, а многоклеточные организмы вообще являются блестящими примерами построенных на альтруизме систем [13]. Исходя из этого, можно осторожно отметить, что макрофаг — строгий и отзывчивый. А эритроцит — жертвенный. Просто они не знают об этом.

рисунок автора
Литература
- Сарбаева Н.Н., Пономарева Ю.В., Милякова М.Н. (2016). Макрофаги: разнообразие фенотипов и функций, взаимодействие с чужеродными материалами. Гены и клетки. 11, 9–17;
- Савченко А.А., Кудрявцев И.В., Борисов А.Г. (2017). Методы оценки и роль респираторного взрыва в патогенезе инфекционно-воспалительных заболеваний. Инфекция и иммунитет. 7, 327–340;
- Ельчанинов А. В., Фатхудинов Т. Х. Макрофаги. М.: «Геотар-медиа», 2023. — 197 с.;
- Семенова Н.Ю., Бессмельцев С.Е., Ругаль В.И. (2014). Биология ниши гемопоэтических стволовых клеток. Клин. онкогематол. 7, 501–510;
- Липунова Е.А., Скоркина М.Ю. Система красной крови. Сравнительная физиология // ГОУ ВПО «Белгородский государственный университет»: учебное пособие. Белгород, 2004. — 235 с.;
- Ю. А. Силкин, Е. Н. Силкина, В. Н. Черняева, В. Е. Василец. (2019). Исследование размерных характеристик и морфологических особенностей эритроцитов у некоторых черноморских рыб разного эволюционного положения и экологической специализации. Вопр. ихтиол.. 59, 87-93;
- Чернявских С.Д., Кует Д. Х., Буковцева И.С., Тхань В.В. (2016). Способности к фагоцитозу и фагоцитарной активности ядерных эритроцитов холоднокровных. Научные ведомости. 232, 3–10;
- Захаров Ю.М., Рассохин А.Г. Эритробластический островок М.: «Медицина», 2002. — 280 с.;
- Тишевская Н.В., Шевяков С.А. (2020). Роль тканевого эритропоэтина и механизмов обратной связи в локальной регуляции эритропоэза. Российский физиологический журнал. 106, 1122–1131;
- LI Gordon, WJ Miller, RF Branda, ED Zanjani, HS Jacob. (1980). Regulation of erythroid colony formation by bone marrow macrophages. Blood. 55, 1047-1050;
- Гуцуляк С.А. Железодефицитная анемия у детей // ФГБОУ «Иркутский государственный медицинский университет»: учебное пособие. Иркутск, 2020. — 55 с.;
- Ana Gomes, Ana Moreira, Gonçalo Mesquita, Maria Gomes. (2018). Modulation of Iron Metabolism in Response to Infection: Twists for All Tastes. Pharmaceuticals. 11, 84;
- Марков А. В. Эволюция кооперации и альтруизма: от бактерий до человека. М.: Corpus, 2009. — 304 с..