
Вакцины против коронавируса: последние новости
26 июня 2020
Вакцины против коронавируса: последние новости
- 3693
- 2
- 2
Вакцина от коронавируса: новые данные — новые вопросы
-
Автор
-
Редакторы
Страны постепенно ослабляют карантинные меры, и всё громче звучит вопрос: «А что дальше?». Будет ли новая волна эпидемии? Когда мы сможем вздохнуть спокойно — когда, наконец, появится вакцина против коронавируса? Многочисленные компании и исследовательские группы из разных стран пытаются найти ответ на этот вопрос. Следить за всеми новостями и пресс-релизами сложно, если не невозможно. На помощь приходят обзоры людей, которые пристально следят за происходящим. В данном случае речь идет о Дереке Лоу (Derek Lowe) — медицинском химике и фармакологе, который пишет в своем блоге In the pipeline («В разработке») о новостях фарминдустрии.
Этот материал — адаптированный перевод нескольких постов Дерека [1]. Мы уже переводили один из его предыдущих постов месяц назад [2]. Там Лоу описал типы вакцин, их механизмы, преимущества и недостатки, а также рассмотрел вопросы эффективности, безопасности и логистики кандидатных вакцин против коронавируса.
В этом переводе мы подробнее обсудим кандидатные вакцины, разработанные в разных компаниях и исследовательских группах. Мы узнаем, какие методы они выбирают, с какими проблемами сталкиваются и как планируют их решать. И, главное, на какие сроки испытаний мы можем рассчитывать.
Итак, о чем пишет Дерек Лоу
С публикации прошлого поста о передовых кандидатных вакцинах прошло около месяца [3]. За это время появилось много новостей, и я решил написать новый пост. Из старого можно почерпнуть общую информацию о большинстве описанных ниже проектов. Если вы его ещё не читали, он станет хорошим вступлением.
Кандидатные вакцины, что описаны ниже, я расположил в совершенно произвольном порядке. Нужно быть сумасшедшим, чтобы сейчас пытаться угадать, какие из них сработают, а какие — нет. Впрочем, мы можем быть уверены, что многие из них по той или иной причине провалятся — такова судьба большинства лекарств и вакцин. Мы также можем быть уверены, что придется пойти на сложные компромиссы, касающиеся эффективности, производства, безопасности и других вопросов. Честно говоря, я удивлюсь, если этого НЕ произойдет. Имея это в виду, начнем! (Обратите внимание, что в пункте про вакцину от J&J есть и интересные общие новости о вакцинах.)
Ad5-nCoV от компании CanSino
Несколько дней назад The Lancet опубликовал очень подробный отчет команды CanSino о первой фазе исследований своей вакцины [4]. Как видно из названия, это вирусный вектор, использующий аденовирус-5. Этот выбор, с одной стороны, ускоряет разработку, с другой — вызывает беспокойство насчет эффективности и переносимости. В этом случае аденовирус предназначен для экспрессии коронавирусного гликопротеина Spike — общей мишени для многих кандидатных вакцины. У большого числа людей уже есть антитела к этому виду аденовируса. Однако прошлые усилия по разработке подобной вакцины столкнулись с проблемой иммунной атаки на вектор, которая (как можно догадаться) может нарушить развитие иммунитета к его грузу.
Основной конечной точкой этого открытого исследования с повышением дозы были побочные эффекты на седьмой день после внутримышечной инъекции, с последующим наблюдением в течение 28 дней. Исследователи также определяли выработку нейтрализующих антител и Т-клеточный ответ. Это ценные данные, но необходимо заметить (как это и делается в статье), что, пока мы не перейдем ко второй фазе испытаний, мы не узнаем, какие ответы действительно нужны для защиты от вируса. В испытании было три дозировки, по 36 пациентов в каждой группе, с медианным возрастом 36 лет и с почти равным делением на мужчин и женщин.
75–83% пациентов в каждой группе сообщили, по крайней мере, об одной побочной реакции к седьмому дню. Как правило, это была боль в месте инъекции, иногда лихорадка, мышечные боли и т.д. Побочные реакции были сильнее при самой высокой дозе, что неудивительно. Имейте в виду, что с любым вирусным вектором вы заносите пациенту совершенно новую вирусную инфекцию — пусть и ту, что будет производить нужные антигены, а не новые вирусы. Отсюда и симптомы гриппа. Что важно, в течение 28-дневного периода исследования ни в одной группе не было замечено никаких серьезных реакций. В этом случае «серьезный» означает что-либо, что привело бы к госпитализации или возможности необратимого вреда.
Что насчет иммунного ответа? Все пациенты выработали нейтрализующие антитела и развили T-клеточный ответ (как CD4+, так и CD8+) [5]. Это хорошо: хоть мы и не знаем, какой ответ нужен, этот выглядит значительным и дозозависимым. На данном этапе этого достаточно. Когда мы получим более точные данные от других компаний, работающих над вакциной, мы сможем сравнить.
Но в данных CanSino есть и слабые места. У 44–56% участников исследования (в зависимости от группы пациентов) уже был высокий уровень нейтрализующих антител к вирусу Ad5. И, как обнаружили исследователи, это определенно помешало иммунному ответу на груз — белок Spike. Кроме того, был отмечен более низкий уровень антител у пожилых пациентов (45–60 лет, на что я скажу: «не такие уж и пожилые»). На этот факт исследователи собираются обратить особенное внимание при переходе ко второй фазе испытаний, учитывая то, насколько тяжесть заболевания увеличивается с возрастом.
Честно говоря, это ровно то, чего и следовало ожидать: реальный иммунный ответ на белок Spike, которому мешают антитела к Ad5. Много с чем предстоит разобраться, так что будем ждать вторую фазу.
ChAdOx1 nCov19 от AstraZeneca и Оксфорда
Здесь я отправлю вас к моему недавнему посту про данные, полученные на макаках резус [6]. Если кратко, вакцина не вызвала «стерилизующий иммунитет» (то есть полную защиту от инфекции). И, к сожалению, эти цифры невозможно напрямую сравнить с результатами исследований компании SinoVac.
Другой новостью стало заявление Эдриана Хилла, исследователя из Оксфорда, в интервью Sunday Telegraph. Он высказал мнение, что вакцина сработает с вероятностью 50%. Это попало во все заголовки — и не сделало бы этого, живи мы в более информированном мире. Вакцины в принципе проваливают испытания приблизительно в 90% случаев. Конечно, сравнение не совсем корректно, поскольку эта цифра относится к вакцинам против всевозможных патогенных микроорганизмов, а сейчас мы рассматриваем только один из них. С другой стороны, если существует какая-то системная проблема с развитием защитного иммунитета к коронавирусу, она будет общей для всех попыток создания вакцины. (Я не думаю, что это так, но мы не можем исключить эту версию, пока не доберемся до результатов второй фазы.)
Другое замечание Хилла тоже должно быть очевидным: чтобы лучше понять, защищает ли ваша терапия людей, желательно провести испытания второй фазы в популяции, где вирус активно распространяется. Это всё труднее представить в странах, где меры общественного здравоохранения (карантины, маски, социальное дистанцирование и пр.) ограничивают передачу вируса. Возможно, нам придется бегать за вирусом из региона в регион, из страны в страну, чтобы провести лучшие испытания вакцин. А если мы, как многие боятся, снимем меры слишком рано, у нас будет полно мест для тестирования — нам просто нужно будет ждать и наблюдать. Проблема в том, что подготовка этих испытаний требует времени и организации, и трудно угадать заранее, где будут лучшие места для их проведения.
mRNA-1273 от Moderna
Здесь я также отправлю ваc к недавнему посту для более подробной информации [9].
Moderna критикуют за то, как они выпустили свои данные, и в особенности за то, что они сделали это перед запланированной продажей своих акций. Как и люди в этой статье, я сам задаюсь вопросом, кто же покупает эти акции, учитывая неопределенность в разработке вакцин, во всей эпидемии COVID-19 и, в частности, в механизме работы мРНК-вакцин. Хотелось бы посмотреть на результаты Moderna так же обстоятельно, как в случае CanSino.
И все же я рад, что Moderna в деле. Нам нужны разные стратегии, чтобы распределить значительные риски. Конечно, мы не знаем, насколько хорошо мРНК-вакцины будут действовать на людях, но мы узнаем об этом немного раньше благодаря коронавирусу. Я бы не стал ставить на акции Moderna, но я рад, что они ставят на вирус .
Обновление от 11.06: компания подтвердила, что начнет третью фазу в июле с дозой 100 мкг, как и можно было ожидать на основе предыдущих исследований. Кроме того, компания опубликовала данные исследований на мышах.
BioNTech и Pfizer
Здесь — никаких последних новостей. Испытания продолжаются, но о результатах не слышно. Впрочем, вот хорошая обзорная статья Forbes об этом. Имейте в виду, что Pfizer и BioNTech разрабатывают сразу четыре вакцины, а не одну: они берут на себя огромные риски. Рано или поздно они получат много данных, и ожидается, что хотя бы одна из этих четырех вакцин сможет пройти дальше.
PiCoVacc от Sinovac
Насколько я вижу, здесь тоже ничего нового. Компания одной из первых предоставила данные об использовании своей кандидатной вакцины на основе инактивированного вируса на животных моделях. Но нам придется подождать данных на людях (я напишу обновление в этот пост, когда они их опубликуют). Несколько дней назад появились странные новости — пресс-релиз о том, как Sinovac получила больше финансирования для разработки вакцины. Но это всего $15 млн — смехотворная сумма по сравнению с тем, что будет потрачено любой компанией на испытания на людях. Пометьте звездочкой тех, кто передавал эту новость как полезную, — скорее всего, они в этой теме не разбираются.
Sinofarm и Уханьский институт биопрепаратов
Еще один кандидат с инактивированным вирусом. Последние новости говорят о том, что 96 пациентов в трех возрастных группах прошли первую фазу, и вакцина перешла во вторую. Однако новости уже около месяца — пожалуй, это самая тихая из всех разработок вакцины. Интересно, изменится ли это?
INO-4800 от Inovio
Компания недавно опубликовала статью о результатах применения своей кандидатной ДНК-вакцины на мышах и морских свинках [10]. Результаты выглядят неплохо, но они говорят только об иммуногенности. Наблюдается активная выработка антител, но у нас пока нет данных о процессе вирусного заражения на животных моделях и об иммуногенности или переносимости вакцины у людей. Компания заявила, что ожидает получить данные в июне, а руководитель ее отдела R&D довольно неофициально рассказал Reuters, что пока они не видят никаких сигналов, что вакцина небезопасна для людей.
Johnson&Johnson (Jannsen Pharmaceutica)
За последние пару недель не появилось никаких новостей о кандидатной вакцине на основе аденовируса Ad26 от J&J. В этой вакцине, как и в кандидате из Оксфорда, используется тип аденовируса, с которым люди в основном не сталкиваются. Так исследователи хотят избежать проблем вакцины CanSino Ad5 (см. выше). Конечно, всё это должно быть доказано в клинических испытаниях.
Тем временем лаборатория Barouch в Гарварде (разработчики платформы Ad26) опубликовала статью с длинным списком соавторов, в том числе сотрудников J&J [11]. В ней рассматриваются несколько ДНК-вакцин против коронавируса, использованных на макаках резус. Насколько мне известно, это первый подробный обзор их использования в такой модели. Исследователи провели большую работу. Они испробовали шесть вариантов ДНК:
- Кодирующую полноразмерный белок Spike.
- Без цитоплазматической «хвостовой» области.
- Без хвостовой части и трансмембранного домена (то есть только наружняя часть Spike).
- Только с S1-доменом Spike и меткой тримеризации.
- Только с областью RBD (рецептор-связывающего домена) и меткой тримеризации.
- Довольно сложно сконструированный вариант с делецией сайта расщепления фурином и двумя введенными пролиновыми мутациями (вместе с меткой тримеризации) — для того, чтобы сделать полученный белок более стабильным.
Каждый из вариантов дал разный ответ по титру и типу выработанных антител. Варианты 3 и 6 были похожи больше всего, а 5 сильнее всех отличался от других (рис. 3).
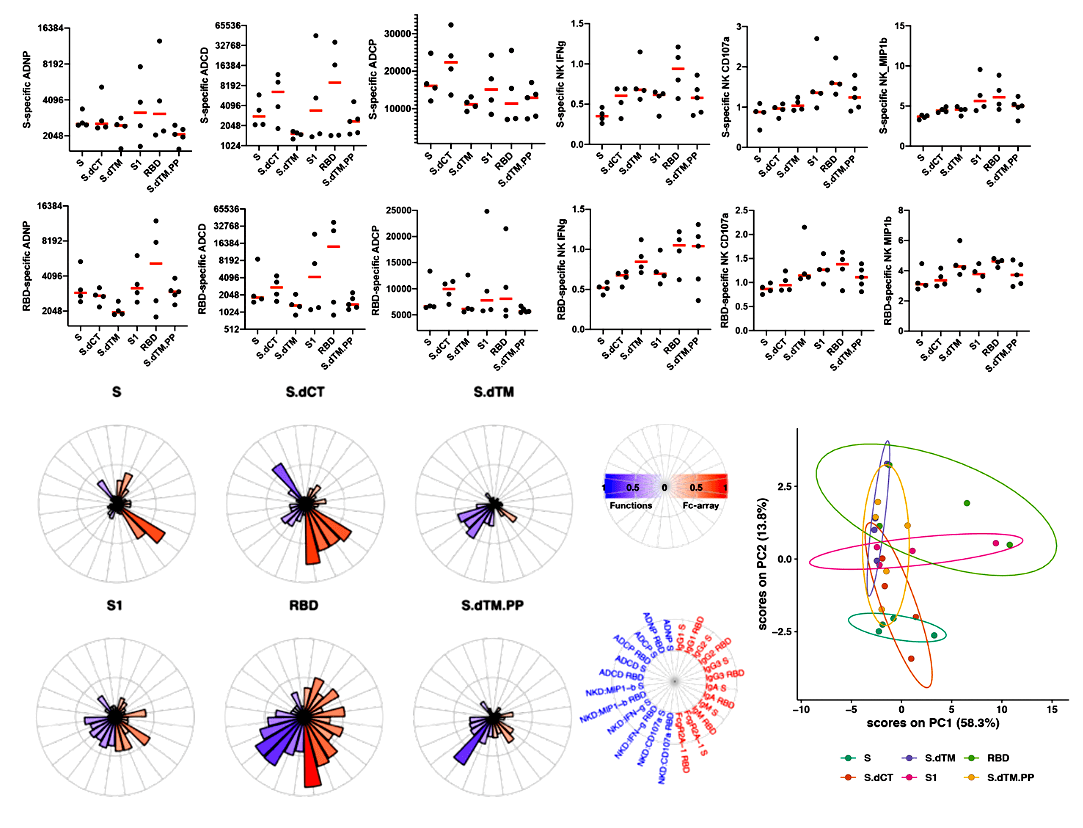
Рисунок 3. Гуморальный иммунный ответ у вакцинированных макак резус. Показаны: S- и RBD-специфический антителозависимый нейтрофильный фагоцитоз (ADNP), антителозависимое отложение комплемента (ADCD), антителозависимый моноцитарный клеточный фагоцитоз (ADCP) и антителозависимая активация NK-клеток (секреция IFN-γ, дегрануляция CD107a и экспрессия MIP-1β). Радиальные диаграммы показывают распределение характеристик антител по группам вакцин. Размер и интенсивность цвета клиньев показывают медиану признака для соответствующей группы (синим цветом обозначены функции антител, красным — связывание изотипа / подкласса / FcγR антитела). График анализа основных компонентов (PCA) показывает многомерные профили антител по группам. Каждая точка представляет животное, цвет точки обозначает группу, а эллипсы показывают распределение групп на 70%-ном доверительном интервале, предполагая многомерное нормальное распределение. Красные столбцы отражают медианные ответы. Пунктирные линии — предел обнаружения теста.
Исследователи также изучили Т-клеточный ответ: более короткие конструкции демонстрировали более слабую активность. Через три недели животным давали бустерную дозу, а еще через три заражали живым коронавирусом. На рисунке 4 показаны результаты (наличие вирусной мРНК проверяли в мазке из носоглотки и в альвеолярной жидкости). Все шесть вариантов были эффективными, между ними не было больших различий. Но всё же обычный белок Spike (1) и RBD (5) были самыми сильными, а дестабилизированный более короткий вариант (3) — самым слабым. Скорее всего, это хорошо, поскольку основные кандидатные вакцины в клинических испытаниях — как раз с использованием Spike и RBD.
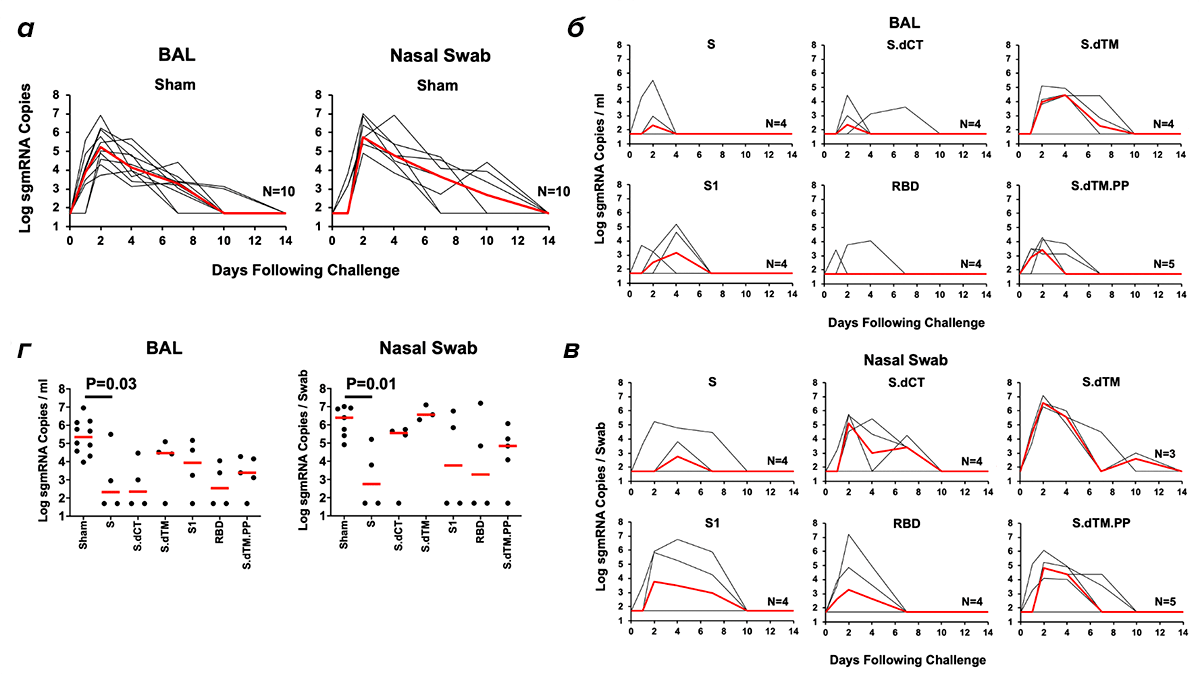
Рисунок 4. Вирусная нагрузка макак резус, зараженных вирусом SARS-CoV-2. Макак резус заражали интраназально и интратрахеально SARS-CoV-2 — 1,2 × 108 VP (вирусных частиц) (1,1 × 104 PFU (бляшкообразующих единиц)). а — Log10 копий субгеномной РНК / мл или копий/мазок (ограничение 50 копий) оценивали в бронхоальвеолярном лаваже (BAL) и назальных мазках (NS) в ложных контролях в нескольких временных точках после заражения. б и в — Log10 копий субгеномной РНК / мл в BAL и log10 копий субгеномной РНК / мазок в NS у вакцинированных животных в различные моменты времени после заражения. г — Сводка пиковых вирусных нагрузок в BAL и NS после заражения. Пиковые вирусные нагрузки возникали на 1–4 день после заражения. Красные линии показывают медианные вирусные нагрузки. Значения P указывают на двусторонние тесты Манна—Уитни.
Еще группа смотрела, какие маркеры и тесты лучше всего соотносятся с фактической защитой от заражения вирусом. Интересно, что уровни CD4+ или CD8+ не были надежными показателями. Данные, полученные из альвеолярной жидкости, были лучше, чем из мазка из носоглотки — вероятно, из-за большей вариабельности последнего. В целом, лучшим показателем был титр нейтрализующих антител. Большинство животных в этом исследовании (как и в случае с оксфордской вакциной, см. выше) не приобрели стерилизующий иммунитет: они всё же заразились, но болезнь протекала легче, чем у непривитых животных. У тех, кто был защищен полностью, были и значительно более высокие титры нейтрализующих антител. Кажется, этот показатель — то, что нам нужно, и нам надо будет помнить об этом, когда накопятся данные на людях.
Sanofi / GSK
Из того, что я вижу, никаких последних новостей и об этом сотрудничестве. Но это изменится!
Novavax
Я писал об этих ребятах в недавнем посте — они работают над рекомбинантной белковой вакциной [12].
Сейчас известно, что компания Novavax набрала первых пациентов в исследования первой/второй фаз. Что ж, удачи им!
Обновление от 11.06: компания сообщила, что в исследовании на приматах обнаруживается очень высокий титр антител, и они считают это следствием использования собственного адъюванта. Как сказано в статье, прямое сравнение с другими исследованиями на приматах невозможно, но результаты интересные. Также компания расширяет производственные мощности.
Конечно, это привело к росту стоимости акций компании, как и всех остальных в этой сфере. Просто подчеркну еще раз, что, на мой взгляд, играть с вакциной против коронавируса в вашем портфеле акций — очень плохая идея. Всё будет очень быстро и сильно меняться, и большинство кандидатов проиграет. Нам нужно гораздо больше данных на людях, чтобы получить хоть какое-то представление о том, какие из них могут сработать. Каждая новая волна новостей летом и осенью будет хаотично бросать оценки в ту или иную сторону. Если это соответствует вашему стилю инвестирования — отлично! Но я предупреждал.
Merck
Наконец, Merck вышел из тени со своими новостями о вакцине. Они покупают Themis, компанию из Вены, которая работает над ослабленной формой вируса кори человека в качестве вектора для доставки вакцины (она используется и в качестве собственно вакцины против кори). Планируется, что испытания на людях кандидатной вакцины с этой технологией начнутся «через несколько недель», вероятно, во Франции.
В том же посте, где я упомянул Novavax, я говорил о векторе VSV, который был успешен в вакцине против вируса Эбола [12].
Merck объявил, что они также работают с IAVI — некоммерческой организацией, которая использует VSV в вакцине против ВИЧ, и планируют попробовать его в вакцине против коронавируса. Похоже, в Merck приняли решение сосредоточиться на вирусных векторах, а не на мРНК, рекомбинантных белках и т.д., полагая, что это лучшее решение в плане потенциального иммунного ответа. Увидим в клинических испытаниях!
British American Tobacco
Таково текущее положение дел. Я буду и дальше следить за новостями. А новости будут — в этом-то я уверен...
P.S. «Биомолекула» о ситуации с вакцинами в России
По информации с сайта ВОЗ от 22 июня 2020 года, в России две вакцины, разработанные Национальным исследовательским центром эпидемиологии и микробиологии им. Н. Гамалеи, находятся в клинических исследованиях фазы 1/2. Обе вакцины представляют собой аденовирусный вектор, несущий ген S-белка SARS-CoV-2 и различаются тем, что одна выпускается в лиофилизованной (высушенной) форме, а вторая — нет.
Ранее сообщалось о введении этой вакцины сотрудникам института до проведения доклинических исследований и выдачи разрешения на клинические исследования. Этот инцидент был резко раскритикован независимыми экспертами, в частности, Ассоциация организаций по клиническим исследованиям (АОКИ) заявила, что «речь идет о грубом нарушении самых основ проведения клинических исследований, российского законодательства и общепризнанных международных норм».
2 июня разработчики заявили, что собираются получить регистрацию в РФ в августе 2020 г. Как видно из переведенной нами статьи, за это время невозможно ни доказать безопасность и эффективность вакцины, ни обеспечить качественное надежное производство в масштабах, необходимых для регистрации. Как мы видели, мировые лидеры вакцинной гонки не обещают вакцину раньше первого квартала 2021 года, и то эти сроки многим кажутся сверхоптимистичными.
Разработчики из института им. Н. Гамалеи апеллируют к своему предыдущему опыту создания вакцин, однако у мировых лидеров — AstraZeneca, GSK, Sanofi, J&J — он, мягко говоря, не меньше. А новый коронавирус достаточно сильно отличается от MERS и вируса Эбола, чтобы нельзя было переносить данные экспериментов с одного вируса на другой и давать прогнозы относительно защиты на два года.
Всего на сайте ВОЗ приводится 13 кандидатов в клинической стадии и 129 кандидатов в доклинической. Из этих 129 в России разрабатывают вакцины:
- НПО «Вектор» (субъединичную и пептидную вакцины и вакцины на основе вирусов кори, везикулярного стоматита и гриппа, а также РНК-вакцину); планирует начать клинические исследования одного из кандидатов в конце июня;
- Санкт-Петербургский институт вакцин и сывороток (наночастицы с рекомбинантными белками вируса);
- МГУ (на основе вируса табачной мозаики);
- «Биокад» (одну на основе вируса гриппа и другую на основе инкапсулированных в липосомы РНК); планирует начать клинические исследования в августе.
Из российских организаций, не попавших в список ВОЗ:
- о начале разработке ДНК-вакцины сообщает Казанский университет;
- над созданием цельновирионной инактивированной (с искусственно ослабленными вирусами) вакцины работает Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова; планируют завершить клинические исследования в январе 2021 года;
- НИИ гриппа им. А.А. Смородинцева в Санкт-Петербурге разрабатывает три разновидности вакцины.
Литература
- Lowe D. (2020). Coronavirus vaccine update, May 26. In the pipeline;
- Вакцины против коронавируса: перспективы;
- Lowe D. (2020). A close look at the frontrunning coronavirus vaccines as of May 1 (updated). In the pipeline;
- Feng-Cai Zhu, Yu-Hua Li, Xu-Hua Guan, Li-Hua Hou, Wen-Juan Wang, et. al.. (2020). Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. The Lancet. 395, 1845-1854;
- Lowe D. (2020). Good news on the human immune response to the coronavirus. In the pipeline;
- Lowe D. (2020). Criticism of the Oxford coronavirus vaccine. In the pipeline;
- van Doremalen N., Lambe T., Spencer A., Belij-Rammerstorfer S., Purushotham J.N., Port J.N. et al. (2020). ChAdOx1 nCoV-19 vaccination prevents SARS-CoV-2 pneumonia in rhesus macaques. bioRxiv;
- Qiang Gao, Linlin Bao, Haiyan Mao, Lin Wang, Kangwei Xu, et. al.. (2020). Development of an inactivated vaccine candidate for SARS-CoV-2. Science. eabc1932;
- Lowe D. (2020). First results from Moderna’s coronavirus vaccine. In the pipeline;
- Trevor R. F. Smith, Ami Patel, Stephanie Ramos, Dustin Elwood, Xizhou Zhu, et. al.. (2020). Immunogenicity of a DNA vaccine candidate for COVID-19. Nat Commun. 11;
- Jingyou Yu, Lisa H. Tostanoski, Lauren Peter, Noe B. Mercado, Katherine McMahan, et. al.. (2020). DNA vaccine protection against SARS-CoV-2 in rhesus macaques. Science. eabc6284;
- Lowe D. (2020). Another set of coronavirus vaccine candidates. In the pipeline.






