Вирус в вашем мозге
25 января 2021
Вирус в вашем мозге
- 904
- 0
- 5
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы боимся вирусов. И правильно: многие из них вызывают самые страшные заболевания и являются источниками эпидемий. Осложнения после вирусной инфекции всегда непредсказуемы: некоторые вирусы, проникая в мозг через гематоэнцефалический барьер, могут провоцировать развитие амнезии и даже, как полагают ученые, болезни Альцгеймера. Однако, будучи такими проныливыми, вирусы могут стать незаменимым инструментом исследования мозга и генной терапии нейродегенеративных заболеваний.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Сначала это были симптомы простуды: повышение температуры, головная боль, ломота в теле. Потом состояние ухудшилось, и наступила кома. В 2009 году врачам удалось реабилитировать 43-летнюю Николь Керд из Австралии после диагностирования энцефалита, вызванного вирусом простого герпеса первого типа. Вот только теперь, к сожалению, она не может вспомнить ни свою поездку в отпуск по Европе с мужем, ни день свадьбы, ни рождение дочери. Все, что происходило с ней 15 минут назад, она также не может вспомнить. Вирусная инфекция привела к геморрагическим поражениям гиппокампа и некоторых других структур мозга, которые участвуют в формировании автобиографической памяти, что привело к амнезии, похожей по своим проявлениям на классический пример повреждения височных структур мозга — Генри Молисона, у которого также была потеряна способность к запоминанию после операции по височной лобэктомии.
Вирусы и болезнь Альцгеймера
Исследования показывают, что тот же вирус герпеса может быть одним из виновников развития болезни Альцгеймера [1]. Ученые решительно пытаются доказать инфекционную природу этого заболевания. Иммунолог и предприниматель в области медицинских изданий Лесли Норинс предложил 1 млн долларов тому, кто докажет эту гипотезу.
Всякий ученый, упоминающий болезнь Альцгеймера, не может не говорить про бета-амилоиды — липкие растворимые белки, которые при нарушении выведения слипаются друг с другом и образуют бляшки, запускающие смертельный каскад, приводящий к образованию белковых волокнистых тау-клубков, в которых нейроны «задыхаются» [2].
Но мало кто понимал функцию бета-амилоида в норме у животных, пока однажды в 2008 году группе ученых под руководством Рудольфа Танзи из Массачусетской больницы общего профиля не пришла одна интересная идея [3]. Просматривая базы данных на предмет генов риска болезни Альцгеймера, они натолкнулись на ген CD33, экспрессируемый в клетках врожденного иммунитета. Озадаченный этим фактом, Танзи обратился за консультацией к своему коллеге — Робу Муару, который исследовал литературу по антимикробным пептидам. Оказалось, что эти пептиды по своей длине и свойствам близки к бета-амилоидам. Пазл сложился! Неужели бета-амилоиды нужны для защиты от патогенных инфекций?
Ученые взялись за тестирование противомикробной активности этого белка и добавляли его в различные культуры микроорганизмов, в том числе возбудителя пневмонии и кишечной палочки. Оказалось, что бета-амилоид показывал свою эффективность ничуть не хуже других антимикробных пептидов [4]. Следующим этапом было проведение экспериментов in vivo, на мышиной модели 5xFAD, производящей бета-амилоид. При локальном введении в мозг бактериальных и вирусных патогенов мыши, синтезирующие этот белок, жили дольше, чем контрольные, а бляшки появлялись у них через два дня [5].
Танзи и его коллеги предложили потенциальный механизм защиты мозга от инфекции с участием амилоидов (рис. 1). Патогены стимулируют микроглию, которая выделяет факторы воспаления (цитокины), связывающиеся с рецепторами на нейронах, которые в свою очередь активируют производство амилоида. Амилоидные белки окружают патоген и образуют бляшки, в которых патоген застревает и теряет свою активность. При нарушении выведения амилоидов бляшки провоцируют дальнейшее воспаление, создавая порочный круг, приводящий к тау-клубкам и гибели нейронов.
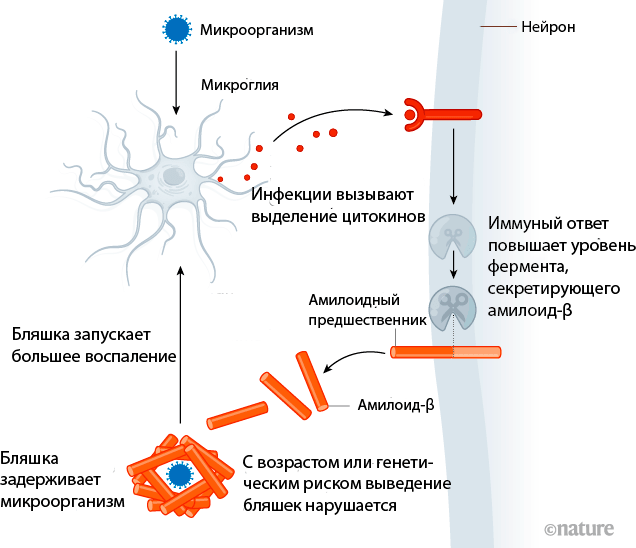
Рисунок 1. Увеличивается количество сведений о том, что инфекция может провоцировать накопление липких белковых бляшек в мозге — отличительного признака болезни Альцгеймера. По одной из теорий, микроорганизмы стимулируют клетки микроглии, запуская иммунную реакцию и поднимая уровень фермента, участвующего в секреции амилоида, из которого состоят бляшки. Этот белок может выступать в качестве механизма защиты, поглощая и инактивируя микроорганизмы. Но нарушение выведения амилоида увеличивает воспаление, создавая токсичную обратную связь.
[1], рисунок адаптирован
Однако пока не ясно, насколько такой иммунный процесс естественен для организма и насколько вообще важен в нем бета-амилоид. Инфекция может быть лишь одним из случайных стимулов к болезни Альцгеймера, так же как в ситуации с вирусом герпеса и амнезией.
Вирусы как инструмент исследования
Пока одни ученые пытаются защитить мозг от проникновения вирусов путем усиления гематоэнцефалического барьера и активации внутренних механизмов защиты, другие решают обратную задачу, создавая рекомбинантные вирусные векторы для изучения клеточного функционирования мозга.
Одним из первых, кто применял вирусы для изучения анатомии мозга, был Джеймс Папец — первооткрыватель лимбической системы мозга, ответственной за эмоции. Однако в то время вирусные векторы обладали довольно высокой токсичностью, что сильно ограничивало их применение. Но технологии не стояли на месте, и сейчас ученые получают векторы [6], активно применяющиеся в оптогенетике, в изучении связей между нейронами, экспрессии генов и даже в вирусной терапии. Идеальный вирусный вектор должен обладать следующими свойствами:
- легкостью производства в больших количествах и потенциально бесконечной вместимостью для трансгенов, чтобы увеличить шансы инфицирования и доставлять в клетку большие по объему генетические продукты;
- неинвазивностью и удобством при введении в организм животного (через системный кровоток или непосредственно в мозг);
- способностью инфицировать любой тип клеток, но быть активным только в определенных типах;
- минимальной токсичностью для организма;
- регулируемостью экспрессии трансгенов, чтобы можно было управлять количеством генетического продукта, началом и окончанием экспрессии трансгена в клетке.
При помощи вектора, основанного на аденоассоциированном вирусе, ученые из Университета Питтсбурга исследовали способ оптогенетической стимуляции нервно-мышечных соединений у макак резус [7], [8]. Такая стимуляция может вернуть парализованным пациентам со спинномозговой травмой возможность двигаться. Учеными она рассматривается как замена функциональной электрической стимуляции, в которой сигналы от мозга поступают в компьютер, интерпретирующий их и передающий разряд на стимулирующие электроды, вживленные в мышцы. При такой стимуляции, однако, пациентам все равно крайне тяжело выполнять движения. Например, чтобы поднести ложку ко рту, у таких пациентов может уходить десятки секунд, в то время как здоровый человек выполнит это движение за секунду. К тому же пациенты не могут сами удерживать руку. Один из существенных недостатков электрической стимуляции — неправильный, случайный порядок вовлечения мышечных волокон, который препятствует нормальной координации, а также быстрое уставание мышц. Функциональная оптическая стимуляция лишена этих недостатков: при увеличении интенсивности стимуляции сначала вовлекаются более тонкие мышечные волокна и только потом — более толстые, мышцы устают гораздо медленнее.
Для того чтобы проводить функциональную оптическую стимуляцию, необходимо доставить к нервно-мышечным соединениям молекулы опсина — светочувствительного белка, образующего ионный канал при активации и деполяризующего мембрану клетки. Доставить его можно путем введения вирусного вектора с необходимым трансгеном, который будет экспрессироваться в нервных окончаниях. Световые импульсы подаются на нерв или в место вхождения нерва в мышцу с помощью оптоволокна. Ученые исследовали основные параметры стимуляции, влияющие на сокращение мышц (длительность импульсов, интенсивность света, частота стимуляции), но, к сожалению, пока им не удалось зарегистрировать никакого локомоторного движения (сгибание/разгибание конечности). Все упирается в экспрессию опсиновых генов, которая зависит от успешности введения векторов в клетки, активности трансгенов и иммунного ответа организма. Наиболее сложная задача — сообщить иммунной системе не реагировать на вводимый вирус и появляющиеся опсины. Новые исследования должны будут решить все эти проблемы.
Вирусы на страже здоровья
Мы привыкли считать вирусы чем-то смертельно опасным, особенно сейчас, в период пандемии коронавируса. Однако практически любой вирус, включая SARS-CoV-2, можно превратить из заклятого врага в лучшего защитника здоровья, удалив из его ДНК или РНК опасные гены и заменив их необходимыми трансгенами, белковые продукты которых так нужны неправильно функционирующим клеткам. Рекомбинантные вирусные векторы [9], таким образом, представляют собой основу генной терапии [10] и являются единственным эффективным способом введения генов в клетки человека, благодаря отточенным миллионами лет эволюции механизмам проникновения и распространения вируса в клетке.
В настоящий момент проводятся клинические исследования эффективности генной терапии болезни Паркинсона, основанной на локальном введении в базальные ядра мозга вектора, созданного из аденоассоциированного вируса [11]. Как известно, болезнь Паркинсона сопровождается гибелью нейронов компактной части черной субстанции, поставляющей дофамин базальным ядрам. Введение вектора, содержащего ген глутаматдекарбоксилазы, в субталамическое ядро восстанавливало баланс нейромедиаторов в базальных ядрах и нормализовывало их активность, что приводило к улучшениям моторных функций и снижало необходимость в заместительной терапии леводопой, которая часто провоцирует непроизвольные движения конечностей (дискинезию). В других исследованиях ученые вводили ген декарбоксилазы ароматических кислот в стриатум и показывали увеличение уровня дофамина в ответ на терапию леводопой. С помощью позитронно-эмиссионной томографии и радиоактивно меченой леводопы ученым удалось показать непосредственный эффект активности введенного гена: обнаруженное увеличение метки в стриатуме прямо отражало ферментативную активность декарбоксилазы. Еще один способ обратить болезнь — ввести гены нейротрофических факторов [12] в черную субстанцию для предотвращения дегенерации нейронов этой структуры, правда, пока такого рода терапия не доказала свою эффективность.
У всех описанных выше методов генной терапии есть один недостаток — она инвазивна: вирусные векторы вводятся непосредственно в мозговые структуры, что требует проведения сложной и рискованной нейрохирургической операции, после которой нередко бывают осложнения в виде воспаления мозга. Альтернативный способ введения вирусных векторов — через системный кровоток, вот только они не проходят через гематоэнцефалический барьер. Для решения этой проблемы ученые предлагают использовать сфокусированный ультразвук [13], который подается локально в структуры, где нужно временно изменить проницаемость гематоэнцефалического барьера. Ультразвуковые волны временно расцепляют плотные контакты клеток эндотелия сосудов, что способствует прохождению в мозг из кровотока вирусных частиц (рис. 2). После таких манипуляций уровень воспаления значительно ниже, чем после нейрохирургической операции, поэтому период реабилитации гораздо короче. Таким образом, сочетание сфокусированного ультразвука с правильно подобранным вирусным вектором, не провоцирующим иммунного ответа, может стать реальным методом исцеления от многих нейродегенеративных заболеваний.
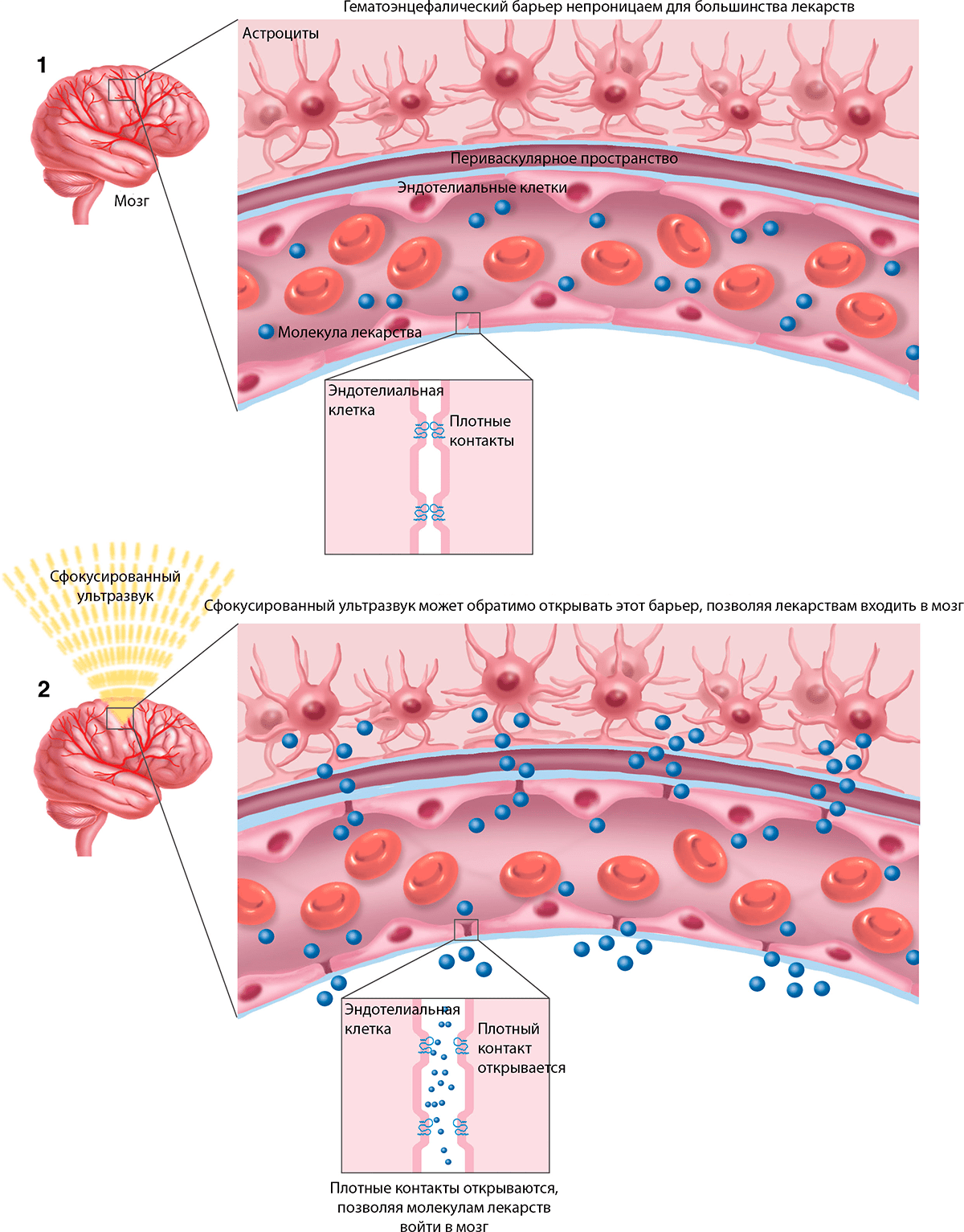
Рисунок 2. Открытие гематоэнцефалического барьера для доставки лекарств
[13], рисунок адаптирован
Будущее медицины может стоять за превращением опасных вирусов в полезные и безопасные лекарства, которые спасут мир от неизлечимых заболеваний. Возможно, и SARS-CoV-2 в недалеком будущем станут использовать в качестве рекомбинантного вектора для лечения, например, болезней легких. Будем надеяться, что эпидемия коронавируса закончится его приручением, и он встанет на стражу здоровья человечества.
Литература
- Alison Abbott. (2020). Are infections seeding some cases of Alzheimer’s disease?. Nature. 587, 22-25;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Stephanie J. Soscia, James E. Kirby, Kevin J. Washicosky, Stephanie M. Tucker, Martin Ingelsson, et. al.. (2010). The Alzheimer's Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide. PLoS ONE. 5, e9505;
- D. K. V. Kumar, S. H. Choi, K. J. Washicosky, W. A. Eimer, S. Tucker, et. al.. (2016). Amyloid- peptide protects against microbial infection in mouse and worm models of Alzheimers disease. Science Translational Medicine. 8, 340ra72-340ra72;
- Alexander R. Nectow, Eric J. Nestler. (2020). Viral tools for neuroscience. Nat Rev Neurosci. 21, 669-681;
- Jordan J. Williams, Alan M. Watson, Alberto L. Vazquez, Andrew B. Schwartz. (2019). Viral-Mediated Optogenetic Stimulation of Peripheral Motor Nerves in Non-human Primates. Front. Neurosci.. 13;
- Светлая голова;
- A. N. Lukashev, A. A. Zamyatnin. (2016). Viral vectors for gene therapy: Current state and clinical perspectives. Biochemistry Moscow. 81, 700-708;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Michael G. Kaplitt. (2019). Gene-targeting approaches for movement disorders. Current Opinion in Neurology. 32, 566-570;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Blood-brain barrier opening. Focused Ultrasound Foundation.