
Витамин D и с чем его едят
01 марта 2023
Витамин D и с чем его едят
- 3260
- 2
- 3
Попытка получить гипервитаминоз D3.
Рисунок в полном размере.
фильм Sunshine
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Что же такое витамин D и какие эффекты он оказывает на все тело человека?
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2022/2023.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое витамин D?
В последние десятилетия с экранов телевизоров, компьютеров и телефонов мы все чаще стали слышать о витамине D, его пользе для организма и о подавляющей нехватке этого всемогущего (как считают некоторые авторы в сети) вещества у населения [1]. Что же кроется под этим тривиальном на первый взгляд названием?
Витамин D — это группа биологически активных жирорастворимых веществ, похожих строением и действием на своих основных представителей — эргокальциферол (D2) и холекальциферол (D3). Стоит отметить, что D2 является аналогом у растений [2] основного витамина D3 (рис. 1), который вырабатывается у животных, но выводится из крови быстрее и, следовательно, имеет меньший эффект на организм [3].
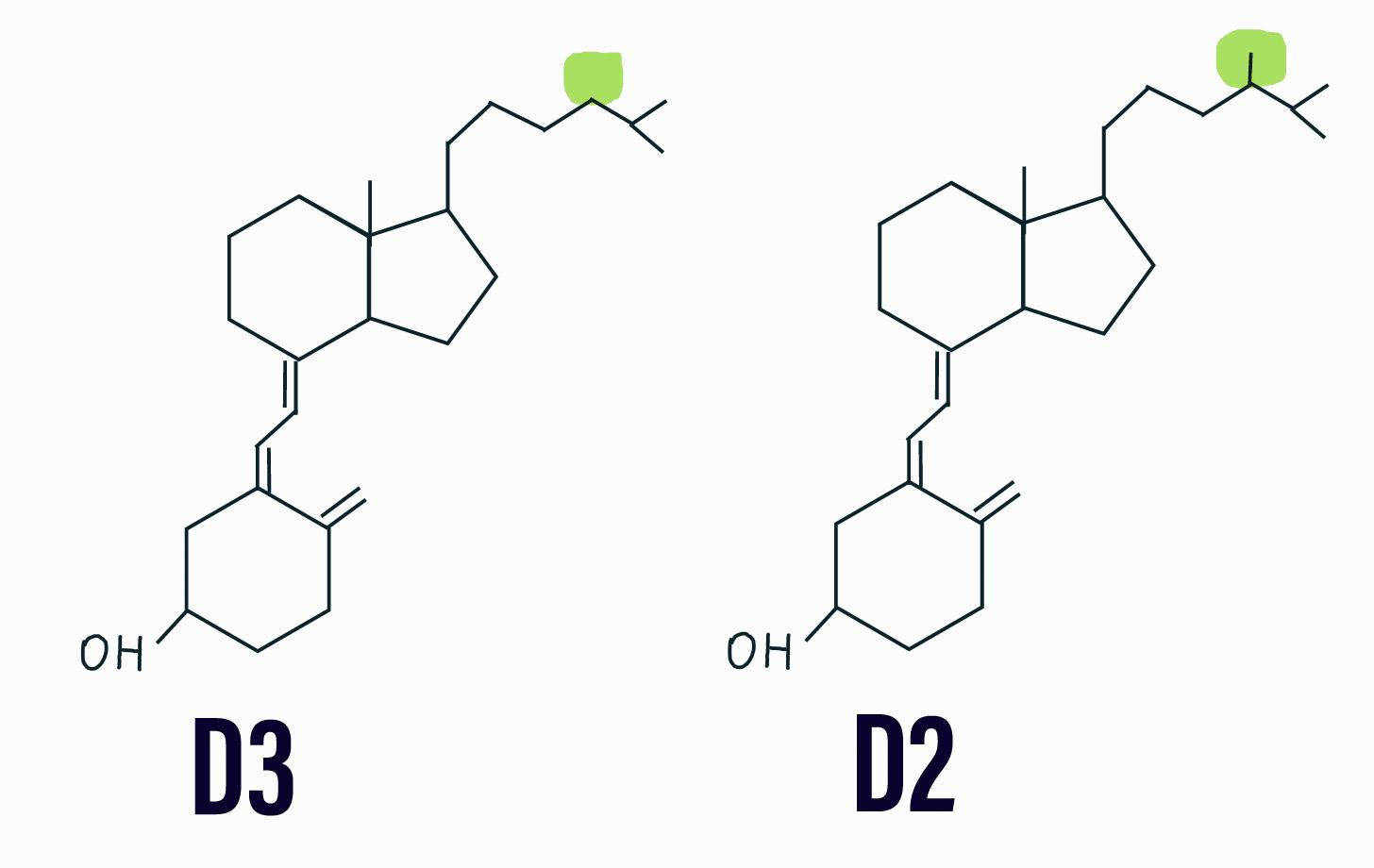
Рисунок 1. Различия в строении витаминов D2 и D3.
рисунок автора статьи на основе «Википедии»
Заранее обговорю, что в статье витамин D3 иногда называется гормоном. Как так получилось? Значение слова «гормон» менялось с течением времени из-за новых открытий. Критерии, которые до сих пор преподают, это:
- вещества органической природы;
- вырабатываются в специальных клетках желез;
- транспортируются через кровь;
- оказывают физиологический эффект на мишени;
- действуют в маленьких концентрациях.
Сейчас же в научной литературе понятие «гормон» расширилось, больше нет критерия про синтез в железе, и наш витамин подходит под оставшиеся критерии.
Откуда он берется?
Несомненно, мы получаем его с пищей, но его содержание в стандартном рационе человека средней полосы невелико. В основном он содержится в жирной рыбе, такой как лосось, форель, сельдь, скумбрия. Они являются источником D3. Но на полках магазинов также можно встретить облученные ультрафиолетом грибы и овощи, являющиеся источником D2.
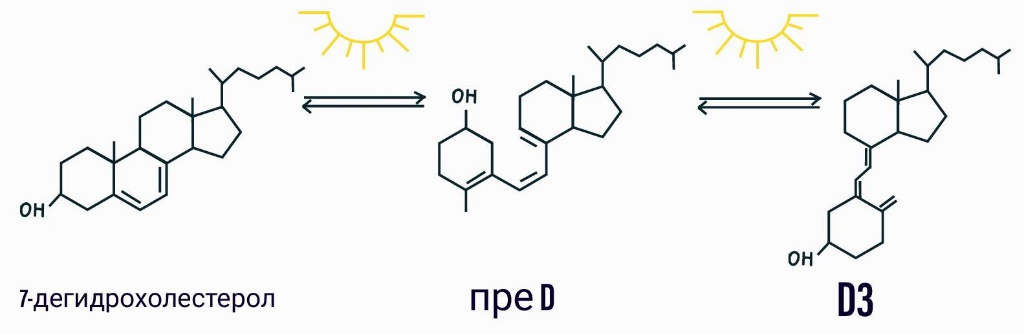
Рисунок 2. Реакции синтеза кальцитриола из 7-дегидрохолестерола.
рисунок автора статьи на основе [4]
Основным же источником витамина является эпидермис. В результате двухэтапного синтеза появляется всем известный D3 (рис. 2) [4]. Первая реакция проходит под воздействием ультрафиолета с длинами волн 290–315 нанометров, только такой свет может пробудить от сна и заставить идти на завод 7-дегидрохолестерол (7DHC), который превращается в пре-D3. К сожалению, и меланин, и одежда, в отличие от солнцезащитного крема, блокируют этот процесс [5]. Затем, как по звонку с обеда, во второй реакции он изомеризуется под воздействием тепла. Конечно, не стоит идти принимать солнечные ванны в 11–14 часов дня, так как в это время самый высокий уровень ультрафиолета, а наша ДНК повреждается под его воздействием, это только увеличит риск меланом — рака кожи.
Обе реакции не являются каталитическими, но обратимы, из-за чего здоровому человеку получить гипервитаминоз витамина D без внешних источников невозможно [4]. Теперь вполне понятно, что у нас должен быть какой-нибудь фермент, который превращает один из предшественников во что-то, с D3 не связанное. Таким белком является DHCR7(7-дегидрохолестеролредуктаза), который превращает 7DHC в предшественник холестерина.
Но что будет с человеком без этой реакции? У него разовьется синдром Смита—Лемли—Опица, у таких детей могут быть как пороки сердца, так и недоразвитость черепа, могут проявляться волчья губа и задержки в физическом развитии, например, более чем у 75% могут срастаться несколько пальцев на руках и ногах. А с возрастом они слабо набирают вес и не растут. Казалось бы, у них уровень D3 должен зашкаливать, но, на удивление, уровень D3 у таких пациентов не отличается от нормального человека или превосходит его, но без симптомов интоксикации [6]. В дальнейших исследованиях выяснилось, что активность синтеза холестерина и D3 находятся в петле обратной связи через фосфорилирование DHCR7, из-за чего синтез витамина D не нарушается [7].
А что происходит дальше?
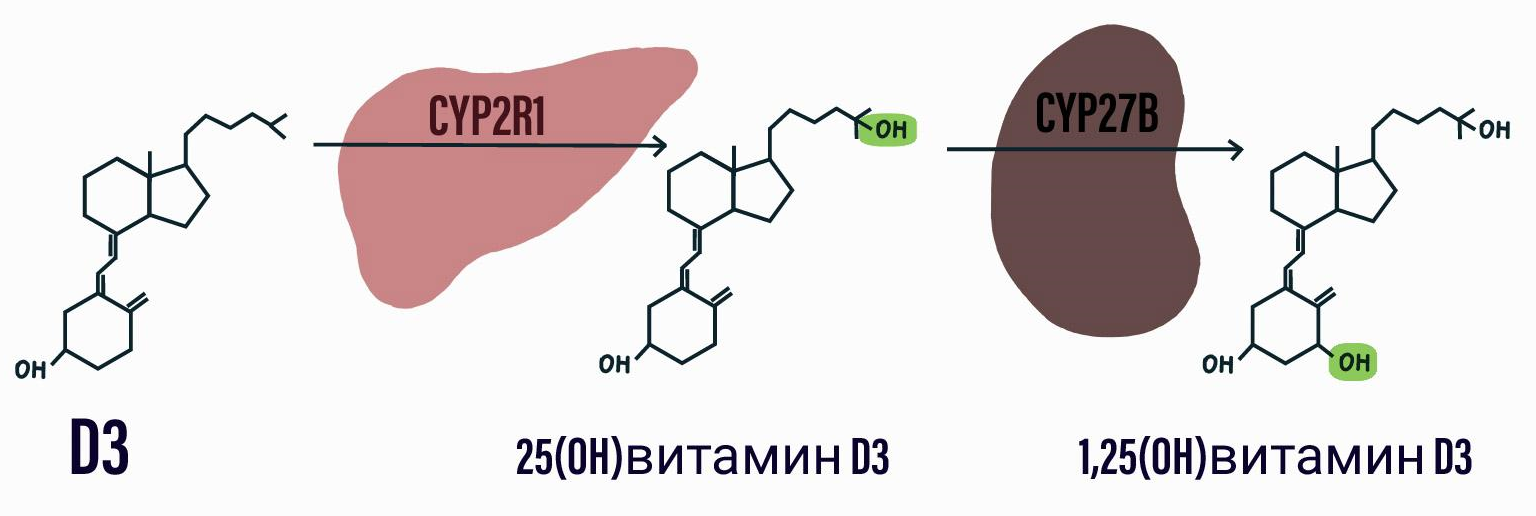
Рисунок 3. Метаболизм витамина D3.
рисунок автора статьи
С кровью и D-связывающим белком (DBP) D3 перетекает в печень, где происходят дальнейшие реакции. Хорошо известно, что витамин D требует двух последовательных стадий гидроксилирования, то есть навешивания OH групп, чтобы стать активным гормоном 1,25(OH)2D (1,25-дигидроксивитамин D, или кальцитриол). Первая реакция происходит в печени с несколькими ферментами, основной из них — CYP2R1 (25-гидроксилаза), отвечающая примерно за 50% реакций [8]. Активность этого фермента зависит от общего состояния организма; так, у людей с ожирением и диабетом обоих типов синтез фермента был снижен относительно людей с нормальным весом. Также экспрессию снижает голодание более 12 часов; эффект сохраняется на протяжении нескольких суток [9]. Так что это еще одна монетка в копилку неэффективности интервального голодания как здорового образа жизни. Из печени полуактивный предшественник транспортируется по крови с уже известным нам DBP в почки [10], где и происходят дальнейшие превращения в кальцитриол (гормон). Вторая реакция происходит с помощью фермента CYP27B.
Рецептор VDR
Имея уже гормон, нужно уметь его использовать, так что почти в любой клетке человеческого организма, будь то печень, кишечник, кости или сердце, присутствует VDR. Данный рецептор принадлежит к суперсемейству ядерных рецепторов наряду с рецепторами других стероидных гормонов, так что он непосредственно действует на активаторы или супрессоры генов, а так как кальцитриол все еще гормон, то рецептор способен улавливать его наличие в наноконцентрациях [4].
Витамин Д и нутригеномика
Хроматин представляет собой салат в ядре из ДНК, гистонов и других белков, выполняющих роль каркаса для ДНК, и является хранителем всей наследуемой информации человека. Хроматин существует по крайней мере в двух различных формах: менее плотный и доступный для транскрипции эухроматин и компактный, функционально репрессированный гетерохроматин. Эти различные конформации в значительной степени связаны с посттрансляционными изменениями белков хроматина. Эпигеномные исследования изучают эффекты от всех модификаций, таких как метилирование и ацетилирование гистонов, происходящих в хроматине в отсутствие геномных изменений [11]. Эти эпигенетические изменения могут быть очень стабильными и наследственными или нестабильными и преходящими, и катализируются так называемыми ферментами-модификаторами хроматина. VDR действует как фактор транскрипции и способен изменять скорость транскрипции генов, кодирующих ферменты-модификаторы хроматина, тем самым изменяя эпигеном человека. Но, так как это направление достаточно новое, провести линию между всеми изменениями и эффектами от них мы еще не можем.
А что по эффектам?
Костно-мышечная система
Несомненно, самой знаменитой целью уже гормона является костно-мышечная система. Еще два века назад люди знали, что недостаток солнечного света сулит рахит и мышечную слабость. В более слабых случаях недостатка D3 мы получаем высокий риск переломов и повышенную утомляемость, вне зависимости от потребляемой пищи и количества кальция в ней [12]. Предполагается, что данный эффект создается не только из-за действия D3 на кость напрямую, но и из-за гиперактивации паращитовидных желез, где синтезируется паратгормон, который усиливает разрушение костей.
Сердечно-сосудистая система
Уже в начале 1980-х годов была обнаружена корреляция между увеличением частоты сердечно-сосудистых заболеваний и зимним временем, в которое не хватает витамина D. Однако физиологическая роль витамина D в этой системе до сих пор не ясна. Доминирующей гипотезой является воздействие на ренин-ангиотензиновую систему, повышающую давление, и кальциевые каналы. Так как в плазме ренин обратно пропорционален кальцитриолу, то чем меньше D3, тем выше уровень ренина и давления. Уверенность в этом появляется, как обычно бывает в биологии, после опытов на мышах с нокаутированным геном VDR, у них проявляются симптомы сердечной недостаточности: гипертрофия сердца, высокое кровяное давление и повышение уровня предсердного натрийуретического пептида [13], [14]. Также кальцитриол моделирует рост гладкомышечных и эндотелиальных клеток сосудов и активирует антитромботические гены, что логично уменьшает риск тромбозов [15]. С клинической точки зрения, дефицит витамина в сыворотке был связан с повышенным риском сердечно-сосудистых заболеваний и смерти в результате гипертонии, ишемической болезни сердца и инсульта.
Метаболизм липидов и глюкозы
Стоит сказать, что есть немало исследований, подтверждающих влияние кальцитриола на жировую ткань, некоторые показали отрицательную корреляцию между витамином D и лептином [16]. В основном, дефицит витамина увеличивает шанс развития ожирения, гипергликемии и дислипидемии, резистентности к инсулину, то есть повышает вероятность диабета 2 типа. Так, исследования на мышах показали, что у них наблюдаются проблемы с выделением инсулина в поджелудочной железе, ассоциированные со сниженным уровнем D3 [17].
Иммунная система
Во-первых, стоит сказать, что эффекты витамина на иммунную систему еще до конца не изучены, на данный момент считается, что он имеет противовоспалительный и противоаутоиммуный эффект (рис. 4).
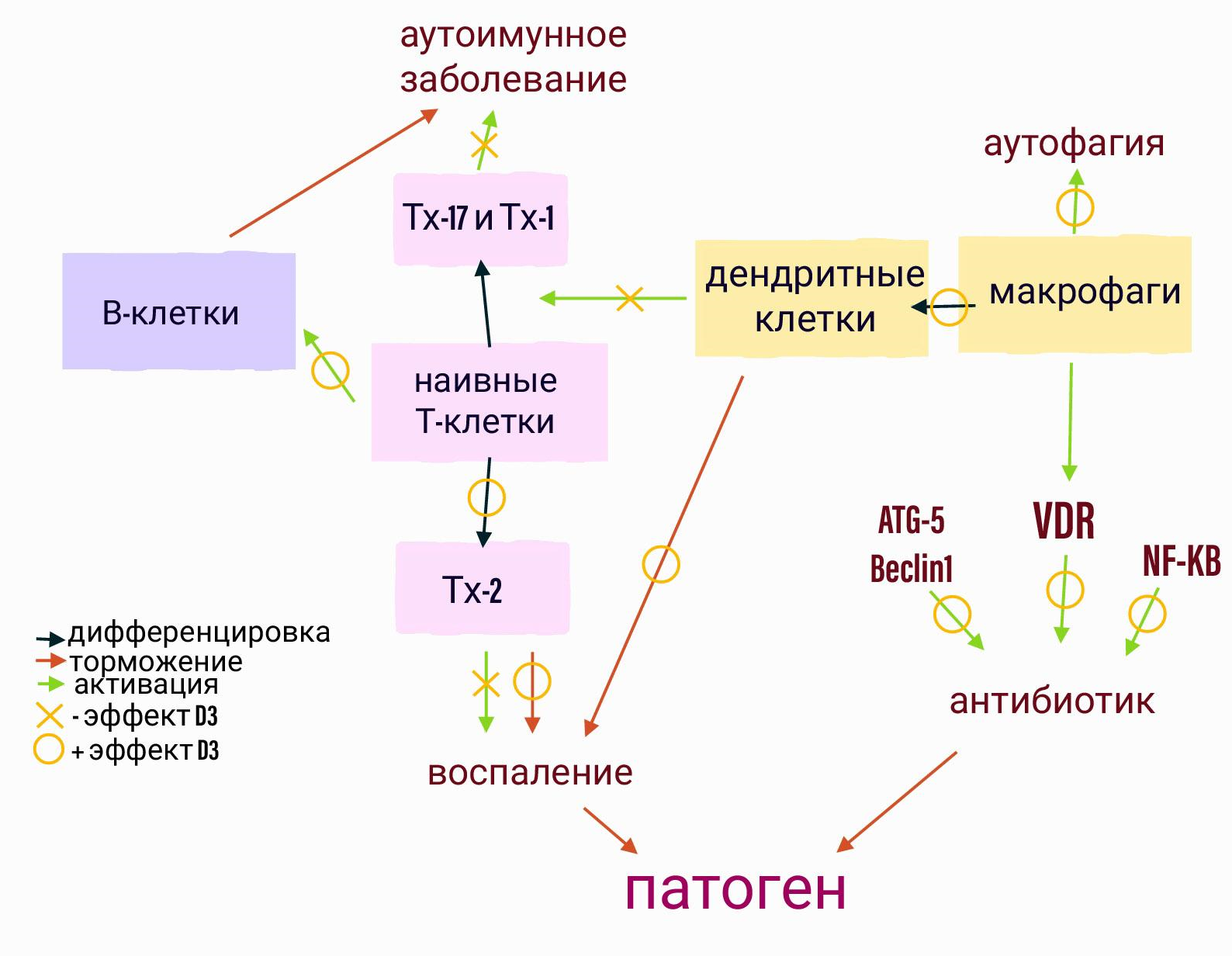
Рисунок 4. Эффекты витамина Д на иммунную систему.
рисунок автора статьи
За счет множества эффектов на разные части иммунной системы, витамин D3 подавляет развитие аутоиммунных заболеваний [18], [19].
Рассмотрим несколько примеров таких заболеваний и корреляции с приемом витамина D. Так, пациентам с ревматоидным артритом прием доз выше 50 000 МЕ облегчал боль, но это достаточно субъективное чувство, поэтому для выводов одного исследования маловато. В итогах другой работы описано, что вместе с кортикостероидами он понижал уровень провоспалительных интерлейкинов, выделяемых T-хелперами 17 и 1 типа [20]. Кроме того, у мышей с дефицитом VDR, рецептора D3, было обнаружено, что один из видов артрита протекает тяжелее, а в суставах обнаруживается больше макрофагов и фибробластов, чем у обычных крыс [21]. Дефицит витамина D также увеличивает шанс появления аутоиммунных эндокринных нарушений, включая тиреоидит Хашимото, сахарный диабет 1 типа, болезнь Аддисона и болезнь Грейвса [22]. Немаловажная связь обнаружена между низким уровнем витамина D и повышенным риском развития рассеянного склероза. Некоторые исследования показали, что повышение уровня D3 значительно снижает риск этой болезни [23].
Конечно же, снижением риска аутоиммунных заболеваний эффект витамина D не ограничивается. Противовоспалительный эффект опосредован подавлением выделения провоспалительных интерлейкинов Т- хелперов 2 типа и фактора некроза опухоли [24], и усиление выработки противовоспалительных интерлейкинов, и фактора транскрипции Fox3 [25].
Еще одним эффектом гормона служит усиление противомикробного ответа. Как недавно выяснили, активация макрофагов приводит к усиленной экспрессии VDR в их же клетках [26]. Далее комплекс VDR + кальцитриол в ядерном цитозоле связывается с определенным белком, который запускает продукцию антибиотиков, таких как кателицидин, кроме этого, витамин увеличивает влияние фактора транскрипции NF-kB и белков ATg-5, Beclin-1, которые также усиливают выделение антибиотиков [27]. При недостатке гормона ответ на туберкулез и подобные ему микробные заболевания ослабевает, это также влияет на ответ в кишечнике, легких, плаценте и коже [28–32]. Так что дисбактериоз в кишечнике может быть частично зависим от дефицита D3 в организме [33].
Так, с микробами разобрались, но помогает ли витамин D справиться с вирусами? На данный момент неизвестен точный механизм влияния D3 на вирусные заболевания [34]. Но точно известно, что доза в районе 3000–5000 МЕ снижает шанс простуды, гриппа и астмы [35], [36]. Также уровень витамина D в крови обратно коррелирует с тяжестью COVID-19, то есть, чем больше кальцитриола в крови, тем ниже шанс тяжелого течения заболевания [37]. Возможно, это происходит из-за легкого подавления ренин-ангиотензиновой системы и усиления противовирусной реакции за счет интерферона IFN. Интересная ситуация сложилась со связью ВИЧ и уровнем D3, сами по себе они не связаны, но определенные варианты ДНК VDR, которые хуже связывают витамин, повышают вероятность заразиться данным вирусом [34].
Послесловие
В итоге можно лишь сказать, что мы пока не знаем полный набор эффектов и не до конца понимаем, почему появляются некоторые болезни, связанные с витамином, но уже знаем его синтез и многие функции. Это все еще развивающаяся область исследований человека, которая, как мне кажется, приведет не к одному интересному ответу. А пока понятно, что он важен для всего тела и без него появляются серьезные проблемы со здоровьем. Так что в любое время стараемся есть жирную рыбу, зимой пьем витамины с D3, но не БАДы, а летом чаще выходим на улицу после обеда.
Литература
- A. Mithal, on behalf of the IOF Committee of Scientific Advisors (CSA) Nutrition Working Group, D. A. Wahl, J.-P. Bonjour, P. Burckhardt, et. al.. (2009). Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 20, 1807-1820;
- Rie B. Jäpelt, Jette Jakobsen. (2013). Vitamin D in plants: a review of occurrence, analysis, and biosynthesis. Front. Plant Sci.. 4;
- Laura Tripkovic, Helen Lambert, Kathryn Hart, Colin P Smith, Giselda Bucca, et. al.. (2012). Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. The American Journal of Clinical Nutrition. 95, 1357-1364;
- Daniel D. Bikle. (2014). Vitamin D Metabolism, Mechanism of Action, and Clinical Applications. Chemistry & Biology. 21, 319-329;
- T. Passeron, R. Bouillon, V. Callender, T. Cestari, T.L. Diepgen, et. al.. (2019). Sunscreen photoprotection and vitamin D status. Br J Dermatol. 181, 916-931;
- Federica Saponaro, Alessandro Saba, Riccardo Zucchi. (2020). An Update on Vitamin D Metabolism. IJMS. 21, 6573;
- Anika V. Prabhu, Winnie Luu, Laura J. Sharpe, Andrew J. Brown. (2017). Phosphorylation regulates activity of 7-dehydrocholesterol reductase (DHCR7), a terminal enzyme of cholesterol synthesis. The Journal of Steroid Biochemistry and Molecular Biology. 165, 363-368;
- Ying Meng, Ting Li, Gao-su Zhou, Yan Chen, Chang-Hui Yu, et. al.. (2015). The Angiotensin-Converting Enzyme 2/Angiotensin (1–7)/Mas Axis Protects Against Lung Fibroblast Migration and Lung Fibrosis by Inhibiting the NOX4-Derived ROS-Mediated RhoA/Rho Kinase Pathway. Antioxidants & Redox Signaling. 22, 241-258;
- Sanna-Mari Aatsinki, Mahmoud-Sobhy Elkhwanky, Outi Kummu, Mikko Karpale, Marcin Buler, et. al.. (2019). Fasting-Induced Transcription Factors Repress Vitamin D Bioactivation, a Mechanism for Vitamin D Deficiency in Diabetes. Diabetes. 68, 918-931;
- J G Haddad, L Y Matsuoka, B W Hollis, Y Z Hu, J Wortsman. (1993). Human plasma transport of vitamin D after its endogenous synthesis.. J. Clin. Invest.. 91, 2552-2555;
- Bonet, M.L.; Palou, A. Regulation of gene expression. In: Principles of Nutrigenetics and Nutrigenomics: Fundamentals of Individualized Nutrition / ed. By De Caterina R., Martinez J.A., Kohlmeier M.MA: Academic Press, 2019. P. 17–27;
- Heike A Bischoff-Ferrari, Douglas P Kiel, Bess Dawson-Hughes, John E Orav, Ruifeng Li, et. al.. (2009). Dietary Calcium and Serum 25-Hydroxyvitamin D Status in Relation to BMD Among U.S. Adults. Journal of Bone and Mineral Research. 24, 935-942;
- Yan Chun Li. (2003). Vitamin D regulation of the renin-angiotensin system. J. Cell. Biochem.. 88, 327-331;
- Songcang Chen, Christopher S. Law, Christopher L. Grigsby, Keith Olsen, Ting-Ting Hong, et. al.. (2011). Cardiomyocyte-Specific Deletion of the Vitamin D Receptor Gene Results in Cardiac Hypertrophy. Circulation. 124, 1838-1847;
- J. Ruth Wu-Wong, Masaki Nakane, Junli Ma, Xiaoan Ruan, Paul E. Kroeger. (2006). Effects of Vitamin D analogs on gene expression profiling in human coronary artery smooth muscle cells. Atherosclerosis. 186, 20-28;
- Edita Stokić, Aleksandar Kupusinac, Dragana Tomic-Naglic, Dragana Smiljenic, Branka Kovacev-Zavisic, et. al.. (2015). Vitamin D and Dysfunctional Adipose Tissue in Obesity. Angiology. 66, 613-618;
- Chantal Mathieu. (2015). Vitamin D and diabetes: Where do we stand?. Diabetes Research and Clinical Practice. 108, 201-209;
- Utako Ikeda, Daiko Wakita, Takayuki Ohkuri, Kenji Chamoto, Hidemitsu Kitamura, et. al.. (2010). 1α,25-Dihydroxyvitamin D3 and all-trans retinoic acid synergistically inhibit the differentiation and expansion of Th17 cells. Immunology Letters. 134, 7-16;
- Sheng Chen, Gary P. Sims, Xiao Xiang Chen, Yue Ying Gu, Shunle Chen, Peter E. Lipsky. (2007). Modulatory Effects of 1,25-Dihydroxyvitamin D3 on Human B Cell Differentiation. The Journal of Immunology. 179, 1634-1647;
- Wendy Dankers, Claudia González-Leal, Nadine Davelaar, Patrick S. Asmawidjaja, Adriana M. C. Mus, et. al.. (2018). 1,25(OH)2D3 and dexamethasone additively suppress synovial fibroblast activation by CCR6+ T helper memory cells and enhance the effect of tumor necrosis factor alpha blockade. Arthritis Res Ther. 20;
- Karin Zwerina, Wolfgang Baum, Roland Axmann, Gisela Ruiz Heiland, Jörg H Distler, et. al.. (2011). Vitamin D receptor regulates TNF-mediated arthritis. Ann Rheum Dis. 70, 1122-1129;
- Barbara Altieri, Giovanna Muscogiuri, Luigi Barrea, Chantal Mathieu, Carla V. Vallone, et. al.. (2017). Does vitamin D play a role in autoimmune endocrine disorders? A proof of concept. Rev Endocr Metab Disord. 18, 335-346;
- Kassandra L. Munger, Lynn I. Levin, Bruce W. Hollis, Noel S. Howard, Alberto Ascherio. (2006). Serum 25-Hydroxyvitamin D Levels and Risk of Multiple Sclerosis. JAMA. 296, 2832;
- Francesco Colotta, Birger Jansson, Fabrizio Bonelli. (2017). Modulation of inflammatory and immune responses by vitamin D. Journal of Autoimmunity. 85, 78-97;
- Zoë Urry, Emma S. Chambers, Emmanuel Xystrakis, Sarah Dimeloe, David F. Richards, et. al.. (2012). The role of 1α,25-dihydroxyvitamin D3 and cytokines in the promotion of distinct Foxp3+and IL-10+CD4+T cells. Eur. J. Immunol. 42, 2697-2708;
- P. T. Liu. (2006). Toll-Like Receptor Triggering of a Vitamin D-Mediated Human Antimicrobial Response. Science. 311, 1770-1773;
- Tomoka Ao, Junichi Kikuta, Masaru Ishii. (2021). The Effects of Vitamin D on Immune System and Inflammatory Diseases. Biomolecules. 11, 1624;
- K. E Nnoaham, A. Clarke. (2008). Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis. International Journal of Epidemiology. 37, 113-119;
- Siegfried Segaert. (2008). Vitamin D Regulation of Cathelicidin in the Skin: Toward a Renaissance of Vitamin D in Dermatology?. Journal of Investigative Dermatology. 128, 773-775;
- Adit A. Ginde, Jonathan M. Mansbach, Carlos A. Camargo. (2009). Association Between Serum 25-Hydroxyvitamin D Level and Upper Respiratory Tract Infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 169, 384;
- Nancy Liu, Lisa Nguyen, Rene F. Chun, Venu Lagishetty, Songyang Ren, et. al.. (2008). Altered Endocrine and Autocrine Metabolism of Vitamin D in a Mouse Model of Gastrointestinal Inflammation. Endocrinology. 149, 4799-4808;
- Sif Hansdottir, Martha M. Monick, Sara L. Hinde, Nina Lovan, Dwight C. Look, Gary W. Hunninghake. (2008). Respiratory Epithelial Cells Convert Inactive Vitamin D to Its Active Form: Potential Effects on Host Defense. The Journal of Immunology. 181, 7090-7099;
- Kun Zuo, Jing Li, Qiuhua Xu, Chaowei Hu, Yuanfeng Gao, et. al.. (2019). Dysbiotic gut microbes may contribute to hypertension by limiting vitamin D production. Clin Cardiol. 42, 710-719;
- Choongho Lee. (2020). Controversial Effects of Vitamin D and Related Genes on Viral Infections, Pathogenesis, and Treatment Outcomes. Nutrients. 12, 962;
- Mitsuyoshi Urashima, Takaaki Segawa, Minoru Okazaki, Mana Kurihara, Yasuyuki Wada, Hiroyuki Ida. (2010). Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. The American Journal of Clinical Nutrition. 91, 1255-1260;
- Peter Bergman, Anna-Carin Norlin, Susanne Hansen, Rokeya Sultana Rekha, Birgitta Agerberth, et. al.. (2012). Vitamin D3supplementation in patients with frequent respiratory tract infections: a randomised and double-blind intervention study. BMJ Open. 2, e001663;
- Mohamed Ben-Eltriki, Robert Hopefl, James M. Wright, Subrata Deb. (2022). Association between Vitamin D Status and Risk of Developing Severe COVID-19 Infection: A Meta-Analysis of Observational Studies. Journal of the American Nutrition Association. 41, 679-689.







