
Внеклеточная ДНК приподнимает завесу тайны беременности
23 февраля 2022
Внеклеточная ДНК приподнимает завесу тайны беременности
- 3011
- 1
- 1
Рисунок в полном размере.
рисунок Анастасии Трошиной
-
Автор
-
Редакторы
-
Рецензент
Статья на конкурс «Био/Мол/Текст»: Раньше диагностика плода во время беременности проводилась только при помощи инвазивных методов. Для этого специальными инструментами проходят через стенку матки и отбирают образец хориона, плаценты, околоплодных вод или крови ребенка, и этот процесс ассоциирован с риском выкидыша. Но все изменилось, когда исследователь Деннис Ло открыл ее — внеклеточную ДНК плода в плазме матери. С ее помощью стало возможно проводить широкие скрининговые исследования — и только беременных из группы риска отправлять на инвазивную диагностику. Из этой статьи вы узнаете историю метода пренатального неинвазивного тестирования, его возможности, а также в каких других смежных областях он сейчас используется.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Академия и бизнес» конкурса «Био/Мол/Текст»-2021/2022.
Эта работа заняла первое место в номинации «Академия и бизнес» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — BIOCAD.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Когда Деннис Ло, будучи еще студентом-медиком в Оксфорде в начале 1990-ых годов, проходил акушерское дело, его удивило, что до сих пор для пренатальной диагностики плода используются инвазивные техники, такие как биопсия хориона (получение образца ткани для анализа пункцией матки или через влагалище) или амниоцентез (получение образца околоплодных вод пункцией матки). И, хотя это сравнительно исследованные и безопасные методы [1], они все равно связаны с риском выкидыша [2] (меньше 0,2%, то есть около 2 беременностей из 1000 протестированных). «Разве мы не можем взять образец крови у матери и из него понять что-нибудь о ребенке?» — думал он.
В настоящее время методы, разработанные Деннисом Ло и его командой, широко используются для неинвазивного пренатального тестирования более чем в 60 странах [3]. Появление этого метода существенно снизило использование инвазивных методов [4]. В некоторых странах — например, с 2017 года в Нидерландах [5] — этот тест используется как рутинная скрининговая процедура для выявления трисомий у плода. Но при положительном результате теста все равно требуется подтверждение диагноза при помощи инвазивных методов.
Также этот метод широко исследуется и улучшается различными биотех-компаниями. Посвященные ему патенты зарегистрированы по всему миру и принадлежат крупным международным организациям: например, Illumina владеет 26 патентами, а Labcorp — 24. И на «Биомолекуле», кстати, уже выходил материал про одну из компаний, использующих сделанные Ло и его командой открытия, — Natera [6].

Рисунок 1. Распределение патентов по неинвазивному пренатальному тестированию по миру и между различными организациями.
отчет, созданный с помощью app.Cipher.ai. Рисунок адаптирован Анастасией Трошиной
В этой статье я подробно расскажу, в чем заключается неинвазивное тестирование плода при помощи одного только образца крови матери, какие особенности плода можно таким образом обнаружить и почему за этим методом — будущее современной диагностики. Еще я поговорила с самим профессором Ло, и он рассказал мне про свой путь в науке и бизнесе, а также про самые важные качества для исследователя.
Первые шаги в пренатальной диагностике
Для неинвазивного тестирования плода используется биохимический анализ крови матери — например, на хорионический гонадотропин, по уровню которого можно на ранних сроках определить гибель плода, внематочную беременность [7] или синдром Дауна [8]. Но точность этого теста не слишком высока: в первом триместре его чувствительность для синдрома Дауна достигает 65%, то есть только у 65 из 100 детей с синдромом Дауна его удается выявить при помощи этого метода [8]. Гораздо информативнее было бы исследование клеток ребенка — по ним можно понять и пол, и резус-фактор, и наличие каких-либо отклонений, однако откуда эти клетки можно взять, если не из самого плода? Тогда Деннис Ло подумал: а почему бы не попробовать найти их в крови матери?
Ему удалось убедить одного из профессоров начать этот проект, и спустя несколько месяцев у них при помощи ПЦР получилось найти среди клеток крови беременной женщины клетки, содержащие Y-хромосому (то есть мужские и, соответственно, принадлежащие плоду), а затем и просто Y-специфичную последовательность ДНК [9]. Однако этот метод требовал значительной доработки — из-за слишком маленького количества ДНК плода он был очень чувствителен к загрязнениям. Ло вновь обратился к нему во время своей аспирантуры, но существенных улучшений так и не добился, поэтому занялся клинической практикой.
В 1997 году Ло решил вернуться на родину, в Гонконг. По его мнению, это было подходящее время для нового старта — то есть для нового направления в его исследованиях. Как раз за пару месяцев до этого ему попалось несколько статей о том, что клетки опухоли выпускают в кровь свою ДНК, и ему пришло в голову, что ребенок очень похож на опухоль. Раз уж даже маленькие опухоли высвобождают в кровь достаточно ДНК, чтобы ее можно было обнаружить, то и ребенок уж точно должен! В этот момент Деннис Ло осознал, что все это время искал в неправильном месте — среди клеток крови, тогда как нужно было искать в жидкости, в которой эти клетки находятся — то есть в плазме крови.
Важная составляющая успеха профессора Ло — его потрясающая способность заряжать своих собеседников уверенностью, что его идея будет стоить вложенных в нее денег и ресурсов. Например, однажды у него было всего пять минут, чтобы по телефону убедить CEO (Chief Executive Officer, то есть главного исполнительного директора) компании, с которой сотрудничала его лаборатория, на покупку секвенатора — весьма дорогого прибора. «Безусловно, наличие идей для ученого очень важно. Но доступность ресурсов для их реализации еще важнее, и она целиком зависит от вашего умения обсуждать ваши идеи и убеждать остальных в их потенциале, — считает он. — Иногда у вас будет всего пять минут — или даже две минуты — и нужно уметь их правильно использовать».
В этом же году вышла его знаменитая статья про обнаружение свободной внеклеточной ДНК в плазме крови беременных женщин [10]. Из 43 обследованных женщин у 26 в плазме и сыворотке крови была обнаружена ДНК, специфичная для Y-хромосомы, и все 26 из них впоследствии родили сыновей. Еще 4 женщины родили сыновей, хотя тест для них был отрицательным, а оставшиеся 23 участницы родили дочерей. Результат был потрясающим: всего 10 микролитров плазмы матери хватало для 80% выявляемости (при использовании сыворотки крови — 70%), что было гораздо выше выявляемости при использовании клеток (17%). Конечно, уже тогда было ясно, что применение внеклеточной ДНК не исчерпывается одним лишь определением пола ребенка, и получение такого точного результата открыло широкие возможности в пренатальном тестировании.
Как пишет профессор Ло в своей статье, иронично, что ответ был найден в плазме и сыворотке — материалах, обычно отбрасываемых при исследованиях крови в то время [10].
Внеклеточная ДНК и где она обитает
В крови матери можно найти самые разные клетки плода: трофобласты, лейкоциты, эритроциты [11]. Конечно, какая-то часть внеклеточной ДНК плода в крови матери происходит из них [12], однако самая большая часть появляется из-за разрушения трофобластов путем апоптоза [13]. Также ДНК плода способна сама мигрировать через плаценту и таким образом попадать в кровь [14].
Обнаружить ДНК плода в плазме матери можно уже на 4 неделе беременности [15], однако более точными результаты становятся после 7 недели [16] — из-за увеличения ее количества из-за роста плода в течение беременности. На ранних сроках в одном миллилитре материнской плазмы содержится 25,4 геномных наборов ребенка, тогда как на поздних — уже 292,2 [17]. К последним неделям количество ДНК плода достигает 10–20% от всей свободной ДНК в плазме матери [18], однако эти цифры очень сильно зависят от метода экстракции ДНК, времени хранения и транспортировки — чем больше материнских клеток крови разрушается во время этих процессов, тем сложнее детектировать ДНК плода в образце.
Существуют и другие факторы, затрудняющие анализ — например, ожирение матери [19], беременность близнецами [20], гибель одного ребенка при многоплодной беременности [21], пересаженные матери органы и перелитая ей кровь [21] или рак. Опухоли — постоянный источник внеклеточной ДНК в крови пациента, поэтому их наличие также может существенно повлиять на результат. Однажды одна беременная женщина прислала свой образец крови в лабораторию Ло, и во время анализа внеклеточной ДНК из этого образца обнаружилось, что она содержит очень много хромосомных аберраций. После дополнительных исследований выяснилось, что эта ДНК принадлежит не ребенку, а матери, и происходит из B-клеточной лимфомы.
Несмотря на эти особенности, внеклеточная ДНК является очень удобным объектом для пренатального тестирования из-за неинвазивности, точности и доступности анализа уже в первом триместре (первое скрининговое УЗИ проводится во втором). Также очень удобно то, что внеклеточная ДНК плода быстро пропадает из крови матери после родов: ее невозможно обнаружить уже через две недели [22]. Впрочем, в одном исследовании было показано, что внеклеточная ДНК плода остается в плазме матери на куда более долгий срок: в 35% образцов плазмы женщин, которые родили мальчиков от 1 года до 60 лет назад, была найдена ДНК Y-хромосомы [23]. Однако еще раз этот результат повторить не удалось, поэтому, вероятно, такие внушительные цифры были вызваны загрязнением образцов из-за выбранного метода экстракции ДНК [24]. Так что можно быть уверенным, что внеклеточная ДНК плода, найденная в течение текущей беременности, принадлежит именно этому ребенку, а не предыдущему. Тем не менее, после получения положительного результата все равно требуется подтверждение диагноза при помощи инвазивных методов.
Внеклеточная ДНК и тестирование плода
Конечно же, проще всего с помощью внеклеточной ДНК выявлять у плода те последовательности, которых у матери совершенно точно нет: например, определять пол по наличию Y-хромосомы или выявлять положительный резус-фактор, если у матери он отрицательный (рис. 2).
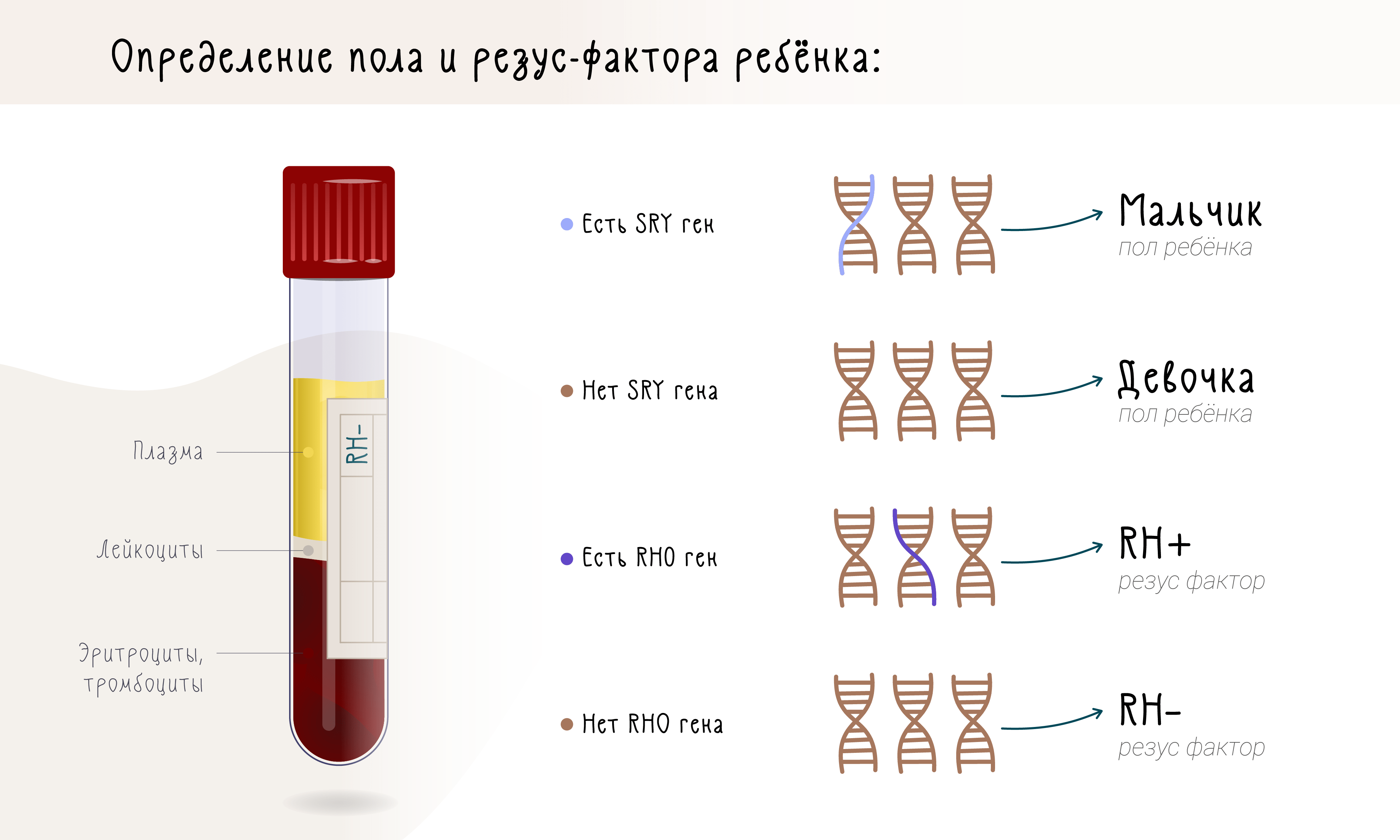
Рисунок 2. Определение пола и резус-фактора ребенка.
рисунок Анастасии Трошиной
Сейчас пол ребенка рутинно определяется во время ультразвуковых исследований во время второго триместра, но использование внеклеточной ДНК плода позволяет определить его еще в первом. Таким образом можно рано диагностировать наличие у плода сцепленных с X-хромосомой заболеваний: например, гемофилию или миодистрофии Дюшенна. Это может быть особенно важно для беременностей с высоким риском рождения подобных детей.
Определение же резус-фактора ребенка важно для наблюдения резус-конфликтных беременностей. Подробнее об этом явлении можно прочитать в статье «Биомолекулы» «„Кровавая“ работа врачей, ученых и природы» [25]. Принцип здесь точно такой же, как с определением пола: если мать — резус-отрицательная, но среди внеклеточной ДНК в ее плазме нашли неповрежденный ген RHD, это означает, что ребенок будет резус-положительным (рис. 2).
Однако чаще всего неинвазивное тестирование плода используется не для определения пола и резус-фактора плода, а для скрининга на наличие анеуплоидий — изменений количества хромосом, при котором оно не кратно двадцати трем.
В каждой клетке человека, за исключением гамет, содержится 46 хромосом: половина от отца, половина от матери. В яйцеклетке и сперматозоиде же только по 23 хромосомы: во время своего образования они претерпевают мейотическое деление (редукционное), в результате которого хромосомы из одной пары расходятся по разным клеткам. Потом во время оплодотворения гаметы сливаются, и зигота получает стандартный набор хромосом. Но иногда что-то идет не так и в гаметы попадает больше хромосом, чем нужно: например, не одна восемнадцатая хромосома, а две. Тогда после оплодотворения зигота будет обладать тройным набором восемнадцатых хромосомом вместо нормального двойного. Такие случаи называются трисомиями и, в зависимости от номера лишней хромосомы, влекут за собой разнообразные проблемы со здоровьем. В основном при помощи неинвазивного пренатального тестирования детектируют трисомии по 21 хромосоме (синдром Дауна), по 18 хромосоме (синдром Эдвардса) и по 13 хромосоме (синдром Патау).
Анеуплоидии (в том числе трисомии) встречаются у людей очень часто: примерно у 0,3% рожденных детей, и еще 35% всех беременностей заканчивается спонтанным абортом, вызванным анеуплоидией плода [26]. Большинство таких случаев происходит из-за ошибок во время мейоза при образовании яйцеклеток — женских половых клеток. На количество этих ошибок влияет множество факторов, в том числе курение [27], экзогенные гормоны и возраст матери [26]. Что интересно, на вероятность нерасхождения разных хромосом эти факторы влияют по-разному: например, зависимость возраста матери и вероятности трисомии по 16 хромосоме практически линейная, тогда как для 18 и 21 хромосом — экспоненциальная [26]. Таким образом, частота анеуплоидий по разным хромосомам неодинаковая.
В случае разрушения клеток, обладающих лишней хромосомой, в кровь матери будет попадать больше ДНК из этой хромосомы, по сравнению с другими хромосомами. Соответственно, измеряя относительные количества генетического материала из разных хромосом, можно выявить наличие лишней хромосомы (рис. 3).
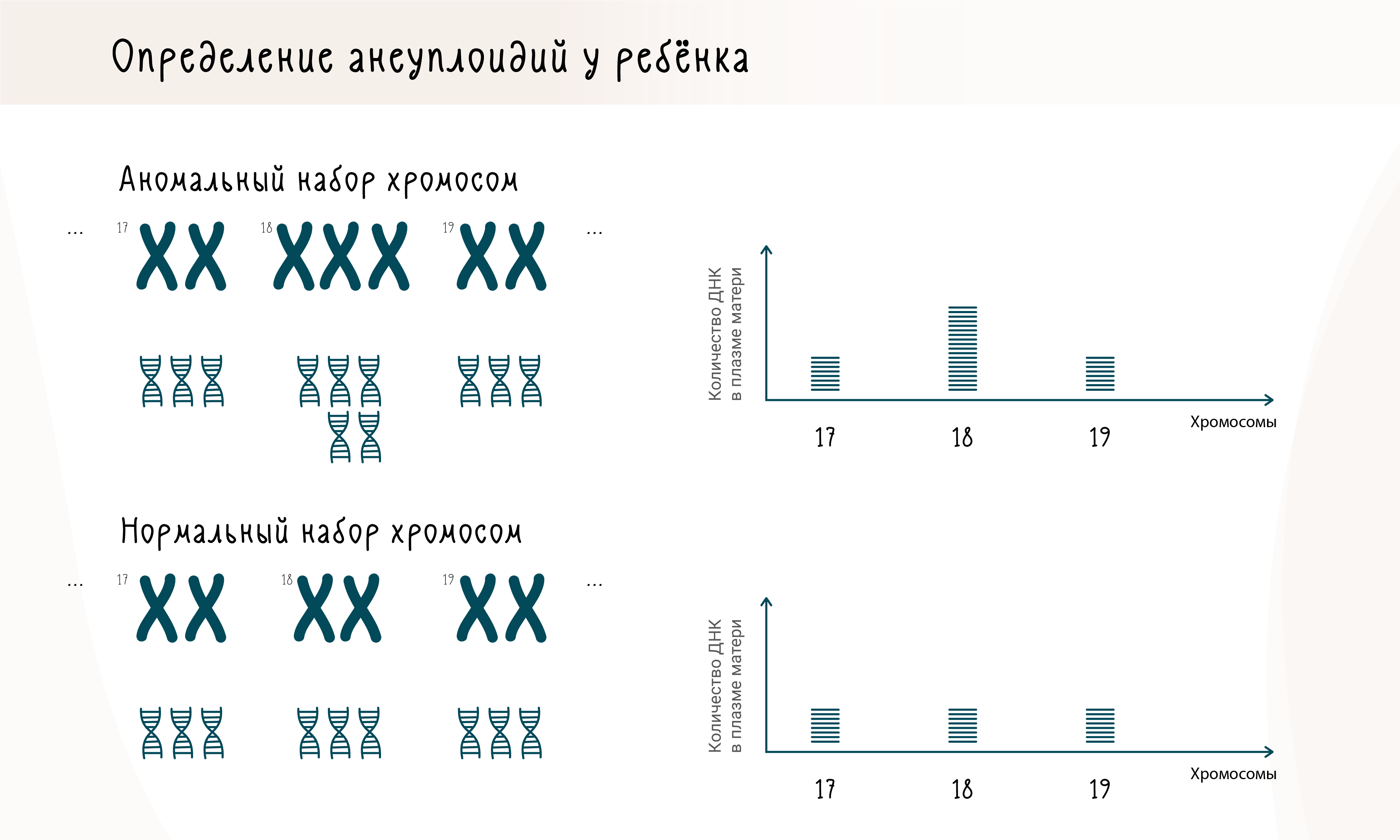
Рисунок 3. Выявление анеуплоидий у плода.
рисунок Анастасии Трошиной
Первые статьи об этом методе начали выходить в 2007 году [28], [29]. Конкуренция была нешуточная: хотя группа профессора Ло выпустила свою статью первой [28], вторая статья на эту тему от группы Куэйка, профессора Стэнфордского университета, вышла всего на два месяца позже [29], а на деле обе статьи были отправлены в редакцию журналов в один день — 9 мая. История повторилась в 2010 году [30], [31]: статьи Ло и Куэйка вышли в один день. То же самое случилось с патентами: Гонконгский университет продал лицензию на патент компании Sequenom, а Стэнфордский — компании Verinata Health, которую затем приобрела Illumina. Теперь соперничество продолжилось уже между двумя этими компаниями, но в результате вылилось в создание единого пакета патентов, лицензиат которого имеет право на проведение неинвазивного пренатального тестирования.
Поначалу авторам самого первого патента, посвященного неинвазивному пренатальному тестированию, в числе которых был профессор Ло, не везло. Лицензию на патент приобрела американская компания, однако она не сумела распознать его потенциал — поэтому спустя три бесплодных года лицензия вернулась к Гонконгскому университету. Вскоре Ло встретил на конференции Чарльза Кантора — одного из создателей компании Sequenom. Доклад Кантора был посвящен масс-спектрометрии, и Ло понял, что этот метод можно применять для определения количества ДНК в образце. После выступления он подошел к Кантору и пригласил его на свой доклад. Они написали несколько совместных статей, а затем Sequenom приобрел лицензию на несколько патентов группы Ло — в том числе и на тот, самый первый. «Иногда мир еще не готов к вашей технологии, — прокомментировал профессор Ло эту историю во время нашего разговора. — Но нужно быть настойчивым. И однажды ваше время придет».
К 2011 году закончился ряд масштабных клинических испытаний (Noninvasive Screening for Fetal Aneuploidy: A New Maternal Plasma Marker, Non-Invasive Screening for Fetal Aneuploidy, A New Prenatal Blood Test for Down Syndrome, Non-Invasive Screening for Fetal Aneuploidy: A New Maternal Plasma Marker, MatErnal BLood IS Source to Accurately Diagnose Fetal Aneuploidy, MELISSA), и вскоре технология наконец-то стала доступна на рынке — причем сразу от нескольких компаний. Воспользоваться этой услугой можно было в коммерческих медцентрах, а в одной из клиник Гонконга она была доступна бесплатно — по настоянию профессора Ло. Кстати, сейчас существуют еще несколько альтернатив этому методу (впрочем, все они основаны на использовании внеклеточной ДНК из плазмы беременной женщины): компания Natera использует метод, основанный на детекции полиморфизмов единичных нуклеотидов (о нем на «Биомолекуле» уже есть подробная статья [6]), а LifeCodexx использует метил-чувствительные ферменты, чтобы отличить материнскую ДНК от ДНК плода.
В истоках одной из компаний, которая сейчас предлагает неинвазивное пренатальное тестирование, стоял сам профессор Ло. Компания Xcelom была основана в 2014 году. С того времени она запустила несколько новых тестов, как с использованием внеклеточной ДНК (например, тест на синдром Мартина—Белла), так и других технологий (например, на пищевые аллергии при помощи определения IgE в крови), а в декабре 2020 года был выпущен ПЦР-тест на COVID-19 [32].
В России будущие мамы начиная с 11 недели беременности тоже могут воспользоваться неинвазивным пренатальным тестированием. Оно позволяет определить пол плода и протестировать его на все те же синдром Дауна, синдром Эдвардса и синдром Патау, а также синдром Шерешевского—Тернера, анеуплоидии половых хромосом. Как и в Нидерландах, в случае положительного результата теста требуется подтверждение диагноза инвазивными методами.
Между тем, определение анеуплоидий — не предел неинвазивного пренатального тестирования. С помощью ДНК плода, найденной в плазме матери, можно определить, какие варианты генов он унаследовал!
Совокупность вариантов генов, унаследованных от одного родителя, называется гаплотипом. Впрочем, это очень многозначное слово: также оно может означать сочетание вариантов генов, находящихся на одной хромосоме и из-за этого обычно наследуемых совместно. Термин этот происходит от слов «гаплоидный» (то есть обладающий одним набором хромосом) и «генотип». Так как ребенок получает по одному набору хромосом от каждого родителя, чтобы понять, унаследует ли ребенок генетическое заболевание, достаточно определить, получил ли он мутированный вариант гена от родителя-носителя. Таким образом, можно обойтись без полной сборки генома ребенка для определения унаследованных им генетических особенностей.
Но даже и без полной сборки генома плода это крайне нетривиальная задача. Во-первых, ДНК плода очень сильно фрагментирована: 99% внеклеточной ДНК плода короче 313 пар оснований, тогда как средняя длина материнской внеклеточной ДНК составляет 400–500 пар оснований [32]. Этой разницей даже пользуются, чтобы отсеять потенциальные материнские последовательности и таким образом сильнее сконцентрировать образец ДНК плода [32] (то есть повысить его содержание в образце относительно ДНК матери). Во-вторых, половина генома плода будет очень похожа на геном матери — и будет сложно отличить, откуда какие последовательности родом. И в-третьих, доля ДНК плода среди всей внеклеточной ДНК из плазмы матери довольно маленькая, что автоматически затрудняет точный анализ.
И все же Ло и его группа сумели придумать остроумное решение. По словам профессора Ло, этот способ пришел ему в голову, когда он пошел в кино на одну из частей «Гарри Поттера». Они с женой сидели в темноте в 3D очках, и тут вдруг им в лицо вылетела гигантская буква «H» — из слова Harry. Эта «H» — очень похожая на пару хромосом, одна от папы, другая от мамы — вдохновила профессора Ло на идею, которую он обдумывал оставшиеся три часа, а сразу по возвращении домой написал своей группе, что же следует сделать.
Статья об этом методе вышла в 2010 году в журнале Science Translational Medicine [30]. Авторы сравнили ДНК матери и отца и выделили пять категорий:
- когда отец и мать оба гомозиготны, но каждый по разному аллелю;
- когда отец и мать оба гомозиготны по одному аллелю;
- когда отец гетерозиготен, а мать гомозиготна;
- когда отец гомозиготен, а мать гетерозиготна;
- когда оба родителя гетерозиготны.
Для каждой категории требуется свой алгоритм (рис. 4). В случае первой и второй категории все понятно: ребенок будет гетерозиготой и гомозиготой, соответственно. Для третьей категории анализ проводится путем поиска среди внеклеточной ДНК отцовского аллеля, отличного от материнского: если он был найден, значит, ребенок — гетерозигота, если нет — гомозигота. Для четвертой категории нужен анализ относительной доли гаплотипов: если во внеклеточной ДНК доли полиморфизмов равны, то ребенок гетерозигота; если доля одного полиморфизма выше доли другого полиморфизма — то гомозигота по тому аллелю, доля которого выше. Вычисление гаплотипа ребенка для пятой категории полиморфизмов не проводилось из-за недостатка данных об отцовском гаплотипе, однако нетрудно представить, что он будет очень похож на анализ для четвертой категории.
(Конечно же, в тот же день вышла статья профессора Куэйка на похожую тему [31]).
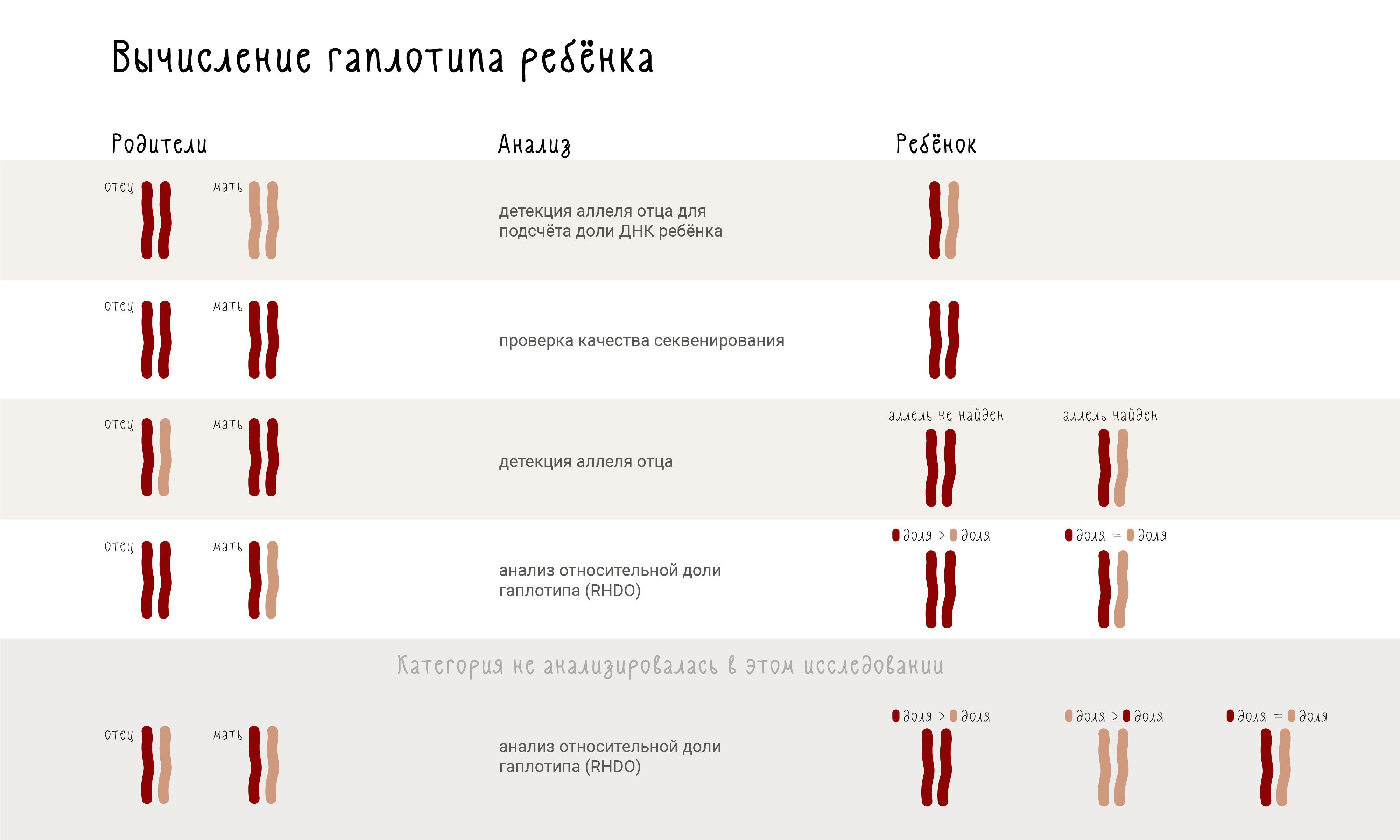
Рисунок 4. Вычисление гаплотипа ребенка.
рисунок Анастасии Трошиной
Описанный метод полностью игнорирует возможность появления у ребенка de novo — то есть новых, а не унаследованных — мутаций (впрочем, их немного — в среднем всего 74 однонуклеотидных замен [33], около 3 замен на 1000 генов). Но на самом деле при должной точности секвенирования их можно определить тоже: в статье [34] из 44 de novo мутаций авторы сумели найти 39. Однако уровень шума был гигантский: на каждую правильно определенную de novo мутацию они нашли 6,4 * 105 потенциальных кандидатов. После фильтрации результатов авторам удалось снизить уровень шума примерно до 4,6 * 105, а с помощью дальнейшего отсеивания подозрительных случаев у них получилось уменьшить количество кандидатов до 3884, но при этом 22 реальных случая были отброшены. Таким образом, метод до сих пор не очень надежный: очень уж высок уровень ложноположительных результатов. Хотя в реальных клинических условиях совсем не обязательно найти все de novo мутации, достаточно правильно предсказать потенциально вредные. Их же будет гораздо меньше: к примеру, из 3884 мутаций только 33 изменяют аминокислотную последовательность, и еще меньше — ассоциированы с генетическими заболеваниями.
Конечно, за статьей последовал патент. Он принадлежит Китайскому университету Гонконга и Sequenom. В 2016 году Sequenom был куплен LabCorp — за 371 миллион долларов. Пока что полное определение генома плода не предоставлено среди тестов LabCorp; тем не менее, видимо, все еще впереди. Впрочем, пока мы недостаточно знаем о влиянии конкретных мутаций на наше здоровье: быть может, сейчас слишком рано для того, чтобы родителям был доступен гаплотип их ребенка еще до его рождения [35].
Очевидно, важную часть этого рассказа занимают патенты. Ученые не всегда склонны уделять им достаточное количество внимания и патентовать свои изобретения. Деннис Ло придерживается противоположного мнения. «Наука — это очень весело, — сказал он мне. — Но в первую очередь я — доктор. Я хочу помочь своим пациентам». В современном мире же, по его мнению, это можно сделать только при использовании патентов и клинических испытаний.
Внеклеточная ДНК: все, что хочешь, расскажу
Когда профессор Ло только начинал заниматься использованием внеклеточной ДНК в молекулярной диагностике, он сразу решил развивать два направления параллельно: пренатальную диагностику и диагностику рака. Первое направление «выстрелило» раньше, однако и на почве диагностики рака его группа добилась крупных успехов.
То, что опухоль выделяет ДНК в кровь больного онкологическим заболеванием, известно довольно давно [36]. Однако хватит ли этого количества ДНК для детекции первых, протекающих бессимптомно стадий рака? Раннее обнаружение рака очень важно: лучше всего он поддается лечению именно на первых стадиях, когда опухоль еще маленькая и не пустила метастазы. Для уточнения этого вопроса группа Ло провела масштабные испытания с участием более чем 20 100 испытуемых.
В качестве модельного вида рака они выбрали рак носоглотки. Этот тип рака очень распространен в Южном Китае: в некоторых регионах в год им заболевает около 35 человек на 100 000 [37]. С ним тесно связан вирус Эпштейна—Барр: экспрессия некоторых вирусных белков провоцирует пролиферацию клетки-хозяина, ее рост и устойчивость к апоптозу, однако до конца механизм этой ассоциации еще не ясен [38]. Было показано, что ДНК этого вируса в крови пациента может служить надежным маркером присутствия опухоли [39]. Как и для многих других видов рака, раннее обнаружение опухоли в носоглотке способствует лучшей выживаемости: она равна 90% для пациентов с первой стадией рака и всего 58% для пациентов с четвертой стадией [40]. Но из-за отсутствия симптомов на первых стадиях этот вид рака редко удается поймать вовремя на скрининговых исследованиях: в Гонконге только 5,4% случаев приходится на первую стадию и 12,8% — на вторую, тогда как на третью — 47,5%, а 28,5% — на четвертую.
Используя внеклеточную ДНК из плазмы пациентов из группы риска, Ло и его группе удалось существенно улучшить эти показатели: 70% случаев было обнаружено на первой и второй стадии, а выживаемость возросла с 70% до 97% [41]. Чувствительность теста и отрицательная прогностическая ценность составили 97,1% и 99,995%, соответственно (из почти 20 тысяч пациентов с отрицательным результатом только у одного спустя год нашли рак носоглотки, а из 10 тысяч пациентов только 5 получили ложноотрицательный результат). Положительная прогностическая ценность оказалась, конечно, гораздо ниже — всего 11%, но такие низкие показатели типичны для скрининговых исследований рака, проводимых среди бессимптомной популяции (и это выше прогностической ценности, продемонстрированной при использовании комбинаций биохимических онкомаркеров, 2–4%) [42]. Также по количеству внеклеточной ДНК вируса в плазме пациента можно было не только детектировать рак, но и отслеживать успех лечения и возможные рецидивы: по мере лечения количество ДНК вируса в плазме уменьшалось, а в случае рецидива — снова росло.
Конечно же, детекцией одного только рака носоглотки возможности внеклеточной ДНК не ограничиваются.
- Используя вариации числа копий, конкретные мутации [43], характерные эпигеномные метки [44], можно проводить скрининговые исследования нормальной популяции для поиска пациентов из группы риска (хотя потом, опять же, все равно потребуются дополнительные процедуры из-за низкой положительной прогностической ценности). Было показано, что ассоциированные с раком мутации во внеклеточной ДНК можно обнаружить на ранней стадии заболевания, до появления симптомов и даже за два года до постановки диагноза [45].
- При помощи детекции определенных мутаций возможно сразу предложить более подходящее лечение или диагностировать устойчивость рака к терапии [45]. В 2016 году FDA (Американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов) уже одобрило EGFR Mutation Test v.2, который врачи используют для подбора терапии для больных раком легких [46].
- Так как количество внеклеточной опухолевой ДНК быстро уменьшается по мере лечения и снова возрастает в случае рецидива, можно отслеживать успешность терапии или возвращение болезни [45].
Но обнаружение и наблюдение за опухолями — это лишь верхушка айсберга (рис. 5). Донор-специфичная ДНК в плазме реципиента будет указывать на отторжение трансплантата [47–49]. Бактериальная ДНК в плазме пациента свидетельствует о бактериемии [50]. По количеству внеклеточной ДНК в плазме пациента с травмой можно судить о серьезности травмы и темпах его выздоровления [51], [52]. С уровнем внеклеточной ДНК ассоциированы возраст и ухудшение состояния здоровья при старении [53]. После инсульта количество внеклеточной ДНК коррелирует с тяжестью повреждений и отеком мозга [54] и долгосрочными последствиями для больного [55]. И, конечно же, повышенный уровень внеклеточной ДНК может быть связан с аутоиммунными заболеваниями: уже есть исследования про системную красную волчанку [56] и сахарный диабет [57].
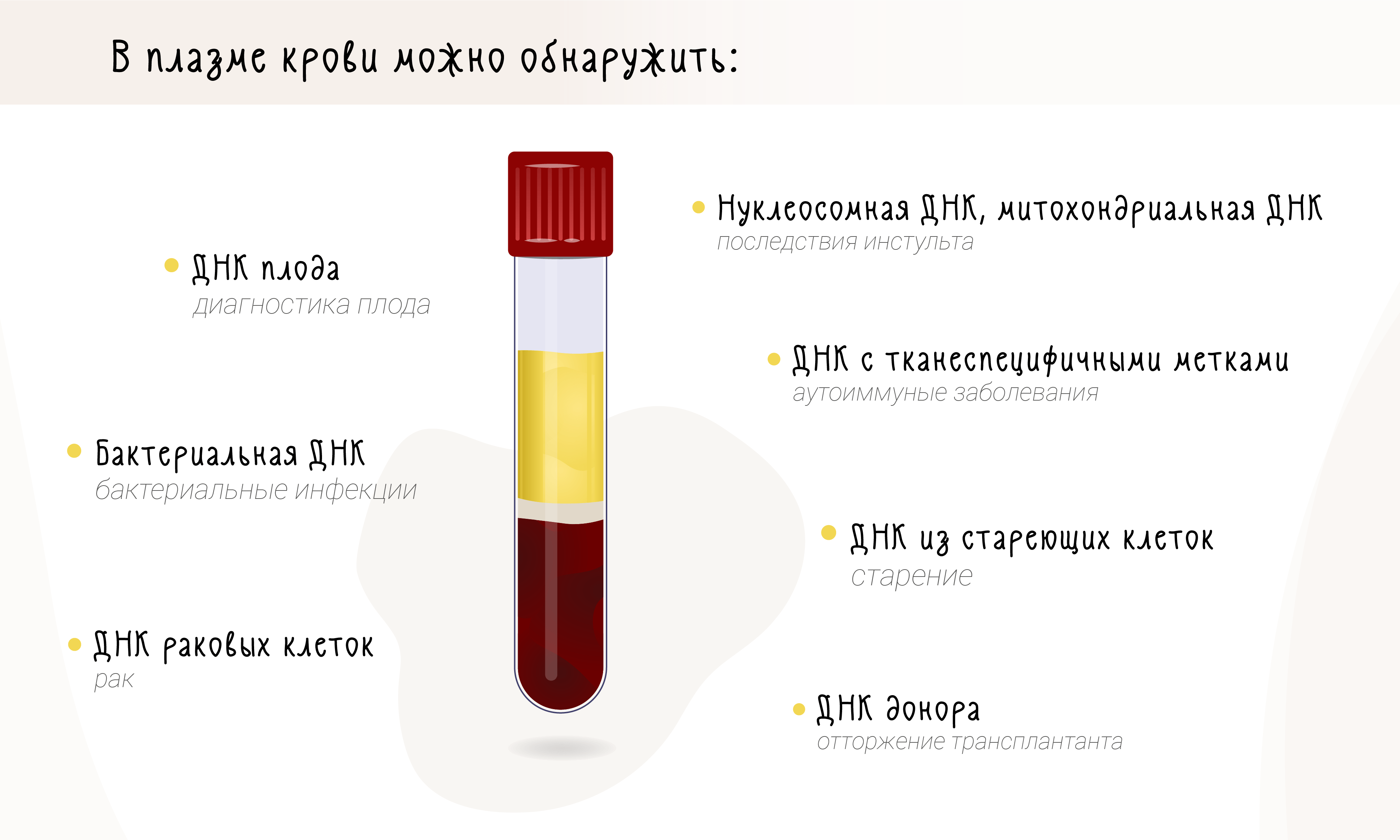
Рисунок 5. Возможности молекулярной диагностики с использованием внеклеточной ДНК.
рисунок Анастасии Трошиной
Безусловно, возникает вопрос: если уровень внеклеточной ДНК коррелирует со всеми болезнями на свете, как по нему можно что-то диагностировать? Дело в том, что внеклеточная ДНК, попадающая в плазму пациента, разная для разных заболеваний! Именно поэтому команде профессора Ло удалось отличить ДНК плода от ДНК опухоли у беременной женщиныс развивающейся В-клеточной лимфомой. Во-первых, ДНК из плазмы пациентки была с большими хромосомными аберрациями, а это очень похоже на ДНК опухоли. Во-вторых, ее эпигеномный профиль соответствовал лейкоцитарному, а значит — источником были лейкоциты. Подробнее об основных концепциях эпигенетики можно прочитать в статьях спецпроекта «Биомолекулы» «Эпигенетика», в том числе про регуляцию генов при помощи метильных меток.
По метильным меткам на ДНК можно определить, из какой ткани эта внеклеточная ДНК родом. Этот подход называется плазма-ДНК-тканевым картированием, и с его помощью можно локализовать интенсивно разрушающиеся клетки (и, соответственно, интенсивно выпускающие в кровь свою ДНК) [44]. Например, если ДНК происходит из бета-клеток, это может свидетельствовать о развивающемся диабете первого типа, а если из нейронов — о повреждении мозга. Уже существуют методы определения внеклеточной ДНК из четырех типов тканей всего по шести маркерам [58]. В перспективе это может привести нас к высокочувствительному тесту для выявления повреждения ткани без предшествующего подозрения на него всего по одному образцу крови!
Диагностикой рака при помощи плазма-ДНК-тканевого картирования занималась вторая компания профессора Ло, Cirina. Она тоже была основана в 2014 году — как и Xcelom. На старте своего пути Cirina собрала 12 миллионов долларов инвестиций. Примерно в то же время в США был основан GRAIL — схожий по целям и методам стартап. В 2017 году эти две компании провели слияние, а через три года их выкупила Illumina — за 8 миллиардов долларов. В ноябре 2020 года GRAIL при поддержке британского правительства запустила испытания своего теста по ранней детекции более чем 50 типов рака — Galleri — всего по одному образцу крови. Моделирование показывает, что включение Galleri в стандартное медицинское обслуживание снизит количество рака, диагностируемого на поздних стадиях, почти наполовину, а смертность от рака в Великобритании — примерно на одну пятую.
Кросс-реактивность науки
Выше я уже приводила мнение профессора Ло про личные качества успешного ученого: он должен уметь рассказывать о своих идеях, быть настойчивым и не опускать руки, даже когда открытый им метод пылится на полке неиспользуемых патентов... Но иногда бывает полезным еще одно свойство.
«Вы должны уметь распознавать сходство между разными научными областями», — отмечает профессор Ло.
Например, между методами изучения рака и диагностикой плода во время беременности. Или между приобретенным иммунитетом у бактерий и генетической инженерией. И, конечно же, между сверлящим свойством взгляда и филологическими характеристиками слова «бетон».
Литература
- Bruno Brambati, Alessandro Lanzani, Lucia Tului. (1990). Transabdominal and transcervical chorionic villus sampling: Efficiency and risk evaluation of 2,411 cases. Am. J. Med. Genet.. 35, 160-164;
- R. Akolekar, J. Beta, G. Picciarelli, C. Ogilvie, F. D'Antonio. (2015). Procedure‐related risk of miscarriage following amniocentesis and chorionic villus sampling: a systematic review and meta‐analysis. Ultrasound Obstet Gynecol. 45, 16-26;
- Megan Allyse, Mollie Minear, Margaret Rote, Anthony Hung, Subhashini Chandrasekharan, et. al.. (2015). Non-invasive prenatal testing: a review of international implementation and challenges. IJWH. 113;
- Shilpa Chetty, Matthew J. Garabedian, Mary E. Norton. (2013). Uptake of noninvasive prenatal testing (NIPT) in women following positive aneuploidy screening. Prenat Diagn. 33, 542-546;
- Karuna R.M. van der Meij, Erik A. Sistermans, Merryn V.E. Macville, Servi J.C. Stevens, Caroline J. Bax, et. al.. (2019). TRIDENT-2: National Implementation of Genome-wide Non-invasive Prenatal Testing as a First-Tier Screening Test in the Netherlands. The American Journal of Human Genetics. 105, 1091-1101;
- Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту;
- Grosskinsky C.M., Hage M.L., Tyrey L., Christakos A.C., Hughes C.L. (1993). hCG, progesterone, alpha-fetoprotein, and estradiol in the identification of ectopic pregnancy. Obstetrics and Gynecology. 81, 705–709;
- Platt L.D. Protocols for High-Risk Pregnancies, 5th edition.Blackwell Publishing Ltd., 2010. — 680 p.;
- Y-M.D. Lo, J.S. Wainscoat, M.D.G. Gillmer, P. Patel, M. Sampietro, K.A. Fleming. (1989). PRENATAL SEX DETERMINATION BY DNA AMPLIFICATION FROM MATERNAL PERIPHERAL BLOOD. The Lancet. 334, 1363-1365;
- Y M Dennis Lo, Noemi Corbetta, Paul F Chamberlain, Vik Rai, Ian L Sargent, et. al.. (1997). Presence of fetal DNA in maternal plasma and serum. The Lancet. 350, 485-487;
- D. W. Bianchi, A. F. Flint, M. F. Pizzimenti, J. H. Knoll, S. A. Latt. (1990). Isolation of fetal DNA from nucleated erythrocytes in maternal blood.. Proceedings of the National Academy of Sciences. 87, 3279-3283;
- Akihiko Sekizawa, Osamu Samura, DongKai Zhen, Vincent Falco, Antonio Farina, Diana W. Bianchi. (2000). Apoptosis in fetal nucleated erythrocytes circulating in maternal blood. Prenat. Diagn.. 20, 886-889;
- M. Alberry, D. Maddocks, M. Jones, M. Abdel Hadi, S. Abdel-Fattah, et. al.. (2007). Free fetal DNA in maternal plasma in anembryonic pregnancies: confirmation that the origin is the trophoblast. Prenat. Diagn.. 27, 415-418;
- Akihiko Sekizawa, Kaori Yokokawa, Yumi Sugito, Mariko Iwasaki, Yasuo Yukimoto, et. al.. (2003). Evaluation of bidirectional transfer of plasma DNA through placenta. Human Genetics. 113, 307-310;
- S. Illanes, M. Denbow, C. Kailasam, K. Finning, P.W. Soothill. (2007). Early detection of cell-free fetal DNA in maternal plasma. Early Human Development. 83, 563-566;
- Stephanie A. Devaney, Glenn E. Palomaki, Joan A. Scott, Diana W. Bianchi. (2011). Noninvasive Fetal Sex Determination Using Cell-Free Fetal DNA. JAMA. 306;
- Y. M. Dennis Lo, Mark S.C. Tein, Tze K. Lau, Christopher J. Haines, Tse N. Leung, et. al.. (1998). Quantitative Analysis of Fetal DNA in Maternal Plasma and Serum: Implications for Noninvasive Prenatal Diagnosis. The American Journal of Human Genetics. 62, 768-775;
- Fiona M F Lun, Rossa W K Chiu, K C Allen Chan, Tak Yeung Leung, Tze Kin Lau, Y M Dennis Lo. (2008). Microfluidics Digital PCR Reveals a Higher than Expected Fraction of Fetal DNA in Maternal Plasma. Clinical Chemistry. 54, 1664-1672;
- Neeta L. Vora, Kirby L. Johnson, Subhabrata Basu, Patrick M. Catalano, Sylvie Hauguel-De Mouzon, Diana W. Bianchi. (2012). A multifactorial relationship exists between total circulating cell-free DNA levels and maternal BMI. Prenat Diagn. 32, 912-914;
- George Attilakos, Deborah G. Maddocks, Teresa Davies, Linda P. Hunt, Neil D. Avent, et. al.. (2011). Quantification of free fetal DNA in multiple pregnancies and relationship with chorionicity. Prenat. Diagn.. 31, 967-972;
- Diana W. Bianchi, Saba Parsa, Sucheta Bhatt, Meredith Halks-Miller, Kathryn Kurtzman, et. al.. (2015). Fetal Sex Chromosome Testing by Maternal Plasma DNA Sequencing. Obstetrics & Gynecology. 125, 375-382;
- L. Hui, J. I. Vaughan, M. Nelson. (2008). Effect of labor on postpartum clearance of cell-free fetal DNA from the maternal circulation. Prenat. Diagn.. 28, 304-308;
- Pietro Invernizzi, Maria Biondi, Pier Battezzati, Francesca Perego, Carlo Selmi, et. al.. (2002). Presence of fetal DNA in maternal plasma decades after pregnancy. Hum Genet. 110, 587-591;
- C. F. Wright, H. Burton. (2008). The use of cell-free fetal nucleic acids in maternal blood for non-invasive prenatal diagnosis. Human Reproduction Update. 15, 139-151;
- «Кровавая» работа врачей, ученых и природы;
- So I. Nagaoka, Terry J. Hassold, Patricia A. Hunt. (2012). Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13, 493-504;
- Osman Demirhan, Cansun Demir, Erdal Tunç, Nihal İnandıklıoğlu, Erdinç Sütcü, et. al.. (2011). The genotoxic effect of nicotine on chromosomes of human fetal cells: The first report described as an important study. Inhalation Toxicology. 23, 829-834;
- Y. M. D. Lo, F. M. F. Lun, K. C. A. Chan, N. B. Y. Tsui, K. C. Chong, et. al.. (2007). Digital PCR for the molecular detection of fetal chromosomal aneuploidy. Proceedings of the National Academy of Sciences. 104, 13116-13121;
- H. Christina Fan, Stephen R. Quake. (2007). Detection of Aneuploidy with Digital Polymerase Chain Reaction. Anal. Chem.. 79, 7576-7579;
- Y. M. Dennis Lo, K. C. Allen Chan, Hao Sun, Eric Z. Chen, Peiyong Jiang, et. al.. (2010). Maternal Plasma DNA Sequencing Reveals the Genome-Wide Genetic and Mutational Profile of the Fetus. Sci. Transl. Med.. 2;
- Christina Fan, Stephen Quake. (2010). In Principle Method for Noninvasive Determination of the Fetal Genome. Nat Prec;
- Ying Li, Bernhard Zimmermann, Corinne Rusterholz, Anjeung Kang, Wolfgang Holzgreve, Sinuhe Hahn. (2004). Size Separation of Circulatory DNA in Maternal Plasma Permits Ready Detection of Fetal DNA Polymorphisms. Clinical Chemistry. 50, 1002-1011;
- Joris A. Veltman, Han G. Brunner. (2012). De novo mutations in human genetic disease. Nat Rev Genet. 13, 565-575;
- Jacob O. Kitzman, Matthew W. Snyder, Mario Ventura, Alexandra P. Lewis, Ruolan Qiu, et. al.. (2012). Noninvasive Whole-Genome Sequencing of a Human Fetus. Sci. Transl. Med.. 4;
- Y.M. Dennis Lo. (2013). Non-invasive prenatal testing using massively parallel sequencing of maternal plasma DNA: from molecular karyotyping to fetal whole-genome sequencing. Reproductive BioMedicine Online. 27, 593-598;
- M. Stroun, P. Anker, P. Maurice, J. Lyautey, C. Lederrey, M. Beljanski. (1989). Neoplastic Characteristics of the DNA Found in the Plasma of Cancer Patients. Oncology. 46, 318-322;
- Ling-Ling Tang, Wan-Qing Chen, Wen-Qiong Xue, Yong-Qiao He, Rong-Shou Zheng, et. al.. (2016). Global trends in incidence and mortality of nasopharyngeal carcinoma. Cancer Letters. 374, 22-30;
- Susanna Hilda Hutajulu, Johan Kurnianda, Bing I Tan, Jaap M Middeldorp. (2014). Therapeutic implications of Epstein–Barr virus infection for the treatment of nasopharyngeal carcinoma. TCRM. 721;
- Shotelersuk K., Khorprasert C., Sakdikul S., Pornthanakasem W., Voravud N., Mutirangura A. (2000). Epstein-Barr Virus DNA in Serum/Plasma as a Tumor Marker for Nasopharyngeal Cancer. Clinical Cancer Research. 6, 1046–1051;
- Anne W.M. Lee, W.M. Sze, Joseph S.K. Au, S.F. Leung, T.W. Leung, et. al.. (2005). Treatment results for nasopharyngeal carcinoma in the modern era: The Hong Kong experience. International Journal of Radiation Oncology*Biology*Physics. 61, 1107-1116;
- K.C. Allen Chan, John K.S. Woo, Ann King, Benny C.Y. Zee, W.K. Jacky Lam, et. al.. (2017). Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. N Engl J Med. 377, 513-522;
- Hsin-Yao Wang, Chia-Hsun Hsieh, Chiao-Ni Wen, Ying-Hao Wen, Chun-Hsien Chen, Jang-Jih Lu. (2016). Cancers Screening in an Asymptomatic Population by Using Multiple Tumour Markers. PLoS ONE. 11, e0158285;
- KC Allen Chan, Peiyong Jiang, Yama WL Zheng, Gary JW Liao, Hao Sun, et. al.. (2013). Cancer Genome Scanning in Plasma: Detection of Tumor-Associated Copy Number Aberrations, Single-Nucleotide Variants, and Tumoral Heterogeneity by Massively Parallel Sequencing. Clinical Chemistry. 59, 211-224;
- Kun Sun, Peiyong Jiang, K. C. Allen Chan, John Wong, Yvonne K. Y. Cheng, et. al.. (2015). Plasma DNA tissue mapping by genome-wide methylation sequencing for noninvasive prenatal, cancer, and transplantation assessments. Proc Natl Acad Sci USA. 112, E5503-E5512;
- Abel Jacobus Bronkhorst, Vida Ungerer, Stefan Holdenrieder. (2019). The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087;
- Paul Brown. (2016). The Cobas® EGFR Mutation Test v2 assay. Future Oncology. 12, 451-452;
- Simon Robert Knight, Adam Thorne, Maria Letizia Lo Faro. (2019). Donor-specific Cell-free DNA as a Biomarker in Solid Organ Transplantation. A Systematic Review. Transplantation. 103, 273-283;
- Naveen Kumar, Rashmi Rana, Devender Singh Rana, Anurag Gupta, Mohinder Pal Sachdeva. (2021). Donor-Derived Cell-Free DNA to Diagnose Graft Rejection Post-Transplant: Past, Present and Future. Transplantology. 2, 348-361;
- Yanni YN Lui, Ki-Wai Chik, Rossa WK Chiu, Cheong-Yip Ho, Christopher WK Lam, YM Dennis Lo. (2002). Predominant Hematopoietic Origin of Cell-free DNA in Plasma and Serum after Sex-mismatched Bone Marrow Transplantation. Clinical Chemistry. 48, 421-427;
- Lisa Wanda, Felicia Ruffin, Jonathan Hill-Rorie, Desiree Hollemon, Hon Seng, et. al.. (2017). Direct Detection and Quantification of Bacterial Cell-free DNA in Patients with Bloodstream Infection (BSI) Using the Karius Plasma Next Generation Sequencing (NGS) Test. Open Forum Infectious Diseases. 4, S613-S613;
- Nicole Y L Lam, Timothy H Rainer, Rossa W K Chiu, Gavin M Joynt, Y M Dennis Lo. (2004). Plasma Mitochondrial DNA Concentrations after Trauma. Clinical Chemistry. 50, 213-216;
- Tor W. Chiu, Richard Young, Lisa Y.S. Chan, Andrew Burd, Dennis Y.M. Lo. (2006). Plasma cell-free DNA as an indicator of severity of injury in burn patients. Clinical Chemistry and Laboratory Medicine (CCLM). 44;
- Yee Voan Teo, Miriam Capri, Cristina Morsiani, Grazia Pizza, Ana Maria Caetano Faria, et. al.. (2019). Cell-free DNA as a biomarker of aging. Aging Cell. 18, e12890;
- Matthew Boyko, Sharon Ohayon, Tomer Goldsmith, Amos Douvdevani, Benjamin Fredrick Gruenbaum, et. al.. (2011). Cell-Free DNA—A Marker to Predict Ischemic Brain Damage in a Rat Stroke Experimental Model. Journal of Neurosurgical Anesthesiology. 23, 222-228;
- Kristina V. Glebova, Natalya N. Veiko, Aleksey A. Nikonov, Lev N. Porokhovnik, Svetlana V. Kostuyk. (2018). Cell-free DNA as a biomarker in stroke: Current status, problems and perspectives. Critical Reviews in Clinical Laboratory Sciences. 55, 55-70;
- Truszewska A., Foroncewicz B., Pączek L. (2016). The role and diagnostic value of cell-free DNA in systemic lupus erythematosus. Clinical and Experimental Rheumatology. 35, 330–336;
- John A. Olsen, Lauren A. Kenna, Michael G. Spelios, Martin J. Hessner, Eitan M. Akirav. (2016). Circulating Differentially Methylated Amylin DNA as a Biomarker of β-Cell Loss in Type 1 Diabetes. PLoS ONE. 11, e0152662;
- Roni Lehmann-Werman, Daniel Neiman, Hai Zemmour, Joshua Moss, Judith Magenheim, et. al.. (2016). Identification of tissue-specific cell death using methylation patterns of circulating DNA. Proc Natl Acad Sci USA. 113, E1826-E1834.







