
Все под контролем, или как сберечь нервную систему во время операции
28 декабря 2023
Все под контролем, или как сберечь нервную систему во время операции
- 365
- 0
- 1
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Наверняка многие натыкались на видео, в которых пациент находится в сознании во время нейрохирургической операции и выполняет определенные действия. Кто-то играет на скрипке, кто-то поет, а кто-то просто повторяет слова и отвечает на заданные ему вопросы. И вот пациент внезапно останавливается. В этот момент все в операционной понимают, что хирург находится в той зоне, удаление которой приведет к потере пациентом тестируемой функции. И сам хирург в процессе дальнейшей операции старается «обходить» эту зону.
Каким же образом нейрохирургу удалось на время «выключить» функцию участка головного мозга, не повредив его при этом? Человеком, который ответственен за эту часть операции, является врач-нейрофизиолог. Именно он до операции планирует, какие нейрофизиологические методы понадобятся в каждом конкретном случае, устанавливает необходимое оборудование, настраивает его параметры и контролирует функциональное состояние структур нервной системы. Одним из инструментов врача-нейрофизиолога является специальный стимулятор, который нейрохирург прикладывает к участкам коры головного мозга, инактивируя их во время тестирования. Эта инактивация происходит только на время стимуляции и позволяет хирургу ориентироваться, повреждение каких участков может нести неисправимые последствия. Вся эта процедура называется «интраоперационный нейрофизиологический мониторинг» (ИОМ).
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
История электрической стимуляции
В начале 18 века Джованни Альдини, племянник знаменитого итальянского анатома Луиджи Гальвани, путешествует по Европе с демонстрацией уникального феномена — он подавал постоянный ток на нерв отсеченной конечности лягушки, тем самым заставляя мышцы этой конечности сокращаться. Подобные эксперименты Альдини проводит и на телах казненных преступников, проводя публичные показы перед толпами зевак [1]. В 1818 году английская писательница Мэри Шелли под впечатлением от этих опытов напишет свой знаменитый роман «Франкештейн» [2].
Джованни Альдини был одним из первых ученых, продемонстрировавших электрическую природу нейрональной передачи. Зарождение нейрофизиологии в ее современном виде произошло в 1870 году, когда Густав Фрич и Эдуард Гитциг провели успешный эксперимент, напрямую стимулируя кору головного мозга собак [3]. Ученые использовали гальванический ток и наблюдали, что воздействие на определенные участки вызывает движение конечностей на противоположной стороне. Их открытие было важно по нескольким причинам. Во-первых, они смогли доказать существование моторной коры и ее расположение. Во-вторых, это было первым доказательством электрической возбудимости коры головного мозга [4]. Шотландский невролог и психолог Дэвид Ферриер провел подобный эксперимент на приматах [5]. Он смог локализовать не только моторные функции, но также обоняние и слух в различных частях височной доли. Используя стимуляционные и резективные методы, Ферриер определил топографическую локализацию функций в головном мозге у различных видов и опытным путем доказал: эпилептический приступ происходит из-за изменения в электрической активности коры [6], [7]. Во многом Ферриер опирался на идеи Хьюлингса Джексона, британского невролога, предположившего соматотопическое устройство сенсомоторной коры у человека на основе обозреваемых эпилептических приступов, во время которых происходило постепенное вовлечение различных частей тела, начиная с отдаленных отделов руки (например, кисти) или лица и заканчивая вовлечением в приступ всей половины тела [8]. Ферриер впоследствии сказал: «Основываясь на клинических и патологических наблюдениях, Джексон во многом предсказал результаты кортикальной стимуляции».
Впервые кортикальную стимуляцию у человека в сознании независимо провели в 1874 году Дэвид Ферриер [9] и врач Роберт Бартлоу [10]. Бартлоу проводил процедуру кортикальной стимуляции гальваническим током у пациентки с гнойной язвой волосистой части головы. Он заметил, что стимуляция затылочной коры с одной стороны вызывает появление вспышек света в противоположном поле зрения. В 1886 году британский нейрохирург и нейрофизиолог Виктор Александр Горслей первым провел кортикальную стимуляция во время нейрохирургической операции на мозге человека, страдающего эпилепсией [11].
Работу своих предшественников продолжил американский нейрохирург Харви Кушинг. В 1909 году Кушинг был первым, кто отметил изолированные сенсорные феномены в разных частях тела пациентов, стимулируя постцентральную борозду [12]. Кроме того, Кушинг предпринимал попытки нейрохирургического лечения эпилепсии, выявляя эпилептический очаг посредством электрической стимуляции (рис. 1) [13].
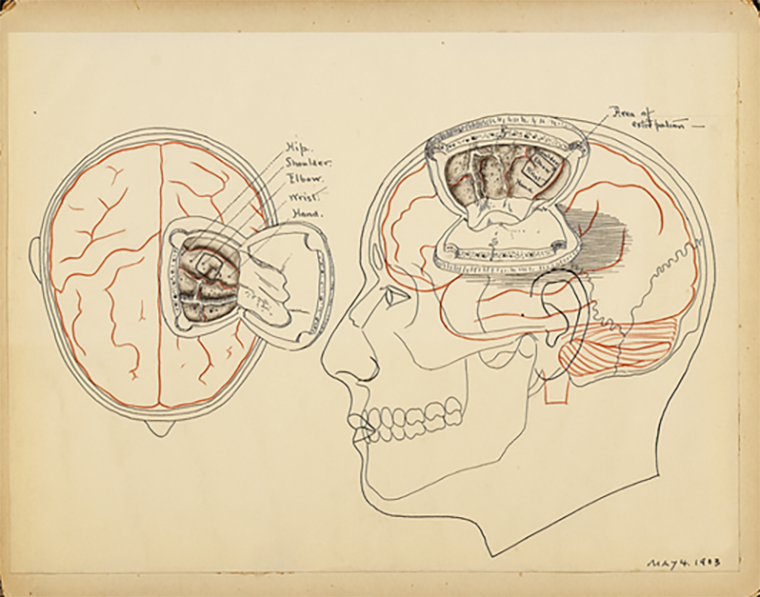
Рисунок 1. Собственные рисунки Харви Кушинга. Результаты стимуляции прецентральной извилины. Были вызваны движения (сверху-вниз) бедра, плеча, локтя, кисти, всей руки.
На основании работ Кушинга в 1930 году канадский нейрохирург Уайлдер Пенфилд и немецкий невролог Отфрид Фёрстер опубликовали результаты своих работ по стимуляции коры переменным током, буквально создав «карту» коры головного мозга, в которую входили моторные, тактильные, зрительные, обонятельные и другие зоны [14], [15]. В 1937 году Пенфилд и его коллега Эдвин Болдри опубликовали статью в журнале Brain, в которой были представлены подробные данные стимуляции сенсорной и моторной коры [16]. Так зародился знаменитый «кортикальный гомункулус» — фигура, демонстрирующая концепт репрезентации человеческого тела в сенсомоторной коре (рис. 2). Было обнаружено и то, что части тела, которыми мы выполняем самые сложные движения — пальцы рук и стоп, язык, губы — занимают самые обширные участки этой коры. Если попытаться изобразить человека с соответствующими пропорциями, то получится весьма искаженная фигурка (рис. 3) [17]. Такие 3D модели, например, можно увидеть в Музее Натуральной Истории в Лондоне.
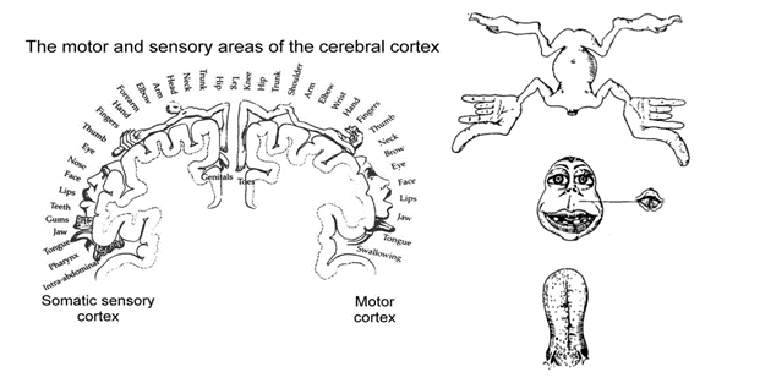
Рисунок 2. Оригинальное изображение, сделанное У. Пенфилдом и Э. Болдри. Представление человеческого тела в сенсомоторной коре (слева); «кортикальный гомункулус» (справа).

Рисунок 3. 3D модель «кортикального гомункулуса» в Музее Натуральной Истории в Лондоне.
Современный интраоперационный мониторинг (ИОМ)
Работы Ферриера, Бартлоу, Кушинга, Пенфилда и других великих ученых вылились в создание такого направления, как ИОМ. Главной причиной использования ИОМ является риск повреждения структур нервной системы во время хирургических вмешательств. Причем это касается не только нейрохирургии, когда операция проводится непосредственно на различных частях нервной системы. Неврологические осложнения могут возникнуть и при оперативных вмешательствах на сердце и крупных сосудах, щитовидной железе, структурах грудной клетки, во время челюстно-лицевых и ортопедических операций. ИОМ представляет из себя совокупность различных нейрофизиологических модальностей, используемых во время хирургических операций для предотвращения повреждения структур нервной системы.
Возможности современной интраоперационной нейрофизиологии достаточно разнообразны. Помимо уже упомянутой прямой электрической стимуляции, используются вызванные потенциалы (ВП), электроэнцефалография (ЭЭГ), электромиография (ЭМГ). Все эти модальности, в большинстве случаев, объединены в одном приборе, который использует врач-нейрофизиолог (рис. 4) [18].
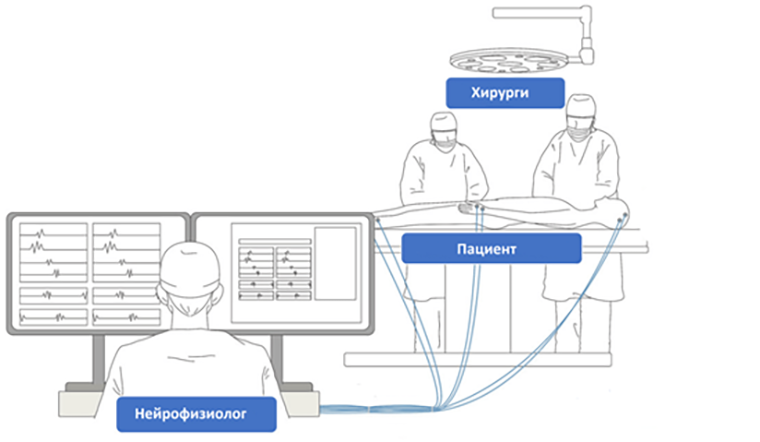
Рисунок 4. Расположение операционной бригады во время проведения ИОМ.
Прямая электрическая стимуляция
Врачам нередко приходится сталкиваться с ситуациями, когда опухоль, порок развития или другое патологическое образование находится в близости или непосредственно связано со структурами нервной системы, поражение которых может привести к нарушению работы той или иной ее части — неврологическому дефициту. В операционном поле нейрохирургу не всегда удается четко увидеть анатомические структуры, а под действием патологического процесса функции в коре головного мозга могут менять свое местоположение [19], [20].
Представим пациента с опухолью головного мозга, находящейся рядом с отделом, который управляет движениями руки. Для того, чтобы понять, где заканчивается опухоль и начинается здоровая ткань, нейрохирург берет в руки стимулятор (небольшую палочку со стимулирующим электродом на конце) и совместно с нейрофизиологом начинает поиски участков, несущих в себе функции движения руки. На другом конце моторного (двигательного) пути, в мышцах руки установлены игольчатые электроды, записывающие ЭМГ. Эти электроды устанавливаются в те мышцы, которые имеют самые крупные представительства в коре головного мозга — на руке это дельтовидная и плечелучевая мышцы, короткая мышца, отводящая большой палец кисти и мышца, отводящая мизинец. Когда стимуляция корковых участков вызывает появление моторного вызванного потенциала (МВП) на ЭМГ, нейрофизиолог сигнализируют хирургу, что цель достигнута. Причем в зависимости от того, какая сила тока необходима для получения МВП, можно предположить, на каком расстоянии от стимулятора локализуется моторная зона. Чтобы быть уверенным, что стимулятор находится на целевой структуре, необходимо получить МВП на минимальной силе тока.
Подобным образом можно исследовать не только участки коры, но и периферические нервы. Например, при удалении опухоли, тесно прилежащей к лицевому нерву [21]. Для этого электроды ЭМГ устанавливаются в мышцы лица. Прямая электрическая стимуляция используется также для поиска корешков спинного мозга, особенно при их иссечении для облегчения симптомов церебрального паралича [22]. У пациентов с этим заболеванием стимуляция отдельных корешков вызывает появление патологических, высокоамплитудных МВП. Такие корешки частично иссекаются, в результате чего мышечный тонус в иннервируемых ими мышцами снижается.
Во время определения локализации в коре речевой функции пациента «пробуждают» на операционном столе. С ним взаимодействует подготовленная группа нейролингвистов с набором тестов на различные аспекты речи. Нейрофизиолог устанавливает необходимые параметры стимуляции, а хирург прикладывает стимулятор к участкам коры головного мозга. Положительным результатом будет нарушение речи во время стимуляции. Если пациент владеет несколькими языками, то вполне возможно, что речевые центры, ответственные за разные языки, локализуются отдельно друг от друга [23], [24]. В таких ситуациях необходимо провести тестирование всех языков, которыми владеет пациент, а иначе существует риск изолированно «повредить» способность говорить или понимать один из освоенных языков (рис. 5) [25].
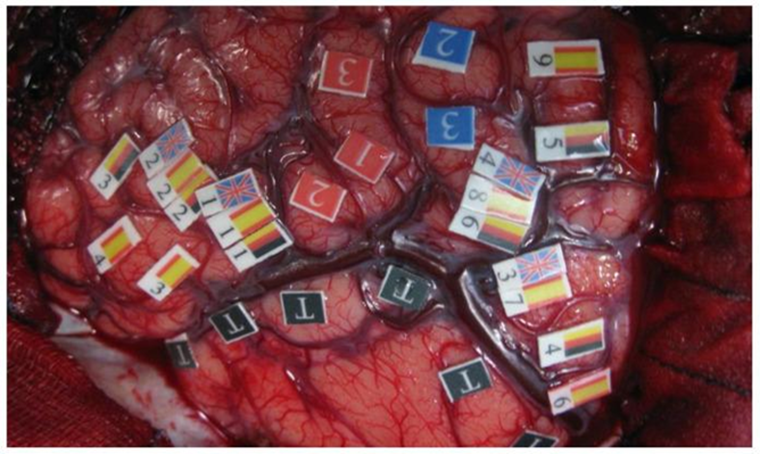
Рисунок 5. Результаты проведенной прямой электрической стимуляции. Красные метки — моторная кора. Синие метки — соматосенсорная кора. Флажками стран отмечены зоны, стимуляция которых вызвала речевые нарушения, специфичные для одного из языков.
Прямая электрическая стимуляция зачастую нужна не только во время нейрохирургических операций. Одним из возможных тяжелых осложнений при хирургическом вмешательстве на щитовидной железе является повреждение возвратного гортанного нерва, что ведет к изменению голоса и затруднению дыхания, сильно ухудшающих качество жизни. Во избежание подобных осложнений хирург может использовать стимулятор и локализовать нерв в операционном поле. Возвратный гортанный нерв иннервирует голосовые связки, поэтому электроды, на которых нейрофизиолог будет регистрировать МВП, устанавливаются вместе с трубкой для интубации [26].
Транскраниальные МВП
Динамический контроль за состоянием моторного пути к спинному мозгу и к ядрам черепных нервов — кортикоспинальный и кортикобульбарный пути -проводится с использованием транскраниальных МВП [27]. Транскраниальные они потому, что стимулирующие электроды устанавливаются на поверхность черепа пациента непосредственно над моторной корой (рис. 6) [28]. На электроды подаются импульсы, которые проходят по моторному пути и фиксируются в виде МВП под электродами, записывающими ЭНМГ. Нейрофизиолог таким образом проверяет функциональное состояние моторного тракта до начала оперативного вмешательства (после получения пациентам анестезии, а иначе процедура была бы очень болезненная), фиксирует показатели МВП, затем контролирует их во время оперативного вмешательства. О значимом их снижении нейрофизиолог сообщает хирургу, и проводятся попытки восстановить прежние значения. Устойчивое сохраняющееся снижение МВП будет свидетельствовать о вероятном повреждении моторного пути и постоперационном неврологическом дефиците у пациента.
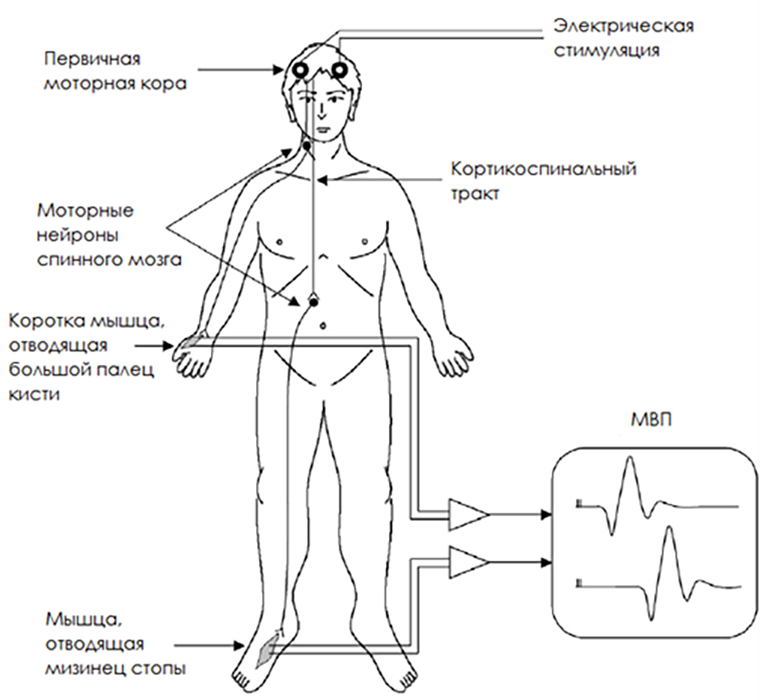
Рисунок 6. Транскраниальные МВП.
Транскраниальные МВП используются во время нейрохирургических операций при расположении патологии рядом с моторными путями в головном и спинном мозге. Помимо нейрохирургии, эта модальность активно применяется и в операциях на магистральных сосудах [29]. Оперативные вмешательства на сонных артериях, аорте и сердце сопряжены с риском инсульта. Во время проведения операции пациент находится под анестезией, поэтому заподозрить повреждение нервной системы невозможно. Нередко при операциях на сосудах и сердце используются аппараты искусственного кровообращения, что также повышает риск образования эмболов и тромбов. Подробнее про устройство аппарата искусственного кровообращения и осложнения операций на сердце можно прочитать в статье «Биомолекулы» [30]. При таких оперативных вмешательствах и используются транскраниальные МВП. При устойчивом снижении показателей операционная бригада будет принимать необходимые меры — от изменения анестезиологических параметров и плана операции вплоть до поиска и иссечения тромба, если он стал причиной нарушения мозгового кровообращения.
Соматосенсорные, слуховые, зрительные вызванные потенциалы
При регистрации сенсорных ВП, в отличие от моторных, стимулирующие электроды располагаются на периферии, а записывающие — преимущественно в центральной нервной системе (ЦНС).
Соматосенсорные вызванные потенциалы (ССВП) — показатель функционального состояния сенсорных путей, которые идут от периферического нерва по задним канатикам спинного мозга в соматосенсорную кору головного мозга. Стимулирующий электрод устанавливается в проекции срединного нерва на руке и большеберцового нерва на ноге (рис. 7) [31]. ССВП регистрируются электродами, установленными на поверхности черепа над соматосенсорной корой.
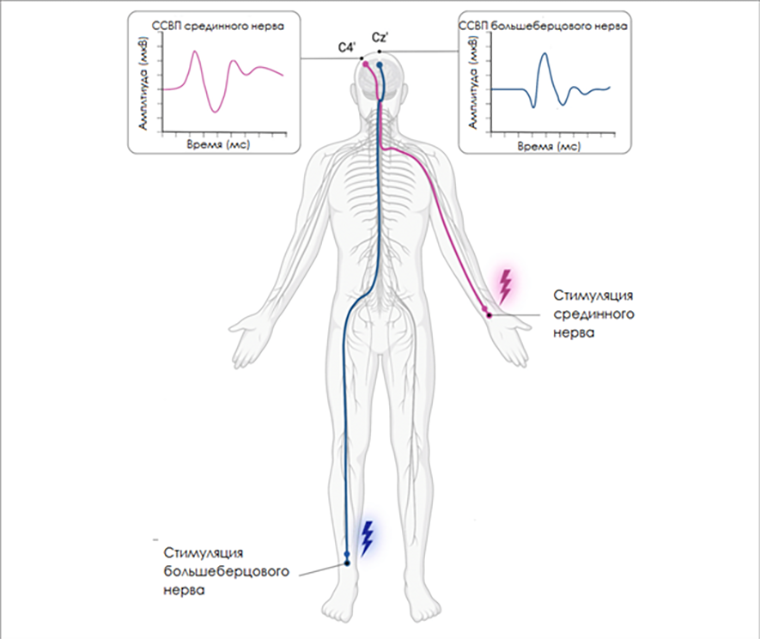
Рисунок 7. ССВП от срединного и большеберцового нерва.
мкВ — микровольты, мс — милисекунды.
Функции ССВП во многом схожи с транскраниальными МВП. Они также применяются в сосудистой хирургии для отслеживания нарушения мозгового кровообращения [29]. При операциях на головном мозге в качестве регистрирующего электрода можно использовать записывающие пластинки, установленные напрямую на кору головного мозга (рис. 8). Определенная конфигурация ССВП будет подсказывать нейрофизиологу о том, в каком месте находится центральная борозда, что также помогает нейрохирургу ориентироваться в структурах головного мозга [32].
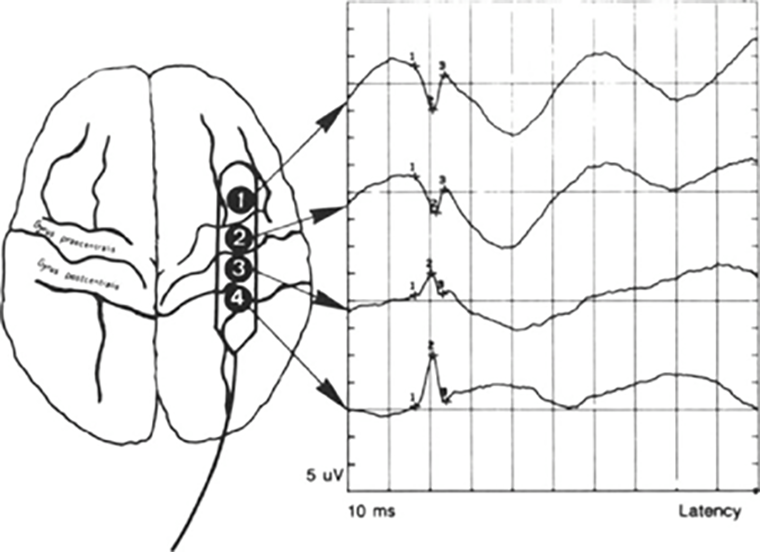
Под электродами 2 и 3 регистрируется «реверсия фаз» — ВП от моторной коры имеет позитивное направление, а ВП от соматосенсорной коры — негативное. Между электродами, формирующими «реверсию фаз», находится центральная борозда.
Для регистрации слуховых вызванных потенциалов (СВП) пациенту в наружный слуховой проход вставляются наушники, подающие звуки определенной частоты. Регистрацию проводят электродами, установленными кпереди от наружного слухового прохода с обеих сторон [33]. Стимуляция (щелчки) вызывает появление нескольких волн, каждая из которых отображает ответ от разных частей слухового пути (слуховой нерв, ядра ствола головного мозга и т.д.). СВП используется при операциях по удалению опухолей слухового нерва для профилактики постоперационных нарушений слуха. Также СВП позволяют регистрировать грубые изменения ствола головного мозга, такие как отек и нарушение кровоснабжения. Важность этой функции обусловлена тем, что в стволе находятся дыхательный и сосудодвигательный сосуды, поражения которых могут приводить к летальному исходу.
Часть нейрохирургических и сосудистых операций могут затронуть зрительный анализатор, что способно вызвать нарушения зрения. Такие вмешательства, как удаление аденомы гипофиза или менингиомы турецкого седла, проводятся в непосредственной близости со зрительным перекрестом, а операции на аневризмах внутренней сонной артерии могут спровоцировать повреждение глазной артерии. Оценивать функциональное состояние зрительного анализатора во время оперативного вмешательства призваны зрительные вызванные потенциалы (ЗВП) [34]. Для их регистрации на пациента надевают специальные очки, которые подают вспышки света с определенной частотой. Электроды, которые «ловят» ЗВП, ставятся на поверхность черепа в проекции затылочных долей — там находится первичная зрительная кора. При регистрации ЗВП действует тот же принцип, что и везде — их устойчивое снижение или исчезновение будет говорить о повреждении зрительного анализатора.
Электроэнцефалография
ЭЭГ — это регистрация биопотенциалов коры головного мозга. В отличие от ВП, при записи ЭЭГ используются только регистрирующие электроды. ЭЭГ наряду с другими методиками применяется при сосудистых операциях для отслеживания нарушения мозгового кровообращения. «Красными флажками» для нейрофизиолога будет снижение амплитуды ритмов и преобладание медленных волн в одном из полушарий головного мозга [35].
Запись энцефалограммы напрямую с поверхности коры головного мозга называется электрокортикография (ЭКоГ). В последние годы активно ведутся исследования пассивного речевого картирования — во время нейрохирургической операции пациента «пробуждают,» устанавливают на поверхность коры головного мозга электродные полоски или решетки, записывающие кортикограмму, и проводят речевое тестирование [36], [37]. Затем происходит анализ, под каким из электродов во время произнесения или прослушивания слов регистрировались волны высокой частоты (гамма-ритм). Этот гамма-ритм и является маркером участков головного мозга, ответственных за речевую функцию. Метод дает возможность понять расположение речевых зон без использования прямой электрической стимуляции, которая может спровоцировать у пациента эпилептический приступ.
ЭЭГ и ЭКоГ активно используются как во время операции, так и на этапе реабилитации, являясь составной частью нейроинтерфейсов, что описывалось в статьях «Биомолекулы» [38], [39].
Транскраниальная допплерография
Транскраниальная доплерография (ТкДГ), в отличие от вышеперечисленного, является ультразвуковым, а не нейрофизиологическим методом. Однако нельзя не упомянуть про ее эффективность при сосудистых операциях [29]. ТкДГ отображает скорость кровотока на главных артериях, питающих головного мозг. Соответственно, снижение скорости кровотока позволяет заподозрить нарушение мозгового кровоснабжения. Увеличение скорости кровотока может быть следствием жизнеугрожающего состояния — синдрома церебральной гиперперфузии — тяжелого осложнения операций на сонных артериях [40]. Были выявлены и определенные параметры сигнала, свойственные для прохождения эмбола по артерии, названные HIT (high-intensity transient signals) [41]. Часть современных приборов включает в себя автоматическое определение этих сигналов, что значительно облегчает обнаружение эмболии во время операции.
Заключение
Современная хирургия развивается с огромной скоростью. Лечение тех патологий, за которые врачи берутся сегодня, десятки лет назад казалось невозможным. Такой бурный прогресс привел к спасению миллионов жизней по всему миру и подарил надежду огромному количеству пациентов. Однако чем сложнее и рискованнее хирургическая манипуляция, тем выше вероятность осложнений. Из-за чего вектор развития хирургии обратился в сторону улучшения качества жизни и минимизации постоперационного функционального дефицита.
Одним из методов решения проблемы постоперационных неврологических осложнений является ИОМ — совокупность множества нейрофизиологических методик для контроля функционального состояния нервной системы. Технологическое развитие дало возможность применять эти модальности совместно в рамках одной операции. Например, при удалении опухоли вестибулокохлеарного (VIII черепного) нерва используется прямая электрическая стимуляция, СВП и ЭМГ.
Хирургические методики, как и модальности ИОМа, будут продолжать развиваться. Не все участки и не все функции нервной системы на сегодняшний день возможно мониторить. Совместные усилия ученых, врачей, программистов и других специалистов уже привели к значительным достижениям, но нам всегда есть, куда двигаться дальше для изучения такой сложной структуры, как ЦНС, и совершенствования возможностей помощи пациентам.
Литература
- André Parent. (2004). Giovanni Aldini: From Animal Electricity to Human Brain Stimulation. Can. j. neurol. sci.. 31, 576-584;
- Anthony L. Ritaccio, Peter Brunner, Gerwin Schalk. (2018). Electrical Stimulation Mapping of the Brain: Basic Principles and Emerging Alternatives. Journal of Clinical Neurophysiology. 35, 86-97;
- Michael Hagner. (2012). The Electrical Excitability of the Brain: Toward the Emergence of an Experiment. Journal of the History of the Neurosciences. 21, 237-249;
- Charles G. Gross. (2007). The Discovery of Motor Cortex and its Background. Journal of the History of the Neurosciences. 16, 320-331;
- Ferrier D. The functions of the brain. London: Smith Elder, 1886. P. 268–345;
- Ferrier D. (1892). Functions of the brain. J Physiology. 13, 773;
- Mervyn Eadie. (2018). Cortical epileptogenesis and David Ferrier. Journal of the History of the Neurosciences. 27, 107-116;
- G. K. York, D. A. Steinberg. (2011). Hughlings Jackson's neurological ideas. Brain. 134, 3106-3113;
- D. Ferrier. (1873). Experimental researches in cerebral physiology and pathology. J AnatPhysiol. 8, 152–155;
- R. Bartholow. (1874). Experimental investigations into the functions of the human brain. Am J Med Sci. 66, 305–313;
- Mervyn J. Eadie. (2005). Victor Horsley's Contribution to Jacksonian Epileptology. Epilepsia. 46, 1836-1840;
- HARVEY CUSHING. (1909). PARTIAL HYPOPHYSECTOMY FOR ACROMEGALY.* WITH REMARKS ON THE FUNCTION OF THE HYPOPHYSIS. Annals of Surgery. 50, 1002-1017;
- Richard Leblanc. (2018). Cushing, Penfield, and cortical stimulation. Journal of Neurosurgery. 130, 76-83;
- Alastair Compston. (2017). The structural basis of traumatic epilepsy and results of radical operation. By O. Foerster, Breslau, and Wilder Penfield, Montreal. Brain 1930; 53: 99–119. Brain. 140, 508-513;
- Penfield W. (1968). Engrams in the human brain. Mechanisms of memory. Proc R Soc Med. 61, 831–840;
- WILDER PENFIELD, EDWIN BOLDREY. (1937). SOMATIC MOTOR AND SENSORY REPRESENTATION IN THE CEREBRAL CORTEX OF MAN AS STUDIED BY ELECTRICAL STIMULATION. Brain. 60, 389-443;
- Lueders H.O. Invasive Studies of the Human Epileptic Brain: Principles and Practice. Oxford, United Kingdom, 2018. — 576 p.;
- Dougho Park, Injung Kim. (2022). Application of Machine Learning in the Field of Intraoperative Neurophysiological Monitoring: A Narrative Review. Applied Sciences. 12, 7943;
- Alice Maulisova, Brandon Korman, Gustavo Rey, Byron Bernal, Michael Duchowny, et. al.. (2016). Atypical language representation in children with intractable temporal lobe epilepsy. Epilepsy & Behavior. 58, 91-96;
- Ryan A. Fisicaro, Ethan Jost, Katharina Shaw, Nicole Petrovich Brennan, Kyung K. Peck, Andrei I. Holodny. (2016). Cortical Plasticity in the Setting of Brain Tumors. Topics in Magnetic Resonance Imaging. 25, 25-30;
- Taemin Oh, Daniel T. Nagasawa, Brendan M. Fong, Andy Trang, Quinton Gopen, et. al.. (2012). Intraoperative neuromonitoring techniques in the surgical management of acoustic neuromas. FOC. 33, E6;
- Robert P. Turner. (2009). Neurophysiologic Intraoperative Monitoring During Selective Dorsal Rhizotomy. Journal of Clinical Neurophysiology. 26, 82-84;
- Alejandro Fernández-Coello, Viktória Havas, Montserrat Juncadella, Joanna Sierpowska, Antoni Rodríguez-Fornells, Andreu Gabarrós. (2016). Age of language acquisition and cortical language organization in multilingual patients undergoing awake brain mapping. JNS. 126, 1912-1923;
- Jesús Martín-Fernández, Andreu Gabarrós, Alejandro Fernandez-Coello. (2022). Intraoperative Brain Mapping in Multilingual Patients: What Do We Know and Where Are We Going?. Brain Sciences. 12, 560;
- C. Giussani, F.-E. Roux, V. Lubrano, S. M. Gaini, L. Bello. (2007). Review of language organisation in bilingual patients: what can we learn from direct brain mapping?. Acta Neurochir (Wien). 149, 1109-1116;
- Sun H., Tian W., Jiang K., Chiang F., Wang P., Huang T., Zhu J., Qin J., Liu X. (2015). Clinical guidelines on intraoperative neuromonitoring during thyroid and parathyroid surgery. Ann Transl Med. 3, 213;
- Shunji TSUTSUI, Hiroshi YAMADA. (2016). Basic Principles and Recent Trends of Transcranial Motor Evoked Potentials in Intraoperative Neurophysiologic Monitoring. Neurol. Med. Chir.(Tokyo). 56, 451-456;
- Yujiro Kawanishi, Hiroshi Munakata, Masamichi Matsumori, Hiroshi Tanaka, Teruo Yamashita, et. al.. (2007). Usefulness of Transcranial Motor Evoked Potentials During Thoracoabdominal Aortic Surgery. The Annals of Thoracic Surgery. 83, 456-461;
- V.C. So, C.C.M. Poon. (2016). Intraoperative neuromonitoring in major vascular surgery. British Journal of Anaesthesia. 117, ii13-ii25;
- Спасти сердце и не потерять разум;
- Tom Maudrich, Susanne Hähner, Rouven Kenville, Patrick Ragert. (2022). Somatosensory-Evoked Potentials as a Marker of Functional Neuroplasticity in Athletes: A Systematic Review. Front. Physiol.. 12;
- U. Ebeling, H.-J. Reulen. (1995). Space-Occupying Lesions of the Sensori-Motor Region. Advances and Technical Standards in Neurosurgery. 137-181;
- Nishanth Sampath, Sudhakar Subramaniam, Vijay Sankaran, Roopesh Kumar, Suresh KR. (2016). Brainstem auditory evoked potentials for intraoperative neurophysiological monitoring. Journal of Neuroanaesthesiology and Critical Care. 03, S1-S3;
- Hironobu Hayashi, Masahiko Kawaguchi. (2017). Intraoperative monitoring of flash visual evoked potential under general anesthesia. Korean J Anesthesiol. 70, 127;
- Hong Liu, Anthony M Di Giorgio, Eric S Williams, William Evans, Michael J Russell. (2010). Protocol for electrophysiological monitoring of carotid endarterectomies. Journal of Biomedical Research. 24, 460-466;
- Синкин М.В., Осадчий А.Е., Лебедев М.А. (2019). Пассивное речевое картирование высокой точности во время операций по поводу глиом доминантного полушария. Нейрохирургия. 21,37–43;
- Kohei Kanaya, Takumi Mitsuhashi, Takafumi Kiuchi, Sumio Kobayashi. (2021). The Efficacy of Intraoperative Passive Language Mapping for Glioma Surgery: A Case Report. Front. Neurol.. 12;
- Киборги сегодня: нейрокомпьютерные технологии становятся неотъемлемой частью нашей жизни;
- Нейроинтерфейсы: как наука ставит людей на ноги;
- Walther NKA van Mook, Roger JMW Rennenberg, Geert Willem Schurink, Robert Jan van Oostenbrugge, Werner H Mess, et. al.. (2005). Cerebral hyperperfusion syndrome. The Lancet Neurology. 4, 877-888;
- M. Müller, S. Behnke, P. Walter, G. Omlor, K. Schimrigk. (2009). Microembolic signals and intraoperative stroke in carotid endarterectomy. Acta Neurologica Scandinavica. 97, 110-117.






