
Выживший. Вирус гепатита, пришедший к нам через великие массовые вымирания
03 января 2022
Выживший. Вирус гепатита, пришедший к нам через великие массовые вымирания
- 1112
- 0
- 3
«Новые виды динозавров, обнаруженные в Неукене, Патагония», рисунок адаптирован
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вирусные эпидемии давно стали актуальной новостной повесткой в нашей каждодневной жизни. Однако люди редко задумываются о том, каким был мир болезней до того, как на планету ступила нога человека. Вирусы оставили значимый след в эволюции всего живого на Земле, встроив элементы своего генома в ДНК многоклеточных организмов. Изучение таких вставок может помочь нам пролить свет на древние эпидемии, поражавшие животных задолго до появления рода Homo. В этой статье читателю предлагается погрузиться в глубь геологических эпох и найти в геноме ныне живущих позвоночных следы масштабных доисторических эпидемий. Нашим сегодняшним героем станет вирус гепатита В — возбудитель одного из самых распространенных сейчас инфекционных заболеваний. Вирус, переживший три массовых вымирания многоклеточных форм жизни и поразивший ученых своей древностью.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Взять динозавра в скобки
До относительно недавнего времени ученым было трудно делать выводы о наличии того или иного признака у давно вымерших организмов, если он достоверно не отражается на окаменелостях. Одним из немногих методов для таких исследований является филогенетический брекетинг. Он позволяет делать выводы относительно интересующего нас признака или, например, поведенческого явления на основе взаимного расположения нескольких групп организмов на филогенетическом древе, начиная с последнего общего предка интересующего нас объекта. Анализ достаточно узких показателей требует того, чтобы как минимум два таксона дожили до наших дней. Именно они и образуют своеобразные родственные скобки — «филогенетические брекеты», внутри которых мы и можем поместить исчезнувшие с лица Земли виды. Например, зададимся вопросом: болели ли все вымершие динозавры раком? Для ответа мы можем взять кладу архозавров — обширный таксон пресмыкающихся, объединяющий крокодилов, птерозавров и динозавров: как вымерших, так и современных. Нынешние крокодилы выступят в качестве первой скобки, процветающие в наши дни тероподные динозавры — птицы — образуют вторую. Поскольку нам доподлинно известно, что как первые, так и вторые страдают онкологическими заболеваниями, то мы может сделать вывод о том, что все вымершие динозавры также могли болеть раком (рис. 1) [1].
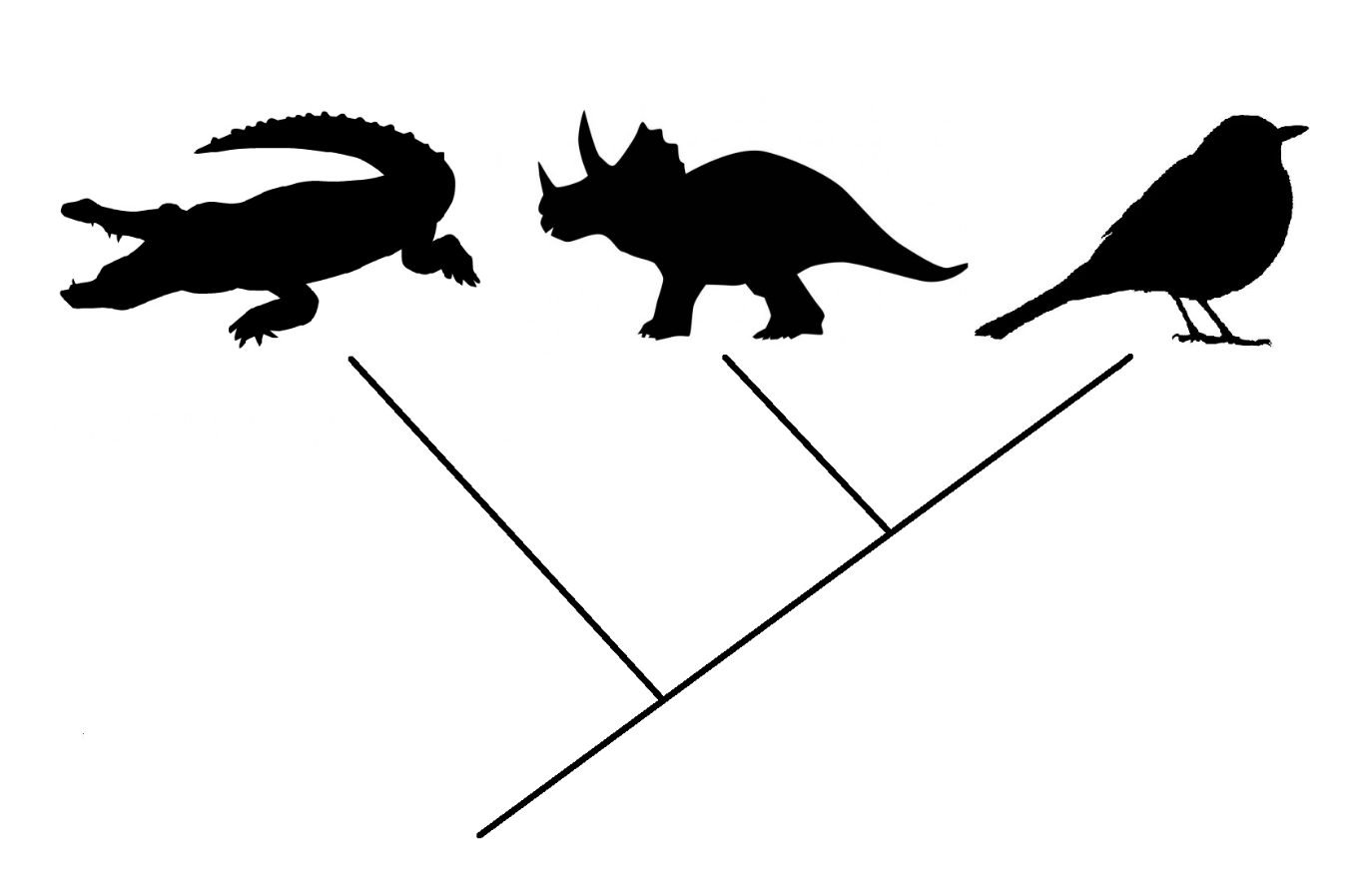
Рисунок 1. Пример работы метода филогенетического брекетинга внутри клады архозавров. Последний общий предок крокодилов и динозавров жил раньше, чем общий предок птицетазовых и ящеротазовых динозавров. Это филогенетическое знание позволяет выбрать крокодилов и птиц в качестве «скобок» для выводов о наличии некоторых признаков у всех вымерших динозавров вообще.
Рисунок составлен автором на основе изображений из открытых источников
Подобным умозрительным выводам, сделанным учеными-палеонтологами в XX веке, совсем недавно нашлось фактическое подтверждение. Объединенному коллективу ученых из Китая и Японии удалось доказать наличие следов злокачественных новообразований костной ткани у рогатых динозавров из рода центрозавров. Авторы статьи, опубликованной в журнале The Lancet Oncology, утверждают, что их работа является первым в мире достоверным доказательством присутствия следов рака у вымерших динозавров [2]. Останки центрозавра были обнаружены еще в 1989 году, и сперва деформация его малоберцовой кости рассматривалась как последствие заживления перелома. Однако тщательное рассмотрение образца указало на то, что разрастание кости распространилось значительно дальше самой области поражения.
Детальный анализ с применением компьютерной томографии и гистологического исследования позволили определить данную патологию как остеогенную саркому — злокачественное новообразование костной ткани. Помимо этого, авторы изучили здоровую кость центрозавра и сопоставили палеопатологический материал с клиническим случаем саркомы у девятнадцатилетнего человека, перенесшего ампутацию ноги из-за этого заболевания. Полученные данные гистологических и лучевых исследований позволили установить высокую степень сходства патологических изменений в кости современного человека и динозавра, жившего 77 млн лет назад. Клиника течения остеогенной саркомы мало чем отличается у млекопитающих и рептилий, что дает возможность применить человеческий алгоритм постановки диагноза к центрозавру и исключить все внешне похожие на саркому патологии (рис. 2).
Остеомиелит у динозавра не был подтвержден из-за отсутствия четко выраженного слоя новой костной ткани, возникающего при инфицировании микобактериями. Характерная для фибромы переходная группа клеток между больными и здоровыми участками соединительной ткани также не была обнаружена [2].
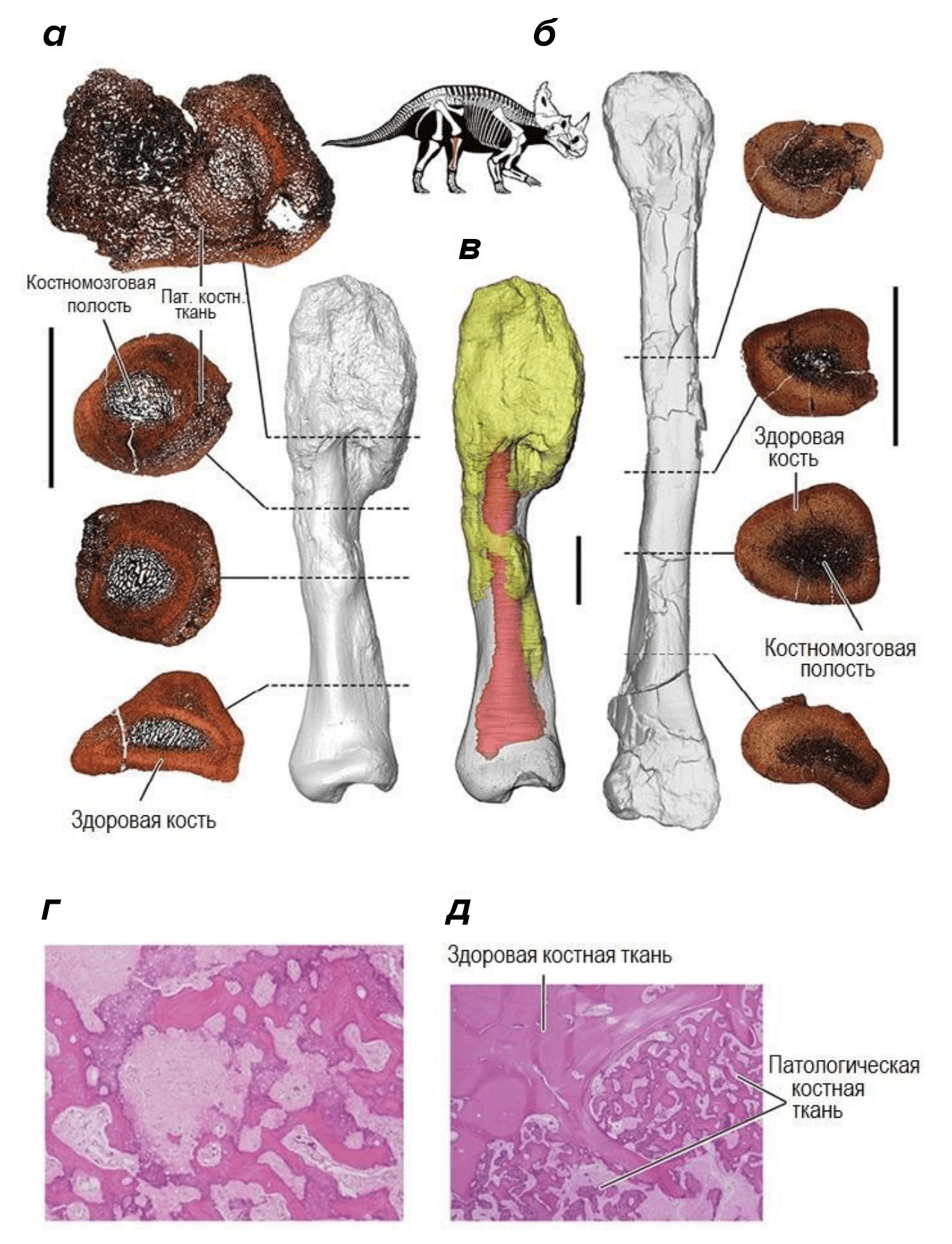
Рисунок 2. Гистологический анализ остеосаркомы у центрозавров и человека. В центре сверху: скелет Centrosaurus apertus с исследованной малоберцовой костью, выделенной красным цветом. а — патологическая половина малоберцовой кости; б — здоровая полная малоберцовая кость центрозавра с изображениями тонких срезов; в — трехмерная реконструкция, показывающая опухоль (желтый цвет) и костномозговую полость (красный цвет); г — окрашенная гематоксилином и эозином патологическая ткань левой малоберцовой кости человека (при 200-кратном увеличении); д — окрашенная гематоксилином и эозином патологическая и здоровая ткани левой малоберцовой кости человека (при 200-кратном увеличении). Изображения срезов костей динозавров сделаны с проксимальной стороны. Пунктирными линиями обозначены выбранные плоскости каждого среза. Изображения образцов человеческой костной ткани получены по срезам толщиной 5 мм. Размер масштабной линейки — 5 см.
[2], рисунок адаптирован автором статьи
Для этого исследования не стало помехой даже очевидное отсутствие мягких тканей на окаменелостях. Предсказанные филогенетическим брекетингом явления нашли свое доказательство в ископаемом материале и позволили нам узнать о том, что мезозойские рептилии могли страдать от тех же заболеваний, что и люди.
Вот только как быть с инфекционными болезнями, поражающими исключительно неокаменевающие органы? Здесь нам на помощь приходит археогенетика. Анализ геномов современных организмов может дать ответ на вопрос об их эволюционном пути, помочь понять, когда у предков ныне существующих животных появились те или иные признаки.
Окаменевшие вирусы
Если бы человек вздумал соорудить вечный двигатель,
он столкнулся бы с запретом в виде физического закона.
В отличие от этой ситуации, в биологии нет закона,
который утверждал бы обязательную конечность жизни.
Ричард Фейнман
Ничто на Земле не проходит бесследно — гласит строчка из известной песни на стихи Добронравова. Любое значимое воздействие, так или иначе повлиявшее на эволюцию всего живого, отразится на его генетическом материале. Болезни здесь — совсем не исключение. Хотя у вирусов и не может быть собственной геологической летописи, некоторые из них все же оставили следы своей эволюции в геномах инфицированных хозяев. Это могло произойти в том случае, если вирусная инфекция не стала летальной для популяции и затронула клетки зародышевой линии. В этом случае наследие вирусного генома может передаться потомкам и в спящем состоянии будет «бродить» по следующим поколениям очень долго, иногда — миллионы лет. Такие запечатленные в эпохах генетические следы ученые называют эндогенными вирусными элементами (EVE), а процесс их включения в геном хозяина — эндогенизацией [3]. Они так ярко свидетельствуют о различных эволюционных процессах, что заставили ученых говорить о себе как о «вирусных окаменелостях». Хотя вирусные геномы сами по себе меняются быстро, после эндогенизации скорость их изменения замедляется до темпов мутации многоклеточного организма. Это позволяет им жить в ДНК хозяина практически вечно, а нам — изучать последовательности вирусных нуклеотидов, чей возраст может насчитывать миллионы лет.
У животных EVE представлены по большей части РНК-содержащими ретровирусами. В геномах позвоночных они встречаются довольно часто и, как правило, абсолютно нейтральны, в некоторых же случаях могут защищать организм от инфекций, вызванных похожими вирусами. Совсем уж редко эти вирусные обломки способны творить поистине чудесные дела. Например, у млекопитающих обломки таких ретровирусов после внедрения в ДНК хозяина сменили свою эволюционную роль и стали генами белков синцитинов, ответственных за развитие и организацию плаценты. Особенно любопытно то, что различные отряды млекопитающих приобрели гены, кодирующие синцитин, от совершенно разных ретровирусов. Захват такого синцитин-подобного вирусного гена мог сыграть решающую роль в эволюционном переходе от однопроходных к плацентарным и позволить млекопитающим захватить все экологические ниши на Земле. Приобретение этого фрагмента, в итоге давшего нам такой важный эволюционный козырь как плацента, произошло очень давно: от 85 до 10 миллионов лет назад [4]. Однако в этом тексте мы познакомимся с событиями куда более древними и не менее захватывающими.
Что же касается ДНК-содержащих вирусов, то они чаще всего присутствуют в качестве EVE в геномах растений и редко интегрируются в наследственный материал животных. Однако обнаружение последовательностей вируса гепатита B (HBV) в клетках печени людей с инфекцией в хронической стадии позволило по-новому взглянуть на механизмы включения вирусов с обратной транскрипцией в геном человека, хоть их репликация и не зависит от эндогенизации в геном хозяина [5].
На «Биомолекуле» уже есть яркий текст, посвященный истории борьбы человечества с гепатитом B и важности его вакцинопрофилактики у детей [6].
По оценкам Всемирной организации здравоохранения, в 2019 году в мире насчитывалось около 300 миллионов инфицированных HBV людей. Ежегодно это заболевание уносит более 800 тысяч жизней, главным образом из-за вызываемых гепатитом цирроза и первичного рака печени. В России вирусные гепатиты относятся к социально значимым заболеваниям, представляющим опасность для окружающих [7]. Болезнь является одной из самых распространенных вирусных инфекций и передается вертикальным путем (от матери к плоду), а также при контакте с зараженными биологическими жидкостями или нестерильными инструментами для инъекций. При остром течении гепатита B специфического лечения не существует. Хотя большинство людей, страдающих хронической формой, полностью выздоравливает, примерно 5% остаются инфицированными на протяжении всей своей жизни, выступая в качестве носителей, способных заразить других. Проблема осложняется тем, что о своем диагнозе информировано в среднем всего 10% первично обследованных пациентов. Прежде всего это связано с тем, что однозначно установить факт инфицирования человека HBV только по клинической картине течения болезни попросту невозможно [8]. Все это требует от науки всестороннего анализа вопроса, в том числе изучения истории нашего взаимодействия с вирусом гепатита B. Например, секвенирование палеовирусов и изучение того, как они формировали антивирусные гены своих хозяев на протяжении миллионов лет эволюции, может дать нам неожиданные подсказки для будущих перспективных разработок в области специфической терапии [9].
Недавно опубликованное в журнале Science исследование показывает, что вирус гепатита B активно циркулировал в группах охотников-собирателей еще в эпоху мезолита. Анализ геномов 137 людей, живших в Евразии и Южной Америке от 10500 до 400 лет назад, обнаружил в их наследственном материале участки HBV. Международный коллектив авторов сопоставил штаммы древнего вируса и установил время жизни их последнего общего предка: от 20 000 до 12 000 лет назад. По всей видимости, контакты между первыми популяциями Нового Света и древними евразийцами происходили еще до беллингского потепления, давшего толчок к освоению Америки. 10 тысяч лет назад HBV был уже широко распространен на всей территории Европы и Малой Азии. Древнейшие штаммы европейского возбудителя гепатита В объединяются в две группы: первая была обнаружена у трех охотников-собирателей северо-запада России и Бельгии (Mesolithic 1), вторая — у древнего жителя запада России (Mesolithic 2). Вариант HBV, обнаруженный в Малой Азии, относится к отдельной группе, промежуточной между двумя европейскими. Интересно, что все найденные у разных популяций охотников-собирателей с севера и юга Европы вариации вируса гепатита В относились к группе Mesolithic 2 [10].
Этот феномен не согласуется с распространенным в науке взглядом на логику распространения инфекционных заболеваний в доцивилизационную эпоху. Принято думать, что до неолитической революции изолированные группы людей мало контактировали и практически не передавали друг другу патогены. Причиной возрастания инфекционной нагрузки традиционно считается появление оседлого образа жизни, скотоводства и земледелия, способствовавших накоплению возбудителей болезней вследствие длительного скученного проживания людей на одном месте. Однако это исследование позволяет полагать, что инфекционные агенты могли передаваться и долго сохраняться в популяциях даже в таких изолированных условиях.
С наступлением неолита в Европе подавляющее большинство древних вирусных штаммов каменного века были вытеснены новыми, получившими название линии WENBA (Western-Eurasian Neolithic-to-Bronze-Age). Вероятно, они были распространены первыми земледельцами, широко расселившимися по континенту, и доминировали на временном промежутке с 4000 до 2000 лет назад (рис. 3) [10].
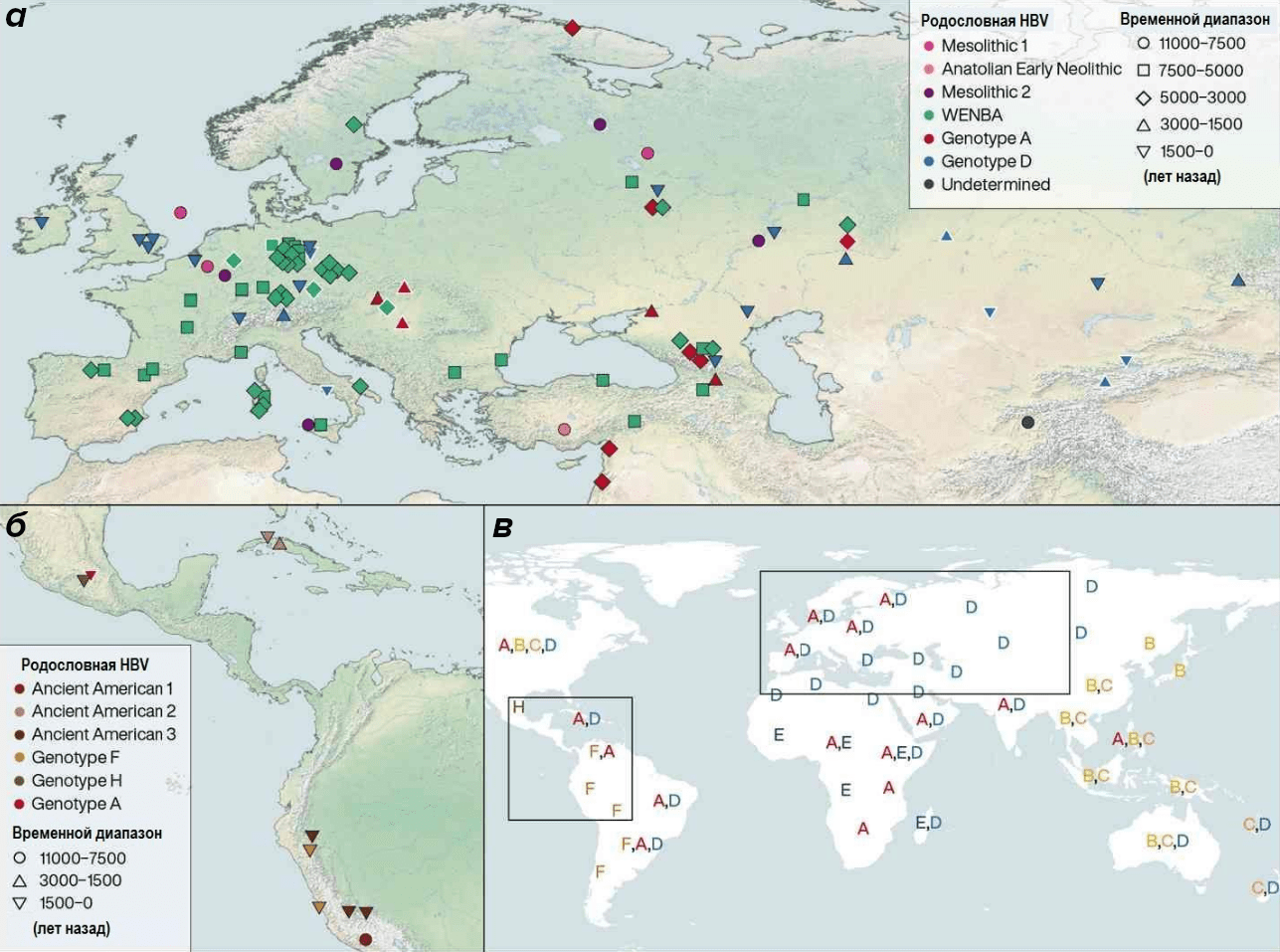
Рисунок 3. Пространственное и временное распределение различных генетических линий вируса гепатита В с эпохи мезолита по наши дни. а — евразийские штаммы; б — штаммы, характерные для Центральной и Южной Америки; в — современное распространение различных генотипов HBV для регионов с территорий, обозначенных на разделах А и В настоящего рисунка.
[10], рисунок адаптирован автором статьи
Мы знаем, что предками европейских земледельцев были выходцы с территорий Ближнего Востока, ведь археологические находки свидетельствуют о том, что производящее хозяйство возникло именно там [11]. Удивительно, но генетические линии HBV, обнаруженные в Средней Азии в эпоху мезолита, не имеют родственных связей с WENBA. Откуда же тогда появились новые генетические линии вируса гепатита? Почему именно они так быстро и широко распространились по Евразии? На эти вопросы науке еще предстоит ответить. Резкое сокращение WENBA приблизительно 3000 лет назад и появление распространенных сейчас в Евразии генотипов А и D — еще один нерешенный вопрос, возникнувший в результате этого исследования.
Примечательно, что генетическая линия WENBA не исчезла совсем. Она дала потомство в виде современной, очень редкой группы штаммов с генотипом G, описанной медицинской генетикой совсем недавно. Этот вариант был обнаружен у пациентов из различных стран Европы, Азии и Америки, что еще сильнее затрудняет объяснение условий его происхождения. Еще более загадочным генотип G делает то, что обнаруживается он, как правило, у ВИЧ-положительных людей, и логика его распространения уж очень похожа на таковую вируса иммунодефицита [10].
Мы убедились в том, что эволюция вируса гепатита В сложна, а на карте истории его распространения еще много белых пятен. Однако наивно было бы полагать, что HBV является только человеческой проблемой. Работы последних лет указывают на то, что вирус гепатита B на десятки миллионов лет древнее, чем было принято считать раньше. История его взаимодействия с позвоночными животными началась еще до мел-палеогенового вымирания. Произошло это задолго до появления человека на Земле, в эпоху, когда миром правили архозавры.
Наследие Палеозоя
Исследование древнего гепатита осложнялось тем, что в организмах инфицированных животных содержалось крайне мало эндогенизированных участков вирусного генетического материала. До недавнего времени понимание природы происхождения семейства гепаднавирусов (Hepadnaviridae) было основано исключительно на анализе нуклеотидных последовательностей современного HBV. Ранее предполагалось, что эволюционные пути двух давно известных науке родов гепатита В, Orthohepadnaviridae и Avihepadnaviridae, разошлись примерно 125 000 лет назад [12]. За нехваткой иных данных именно эта отметка долго считалась временем предположительного появления всего семейства Hepadnaviridae.
Неожиданные открытия в этой области принесла публикация полностью расшифрованного генома зебровой амадины (Taeniopygia guttata) из семейства вьюрковых ткачиков (рис. 4). Анализ последовательностей нуклеотидов, выполненный в компьютерной системе BLAST, дал удивительные плоды, ведь в более ранних исследованиях вьюрковые птицы никогда не рассматривались как природный резервуар HВV. Сопоставление генетического материала амадин с имеющимися в обширной базе данных материалами четко указывало на «гепатитное» происхождение некоторых EVE в геноме этих птиц [13]!

Рисунок 4. Зебровая амадина — маленький герой больших эволюционных открытий.
Не остановившись на достигнутом, ученые провели поиск ортологичных последовательностей, содержащих участки вируса гепатита B амадин (eZHBV) у разных родственных вьюрковым ткачикам таксонов. Генетики называют нуклеотидные последовательности в ДНК ортологичными в том случае, когда к их разделению привел акт видообразования. Иными словами, если ген существует у одного вида, который дивергирует с образованием двух новых, то копии этого гена у дочерних видов называются ортологами. В результате такого анализа было обнаружено 16 вирусных фрагментов HBV, 12 раз включенных в геномы птиц в процессе эволюции. Четыре из них оказались непригодны для дальнейшего анализа из-за дупликации, произошедшей после включения HBV. Дело в том, что уже после внедрения EVE в хромосомах птиц произошел неравный кроссинговер и нуклеотидные последовательности смешались. Из-за этого однозначно говорить о вирусном происхождении этих фрагментов было попросту невозможно. К счастью, оставшиеся восемь помогли приоткрыть завесу тайн мезозойских эпидемий. Все найденные вирусные фрагменты оказались невероятно древними и были неспособны кодировать какой-либо функциональный белок у живущих сейчас птиц.
Палеонтологическое знание о времени жизни последних общих предков различных таксонов позволило понять, когда в «ловушке» птичьего ДНК оказались те или иные генотипические варианты древнего вируса гепатита В (рис. 5) [14].
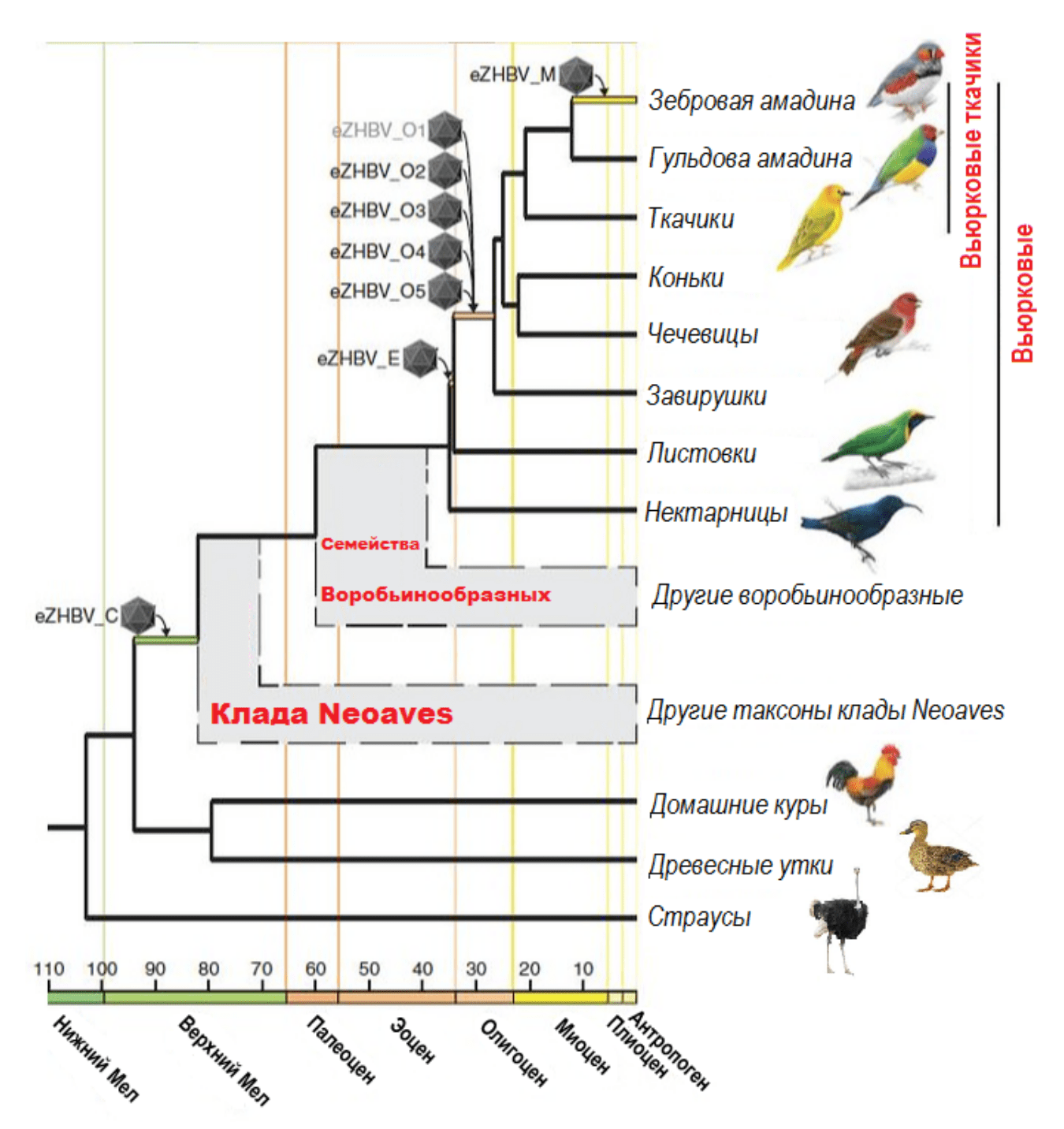
Рисунок 5. События эндогенизации вируса гепатита В в ходе эволюции птиц. Самый молодой из полученных EVE (eZHBV_M) присутствует у зебровой амадины, и его ортологи отсутствуют у всех других родственных ей таксонов. Таким образом, наиболее поздняя интеграция генома вируса гепатита B произошла около 12,1 млн лет назад в миоцене. Шесть из восьми датированных EVE имеют либо олигоценовое (eZHBV_O1–O5; 26,6–34,2 млн. лет назад), либо эоценовое (eZHBV_E; 34,2–35 млн. лет назад) происхождение, так как они присутствуют у всех певчих вьюрковых птиц, за исключением листовок (Chloropsis) и нектарниц (Nectariniidae). Ученым удалось идентифицировать еще более древнюю вставку eZHBV (eZHBV_C), которая является общей для всех птиц клады Neoaves и отсутствует у кур, страусов и уток. Это убедительно указывает на то, что первая эндогенизация HBV произошла у последнего общего предка Neoaves как минимум 82–94 млн. лет назад.
[14], рисунок адаптирован автором статьи
Удивительным оказалось то, что eZHBV_C EVE представляет собой непрерывную и на 99% полную последовательность генома палеовируса, дошедшую до наших дней в ДНК Neoaves со времен мезозойской эры. Ученые также проанализировали скорость включения и были поражены тем, насколько медленно эволюционировали эти вирусы и как сильно они похожи на современные человеческие [14].
Как гласит старая пословица, «мусор для одного человека — сокровище для другого». То, что часто называют «мусорной ДНК», в очередной раз обнаружило в себе драгоценный эволюционный камень [15]. Исследование зебровых амадин оказалось лишь верхушкой палеовирусного айсберга, погруженного вглубь геологических эпох.
На протяжении десятилетий науке были известны только два рода гепаднавирусов: Orthohepadnavirus, поражающий только млекопитающих, и Avihepadnavirus — исключительно птичий. Опубликованный в 2020 году отчет окончательно расширил наше представление о семействе гепаднавирусов до пяти родов, в среднем отличающихся друг от друга на 55% от полного набора их нуклеотидных последовательностей [16]. Три недавно открытых таксона представлены герпетогепаднавирусами (род Herpetohepadnavirus), инфицирующими только земноводных и рептилий, а также двумя группами, заражающими рыб, — метагепаднавирусами (род Metahepadnavirus) и парагепаднавирусами (род Parahepadnavirus)
Филогенетический анализ новоявленных членов вирусной семьи гепатита В выявил неожиданный факт: оказалось, рыбьи метагепаднавирусы более тесно связаны с ортогепаднавирусами млекопитающих, чем с другими генетическими линиями HBV. Ранее подобные явления рассматривались как доказательство межклассовой передачи патогена, но современные исследования заставляют сильно усомниться в этом. Скорее всего, такие родственные связи могут означать, что варианты вируса гепатита рыб и наземных позвоночных имели общего предка, а их эволюционные пути разошлись как минимум 200 миллионов лет назад [17], [18].
Эти открытия побудили ученых искать все новые доказательства невероятной древности гепаднавирусов. Как говорится, кто ищет, тот всегда находит: in silico скрининг геномных последовательностей современных животных пролил свет на вопрос о времени появления семейства Hepadnaviridae [19]. Авторы статьи, опубликованной на страницах журнала Virus Evolution в октябре 2021 года, использовали в своей работе те же методы, что и исследователи генома зебровой амадины, но проанализировали больше материала и оказались в более выигрышной ситуации, чем их предшественники. Знание о том, что резервуаром для HBV могут быть не только млекопитающие и птицы позволило «состарить» эволюцию гепатита В на многие миллионы лет. Ученые проанализировали полные геномные последовательности 1220 видов животных (включая 415 беспозвоночных и 805 позвоночных) на наличие интегрированных в их ДНК древних гепаднавирусных элементов (eHBV) [20].
Включение последовательностей eHBV в зародышевую линию ярче всего проявилось у рептилий — именно у них обнаружены наиболее длинные последовательности нуклеотидов, имеющие вирусную природу. Настолько значительное количество вирусных вставок генома может быть связано с особенностями передачи вируса в организмах пресмыкающихся и птиц. Вероятно, герпето- и авигепаднавирусы могли больше полагаться на вертикальную передачу через инфицирование клеток зародышевой линии, чем другие роды HBV. Ученые полагают, что это может быть связано с особенностями репродуктивной системы хозяев этих родов и механизмом формирования яйца с твердой скорлупой [21].
Еще более примечательно то, что элемент eHBV-Meta.1-Sauria, найденный у гаттерий и птиц, крайне похож на геном древних метагепаднавирусов. Это означает, что его включение в зародышевую линию произошло еще до эволюционного расхождения путей лепидозавроморфов и архозавроморфов, то есть более 280 млн лет назад! Это открытие делает eHBV-Meta.1-Sauria самым старым EVE из числа всех описанных на сегодняшний день. Полученные исследователями данные свидетельствуют о том, что вирус гепатита В циркулировал на Земле еще в палеозойскую эру (541–252 миллиона лет назад) [20] (рис. 6).
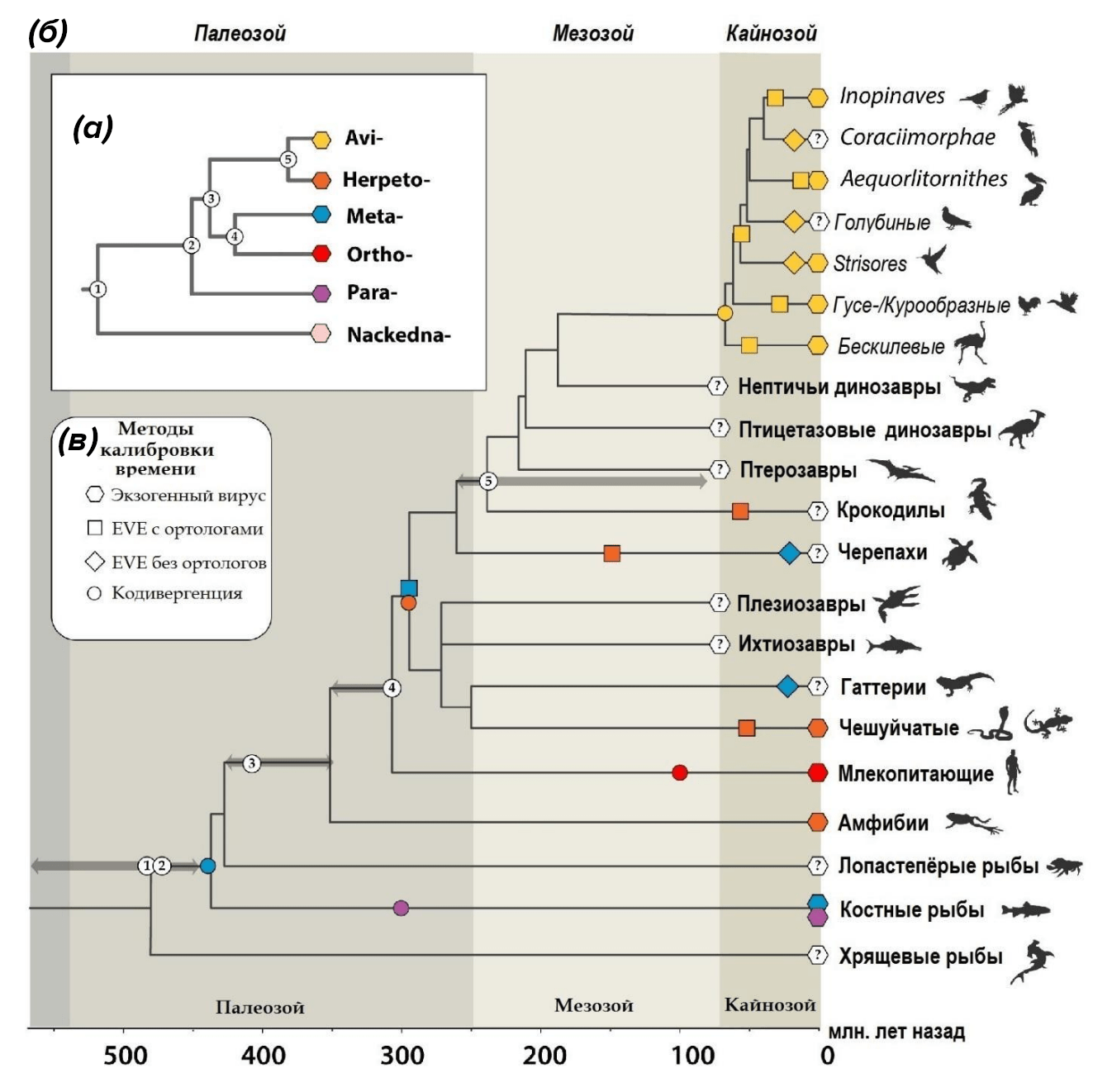
Рисунок 6. Хронология эволюции гепаднавирусов. а — эволюционные отношения между различными родами гепаднавирусов. Узлы пронумерованы в соответствии с калиброванной по времени филогенией позвоночных; б — временная характеристика эволюции вируса гепатита В. Цвета и фигуры указывают на роды гепаднавирусов в соответствии с обозначениями на блоках а и в; в — геометрические фигуры на ветвях обозначают четыре различных типа калибровки времени. EVE с отсутствующими ортологичными копиями (обозначенные ромбиками) не позволяют сделать вывод о минимальном времени эндогенизации, но, тем менее, указывают на присутствие гепаднавируса у предковых форм данной эволюционной линии. Цифры в белых кружках показывают предполагаемое расположение узлов на дереве гепаднавирусов по отношению к временной шкале эволюции позвоночных. Калибровки, основанные на предположении о кодивергенции, представлены кружками: (1) — метагепаднавирусы обнаружены у рыб и ящеров; (2) — парагепаднавирусы найдены у всех костистых рыб; (3) — герпетогепаднавирусы (основано на предположении, что вставка гепатитного генома возникла в результате межклассовой передачи от рептилий к амфибиям); (4) — ортогепаднавирусы присутствуют в основных линиях плацентарных млекопитающих. Серые стрелки, расположенные по бокам пронумерованных узлов, выделяют временной диапазон, в котором могла произойти соответствующая дивергенция родов вируса.
[20], рисунок адаптирован автором статьи
На рисунке 6a показано, что род Metahepadnavirus эволюционно формируется как относительно близкий сестринский таксон к ортогепаднавирусам млекопитающих. Раньше это широко интерпретировалось как свидетельство межвидовой передачи вируса гепатита от рыб к млекопитающим. Современный анализ генов-ортологов показал, что метагепаднавирусы не только циркулировали еще у предков рептилий, но и инфицировали их потомков. Это позволяет более просто объяснить современное разнообразие гепаднавирусов. Семейство Hepadnaviridae эволюционно разделилось на отдельные линии Meta-Ortho и Herpeto-Avi еще в палеозое, во время жизни последнего общего предка всех рыб и всех четвероногих, а затем эволюционировало уже совместно со своими группами хозяев. Такой феномен параллельной согласованной изменчивости известен нам как кодивергенция. Он был использован авторами исследования как один из методов определения времени расхождения различных родов вируса гепатита В [20].
Представленная на рисунке модель не исключает зоонозную передачу родственных гепаднавирусов (например, видов из одного и того же рода) между близкими группами хозяев. Филогенетический анализ по ортологичным EVE свидетельствует о том, что такая межклассовая передача герпетогепаднавирусов произошла, скорее всего, только между рептилиями и амфибиями. Это выглядит вполне логичным результатом, ведь мы знаем, что чем больше эволюционное расстояние между хозяевами, тем менее вероятно, что зоонозный переход вируса будет успешным [22].
Что же дальше?
Наука развивается стремительно. Одиннадцать лет назад мы считали, что гепаднавирусы появились на Земле чуть более 100 тысяч лет назад, до 2016 года все были уверены в их способности поражать только млекопитающих и птиц. Начало же третьего десятилетия XXI века открыло нам глаза на то, что вирус гепатита В возник на эволюционной арене нашей планеты задолго до воцарения на ней динозавров. Вместе с этим, открытия последних лет ставят перед нами новые вопросы. Ученым еще предстоит узнать, почему миллионы лет назад включение вирусных фрагментов HBV в геном организма хозяина было поддержано естественным отбором и закрепилось в рядах поколений на миллионы лет. Дальнейшие исследования в этой области могут улучшить наше понимание эпидемиологии гепатита, а также предсказать и побороть будущие вирусные эпидемии, подстерегающие человечество на нашем эволюционном пути.
Литература
- Bryant, H. N., Russell, A. P. (1992). The Role of Phylogenetic Analysis in the Inference of Unpreserved Attributes of Extinct Taxa. Philosophical Transactions: Biological Sciences, 337, 405–418;
- Seper Ekhtiari, Kentaro Chiba, Snezana Popovic, Rhianne Crowther, Gregory Wohl, et. al.. (2020). First case of osteosarcoma in a dinosaur: a multimodal diagnosis. The Lancet Oncology. 21, 1021-1022;
- Вирусные геномы в системе эволюции;
- A. Dupressoir, C. Lavialle, T. Heidmann. (2012). From ancestral infectious retroviruses to bona fide cellular genes: Role of the captured syncytins in placentation. Placenta. 33, 663-671;
- Ruben Bonilla Guerrero, Lewis R. Roberts. (2005). The role of hepatitis B virus integrations in the pathogenesis of human hepatocellular carcinoma. Journal of Hepatology. 42, 760-777;
- Не дружите, дети, с гепатитом B;
- Постановление Правительства РФ от 1 декабря 2004 г. № 715 «Об утверждении перечня социально значимых заболеваний и перечня заболеваний, представляющих опасность для окружающих»;
- Jade Pattyn, Greet Hendrickx, Alex Vorsters, Pierre Van Damme. (2021). Hepatitis B Vaccines. The Journal of Infectious Diseases. 224, S343-S351;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Arthur Kocher, Luka Papac, Rodrigo Barquera, Felix M. Key, Maria A. Spyrou, et. al.. (2021). Ten millennia of hepatitis B virus evolution. Science. 374, 182-188;
- Ofer Bar-Yosef. (1998). The Natufian culture in the Levant, threshold to the origins of agriculture. Evol. Anthropol.. 6, 159-177;
- Formijn J. van Hemert, Maarten A. A. van de Klundert, Vladimir V. Lukashov, Neeltje A. Kootstra, Ben Berkhout, Hans L. Zaaijer. (2011). Protein X of Hepatitis B Virus: Origin and Structure Similarity with the Central Domain of DNA Glycosylase. PLoS ONE. 6, e23392;
- Clément Gilbert, Cédric Feschotte. (2010). Genomic Fossils Calibrate the Long-Term Evolution of Hepadnaviruses. PLoS Biol. 8, e1000495;
- Alexander Suh, Jürgen Brosius, Jürgen Schmitz, Jan Ole Kriegs. (2013). The genome of a Mesozoic paleovirus reveals the evolution of hepatitis B viruses. Nat Commun. 4;
- Сколько сора в нашей ДНК;
- Lars Magnius, William S. Mason, John Taylor, Michael Kann, Dieter Glebe, et. al.. (2020). ICTV Virus Taxonomy Profile: Hepadnaviridae. Journal of General Virology. 101, 571-572;
- Jemma L. Geoghegan, Sebastián Duchêne, Edward C. Holmes. (2017). Comparative analysis estimates the relative frequencies of co-divergence and cross-species transmission within viral families. PLoS Pathog. 13, e1006215;
- Jennifer A. Dill, Alvin C. Camus, John H. Leary, Francesca Di Giallonardo, Edward C. Holmes, Terry Fei Fan Ng. (2016). Distinct Viral Lineages from Fish and Amphibians Reveal the Complex Evolutionary History of Hepadnaviruses. J Virol. 90, 7920-7933;
- In vivo — in vitro — in silico;
- Spyros Lytras, Gloria Arriagada, Robert J Gifford. (2021). Ancient evolution of hepadnaviral paleoviruses and their impact on host genomes. Virus Evolution. 7;
- Allison R. Jilbert, Georget Y. Reaiche-Miller, Catherine A. Scougall. (2021). Avian Hepadnaviruses (Hepadnaviridae). Encyclopedia of Virology. 100-111;
- Sudhir Kumar, Glen Stecher, Michael Suleski, S. Blair Hedges. (2017). TimeTree: A Resource for Timelines, Timetrees, and Divergence Times. Molecular Biology and Evolution. 34, 1812-1819.







