
Снижение затрат на иммуногистохимические исследования — японский подход
Одним из значимых диагностических методов сегодня является иммуногистохимия. Для быстроты, удобства постановки анализа и низкой стоимости японская фирма Nichirei Biosciences Inc. разработала оригинальное решение — Histofine. Приобрести продукцию возможно у официального дистрибьютора в России — компании Микротесты б.м.в.
Иммуногистохимия (ИГХ) — это методика исследования тканей на выявление клеточных или тканевых маркеров (антигенов) благодаря их связыванию с мечеными антителами, что оценивается с помощью световой или флуоресцентной микроскопии. Специфическое связывание антиген—антитело позволяет локализовать значимые молекулы (ферменты, гормоны, цитокины, транскрипционные факторы и др.) [1]. Подробнее «Биомолекула» об этом рассказывала в статье «Иммунологические технологии» спецпроекта «12 биологических методов в картинках» [2].
ИГХ имеет широкую применимость: молекулярная и клеточная биология, разработка лекарств, клиническая лабораторная диагностика. Так, ИГХ часто используется в медицине (онкологии) для обнаружения онкомаркеров, для диагностики опухолей неясного генеза, для определения типа опухоли и характера ее метастазирования, для прогнозирования ответа на терапию. Помимо этого, ИГХ в медицинской практике используется для диагностики инфекций (вирусы, бактерии, простейшие), нейродегенеративных заболеваний, травм мозга, мышечной дистрофии и др. В научных целях иммуногистохимию применяют для изучения фенотипических изменений ткани (дифференцировка клеток, рост, развитие и деление клеток, апоптоз), характера иммунного ответа, процесса заживления ран, отторжения тканей и взаимодействия ткани и биоматериала и т.д. [3], [4].
Несмотря на давнее начало применения (1941 г.), совершенствование метода ИГХ продолжается. Японская компания Nichirei Biosciences Inc. разработала и запатентовала технологию для ИГХ-окрашивания — иммуно-энзимный полимер, — позволяющую ускорить процесс и существенно снизить затраты на исследование. Анализ рынка подтверждает, что стоимость набора этого производителя в два раза ниже общерыночной. В предложении производителя целая линейка реактивов для ИГХ-исследований на тканях человека, и самые востребованные — серия N-Histofine® Simple Stain. Реактив основан на прецизионно приготовленных полимерах из аминокислот, меченных пероксидазой хрена или щелочной фосфатазой и конъюгированных с Fab-фрагментами вторичных антител. Реактив Histofine® Simple Stain Max Po может применяться с первичными мышиными или кроличьими антителами, а в комбинации с реактивом Histofine ® Simple Stain AP (M) может использоваться и для тройного мечения на одном срезе.
Для примера, три разных мышиных первичных антитела при разных локализациях (ядро, цитоплазма, мембрана) могут быть выявлены тетразолиевым синим, новым фуксином (красный цвет) и ДАБ (коричневый), что дает хорошие методические возможности.
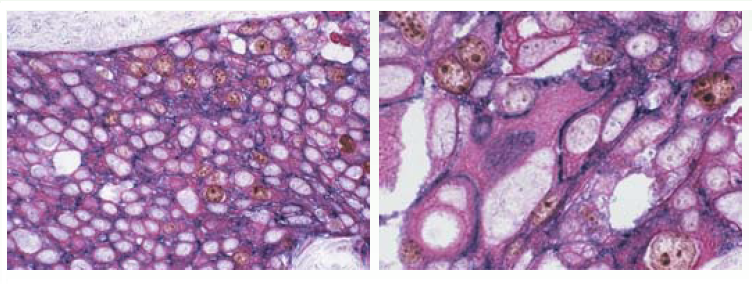
Рисунок 1. Плоскоклеточный рак шейки матки: бета-катенин окрашен BCIP/NBT (выделен синим цветом) цитокератин (AE1/AE3) — новым фуксином (выделен красным цветом), Ki-67 антиген — ДАБ (выделен коричневым цветом).
Наряду с полимерными системами Histofine, для тканей человека разработаны аналоги для тканей экспериментальных животных: мыши и крысы продолжают оставаться самыми частыми объектами исследований (см. статью спецпроекта «Биомолекулы» «Модельные организмы: грызуны») [5]. Применение первичных мышиных антител может вызвать проблемы. В этом случае особенно ценной будет возможность использования Histofine® Mousestain kit, который гарантирует использование первичных мышиных антител на ткани мыши. Это нашло отражение в многочисленных исследованиях японского общества токсикологов-патологов [6], [7].
Хромогены (диаминобензидин, аминоэтил карбазол, новый фуксин, BCIP/NBT) подобраны производителем в оптимальном формате, что позволяет максимально быстро провести заключительный этап выявления антигена.
Принцип метода не отличается от общепринятого:
- Заключение в парафин фиксированной в формалине ткани или заморозка свежей ткани.
- Приготовление среза ткани.
- Температурная демаскировка антигенов. Промывка в PBS.
- Забивка неспецифических антигенов (3% раствор перекиси водорода для блокировки эндогенной пероксидазы). Промывка в PBS.
- Добавление первичных антител во влажной камере. Трехкратная промывка в PBS.
- Добавление реактива Histofine (усилитель первичных антител, вторичные антитела и фермент). Промывка в PBS.
- Контрастное окрашивание с помощью хромогена в субстратном буфере Histofine.
- Заключение гистологических срезов в заливочную среду.
- Анализ результатов на световом микроскопе.
Преимущества системы Histofine® Simple Stain:
-
Уменьшение количества этапов выполняемого протокола. Объединены этапы применения вторичных антител, использования фермента и амплификации сигнала (реактивы в одном флаконе). Реактив не требует предварительного разведения, готов к использованию. Это способствует упрощению и ускорению проведения анализа.
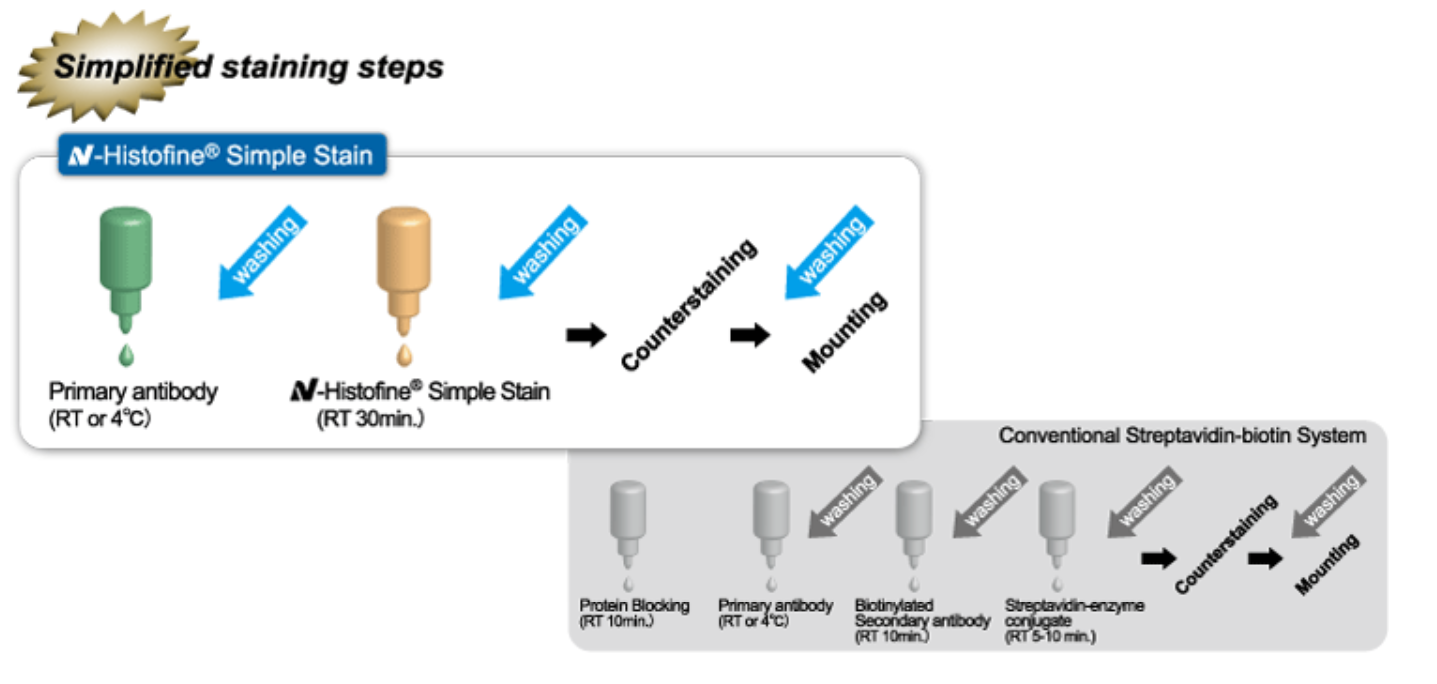
Рисунок 2. Реактивы Histofine® Simple Stain уменьшают количество этапов протокола
-
Высокая чувствительность и высокий сигнал. Ферментная метка выявляется во многих участках аминокислотного полимера, имеющего конфигурацию «грозди винограда», что обеспечивает амплификацию сигнала и высокую чувствительность.
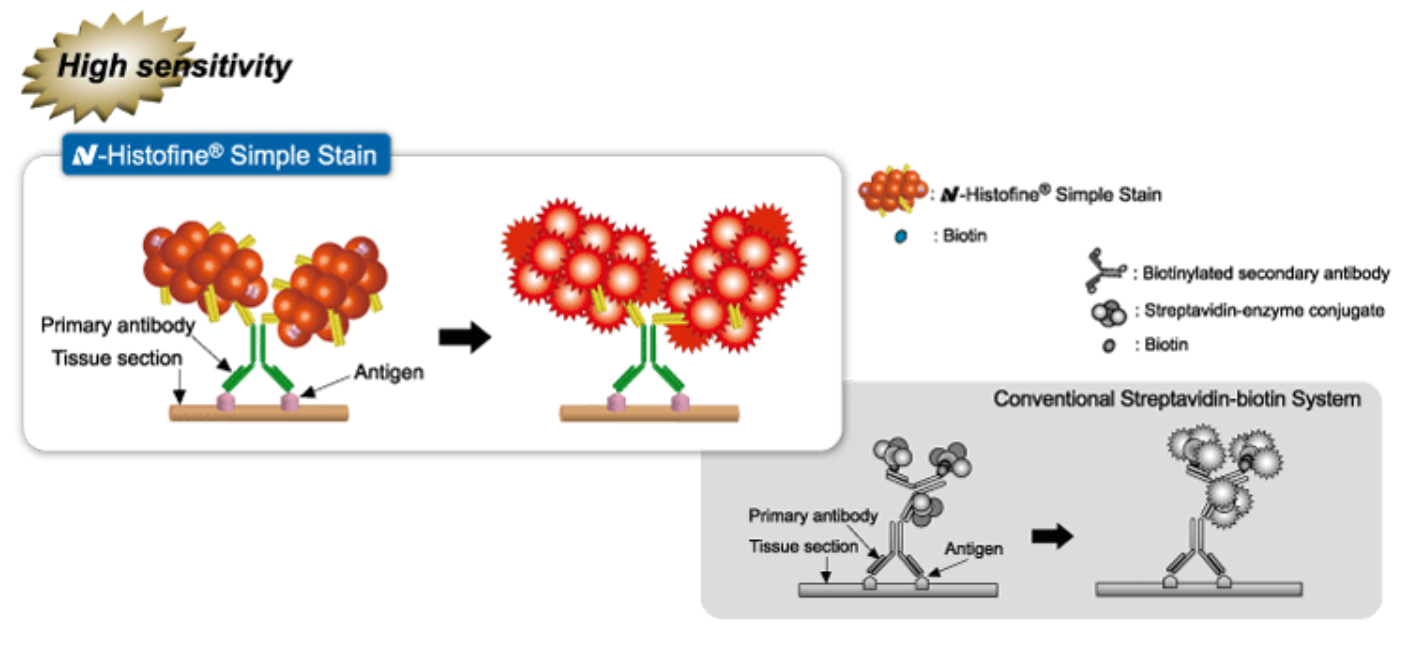
Рисунок 3. Выявление ферментной метки
-
Чистота сигнала. Не требуется проведение этапа блокирования эндогенного биотина (безбиотиновая система). Уменьшать вероятность фонового окрашивания позволяет использование Fab-фрагментов вторичных антител и использование полимера из аминокислот в отличие от молекулы декстрана. Полноразмерные IgG молекулы способны к опсонизации с Fc-рецепторами на поверхности лейкоцитов; использование Fab-фрагментов позволяет этого избежать. Аминокислотный полимер, по сравнению с традиционно используемой молекулой декстрана, отличается меньшими размерами, что обеспечивает более высокую степень диффузии при отмывке.
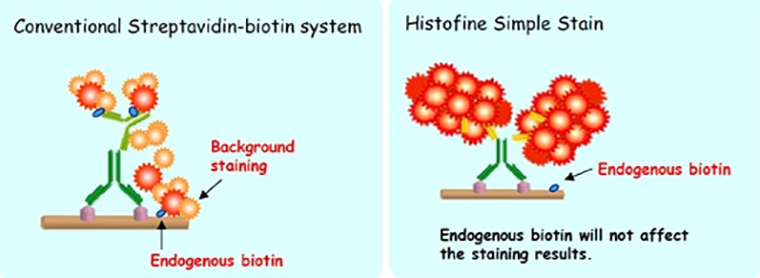
Рисунок 4. Фоновое окрашивание
-
Поливалентность вторичных антител расширяет возможности лаборатории в выборе первичных антител (использование мышиных или кроличьих первичных антител).

Рисунок 5. Поливалентность антител
Ассортимент
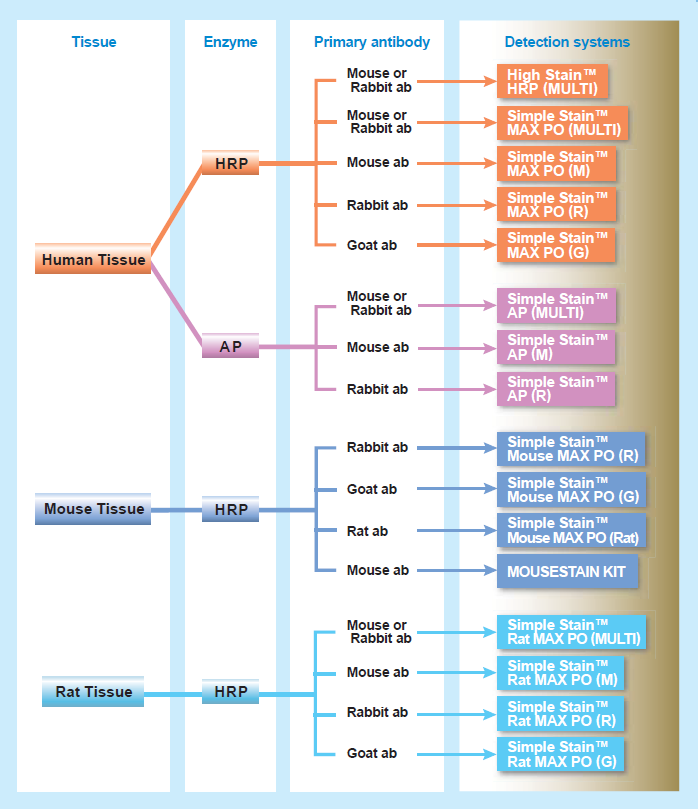
Рисунок 6. Ассортимент реактивов. Реактивы предназначены как для диагностики in vitro, так и для исследовательских целей, имеют регистрационное удостоверение в России.
Этапы работы с реактивом Histofine® Simple Stain MAX PO: объясняют сотрудники «Микротестов».
Приобрести продукцию Histofine производителя Nichirei Biosciences Inc. вы можете у официального дистрибьютора в России — компании «Микротесты б.м.в.»
Литература
- Aikawa E . Methods of Analysis in Comprehensive Biomaterials (Volume). Immunohistochemistry, 2011. P. 277–290.
- 12 биологических методов в картинках
- Lewis T.L., Roth K.A. Immunohistochemical Detection Methods. University of Alabama at Birmingham, Birmingham, AL, USA, 2014. P. 3829–3840
- Duraiyan J., Govindarajan R., Kaliyappan K., Palanisamy M. Applications of immunohistochemistry. J Pharm Bioallied Sci., 2012. P.307–S309
- Модельные организмы: грызуны
- Furukawa S., Nagaike M., Ozaki K. (2017). Databases for technical aspects of immunohistochemistry. Journal of Toxicologic Pathology. 1, 79–107
- Takayasu M., Saori M., Hirofumi H., Kiyokazu O. (2021). Databases for technical aspects of immunohistochemistry. Journal of Toxicologic Pathology. 2, 161–180



