
Модельные организмы: грызуны
02 ноября 2020
Модельные организмы: грызуны
- 3141
- 0
- 8
Грызуны — родственники приматов, верные помощники в медицине. Классика модельного организма!
иллюстрация Ксении Сайфулиной
-
Автор
-
Редакторы
-
Иллюстратор
Когда редакция «Биомолекулы» предложила мне написать эссе об использовании грызунов в качестве модельных организмов, я согласился легко и сразу. Тема казалась простой, находящейся буквально на кончиках пальцев — уже больше двенадцати лет я ежедневно держу в руках мышей или крыс, организую и провожу различные исследовательские проекты с ними, пишу и редактирую статьи, в которых они в качестве тех самых модельных организмов и упоминаются. А до того я работал с грызунами в полевых условиях, но это уже совсем другая история...
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!

Партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Трудно дело крысолова — Модель в мыши, а мышь в модели — Модельная этика — Сделай сам — Старый друг лучше новых двух — А как же COVID? — За разнообразие!
«По данным Еврокомиссии, из 9,39 млн лабораторных животных, использованных за 2017 год в Евросоюзе, 61% — это мыши и еще 12% — крысы, — бодро начал я. — Слово mice упоминается в названии статей из базы PubMed 1 704 242 раза, слово rat — 1 765 479 раз». В этот момент меня отвлекли — необходимо было принимать тех самых крыс, поступивших в нашу лабораторию из питомника. Вернуться к компьютеру я смог только через несколько часов. Написанное начало показалось мне неудачным. Какая разница, сколько животных тратят европейские лаборатории в год? Разве в этом дело? Я всё стер и начал по новой.
«Лабораторные крысы происходят от диких особей вида Rattus norvegicus, все лабораторные мыши принадлежат к виду Mus musculus. Родина и тех и других — Юго-Восточная Азия . И тот и другой вид давно стали синантропными, и в историческое время распространились вместе с человеком по всему земному шару. Человек с ними всегда боролся, иногда содержал для развлечения, и из этих — развлекательных — грызунов и получились первые животные для исследований, причем с мышами это произошло на 100 лет позже, чем с крысами». На этом месте я вспомнил, что авторы цикла — например, в предисловии к тексту про модельных птиц [1], — призывали не копировать стиль «Википедии». Снова выходило не то.
Вообще, интересное место эта Юго-Восточная Азия. По меньшей мере четыре листа из календаря посвящены выходцам из этой части света.

Рисунок 1. В процессе работы над этим текстом я попытался найти первую научную публикацию, посвященную мышам и крысам. Это руководство официального рэткэтчера английского королевского флота Томаса Суэйна увидело свет в 1783 году. Вероятно, были и более ранние публикации...
Я с удивлением понял, что для меня написать текст о значении лабораторных грызунов для биомедицинской экспериментальной науки чрезвычайно сложно. Так же сложно, как если бы кто-то попросил меня написать о роли в моей бытовой жизни интернета или электричества. Есть вещи, которые вошли в жизнь настолько прочно и бесповоротно, сделались такими привычными и незаменимыми, что любая попытка полного описания их роли обречена на провал. И я решил рассказать о событиях из моей научной жизни последнего года, связанных так или иначе с ролью грызунов в качестве модельного организма в биомедицинской экспериментальной работе. Я надеюсь, что этот срез, не претендующий на полноту охвата, это лоскутное одеяло, поможет читателю понять, как глубока и разнообразна роль грызунов в современной науке.
Надо не только видеть в мыши биомодель, но и в биомодели уметь разглядеть мышь
В декабре 2019 года, последнем спокойном месяце современности, я был в Цюрихе на конференции Швейцарской ассоциации специалистов по лабораторным животным (SGV) (подробнее про ассоциации см. в следующем разделе). Это одна из самых старых, многочисленных, и, что немаловажно, богатых ассоциаций Европы. SGV может позволить себе приглашать лучших спикеров. Наиболее впечатляющим для меня был доклад об исследованиях восприятия боли среди лабораторных грызунов. Надо сказать, что в большинстве биомедицинских исследований, хотя животных и называют объектом, по сути они являются средством для обнаружения интересующих исследователя закономерностей. Просто говоря, в биомедицинских исследованиях мыши и крысы выступают в качестве средства измерения. Поэтому любые исследования, в которых животные интересуют исследователя все-таки как объект в полном смысле этого слова, не оставляют меня — зоолога — равнодушным. В исследовании, о котором идет речь, задачей было изучение контекстного восприятия боли. Исследования социальных феноменов на мышах имеют давнюю историю, можно вспомнить одиозные эксперименты Джона Кэлхуна с «мышиным раем» в 1960-х. Современные работы этого направления, конечно, отличаются бóльшим изяществом, но цель имеют примерно ту же — понять взаимовлияние и взаимозависимость индивидуумов в социуме.
В работе, о которой идет речь, было показано, что, например, когда мышку бьют током в камере, а на следующий день в этой же камере производят другое болевое воздействие, восприятие этого нового воздействия (и генерируемый стресс) модифицируется предыдущим опытом. То есть животные, помещенные в контекст, связанный с предыдущими негативными впечатлениями, переживают новую боль тяжелее, чем «наивные» особи. Схожие по дизайну эксперименты провели также с людьми-добровольцами. У них тоже обнаружили гиперсенситизацию, однако, что интересно, в обоих случаях это явление наблюдалось у самцов, но не у самок. Поэтому, например, для мужчины ходить каждую неделю в один и тот же зубной кабинет не то же самое, что для женщины [2].
Исследования этого направления могут показаться отвлеченными от реальности, однако они важны, в первую очередь, для понимания механизмов восприятия и формирования собственного психологического состояния. Кроме того, они помогают выяснить, как обеспечить животным благополучие, которое крайне важно не только с точки зрения этических соображений, но и для обеспечения достоверности экспериментальных данных.
В одной из последних работ, выполненных в Университете Ньюкасла , показано, что мыши, находящиеся в неблагополучных условиях, хуже переносят негативные воздействия, в то время как их реакция на позитивное подкрепление не отличается от контроля [3]. Это важно, поскольку экспериментальные воздействия на животных чаще всего носят негативный характер, и чтобы делать выводы, важно понимать, в какой степени реакция животных обусловлена условиями содержания.
Университет Ньюкасла известен всем специалистам по лабораторным животным в качестве основного центра по изучению благополучия грызунов в лабораториях и его влияния на результаты исследований. В этом университете разработаны общепринятые теперь неинвазивные методы распознавания боли у лабораторных грызунов, предпочтительные методы хэндлинга и т.д. Страница руководителя этого направления Пола Флекнела на ResearchGate должна быть в закладках браузера каждого, кто интересуется современными технологиями научной работы с грызунами.
Существует отдельное направление работ, связанное с обнаружением оптимистов и пессимистов среди крыс. В нескольких остроумных опытах было показано, что крысы-оптимисты воспринимают нейтральный сигнал в качестве предвестника чего-то хорошего, пессимисты — наоборот, считают, что любая новость — к плохому. При кажущейся банальности этого подхода («Смеющиеся крысы — это оптимисты» — так называется одна из статей [4]) вопросы здесь поднимаются серьезные. Если оптимистическое (или пессимистическое) состояние животных формирует мотивацию и модулирует восприятие, в какой степени это может повлиять на результаты исследований [5]?
Наконец, я хотел бы упомянуть и мое любимое в этой теме — использование роботов iRat (!) для исследования того, насколько партнер должен быть похож на животное, чтобы с ним возникла устойчивая социальная связь (спойлер: может быть вообще не похож!). Хорошая статья с обзором этого направления недавно вышла на «Элементах» [6].
Этика использования грызунов в экспериментах
У любого нормального читателя к этому моменту уже должен возникнуть вопрос — а допустимо ли в XXI веке причинять животным страдания, пусть и в научных целях? И кто вообще решает — что можно в этом отношении, а что — нет?
Действительно, со времен Томаса Суэйна (рис. 1) представления в обществе о том, что этично в отношении животных, а что — не очень — существенно изменились. В то же время, общественная дискуссия вокруг использования животных в научных целях приобрела известную остроту. Кто же судьи?
В большинстве стран имеются общественные организации — ассоциации специалистов по лабораторным животным (laboratory animal science association). Они объединяют исследователей, ветеринарных врачей, специалистов в области этики и права, производителей и разработчиков научного оборудования и др. — всех, чья работа так или иначе связана с экспериментами над животными. Наряду с разработкой собственно научных вопросов ассоциации занимаются созданием гуманных экспериментальных практик, нормативов и рекомендаций по уходу за животными, просветительской и образовательной деятельностью.
В мае 2020 года я представлял нашу ассоциацию — Rus-LASA — на заседании правления Федерации европейских ассоциаций специалистов по лабораторным животным (FELASA) .
FELASA — самая влиятельная в мире общественная организация в области использования животных в научных целях. Она основана в 1978 году представителями британской, скандинавской и немецкой ассоциаций. На сегодняшний день в FELASA входит 21 национальная ассоциация из различных европейских стран. FELASA формирует рекомендации по различным аспектам научной работы с животными, которые, как правило, принимаются научным сообществом за стандарт (самый известный пример — рекомендации по мониторингу здоровья лабораторных грызунов FELASA, которые получили всемирное признание). FELASA является безусловным авторитетом в вопросах подготовки специалистов по работе с животными.
Биоэтический подход к экспериментам на животных идеологически основан на принципе 3R, сформулированном Расселом и Берчем почти 60 лет назад. 3R — это Refinement, Replacement и Reduction, только с учетом накопленного за это время огромного опыта.
Reduction — это любые подходы, позволяющие уменьшить количество животных, необходимых для работы. Сюда относится выбор адекватной модели, соблюдение стандартов работы, уменьшающих ошибки, обязательное обнародование всех результатов во избежание дублирования экспериментов и прочее.
Refinement — это улучшение условий содержания (то самое благополучие животных, о котором шла речь в предыдущем разделе), применение менее инвазивных методов, внедрение прогрессивных методов обезболивания.
Наконец, Replacement — это подходы, позволяющие исключить животных из экспериментов: разнообразные альтернативы — культуры клеток и тканей, химические тест-системы, модели — реальные и in silico [7]. Это наиболее интенсивно растущее направление «гуманизации» работы с животными. Базы валидированных альтернативных методов доступны ученым, они активно пополняются — например, британская NC3Rs или норвежская Norecopa.
По поводу этой последней R — Replacement — в обществе существует активная дискуссия: можно ли уже сейчас полностью отказаться от животных в качестве экспериментального объекта. Заметим, что строго научный взгляд на это вопрос дает однозначный ответ — мы еще долго будем вынуждены использовать животных в своих исследованиях (вот одна из аналитических статей, исследующая замещение животных в экспериментах компьютерными моделями). Что совершенно не отменяет необходимости снижать, насколько это возможно, страдания, причиняемые животным.
По данным Еврокомиссии, на которые я ссылался выше, абсолютное количество животных, потраченных в исследовательских целях, год от года растет, но уменьшается удельное количество животных на одно исследование и доля тяжелых процедур среди всех исследовательских манипуляций. Можно говорить о том, что животных со временем будут расходовать больше, но гуманнее и эффективнее.
Как руководящим принципом в поиске адекватной биологической модели стало «сделай сам»
Наверное, самый главный фактор, обеспечивший триумфальное шествие грызунов по современным биомедицинским лабораториям, — возможности генетической модификации. В конце XX века появились и сразу получили огромное распространение технологии, позволяющие направленно, заданным образом модифицировать генетический материал животных [8]. Судьба распорядилась так, что на первых этапах развития технологий модификации генома мыши имели огромное преимущество перед другими млекопитающими.
Сначала генетически модифицированных млекопитающих получали, подсаживая нужным способом измененные эмбриональные стволовые клетки в бластоцисту (именно этот способ изображен в календаре на рисунке 5). При этом работать с мышами было гораздо проще, чем с другими животными — их клетки легко выделить в культуру, они хорошо в ней живут и легко модифицируются, сами мыши плодовиты, и цикл размножения у них достаточно короткий. Для современных методов получения ГМ-животных (например, с помощью CRISPR/Cas9) эти преимущества уже не так важны, и сейчас мы имеем в лабораториях не только ГМ-мышей, но и крыс [9], кроликов [10], собак, кошек и даже приматов [11]. Однако рывок на старте до сих пор обеспечивает мышам невероятное преимущество среди других видов ГМ-животных. Об этой инертности научных технологий нам еще придется поговорить.
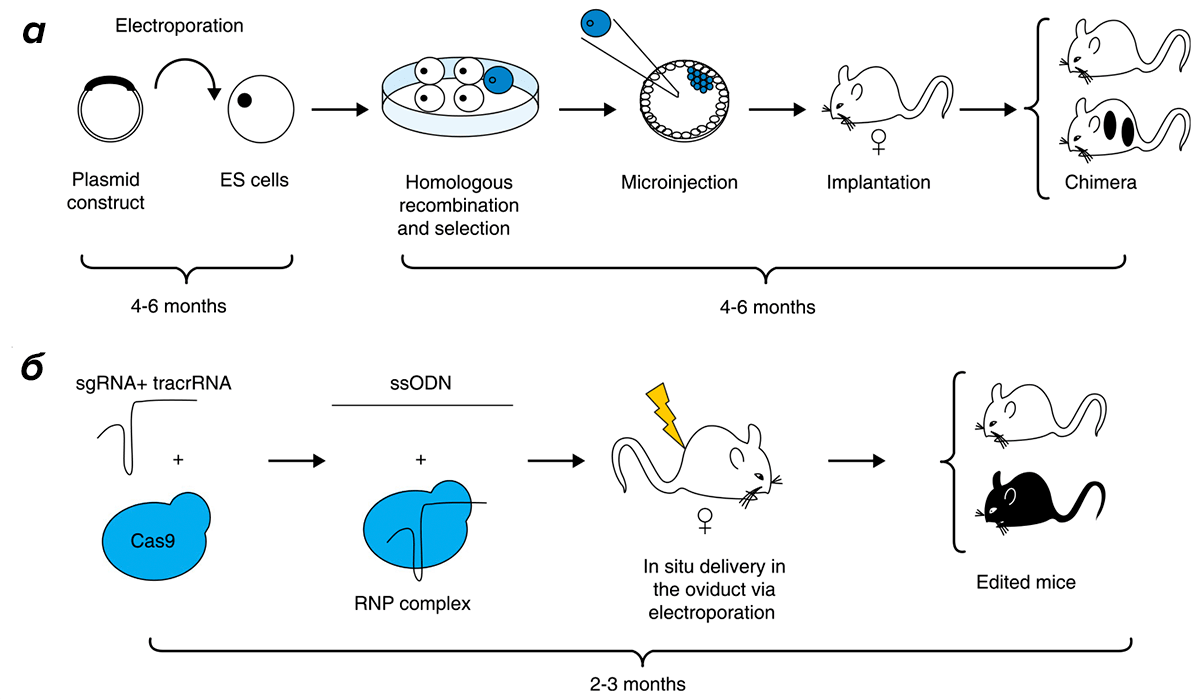
Рисунок 2. Появление технологии CRISPR/Cas9 позволило получать трансгенных мышей быстрее и дешевле, а кроме того делать саму генетическую модификацию более точной. а — Классический путь получения трансгенных мышей предполагает модификацию эмбриональных стволовых клеток, подсадку модифицированных клеток в бластоцисту и получение химерного поколения мышей, которые через ряд возвратных скрещиваний могут дать (а могут и не дать!) начало трансгенной линии. Подробности этого подхода см. в статье «Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей» [8]. б — Использование технологии CRISPR/Cas9 позволяет модифицировать эмбрионы непосредственно в организме матери и получать основателей трансгенной линии уже в первом поколении.
Совсем недавно, в начале октября 2020 года, мы проводили конференцию нашей — российской — ассоциации специалистов по лабораторным животным (Rus-LASA) в небольшом уютном наукограде Пущино на юге Московской области. Заглавный доклад в секции, посвященной трансгенным животным, делал мой друг Борис Скрябин, который руководит лабораторией трансгенеза Вестфальского университета в Мюнстере. Я пригласил его потому, что Борис в своих исследованиях неоднократно показывал, что при модификациях генома с помощью современных технологий появляется довольно много «недокументированных» изменений, которые сложно обнаружить традиционными методами генотипирования [12]. К примеру, в этой работе были созданы шесть кондиционных нокаутов (см. ниже) с помощью метода CRISPR/Cas9. При анализе получившихся линий авторы нашли множественные вставки фрагментов донорской ДНК, которые нельзя было обнаружить с помощью стандартного протокола генотипирования.
В связи с этим интересно проследить, как менялся подход к созданию генетически модифицированных моделей в процессе изменения взглядов в функциональной геномике. В эпоху создания технологий модификации генома считалось, что важной — смысловой — частью ДНК являются только гены в узком смысле, то есть — последовательности, кодирующие белок, которые, как известно, составляют лишь 2% длины ДНК [13]. Остальной ДНК отводилась в лучшем случае структурная роль (появился даже термин junk DNA — «мусорная ДНК»). В эту эпоху основной подход заключался в том, чтобы «выключить» — сломать — определенный ген и посмотреть, каким образом эта поломка скажется на жизни получившейся мыши (описать ее фенотип — фенотипировать).
В процессе создания таких мышей генотипировали, чтобы подтвердить, что поломка интересующего гена действительно произошла. Для этого часто было достаточно показать, что в образцах ткани получившихся мышей отсутствует соответствующий белок, то есть нужный ген не экспрессируется. Исследователей не интересовало ни то, как именно сломан ген, ни то, какие изменения в геноме произошли за пределами этого гена. Такой подход получил название «нокаут» (knock-out — «выключение»), а мышей, соответственно, стали называть нокаутными. Для многих нокаутных мышей, дошедших до нас от той эпохи, мы даже как следует не знаем полной картины изменения генотипа.
Следующим важным шагом было создание так называемых кондиционных нокаутов — мышей, которые фенотипически не отличаются от дикого типа, но могут в нужный исследователю момент в нокаутных превратиться. Это достигается путем вставки в мышиный геном «мины замедленного действия» — механизма модификации, который в любой момент может быть активирован исследователем (например, путем инъекции специального вещества). Более того, этот механизм может быть специфически активирован в строго определенных тканях. С появлением кондиционных нокаутов арсенал исследователей значительно расширился. Во-первых, появилась возможность работать с генами, классические нокауты по которым летальны. Во-вторых, стало возможным, выключая ген на разных этапах онтогенеза, проследить его роль в процессах роста и развития. В-третьих, прицельно выключая ген в отдельных тканях, можно было понять особую роль соответствующего белка в конкретной ткани и механизмы его влияния на весь фенотип.
Но и это еще не конец. По мере накопления генетически измененных мышей и, соответственно, научных данных, стало понятно, что вся ДНК имеет значение, и сломанный одним способом ген не равен тому же гену, поврежденному другим путем. Например, нокаутные животные, полученные с помощью поломки разных экзонов одного и того же гена часто имеют выраженные фенотипические различия [14]. Да и изменения в некодирующих областях [15], даже если это изменения всего одного нуклеотида [16], могут иметь последствия.
В настоящее время данные по генетически модифицированным линиям лабораторных животных и результатам их фенотипирования объединены в обширные базы знаний, доступные каждому исследователю. Пример такой базы — Mousephenotype. На сегодняшний день в ней анонсированы результаты фенотипирования нокаутов по 7022 генам, и их число растет буквально каждый день. Можно подумать, что в конечном итоге будут созданы и исследованы нокауты по всем известным генам, и исследователям останется только выискивать в базах подходящие фенотипы. Однако соображения о фенотипической значимости даже самых, казалось бы, несущественных генетических различий между линиями, а также активно появляющиеся данные о «недокументированных изменениях», возникающих в процессе генетической модификации, заставляют задуматься. В самом недалеком будущем хорошим тоном будет считаться создание нескольких хорошо генотипированных трансгенных линий под каждую исследовательскую задачу. Наблюдаемые фенотипические различия между этими линиями, вероятно, могут стать основой функциональной геномики.
Старые друзья и новые напасти
В самом начале 2020 года мы столкнулись с новой, невиданной ранее инфекцией. Довольно быстро стало понятно, что начавшаяся пандемия затронет всех. И сразу же биомедицинские лаборатории по всему миру включились в работу над приемами профилактики и лечения новой болезни. Процесс этот никак не мог обойтись без биологических моделей.
Что же привнесли грызуны в понимание и лечение COVID-19 за прошедшие десять месяцев?
Надо сказать, что крысы и мыши из общих соображений не являются перспективными участниками антиковидных исследований. Они не умеют чихать и кашлять. Ранее — при исследованиях гриппа — было показано, что патологическая картина ОРВИ у мышей существенно отличается от человеческой. В частности, воспаление легких у этих грызунов развивается совсем по-другому. Но главное — рецептор АСЕ2 (ангиотензинпревращающий фермент 2), через который, собственно, вирус проникает внутрь клетки, у мышей существенно отличается от человеческого, и поэтому мыши новым коронавирусом не заражаются и не болеют. На этом, казалось бы, и должна закончиться история грызунов в исследованиях нового коронавируса , однако не тут-то было.
На «Биомолекуле» вышло внушительное число статей по вирусу SARS-CoV-2, с которыми мы и предлагаем ознакомиться читателю.
В дело пошел принцип, вынесенный мною в заголовок предыдущего раздела — каждый сам творец своей биомодели. И первые подходы к экспериментальным исследованиям в области диагностики и лечения COVID-19 выполнены опять-таки на мышах.
Довольно быстро были созданы трансгенные мыши, экспрессирующие человеческий вариант рецептора АСЕ2 [17]. Оказалось, что эти мыши не только заражаются коронавирусной инфекцией, но и демонстрируют сходную с человеком картину патологии. Сейчас эти мыши (и еще несколько других линий, среди которых есть и одна отечественная разработка) активно используются в исследовании COVID-19. Утверждают, что их применение позволило выработать некоторые терапевтические подходы, в частности — использование стероидов в клинике. Я надеюсь и даже уверен, что использование трансгенных мышей в этой области приведет к дальнейшим успехам. К тому же в процесс включились и другие грызуны (см. ниже раздел о сирийских хомячках). Мне же, живописующему значение грызунов в качестве биомоделей, кажется важным сделать два замечания общего плана.
Во-первых, замечательна инертность исследовательской технологии. В случае, когда мыши не являются оптимальной моделью, исследователи согласованно предпочитают работать... все равно на мышах. Это происходит потому, что в какой-то момент накопленный бэкграунд — знания по общей биологии вида, технологии содержания и генетической модификации, инфраструктура — реагенты, инструменты, да и виварии тоже, — всё в биомедицинских лабораториях оказалось «мышеориентировано». Поэтому, думаю, мышь еще долго будет оставаться на первом месте среди прочих лабораторных животных (рис. 3).

Рисунок 3. Лабораторная мышь еще долго не сойдет со своего пьедестала. На фото — памятник мыши возле Института цитологии и генетики СО РАН в Новосибирском Академгородке. Рекомендуем также почитать статью «Грызун особого назначения» на «Биомолекуле» [18].
фото Ирины Гельбух
Во-вторых, на наших глазах происходит трансформация термина «гуманизированные животные». Этот термин изначально применялся к иммунодефицитным мышам, в которых выращивали человеческие клетки, ткани и даже органы. Сегодня же гуманизированными называют трансгенных животных, которые несут человеческие гены, фрагменты генов, или даже полиморфизмы. В этом смысле мыши, несущие человеческий АСЕ2, безусловно, могут называться гуманизированными.
Чтобы закончить разговор о COVID и лабораторных животных, скажем, что активистами из European Animal Research Association (EARA) создана интерактивная карта мира, на которой отображены все биомедицинские проекты, использующие животных в исследованиях COVID-19. Она позволяет понять реальный масштаб использования различных биомоделей в этом направлении.
За разнообразие
В сентябре я участвовал в аудите фармакологического института недалеко от Санкт-Петербурга. Институт занимается доклиническими и трансляционными исследованиями. Моделируя человеческие патологические состояния, исследователи тестируют эффективность и безопасность потенциальных лекарственных средств. Особенное впечатление на меня произвело то, что, помимо традиционных мышей и крыс, в институте содержали еще более десятка разных видов, бóльшая часть из которых относилась к грызунам.
Под конец мы должны сказать несколько добрых слов про других грызунов — не крыс и не мышей, — которые тоже присутствуют в биомедицинских лабораториях и являются полноправными участниками исследований (рис. 4).
Монгольская песчанка — Meriones unguiculatus — самый симпатичный из грызунов, встречающихся в лабораториях. Песчанки приспособились для обитания в пустынях и представляют собой хорошую модель для тестирования противосудорожных препаратов из-за спонтанно проявляющейся эпилепсии. Песчанки также выступают классической моделью для исследования некоторых возбудителей инфекционных болезней. Однако самая важная их особенность — незамкнутый Виллизиев круг, снабжающий мозг артериальной кровью. Эта их анатомическая особенность приводит к тому, что перевязка левой сонной артерии вызывает острую ишемию мозга — патологию, которую смоделировать у крыс или мышей гораздо сложнее [19].
Дегу (Octodon degus) — южноамериканский грызун, иногда их называют чилийскими белками. Суперспособность дегу — низкая аффинность рецепторов инсулина к своему лиганду. Видимо, естественный рацион дегу обогащен белками, поэтому сдвиг диеты в сторону углеводов вызывает гипергликемию и как следствие — сахарный диабет. Классические модели диабета на грызунах (например стрептозотоциновый диабет) предполагают довольно тяжелое комплексное воздействие на организм. В случае дегу можно легко вызвать диабет «естественным» путем. Поэтому они стали очень хорошей моделью инсулин-зависимого диабета и сопутствующих патологий — нефропатии, катаракты и т.д. [20].
Иглистая мышь (Acomys cahirinus) — африканский житель. Эти мыши, так же как и дегу, получили распространение в исследованиях диабета и ожирения, но в последнее время внимание исследователей всё больше и больше привлекают две другие их уникальные особенности. Во-первых, это зрелорождающие грызуны. В отличие от классических мышей, у акомисов мышата рождаются зрячими, покрытыми шерстью и способными к самостоятельному передвижению. Поэтому их активно используют в исследованиях онтогенеза, созревания ЦНС и влияния на эти процессы различных факторов. Во-вторых, в процессе содержания акомисов в лабораториях было обнаружено, что раны у них на коже заживают существенно быстрее по сравнению с обычными мышами, и сам процесс заживления сопровождается восстановлением структуры кожи, а не образованием рубца. Механизм этого явления сейчас активно изучается и делает акомисов крайне интересной моделью в русле регенеративной медицины [21].
Морская свинка (Cavia porcellus) имеет огромные заслуги перед человечеством — ей мы обязаны открытием витамина С и туберкулезной палочки. Морские свинки (кстати, как и песчанки) слышат в том же диапазоне частот, что и люди — это позволяет использовать их в исследованиях слуха. Благодаря работам с морскими свинками Георг фон Бекеши получил в 1961 году Нобелевскую премию по медицине за исследование физических механизмов восприятия звука. В настоящее время морские свинки в основном применяются в связи с их чувствительностью к аллергенам, особенно ингаляционным, которые получают с вдыхаемым воздухом [22].
Сирийский (или золотистый) хомячок (Mesocricetus auratus) тоже имеет ряд уникальных достоинств. К примеру, строение желчевыводящих путей и протоков поджелудочной железы у представителей этого вида очень похоже на человеческое. Однако наибольшую популярность они приобрели тем, что крайне сходным с нами образом реагируют на заражение вирусами, в особенности — РНК-вирусами млекопитающих [23]. Это уникальное свойство сирийских хомячков практически вытолкнуло их на передний край борьбы с новой коронавирусной инфекцией [24].
Голый землекоп (Heterocephalus glaber) — грызун, внешность которого еще более экзотична, чем название, хотя и вполне ему соответствует. Этот вид, хорошо известный зоологам с 60-х годов ХХ века в качестве единственного примера эусоциальности среди позвоночных, в последние годы стал объектом многочисленных биомедицинских лабораторных исследований. Дело в том, что голые землекопы обладают невероятно большой продолжительностью жизни, и при этом умудряются избежать сопутствующих возрастных заболеваний. У них нет или почти нет онкологических, нейродегенеративных заболеваний и сердечно-сосудистых возрастных патологий. Поэтому многие исследователи считают, что голый землекоп владеет секретом активного долголетия, и пытаются у него этот секрет выведать [25]. Тем, кто еще не устал, мы предлагаем прочесть об этой зверюшке статью «Преодолевшие старение. Часть II. Дети подземелья» [26] и посмотреть комикс «О Нестареющих» [27].
Заключение
Когда ж закончил я рассказ,
То кое-кто спросил: «И все?
Ты говорил тут целый час,
А рассказал ни то ни се!..»
Борис Заходер
Очень много важного, касающегося грызунов как биомоделей, осталась за пределами моего рассказа. Каждое лекарство, которое находится в моей домашней аптечке, проходило через организмы многих сотен крыс и мышей. Через две недели приедут слушатели на курс повышения квалификации — они будут учиться работать, используя этих самых животных. Да и научные проекты идут в ежедневном режиме... Обо всем этом я не сказал ни слова, а можно было бы написать по каждому вопросу еще такую же статью. Однако мне кажется, что такой — отстраненный — взгляд важен, когда мы пытаемся рассуждать о роли грызунов в качестве биологических моделей. Новые научные данные появляются с такой скоростью, что исследователь, формирующий общий взгляд, рискует утонуть в частностях и не увидеть за деревьями леса.
Рисунок 5. Мышь и крыса — герои календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, амадина уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
иллюстрация Ксении Сайфулиной
Благодарности
Я благодарен моим друзьям, с которыми мы когда-то создали ассоциацию специалистов по лабораторным животным (Rus-LASA) — Максиму Ловатю и Екатерине Кушнир из МГУ, Марине Красильщиковой из ИБХ РАН, Екатерине Литвиновой из НИИ физиологии и фундаментальной медицины и Ирине Белозерской из ПСПбГМУ им. акад. И.П. Павлова. В разговорах с ними сформировался мой взгляд на роль грызунов в биомедицинских исследованиях.
Литература
- Модельные организмы: птицы;
- Loren J. Martin, Erinn L. Acland, Chulmin Cho, Wiebke Gandhi, Di Chen, et. al.. (2019). Male-Specific Conditioned Pain Hypersensitivity in Mice and Humans. Current Biology. 29, 192-201.e4;
- Jasmine M. Clarkson, Matthew C. Leach, Paul A. Flecknell, Candy Rowe. (2020). Negative mood affects the expression of negative but not positive emotions in mice. Proc. R. Soc. B.. 287, 20201636;
- Rafal Rygula, Helena Pluta, Piotr Popik. (2012). Laughing Rats Are Optimistic. PLoS ONE. 7, e51959;
- Rafal Rygula, Joanna Golebiowska, Jakub Kregiel, Jakub Kubik, Piotr Popik. (2015). Effects of optimism on motivation in rats. Front. Behav. Neurosci.. 9;
- Элементы: «Крысоподобные роботы заслужили благодарность крыс»;
- 12 методов в картинках: «сухая» биология;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Miyu Nishikawa, Kaori Yasuda, Masashi Takamatsu, Keisuke Abe, Kairi Okamoto, et. al.. (2020). Generation of novel genetically modified rats to reveal the molecular mechanisms of vitamin D actions. Sci Rep. 10;
- Peng X. (2012). Transgenic rabbit models for studying human cardiovascular diseases. Comp. Med. 6, 472–479;
- David Cyranoski. (2016). Monkeys genetically modified to show autism symptoms. Nature. 529, 449-449;
- Boris V. Skryabin, Delf-Magnus Kummerfeld, Leonid Gubar, Birte Seeger, Helena Kaiser, et. al.. (2020). Pervasive head-to-tail insertions of DNA templates mask desired CRISPR-Cas9–mediated genome editing events. Sci. Adv.. 6, eaax2941;
- Геном человека: полезная книга, или глянцевый журнал?;
- Emilie Vénéreau, Lorenza Ronfani. (2017). Editorial: Seeing is not always believing: lessons from knockout mice. J Leukoc Biol. 101, 353-356;
- Nils R. Hansmeier, Pia J. M. Widdershooven, Sajjad Khani, Jan-Wilhelm Kornfeld. (2019). Rapid Generation of Long Noncoding RNA Knockout Mice Using CRISPR/Cas9 Technology. ncRNA. 5, 12;
- Thomas Robeck, Boris V. Skryabin, Timofey S. Rozhdestvensky, Anastasiya B. Skryabin, Jürgen Brosius. (2016). BC1 RNA motifs required for dendritic transport in vivo. Sci Rep. 6;
- Emma S. Winkler, Adam L. Bailey, Natasha M. Kafai, Sharmila Nair, Broc T. McCune, et. al.. (2020). SARS-CoV-2 infection of human ACE2-transgenic mice causes severe lung inflammation and impaired function. Nat Immunol. 21, 1327-1335;
- Грызун особого назначения;
- Margaret Batchelder, Lynn S. Keller, Mary Ball Sauer, Wanda L. West. (2012). Gerbils. The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. 1131-1155;
- A. O. Ardiles, J. Ewer, M. L. Acosta, A. Kirkwood, A. D. Martinez, et. al.. (2013). Octodon degus (Molina 1782): A Model in Comparative Biology and Biomedicine. Cold Spring Harbor Protocols. 2013, pdb.emo071357-pdb.emo071357;
- Gonçalo Pinheiro, Diogo Filipe Prata, Inês Maria Araújo, Gustavo Tiscornia. (2018). The African spiny mouse (Acomysspp.) as an emerging model for development and regeneration. Lab Anim. 52, 565-576;
- The all-purpose guinea pig. (2014). Lab Anim. 43, 79-79;
- Victoria Wahl-Jensen, Laura Bollinger, David Safronetz, Fabian de Kok-Mercado, Dana Scott, Hideki Ebihara. (2012). Use of the Syrian Hamster as a New Model of Ebola Virus Disease and Other Viral Hemorrhagic Fevers. Viruses. 4, 3754-3784;
- Alexandra Le Bras. (2020). Syrian hamsters as a small animal model for COVID-19 research. Lab Anim. 49, 223-223;
- Ewan St John Smith, Laura-Nadine Schuhmacher, Zoé Husson. (2015). The naked mole-rat as an animal model in biomedical research: current perspectives. OAAP. 137;
- Преодолевшие старение. Часть II. Дети подземелья;
- О Нестареющих;
- Thomas. Swaine The universal directory for taking alive, or destroying, rats and mice : by a method hitherto unattempted and calculated as well for the use of ships and houses, as that of farmers and gardeners / — Printed for the author, and sold by J. Bew, No. 28, Pater-Noster Row, 1783;
- Gaetan Burgio. (2018). Redefining mouse transgenesis with CRISPR/Cas9 genome editing technology. Genome Biol. 19.












