12 методов в картинках: иммунологические технологии
03 ноября 2017
12 методов в картинках: иммунологические технологии
- 44271
- 2
- 54
рисунок Ольги Пташник
-
Авторы
-
Редакторы
-
Иллюстратор
За сотни тысяч лет эволюции иммунная система выработала множество инструментов для сражений с патогенами. Один из главных — антитело: белок, способный необычайно избирательно связываться с характерными кусочками молекул — антигенами. Несколько десятилетий назад биологам удалось «приручить» антитела: научиться производить их к нужным антигенам в любом количестве. И это открыло новую страницу в молекулярной биологии: появились иммунологические методики. Благодаря им мы можем «поймать» в растворе, клетке или срезе ткани почти любые молекулы и понять, сколько их, где именно они находятся и как взаимодействуют с другими молекулами.
12 биологических методов в картинках

Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — GE Healthcare

GE Healthcare Life Sciences — производитель высокотехнологичного оборудования, предоставляющий опыт, инновационные решения и широкий спектр услуг для создания крупносерийного биофармацевтического производства, разработки новых лекарств и вакцин, исследования клеток и белков. Обладая всеми биотехнологическими, инженерными и производственными возможностями, мы помогаем нашим заказчикам по всему миру занимать лидирующие позиции на рынке. Глубокая экспертиза, ресурсы, международное присутствие и инновационные разработки GE Healthcare Life Sciences дают возможность нашим клиентам создавать гибкое и экономически эффективное производство биофармпрепаратов.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Что такое иммунные методы и почему они имеют к иммунитету самое отдаленное отношение
Исходя из названия, можно подумать, что иммунологические методы участвуют в борьбе с патогенами. Ничего подобного. Название свое эти методы получили потому, что основным действующим лицом в них является антитело — центральный белок иммунной системы. У человека и животных антитело выполняет важную функцию — распознает чужеродную молекулу, которая вторглась во владения организма, как непрошеный гость. По-научному такие молекулы-чужаки называют антигенами . А умение антител распознавать особые антигены называется специфичностью.
Распознавать молекулы — это значит связываться с ними куда прочнее, чем с другими молекулами; для измерения прочности связывания существует специальная величина — сродство, или константа диссоциации.
Если говорить совсем точно, то антиген — это не всегда целая молекула, а иногда просто характерный кусочек молекулы.
В какой-то момент ученые поняли, что если антитела умеют специфично узнавать различные антигены, то можно это их свойство использовать в собственных, научных интересах. Так исследователи в своих лабораториях стали получать антитела с заданной специфичностью — очень избирательно узнающие один, определенный, нужный исследователям антиген, и ничего больше. И это стало огромным прорывом.
Представьте, например, что нам нужно исследовать опасный белок, который вырабатывают только раковые клетки и не вырабатывают здоровые. Антитело к этому белку — своеобразная «удочка», которая ловит только его и никого больше. Выловив на антительный «крючок» нехорошую молекулу, мы можем внимательно ее изучить, сделать какие-то важные выводы о ее функционировании, определить концентрацию, попытаться найти слабые места, чтобы в дальнейшем сделать против нее лекарство. Можем обнаружить все производящие ее клетки (в нашем случае — раковые!) — их распространение, количество и так далее.
Можно антитела использовать и для других, более сложных, целей. Например, к ним можно «пришивать» разноцветные флуоресцентные молекулы, а потом «сажать» на соответствующие антигены. В результате эти антигены станут светиться, и мы сможем изучать взаимодействия важных молекул даже в живой клетке. Также использование антител позволяет изучать и такие белки, которые связаны с ДНК и оказывают непосредственное влияние на процесс транскрипции.
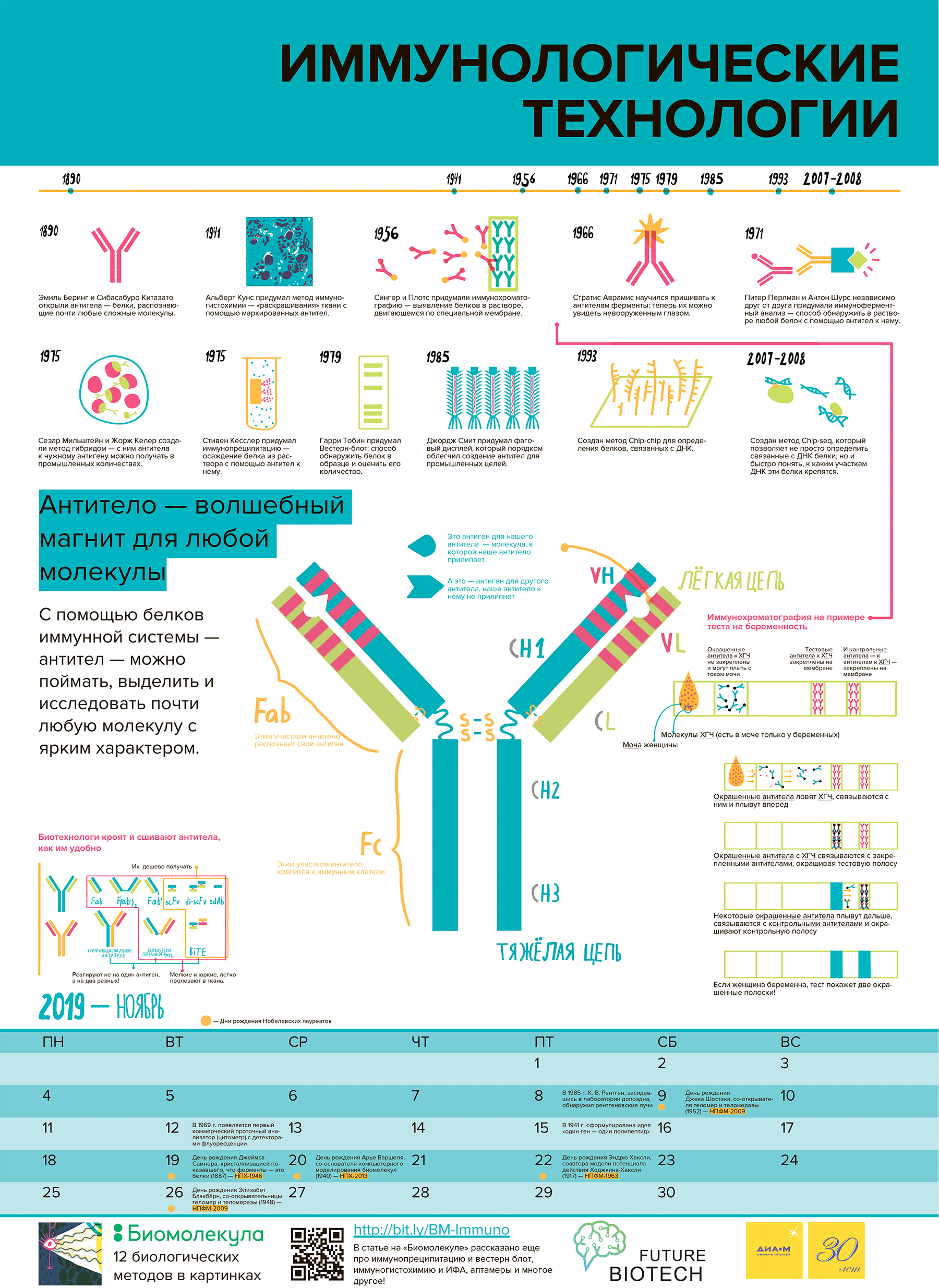
Как правило, методы, которые в качестве инструментов используют антитела, несут в своем названии приставку «иммуно-»: иммунопреципитация, иммунохроматография, иммуноферментный анализ (рис. 1). Именно о таких методах мы и расскажем в этой статье.
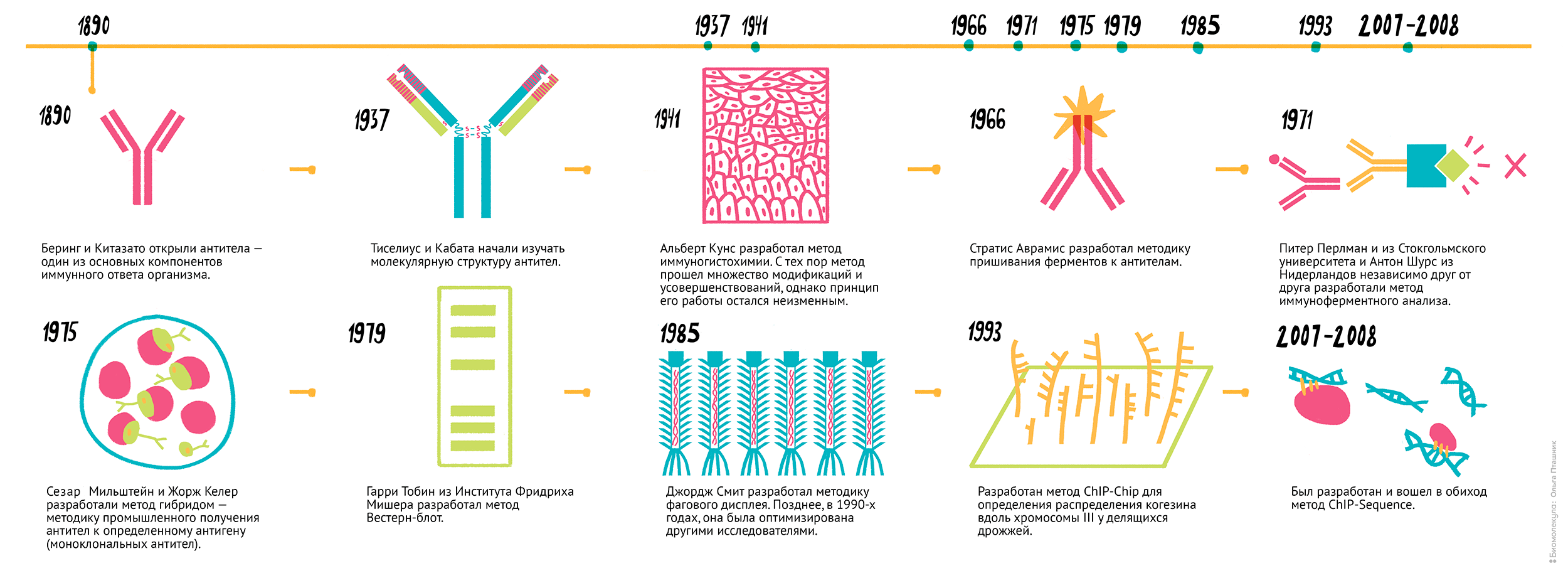
Рисунок 1. Несколько вех на пути развития иммунологических технологий. 1890 г. — Беринг и Китазато открыли антитела — один из основных компонентов иммунного ответа организма. 1937 г. — Тиселиус и Кабата начали изучать молекулярную структуру антител. 1941 г. — Альберт Кунс разработал метод иммуногистохимии [1]. С тех пор метод прошел множество модификаций и усовершенствований, однако принцип его работы остался неизменным. 1966–1969 г. — Стратис Аврамис разработал методику пришивания ферментов к антителам (чуть позже вы поймете, насколько это важно) [2]. 1971 г. — Питер Перлман из Стокгольмского университета и Антон Шурс из Нидерландов независимо друг от друга разработали метод иммуноферментного анализа [3], [4]. 1975 г. — Сезар Мильштейн и Жорж Келер разработали метод гибридом — методику промышленного получения антител к определенному антигену (моноклональных антител). 1979 г. — Гарри Тобин из Института Фридриха Мишера разработал метод вестерн-блоттинг [5]. 1985 г. — Джордж Смит разработал методику фагового дисплея [6]. Позднее, в 1990-х годах, ее оптимизировали другие исследователи. 1999 г. — Разработали метод ChIP-chip для определения распределения когезина вдоль хромосомы III у делящихся дрожжей [7]. 2007–2008 г. — Появился и вошел в обиход метод ChIP-sequence [8].
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Действующие лица
В этом разделе мы представляем вам главные молекулы-инструменты, используемые в иммунологических методах.
Антитела
Антитело, или иммуноглобулин, — это крупный белок, состоящий, как правило, из двух тяжелых и двух легких цепей. Тяжелые и легкие цепи, в свою очередь, состоят из вариабельных (V) и константных (С) доменов. Тяжелые цепи содержат один вариабельный (VH) и три константных домена (СH1, СH2, СH3), легкие цепи — один вариабельный (VL) и один константный (СL) домены (рис. 2) [9]. Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за нее ответственны C-домены).
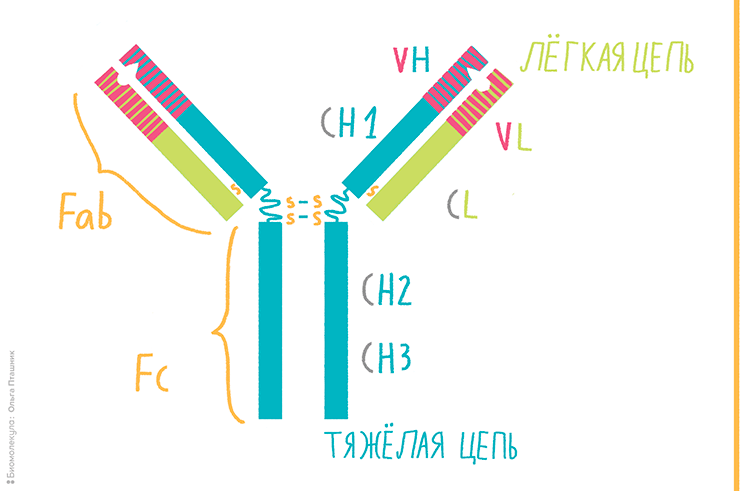
Рисунок 2. Строение антитела. Вариабельные домены легкой и тяжелой цепей (VH и VL) вместе с ближайшими к ним константными доменами (CH1 и CL1) образуют Fab-фрагменты антител (fragment antigen binding). Именно этими фрагментами антитело «цепляется» за свой антиген. Остальную часть, представленную C-концевыми константными доменами тяжелых цепей, обозначают как Fc-фрагмент (fragment crystallizable), которым антитело может цепляться за Fc-рецепторы, расположенные на некоторых иммунных клетках. На границе Fab и Fc фрагментов располагается гибкая «шарнирная область», благодаря которой фрагменты антитела могут двигаться друг относительно друга; эта область содержит дисульфидные связи, соединяющие тяжелые цепи между собой [9].
рисунок Ольги Пташник
Каждое антитело распознает свой антиген и только его. А вот на каждый антиген может быть множество разных антител, которые распознают разные его участки (эпитопы). Разные антитела на один антиген называются поликлональными, то есть, состоящими из множества клонов — популяций антител. А идентичные друг другу, одинаковые молекулы антител называют моноклональными [10]. Поликлональные антитела куда дешевле и проще в производстве, чем моноклональные, но в иммунологических методиках чаще используют моноклональные, потому что они — абсолютно одинаковые молекулы, они гарантированно распознают один и тот же участок одного и того же антигена и потому гораздо стабильнее ведут себя в иммунологических методиках.
Антитело по своей структуре — эдакий Тянитолкай. С одной стороны у него находится связывающая антиген область (Fab-фрагмент), с другой стороны — «хвосты» тяжелых цепей — Fc-фрагмент. И для некоторых задач исследователю выгодно использовать не всё антитело, а лишь какую-то его часть. Так, можно взять Fc-фрагмент и пришить к нему какую-то другую молекулу (например, главный комплекс гистосовместимости (MHC)). Это увеличит время жизни молекулы в сыворотке крови и позволит связываться с рецепторами для антител (Fc-рецепторами). А можно использовать лишь Fab-фрагмент или комбинировать Fab-фрагменты различной специфичности, создавая так называемые биспецифические антитела. Кроме того, можно использовать не весь Fab-фрагмент, а лишь пару вариабельных доменов антитела и также комбинировать их. На рисунке 3 представлены различные варианты таких конструкций.
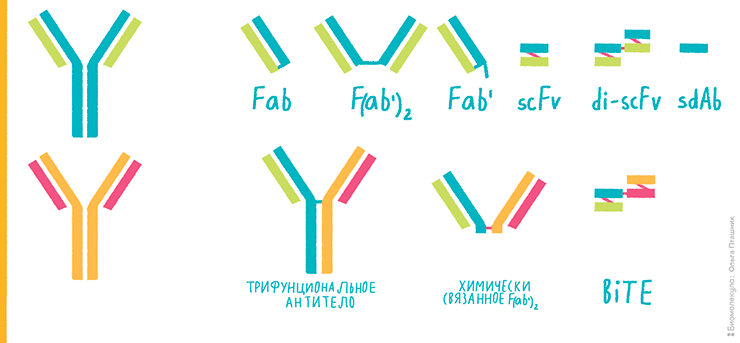
Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым. Пояснения — в тексте.
рисунок Ольги Пташник
Их фрагменты и комбинации представляют собой:
- Fab — отдельно применяемый антигенраспознающий фрагмент антитела.
- F(ab’)2 — двойной антигенраспознающий фрагмент антитела с кусочком шарнирного участка.
- Fab’ — антигенраспознающий фрагмент антитела с кусочком шарнирного участка. Эти три молекулы меньше размером, чем целое антитело, и поэтому более «юркие», лучше проникают в ткани и в некоторых случаях работают лучше полноценных антител. Такие фрагменты получают из целых антител, разрезая их специальными ферментами.
- scFv — одноцепочечный вариабельный фрагмент — только сам антигенраспознающий участок антитела, ничего лишнего. Он модифицирован так, чтобы состоять из одной белковой цепи, а не из двух, как в антителе. Благодаря этому scFv не требует сложной посттрансляционной сборки, и его можно производить в бактериальных клетках, а это — самый простой и дешевый способ биотехнологического производства. Очень легкая и удобная молекула для иммунологических методик.
- di-scFv — двойной одноцепочечный вариабельный фрагмент. То же, что предыдущее, только в двойном экземпляре. Работает чуть активнее, но и весит в два раза больше.
- sdAB — однодоменное антитело. Самая миниатюрная молекула из всех присутствующих. Представляет собой только вариабельный участок тяжелой цепи особых антител, которые наряду с классическими антителами присутствуют в крови у верблюдовых и у некоторых видов хрящевых рыб. Также можно получать sdAb, разделяя димерный вариабельный домен классического антитела на меньшие по размеру мономеры. Такие молекулы легки в производстве и неплохо работают.
- Трифункциональное антитело — представляет собой «химеру» из двух разных антител и имеет три сайта связывания: антигена 1, антигена 2 и Fc-рецептора.
- Химически связанное F(ab)2 — сшитые между собой Fab-фрагменты двух разных антител.
- BiTE (Bi-specific T-cell engager) — очень изящная искусственно выработанная молекула, представляющая собой одну белковую цепь, которая после трансляции сворачивается в два вариабельных участка двух разных антител.
Ловушки для антител
Для многих иммунных методик важно надежно закрепить молекулы антител на каком-то твердом носителе. Этих носителей есть несколько типов (рис. 4):

Рисунок 4. Ловушки для антител — носители, на которых можно надежно закрепить антитела. Пояснения — в тексте.
рисунок Ольги Пташник
- Агароза — полисахарид, который получают из красных и бурых водорослей. Агароза умеет полимеризоваться в плотную структуру, которую называют гелем или смолой. После некоторых манипуляций агарозную смолу можно превратить в прекрасную «ловушку» для антител — сделать так, чтобы они крепко на нее налипали.
- Магнитные частицы — это наночастицы, основу которых составляет магнитный материал, например, оксид железа. Если на поверхность частицы поместить функциональные группы (например, NH2 или COOH), они смогут связывать антитела. Поэтому магнитные частицы также часто используют для иммобилизации антитела на своей поверхности наряду с агарозой.
- Нитроцеллюлозная мембрана — носитель, который за счет гидрофобных взаимодействий может удерживать на себе белки и пептиды.
- Мембрана из поливинилиденфторида (PVDF) — высокогидрофобный носитель, который также может удерживать на своей поверхности белки и пептиды.
- Планшеты из полистирола — также состоят из высокогидрофобного материала, удерживающего на своей поверхности белки и пептиды. Как правило, для нужд иммунохимии используют 96-луночные планшеты с плоским дном (flat-bottom plates). Кроме того, нередко такие планшеты обрабатывают стрептавидином, который может связаться с биотином, присоединенным к Fc-концу антител, и таким образом крепко-накрепко привязать антитела к внутренней поверхности лунок планшета.
Как увидеть антитела
Антитела — это бесцветные белки, и сами по себе увидеть их в реакционной смеси невозможно. Поэтому если мы что-то пометили антителами, то эти самые антитела нам потом нужно как-то визуализировать, сделать видимыми. Для этого есть несколько остроумных способов (рис. 5).
Фермент и субстрат
Можно пришить к антителу какой-нибудь фермент, катализирующий «цветную» химическую реакцию. Обычно это пероксидаза хрена или щелочная фосфатаза. Теперь, когда мы добавляем в реакционную смесь субстрат используемого фермента (DAB или BCIP/NBT соответственно), то, если там есть антитело с пришитым к нему ферментом, субстрат расщепится, произойдет «цветная» реакция, и по изменению цвета реакционной смеси мы сможем понять, есть ли в этой смеси фермент и сколько его — а значит, и сколько там антител.
Флуоресцентная метка
Можно не заморачиваться с двухэтапной системой «фермент—субстрат» и сразу пришить к антителу цветную флуоресцентную метку [11]. Правда, в этом случае, чтобы увидеть результат, нам придется использовать флуоресцентный микроскоп [12].

Рисунок 5. Визуализация антител. Слева: к антителу пришит фермент, катализирующий «цветную» реакцию (то есть, такую, в которой субстрат меняет цвет). И чтобы узнать, есть ли в смеси эти антитела, достаточно добавить в эту смесь субстрат для данного фермента. Если смесь поменяла цвет — значит, антитела есть. Измерив с помощью спектрофотометра, насколько смесь поменяла цвет, можно определить и количество антител. Справа: антитела с пришитыми к ним флуоресцентными метками можно увидеть с помощью флуоресцентного микроскопа и определить, где эти антитела находятся и в каких количествах. К тому же, это очень красиво.
рисунок Ольги Пташник
Иммунологические методы
А теперь, когда мы овладели всей подготовительной информацией, пришло время перейти собственно к иммунологическим методикам.
Иммунопреципитация и коиммунопреципитация
Уникальное свойство антител — возможность налипать только на соответствующие антигены — делает их своего рода «волшебными магнитами» в руках биотехнолога. С помощью антител можно обнаруживать нужные молекулы (как правило, белки) среди ненужных; выделять эти нужные молекулы, очищать их, определять их количество и так далее. Методы, основанные на использовании антител, можно применять и для изучения сложной белковой смеси, или, говоря научным языком, протеома. Рассмотрение иммунных методов мы начнем с одного из самых простых — иммунопреципитации.
Иммунопреципитация — способ, с помощью которого можно выделить из смеси и осадить (precipitate) ту молекулу, которая нас интересует (как правило, это белок; назовем его «Белок Х»).

Рисунок 6. Анимированная схема иммунопреципитации. Пояснения — в тексте.
рисунок Ольги Пташник
Последовательность действия при иммунопреципитации такова (рис. 6):
- Получаем антитела к нашему Белку Х (о том, как это сделать, подробно рассказано в разделе «Фабрика инструментов»).
- Закрепляем эти антитела на каком-нибудь твердом носителе, как правило, агарозной смоле (см. раздел «Ловушки для антител»). А в последнее время все чаще используют магнитные частицы — они очень удобны, их можно с помощью обычного магнита отделить от раствора. «Пришивание» антитела к носителю — отдельная тема: для этого можно сперва облепить носитель специальными белками (A и G), которые умеют крепко связываться с Fc-участком антител (рис. 2), а можно использовать специальную агарозу, которая «ловит» антитела на торчащие альдегидные группы (рис. 3).
- Помещаем антитела на носителе в исследуемый раствор (таким раствором могут быть, например, перемолотые клетки — лизаты, или плазма крови), чтобы на антитела налипли молекулы Белка Х (и только они!).
- Выуживаем носитель с антителами и налипшими на них молекулами Белка Х (чем-то это напоминает сказку про репку, где бабка тащила за дедку, а внучка — за бабку), промываем от ненужных молекул и элюируем (то есть, с помощью специального буфера отлепляем от антител и собираем в отдельной пробирке).
Коиммунопреципитация похожа на иммунопреципитацию, только немного сложней. Она предназначена для выделения антигена вместе с белками, которые с ним связаны. В таких случаях известный антиген называют белком-приманкой (bait protein), а белки, с которыми он взаимодействует, белками-жертвами (prey protein(s)). Жертвами могут быть структурные белки, сигнальные молекулы, кофакторы и т. д.
Иммуноферментный анализ
Разработку метода иммуноферментного анализа предвосхитило открытие метода радиоиммунного анализа. Этот анализ разработали Розалин Сасмен Ялоу и Соломон Берсон для определения концентрации инсулина в плазме крови человека. В 1977 году Розалин Ялоу, совместно с коллегами Роже Гийменом и Эндрю Виктором Шалли получила Нобелевскую премию в области физиологии и медицины «За развитие радиоиммунологических методов определения пептидных гормонов». Она стала второй женщиной (после Герти Терезы Кори), удостоенной этой премии.
Иммуноферментный анализ (ИФА, по-английски ELISA — enzyme-linked immunosorbent assay) используется для определения, присутствует ли в растворе искомый Белок Х, и если да, то в каких количествах. Этот метод, как и иммунопреципитация, похож на сказку «Репка», но цепочка «тянущих репку» немного длиннее. Схема ИФА показана на рисунке 7:

Рисунок 7. Анимированная схема иммуноферментного анализа. Пояснения — в тексте.
рисунок Ольги Пташник
- Получаем антитела к Белку Х.
- Добавляем исследуемый раствор (клеточный лизат, плазму крови или что-то еще) в лунку специального планшета из адгезивного пластика(см. раздел «Ловушки для антител»). Адгезивный — значит такой, к которому крепко прилипают белки. Белки из нашего раствора закрепятся на лунке планшета, и даже если мы теперь промоем лунку, они не смоются. В том числе прилипнет наш Белок Х. Сейчас наша цепочка короткая: Белок Х за планшет.
- Промываем лунку, чтобы избавиться от незакрепившихся в ней белков и небелковых молекул.
- Добавляем «забивку» — какие-нибудь белки, которые займут пустые места в лунке и не позволят налипнуть туда антителам (которые тоже белки!). Как правило, в качестве забивки используют обезжиренное молоко или БСА — бычий сывороточный альбумин, один из самых дешевых и при этом неиммуногенных белков.
- Промываем лунку от лишней забивки.
- Добавляем в лунку антитела к Белку Х. Теперь цепочка такова: Белок Х за планшет, антитело — за Белок Х.
- Промываем лунку от лишних антител.
- Теперь мы делаем хитрый шаг. Дело в том, что поскольку наше антитело не окрашено, мы совершенно никак не можем понять, зацепилось ли оно за Белок Х (то есть, был ли вообще Белок Х в растворе), а если зацепилось, то в каких количествах (то есть, сколько этого Белка Х налипло на лунку). Чтобы обнаружить это, мы добавим в лунку вторичные антитела — то есть антитела к антителам к Белку Х. К каждому такому антителу методом биоконъюгации пришит специальный фермент, катализирующий реакцию, в результате которой получаются цветные, хорошо заметные продукты (мы уже говорили об этом в разделе «Действующие лица»). Наша цепочка становится довольно-таки длинной: Белок Х за планшет, первичное антитело за Белок Х, вторичное антитело за первичное антитело, фермент за вторичное антитело. На самом краю цепочки болтается фермент, и его-то мы и используем спустя пару шагов.
- Но пока мы просто в очередной раз промываем лунку.
- Момент истины: мы добавляем в эту лунку субстрат для фермента. Проходит «цветная» реакция, результаты которой видны и невооруженным глазом. Но если нам важно померить количество искомого Белка Х, то мы вооружим наш глаз — засунем планшет в специальный прибор — спектрофотометр, — который в цифрах покажет, насколько сильно окрашен раствор. По интенсивности окраски раствора мы сможем вычислить концентрацию нашего Белка Х.
В принципе, можно избавиться от шагов 8 и 9, если сразу к антителам к Белку Х пришить фермент. Но вторичные антитела прекрасны тем, что «размножают» сигнал: на одно первичное антитело может налипнуть сразу несколько вторичных, и тогда можно будет «поймать» даже ничтожно маленькую концентрацию Белка Х. Кроме того, вторичные антитела можно использовать в экспериментах с любыми Белками Х, потому что они специфичны не к ним, а к антителам, «поймавшим» белок.
Другие варианты ИФА
Это был классический вариант ИФА, а теперь рассмотрим его модификации.
Например, для детекции малых количеств антигена в пробе используют так называемый сэндвич-ИФА. В лунки планшета изначально вносят антитела, специфичные к детектируемому антигену, которые прилипают к поверхности пластика. Дальше повторяются уже известные нам шаги: добавляется антиген, а следом за ним еще одни антитела, специфичные к нему. Получается структура, действительно напоминающая сэндвич: антиген оказывается между двумя антителами и «не теряется»: удается определить даже крохотные его количества.
Конкурирующий ИФА — еще одна модификация метода, в которой исследуют концентрацию не антигена, а наоборот, антител. Если вы когда-нибудь сдавали кровь на антитела, то анализ проводили именно этим способом. В этом случае в лунки планшета, в которые нанесен антиген, добавляют исследуемые антитела (например, сыворотка крови) — назовем их «антителами А» — и антитела, помеченные ферментом, специфичным к антигену («антитела Б»). Между антителами разгорается нешуточная борьба за право связаться с антигеном. Соответственно, чем меньше в пробе «антител А», тем больше «антител Б» свяжется с антигеном и тем ярче будет сигнал.
Вестерн-блоттинг
Вестерн-блоттинг (англ. western blot) — еще один метод, в котором с помощью антител ученый может поймать нужный ему белок среди множества других. Последовательность этой «молекулярной рыбалки» очень похожа на ИФА, только «ловля» происходит не в лунке планшета, а на нитроцеллюлозной мембране (см. раздел «Ловушки для антител»). Схема вестерн-блоттинга показана на рисунке 8:

Рисунок 8. Анимированная схема вестерн-блоттинга. Пояснения — в тексте.
рисунок Ольги Пташник
- Смесь белков (например, лизат клеток или тканей организма) разделяем методом электрофореза (см. статью «12 методов в картинках: очистка молекул и разделение смесей» [14]).
- Под действием электрического тока переносим белки из геля, в котором проводился электрофорез, на нитроцеллюлозную мембрану. Белки налипают на мембрану и образуют точную реплику того, как они разделились в электрофорезном геле. Такая мембрана с белками на ней и называется блотом.
- Аналогично ИФА, добавляем к мембране «забивку» — обезжиренное молоко или БСА, чтобы антитела неспецифически не прилепились к мембране.
- Добавляем антитела к белку, который мы ищем — Белку Х.
- Несколько раз тщательно отмываем мембрану от несвязавшихся антител.
- Добавляем «вторичные антитела» — антитела к антителам к Белку Х, несущие на себе фермент.
- Еще раз отмываем мембрану от излишков антител.
- Добавляем субстрат для фермента, чтобы наконец-то увидеть, где же спрятан наш Белок Х, и считываем сигнал.
При проведении вестерн-блоттинга можно, конечно, использовать все те же ферменты и субстраты, что и в ИФА. Однако чаще удобнее получить сигнал в виде «светящейся» реакции — хемилюминесценции, которую легко детектировать при помощи рентгеновской пленки. Так у исследователя есть возможность попробовать разное время экспозиции пленки и, соответственно, получить серию снимков, из которых позже выбрать нужный с оптимальным соотношением сигнал—фон. К тому же, после проведения эксперимента вторичные антитела можно легко отмыть и использовать мембрану еще раз. Наиболее часто в качестве фермента при вестерн-блоттинге используется пероксидаза хрена, окисляющая люминол в присутствии пероксида водорода.
Иммунохроматография
Иммунохроматография — очень остроумный метод обнаружения белка в анализируемой жидкости, в котором сам факт наличия жидкости используется для проведения реакции [15].
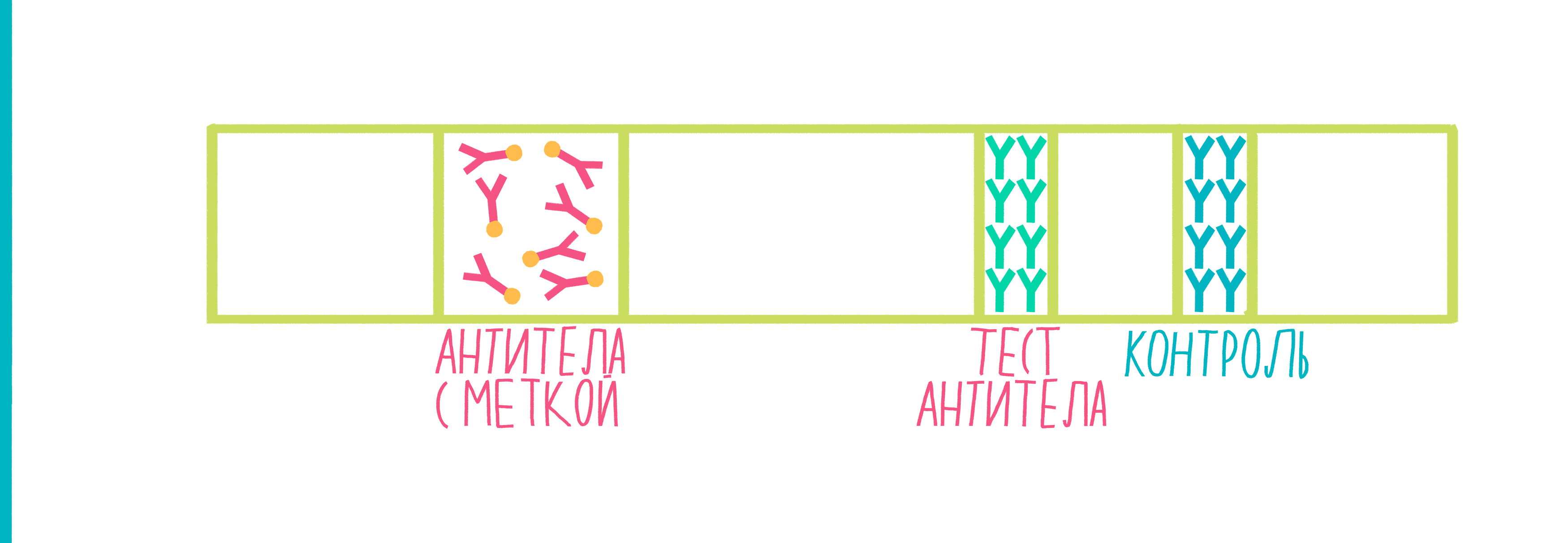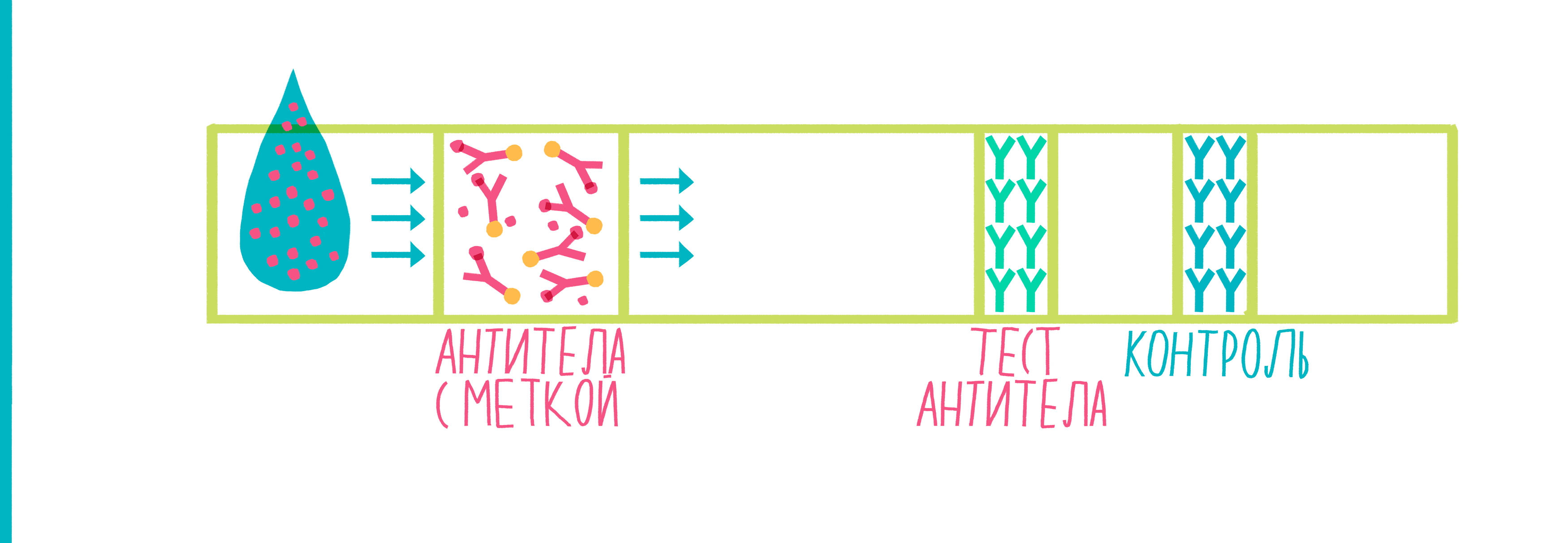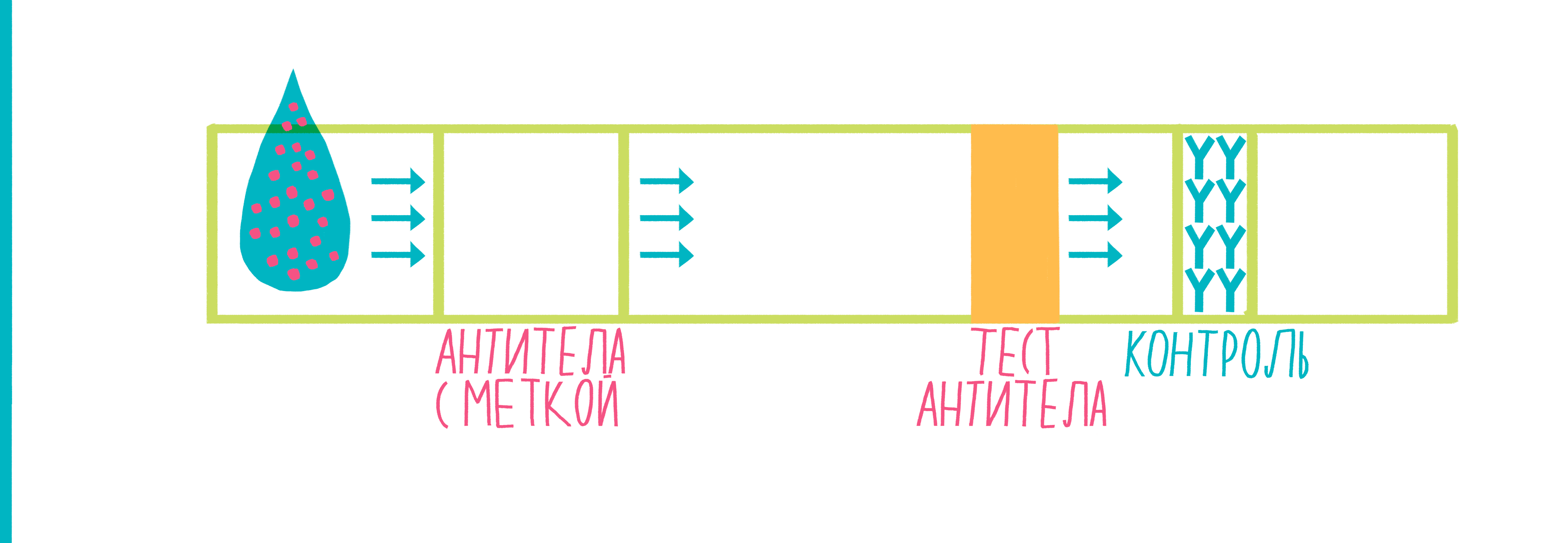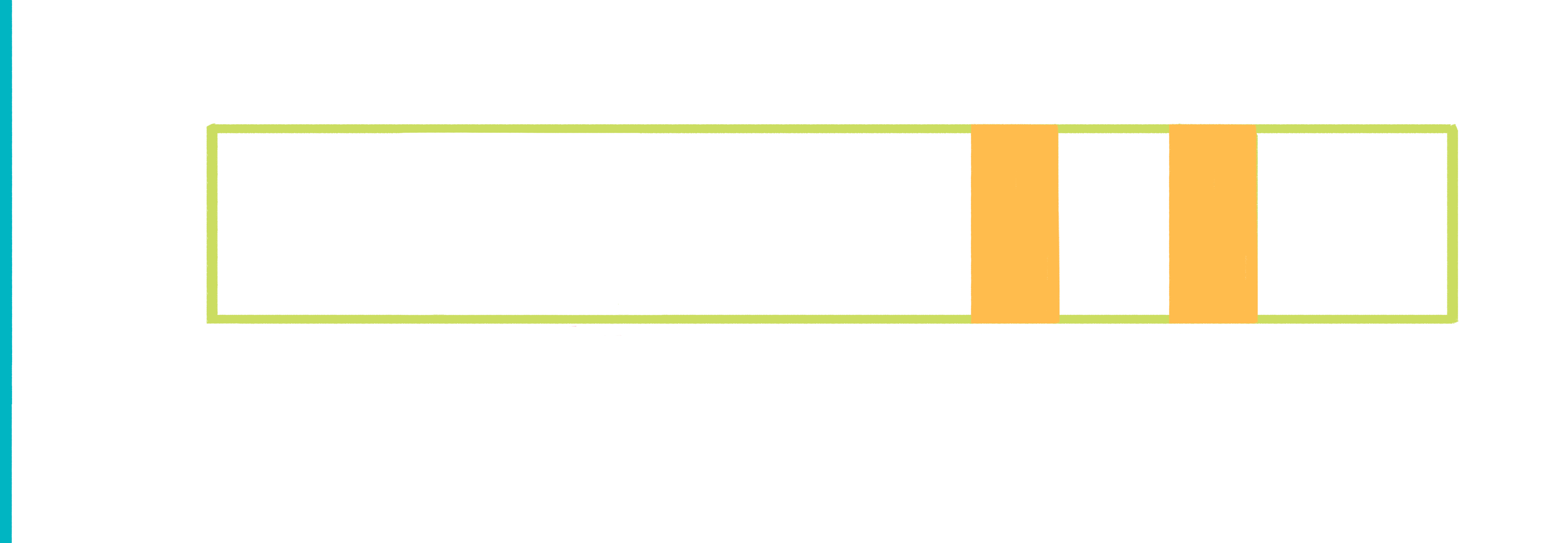
Рисунок 9. Анимированная схема иммунохроматографии. Пояснения — в тексте.
рисунок Ольги Пташник
- На мембрану на некотором расстоянии друг от друга нанесены: а) антитела к Белку Х, к которым пришита метка, — так называемые первичные антитела (меткой могут быть окрашенные латексные шарики, коллоидное золото, флуоресцентный белок и т.п.);б) еще одни антитела, специфичные к Белку Х (тестовая полоса) и, наконец, в) антитела к первичным антителам (контрольная полоса).
- Мембрану погружаем одним концом в исследуемую жидкость, с током которой Белок Х (если он, конечно, присутствует в пробе) передвигается сначала к антителам с меткой, связывается с ними и движется дальше к тестовой полосе.
- На тестовой полосе комплекс антиген—первичное антитело связывается с присутствующими там антителами, закрепляется и окрашивает ее.
- Избыток первичных антител, смытый с их места дислокации, движется дальше, к контрольной полосе, где связывается с присутствующими там антителами, останавливается и окрашивает ее.
- Расшифровка результатов проста: если в анализируемой жидкости есть Белок Х, то на тесте будут видны две полосы, если же белка нет — только контрольная полоса.
Широко распространенный пример использования иммунохроматографии — тесты для определения беременности. Исследуемой жидкостью в них выступает моча женщины, в которой присутствует белок хорионический гонадотропин человека (ХГЧ) — гормон, вырабатывающийся тканью хориона после имплантации эмбриона в стенку матки. ХГЧ движется по тест-полоске, в результате чего на ней появляются две полосы — это означает, что тест положителен, и женщина беременна.
Иммуногистохимия
Многие антигены ученым и врачам хотелось бы определять не в сыворотке крови или в других жидкостях, а прямо на исследуемых тканях. Например, на опухолях. Ведь важно знать, экспрессируется ли на онкологической ткани тот или иной антиген: таким образом можно определить тип опухоли, предположить характер ее метастазирования и так далее. Способ, с помощью которого можно «увидеть» антигены на целой ткани, называется иммуногистохимией.
Она очень часто используется в медицинской диагностике, помогая врачам определить принадлежность опухоли к тому или иному типу и подобрать необходимое лечение [16]. Еще ее часто используют, чтобы диагностировать онкологические и иммунологические заболевания. Ученые иммуногистохимией тоже не пренебрегают. Например, с ее помощью можно определить, начался ли в ткани апоптоз, или исследовать нейродегенеративные заболевания [16].
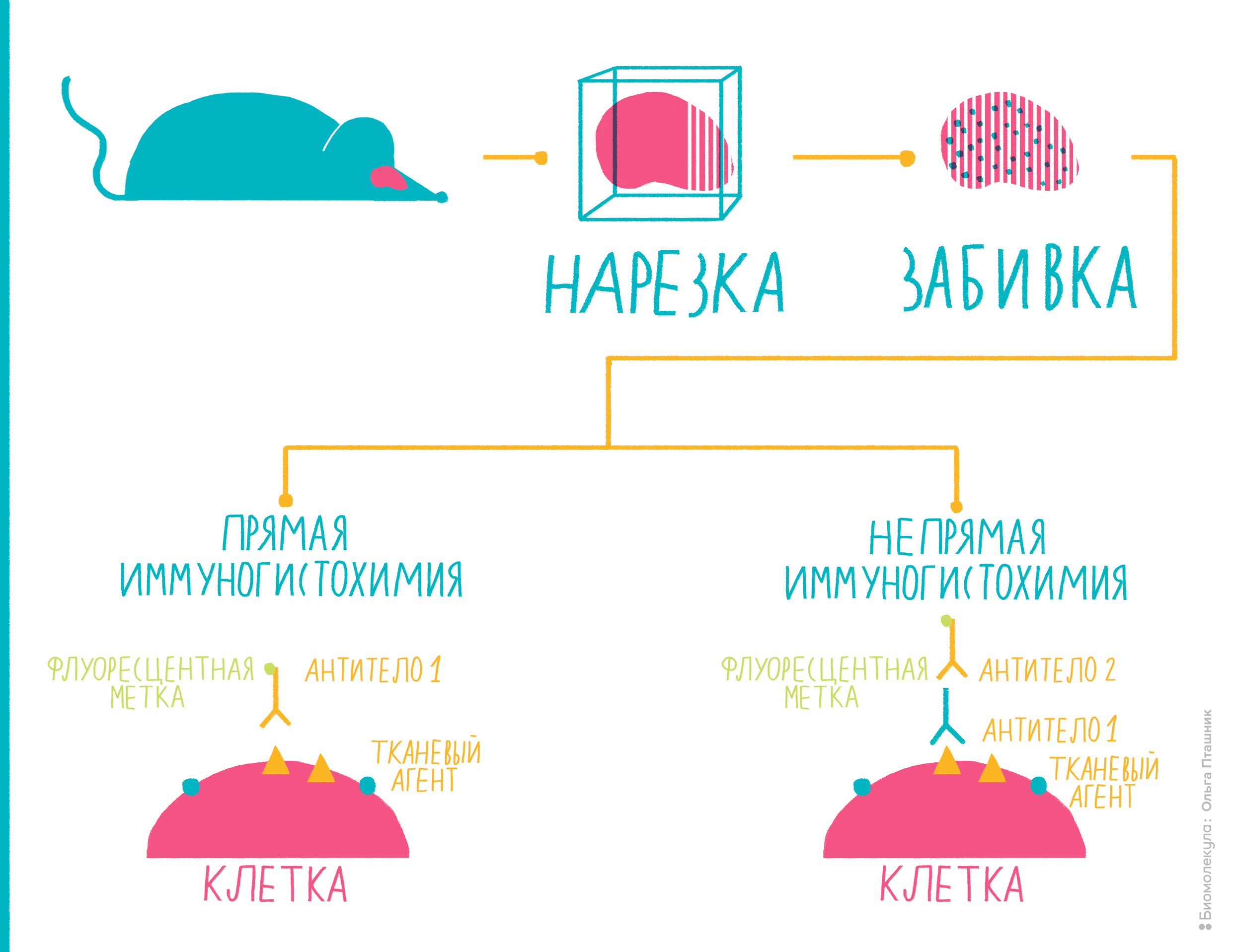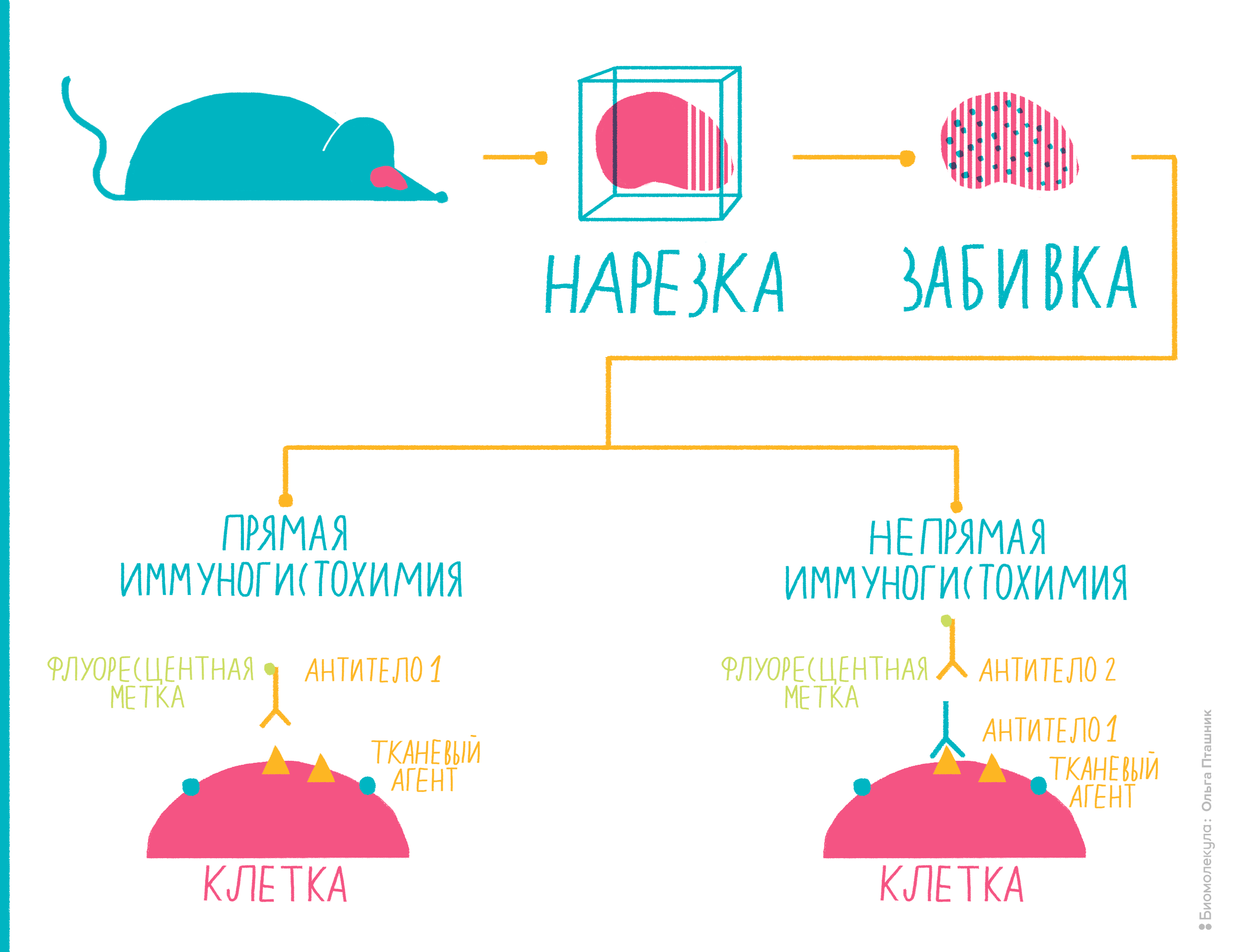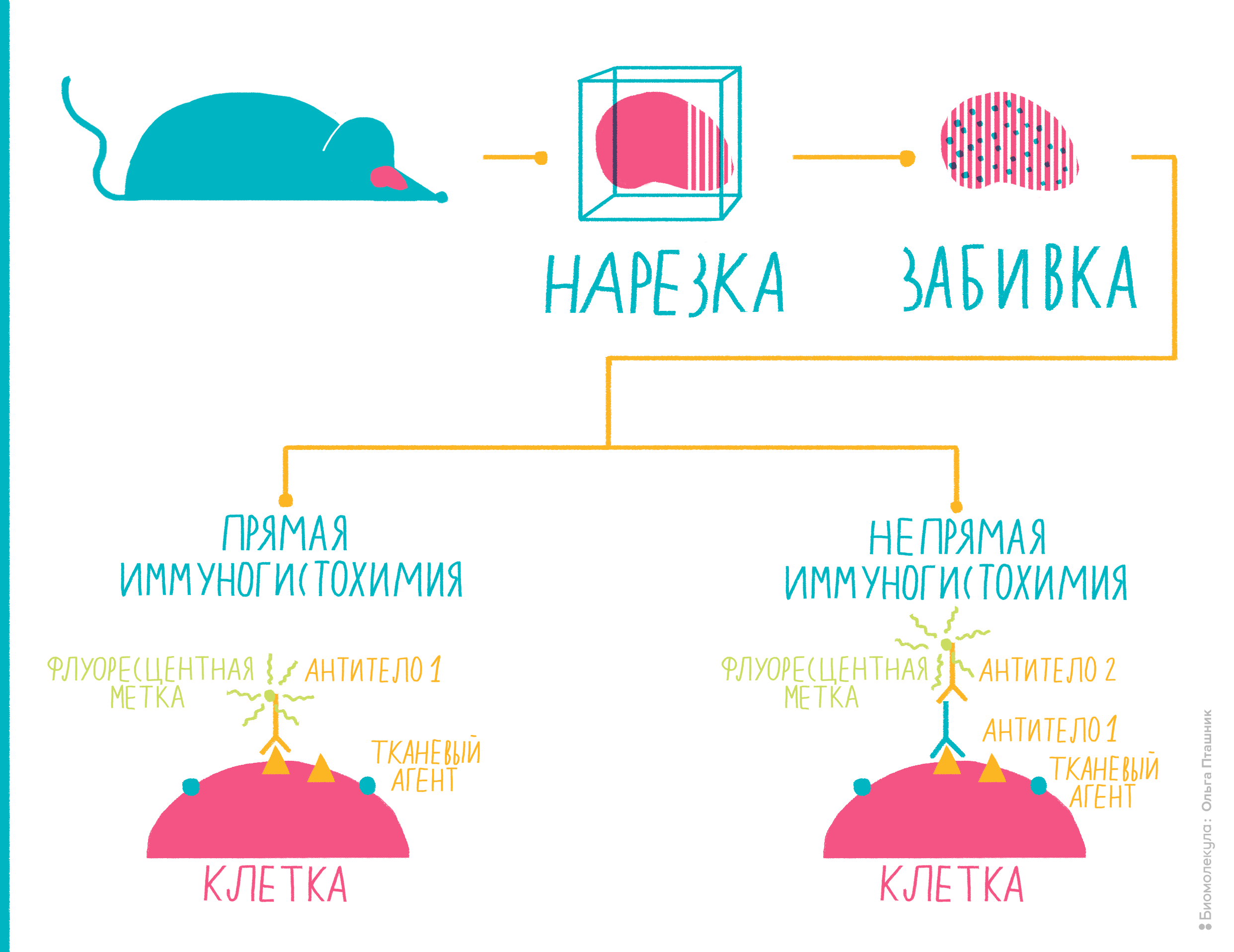
Рисунок 10. Иммуногистохимия представляет собой комбинацию иммунологических, анатомических и биохимических техник исследования. Пояснения — в тексте.
рисунок Ольги Пташник
Вот как проводят иммуногистохимию (рис. 10):
- Для начала исследователю необходимо выбрать орган, ткань которого он хочет исследовать. После этого орган извлекают и специальным образом подготавливают.Обычно ткань замораживают или же заключают в парафин. Суть этой подготовки в том, чтобы орган можно было тонко нарезать и закрепить на специальном стекле, на котором будет происходить исследование. Толщина среза при этом должна быть не более 18 микрон, иначе исследователь рискует при гистохимии ничего не увидеть.
- После того, как тонко нарезанная ткань оказалась на стекле, производят уже много раз встречавшуюся нам «забивку» — блокировку неспецифических антигенов, как правило, с помощью бычьего сывороточного альбумина. Когда процесс блокировки завершен, можно приступать к определению тканевых антигенов. Обычно для этого используют поликлональные или моноклональные антитела. Кроме того, иммуногистохимия может проходить в две или одну стадии — с использованием вторичных антител (непрямая иммуногистохимия) или без них (прямая иммуногистохимия).
- При прямой иммуногистохимии с антигеном на тканисвязываютсяпервичные антитела с флуоресцентной меткой. При непрямой иммуногистохимии флуоресцентную метку на себе несет вторичное антитело, которое связывается с противоположным от ткани концом первичного антитела.
- После завершения всех процедур используют флуоресцентный микроскоп, чтобы увидеть свечение, если на ткани присутствует антиген. Наличие антигена можно определять не только при помощи флуоресцентной метки, но и с помощью системы «фермент—субстрат», о которой мы уже говорили в разделе «Как увидеть антитела».
Помимо иммуногистохимии существует еще один метод с похожим принципом действия — иммуноцитохимия. Как можно заключить из названия, разница в том, что антигены определяют не на ткани, не на поверхности ее клеток, а непосредственно внутри клеток, то есть, отыскиваются внутриклеточные антигены. Для этого исследуемые клетки надо пермеабилизировать — то есть продырявить им мембрану, — а в остальном методика похожа на иммуногистохимию.
Иммуногисто- и иммуноцитохимия — это очень удобные методы для медицинской диагностики и научных исследований, при помощи которых можно отличать друг от друга ткани по внутри- и внеклеточным антигенам.
ChIP-сhip и ChIP-seq
Эти методы нужны для выяснения, с какими последовательностями ДНК в клетке связываются исследуемые белки (например, гистоны) [17]. Методы очень похожи, и отличаются только последним этапом. ChIP расшифровывается как chromatin immunoprecipitation, то есть иммунопреципитация хроматина.
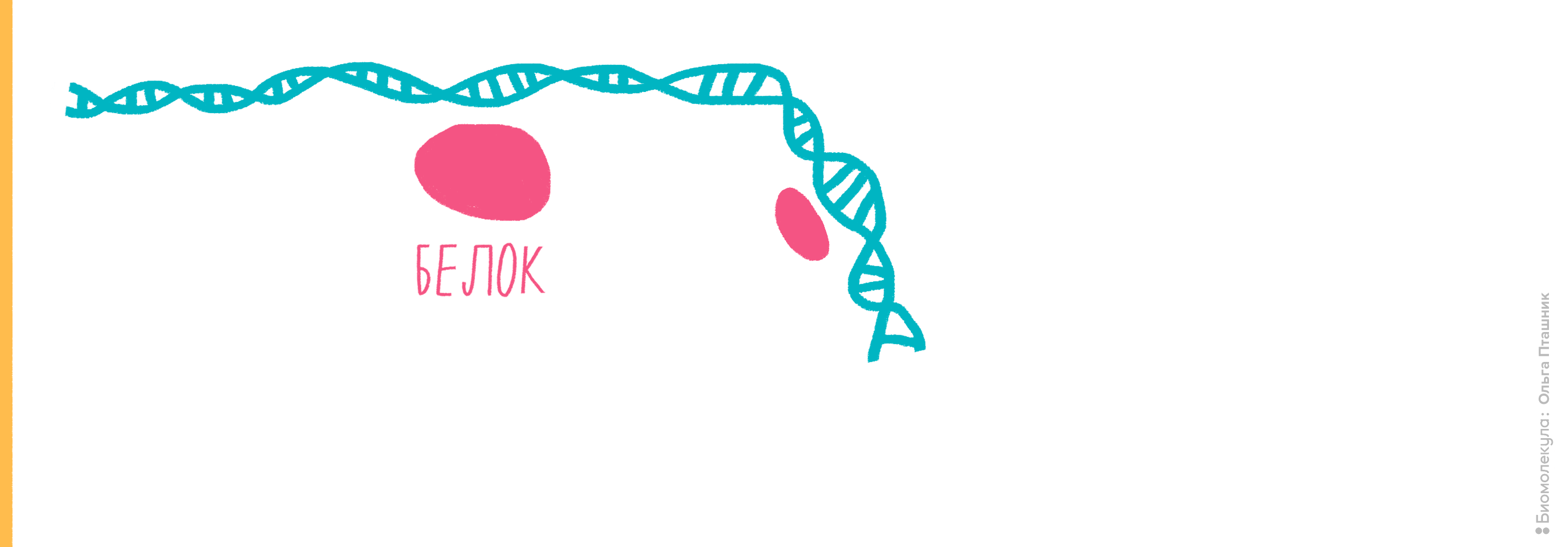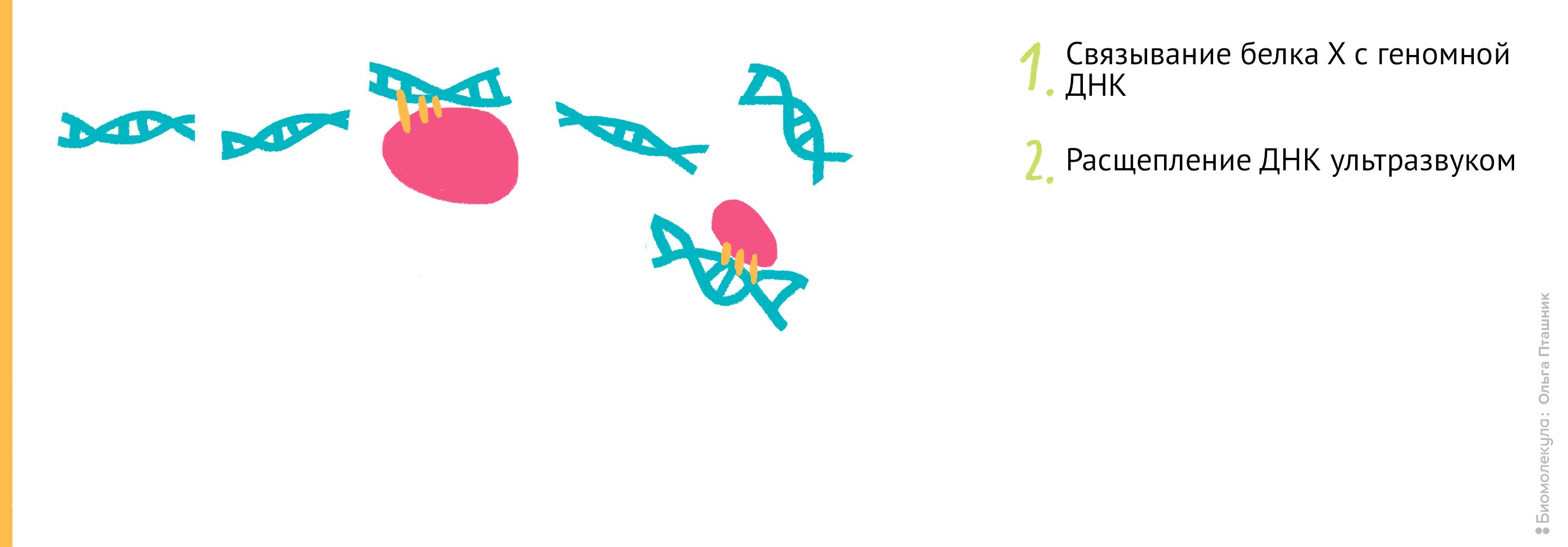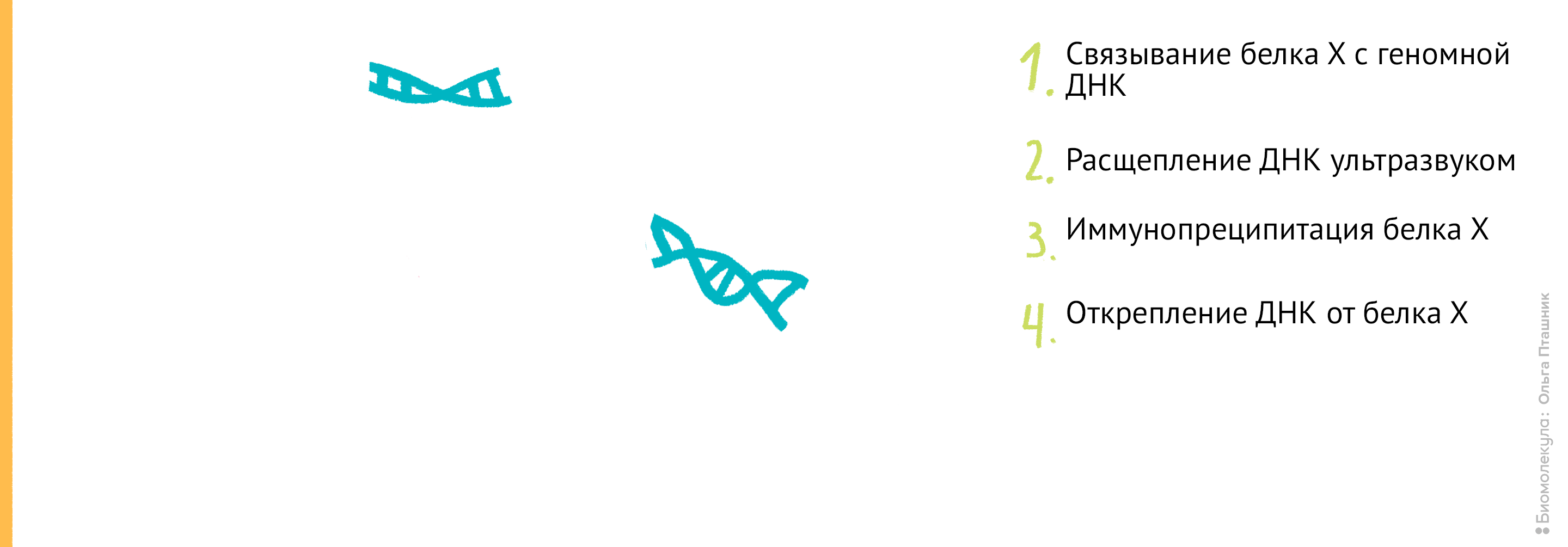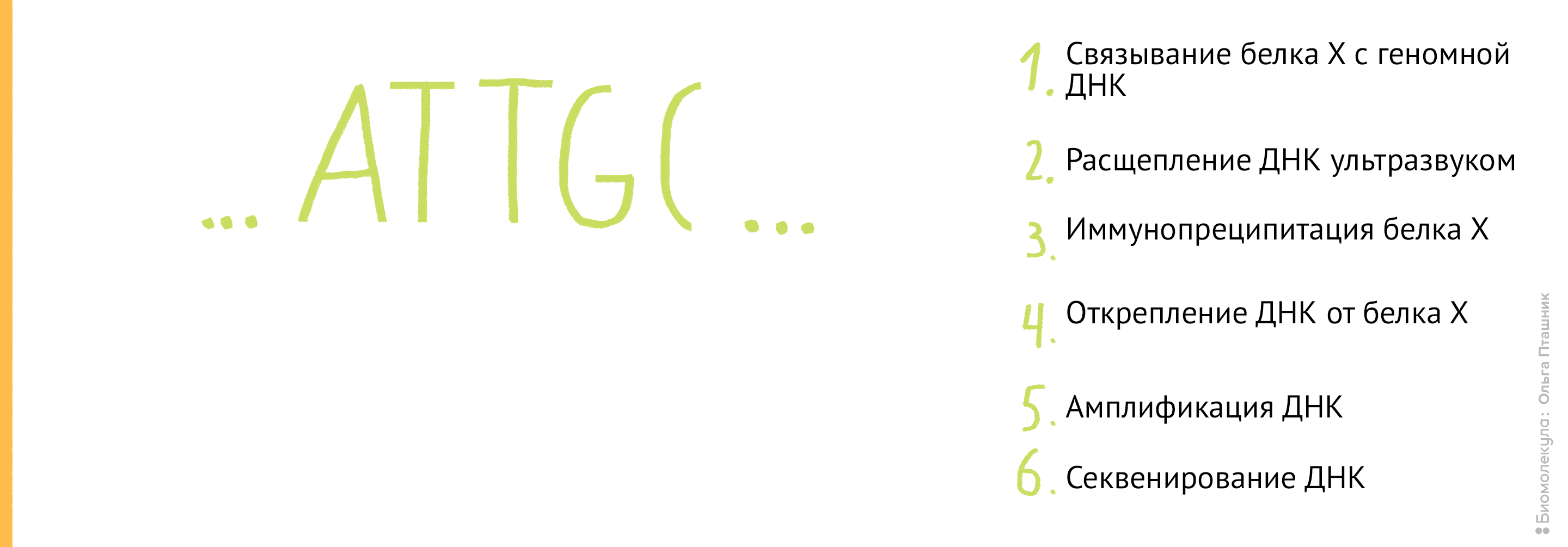
Рисунок 11. Проведение анализа ChIP-seq. Первым делом Белок Х связывается с геномной ДНК, после чего ДНК во всей клетке расщепляется при помощи ультразвука. Для иммунопреципитации искомого белка добавляются полимерные шарики с антителами к нему. После нескольких стадий отмывки белок отсоединяется от ДНК, и ее анализируют при помощи секвенирования для определения нуклеотидной последовательности, которая связывается с Белком Х.
рисунок Ольги Пташник
Начнем с методики ChIP-sequencing (СhIP-seq) (рис. 11).
- С помощью обратимой реакции с формальдегидом Белок Х крепко связывается с геномной ДНК. Такое прочное связывание ДНК с белком необходимо для того, чтобы анализировать именно Белок Х, связывающийся с интересующей нас последовательностью. Эту реакцию можно повернуть вспять при помощи нагревания, что мы и сделаем пару шагов спустя.
- После этого ДНК, уже связанная с Белком Х, расщепляется на фрагменты размером около 1 т.п.н. при помощи ультразвука. Кроме ультразвука иногда могут использовать нуклеазы микрококков, расщепляющие ДНК в случайных местах.
- Затем проводят иммунопреципитацию Белка Х со специфическими к нему антителами (как — мы уже описали в соответствующем разделе). Эта процедура позволяет отделить фрагменты ДНК, связанные с Белком Х, от других, не интересующих нас в данном исследовании фрагментов ДНК.
- Как мы уже говорили в п.1, ДНК связывается с белком обратимо. И теперь при помощи нагревания ее открепляют от Белков Х, соединенных с антителами.
- У нас получились «голые» кусочки ДНК, которые больше не соединены с белками. Осталось выяснить последовательность этих кусочков. Для собственно анализа последовательности ДНК, связывающейся с Белком Х, ее необходимо амплифицировать (то есть приумножить количественно) методом полимеразной цепной реакции [18].
- Далее следует уже собственно секвенирование [19].
Если же мы используем метод ChIP-chip (иммунопреципитация хроматина на чипе), то последние шаги будут немного другие: анализом последовательности ДНК будут заниматься биоинформатики, а не «мокрые» биологи. А именно (рис. 12):
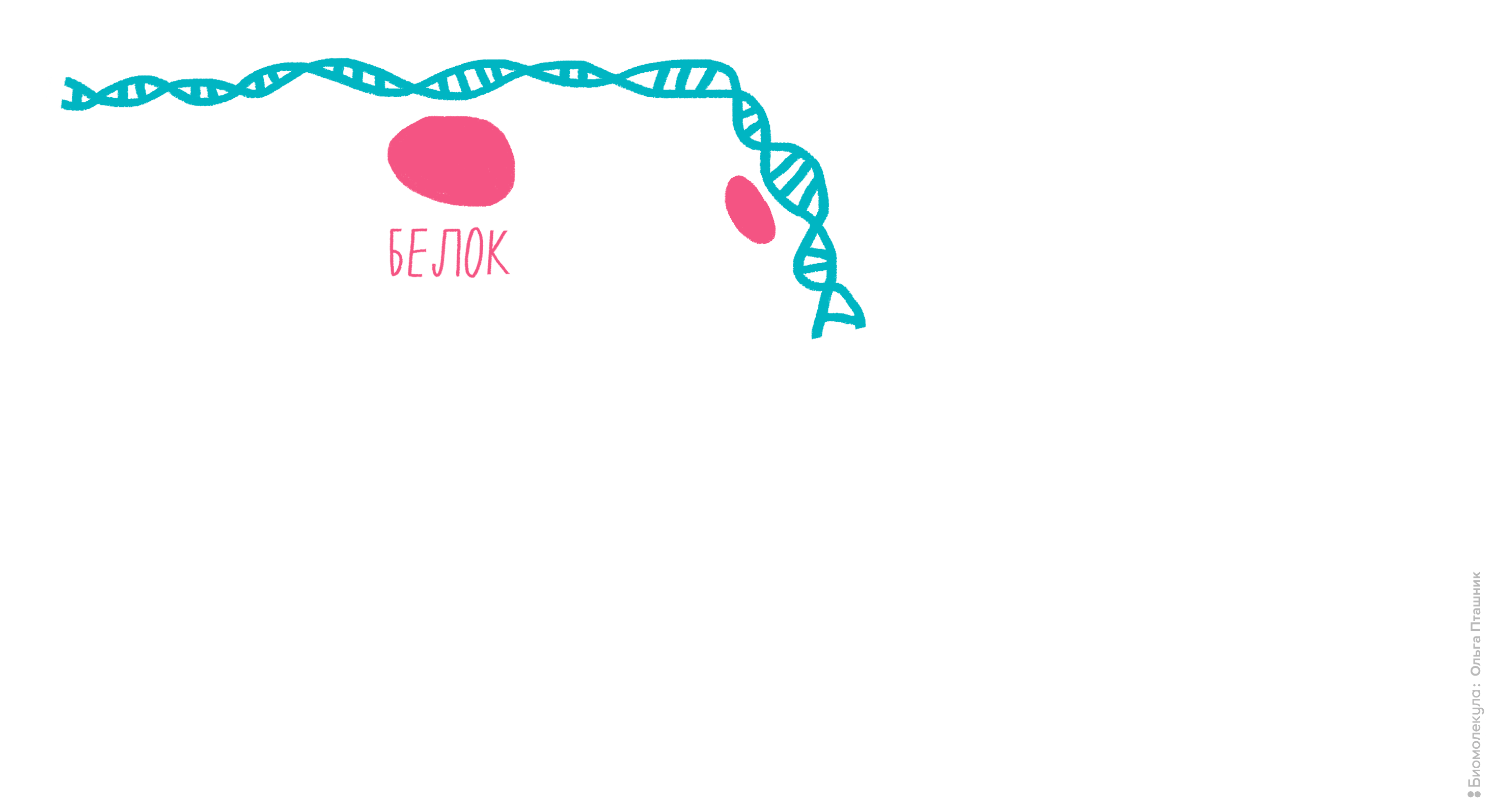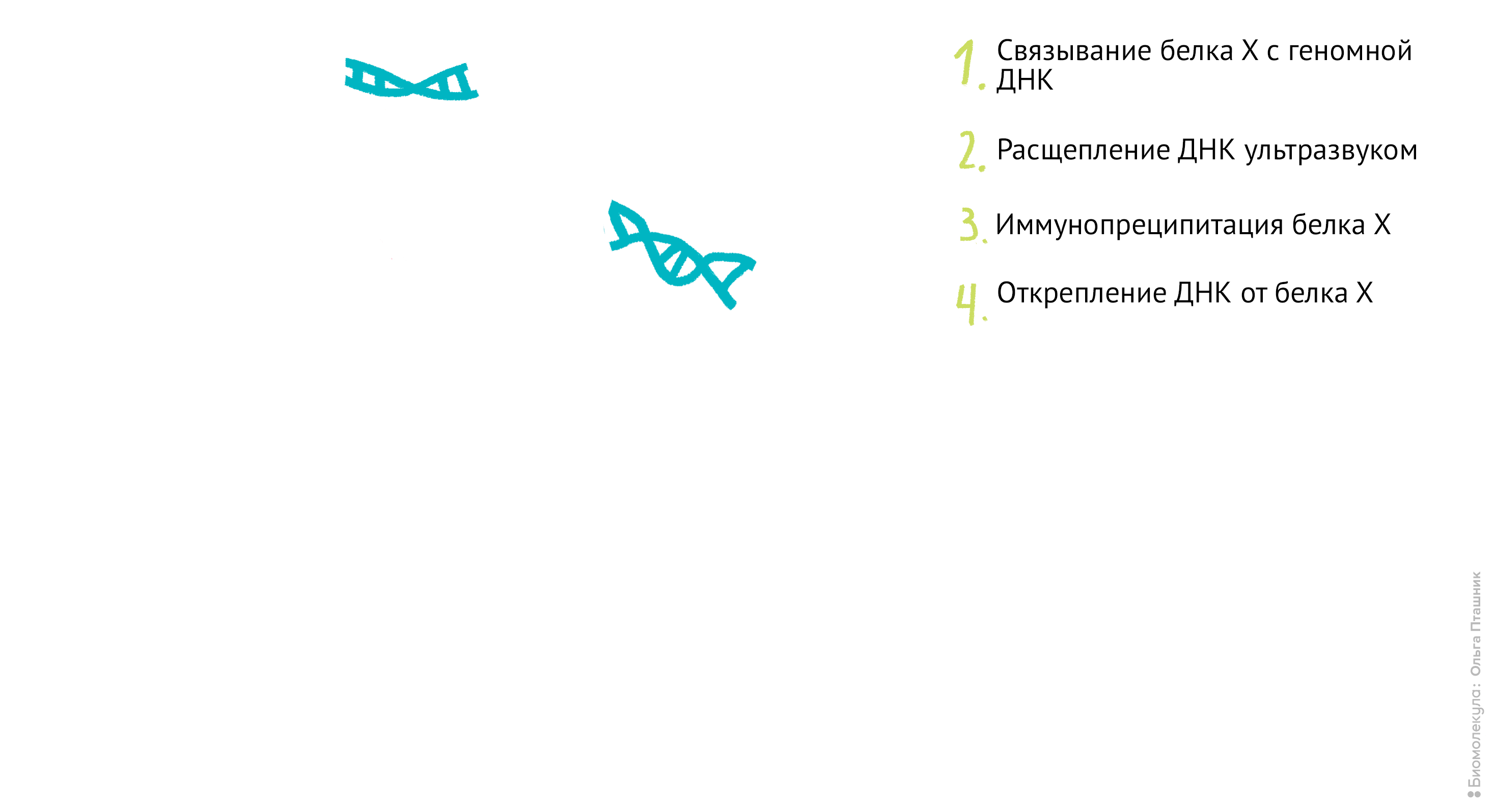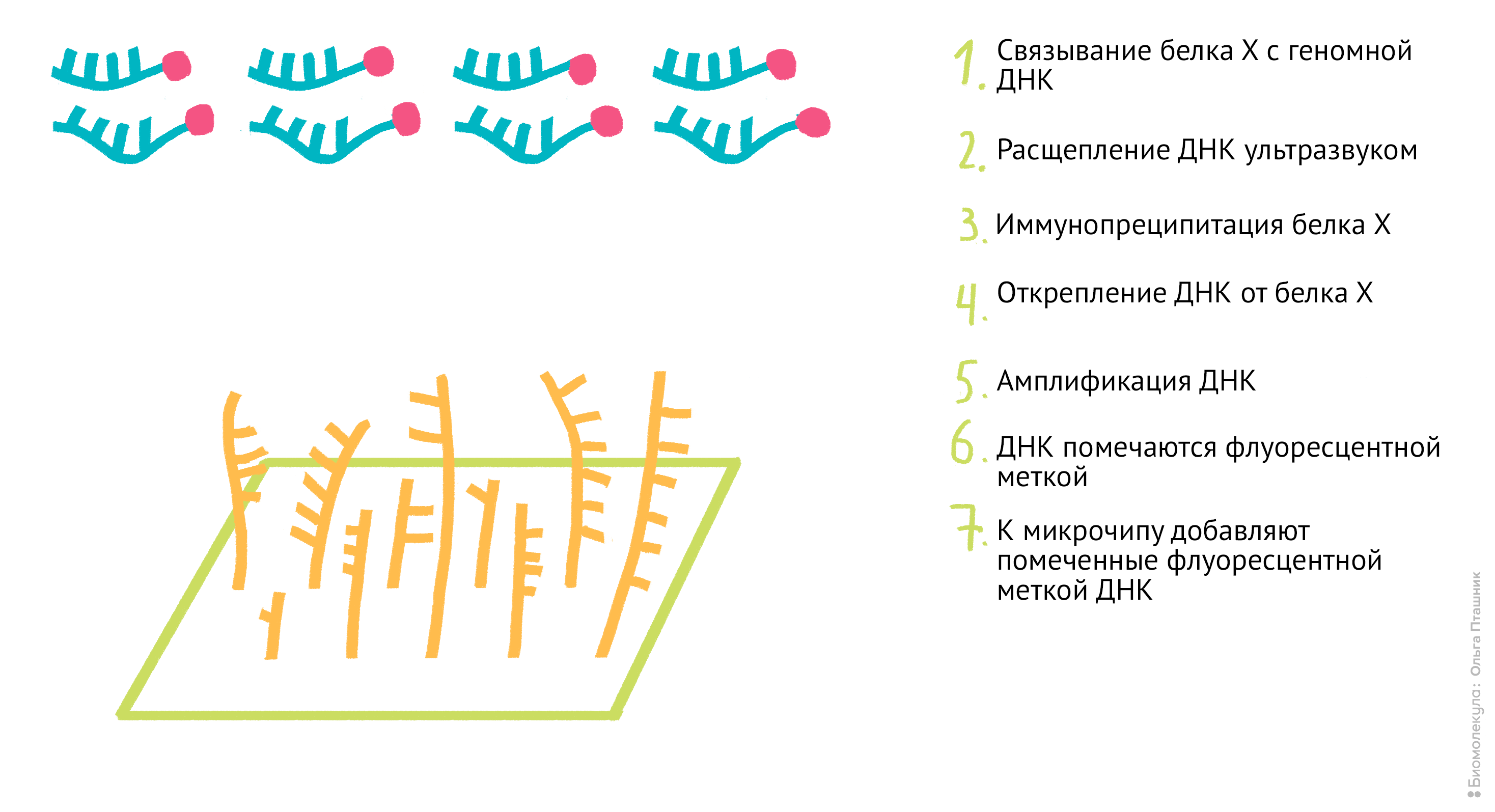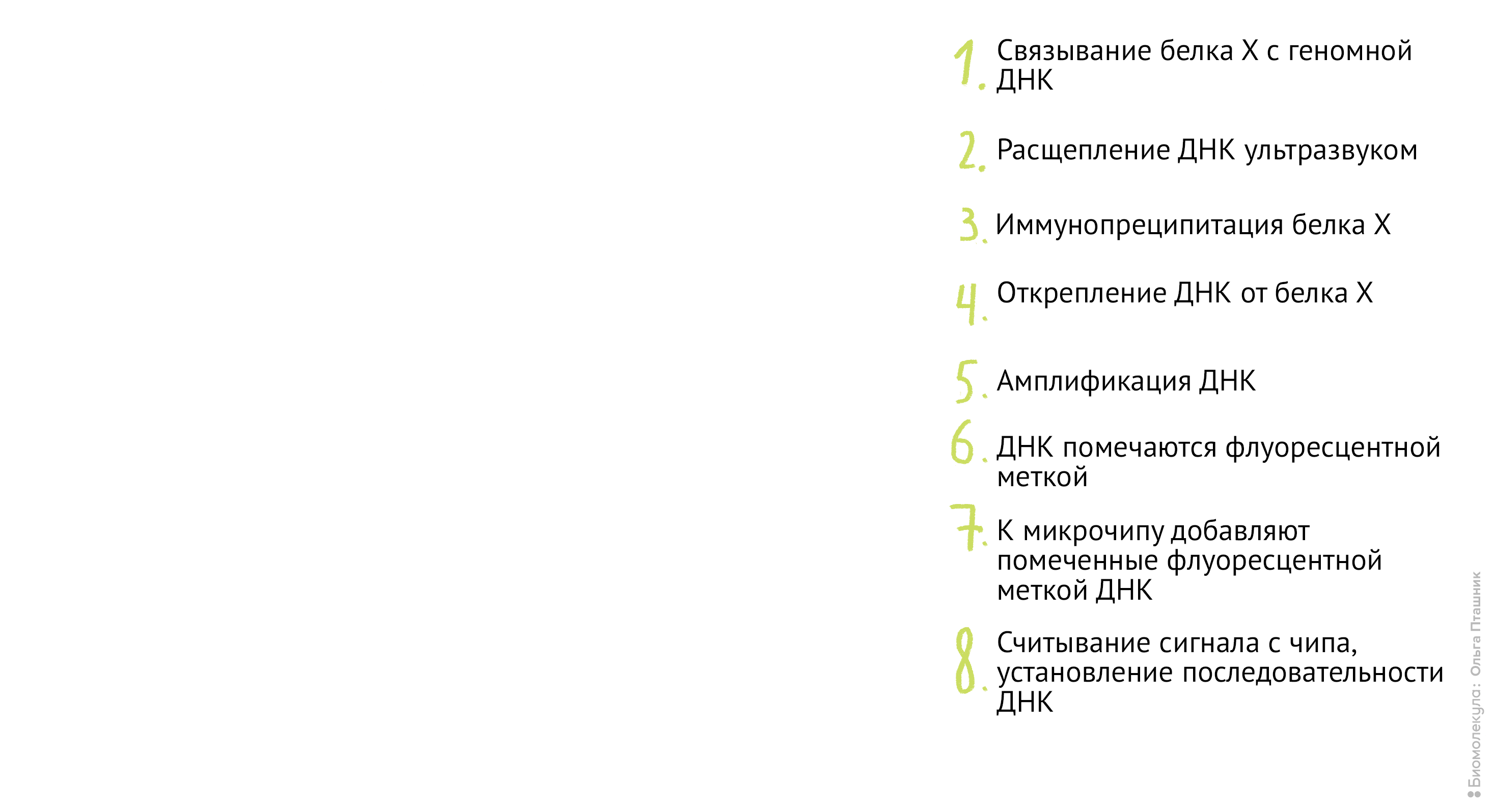
Рисунок 12. Методика ChiP-chip. Белок Х связывается с геномной ДНК в местах специфического связывания при помощи обратимой реакции с формальдегидом. Затем, по методике коиммунопреципитации (о которой мы уже говорили) геномная ДНК разрезается на кусочки и Белки Х связываются с антителами к ним. После этого геномная ДНК отделяется от Белка Х, амплифицируется, очищается и метится флуоресцентной меткой. Помеченные меткой олигонуклеотиды связываются с олигонуклеотидами на специальном чипе (к нему прикреплены различные олигонуклеотиды и связывание происходит между комплементарными последовательностями). Там, где произошло связывание, возникает флуоресцентный сигнал, который потом анализируется в биоинформатической лаборатории. В результате мы узнаем, с какими именно участками ДНК связывается наш белок.
рисунок Ольги Пташник
- Тщательно обработанные и очищенные одиночные цепи ДНК помечаются флуоресцентной меткой. Флуоресцентная метка — это обычно органический краситель, такой как Cy5 или Alexa 647, светящийся в красной области спектра.
- Затем фрагменты одиночной цепи ДНК прикрепляются к специальной структуре, называемой ДНК-микрочип [20]. Микрочип представляет из себя подложку, к которой прикреплены короткие одноцепочечные фрагменты геномной ДНК с различными последовательностями нуклеотидов. Когда к микрочипу добавляют помеченные флуоресцентной меткой ДНК, некоторые из них связываются (гибридизуются) с комплементарными одноцепочечными ДНК на микрочипе и участок микрочипа, на котором находится теперь уже двухцепочечная ДНК, начинает светиться.
- На этом заканчивается часть работы «мокрой» лаборатории и начинается работа биоинформатиков. Биоинформатики считывают световой сигнал с микрочипа и нормализуют его, используя контрольные сигналы от аналогичного первому второго чипа. Затем, используя статистические методы, ученые определяют последовательность нуклеотидов на ДНК, связанной с Белком Х.
Фабрика инструментов
А теперь, когда мы узнали, какие волшебные перспективы открывают перед учеными иммунологические методики, поговорим немного о том, как же можно получить главные молекулы для этих методик — антитела.
Гибридомная технология
Как мы уже говорили выше, технологичность иммунным методикам обеспечивает применение моноклональных антител (то есть, тех, молекулы которых абсолютно идентичны друг другу). Впервые этого удалось достичь с помощью гибридомной технологии, разработанной Жоржем Келером и Сезаром Мильштейном в 1975 году. За это изобретение в 1984 году они получили Нобелевскую премию по физиологии. Методика заключается в создании бессмертной линии гибридных клеток, производящих нужные антитела: такая линия называется гибридомой. Подробности можно прочесть в статье «Моноклональные антитела» [10]. Производство гибридомы состоит из нескольких этапов (рис. 13):
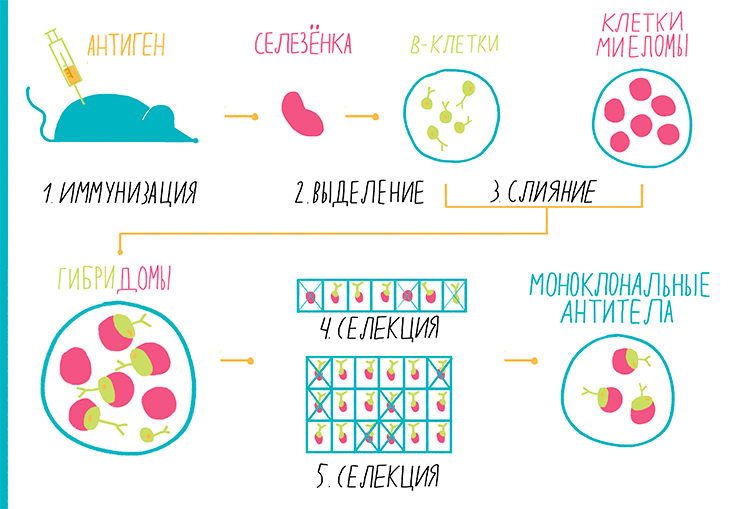
Рисунок 13. Гибридомная технология. Пояснения — в тексте.
рисунок Ольги Пташник
- Иммунизация. Для начала надо провести иммунизацию животного (как правило, мыши или кролика) тем антигеном, ккоторому мы хотим получить антитела. Иммунизация — это просто несколько инъекций антигена. Иммунитет животного воспринимает антигены как вражеские; начинают вырабатываться специализированные В-лимфоциты, производящие антитела именно к этому антигену. Они-то нам и нужны.
- Выделение. Теперь мы выделяем эти В-лимфоциты из мышиной селезенки. Они производят нужные нам антитела, и, казалось бы, они и есть наши искомые клетки. Но увы, это не так: эти клетки смертны и неспособны к бесконечному делению.
- Слияние. Значит, надо сделать эти В-лимфоциты бессмертными. Для этого к ним добавляют клетки миеломы. Миелома — один из видов раковых опухолей, а если точнее — опухоль иммунных клеток, плазмоцитов. Для живого организма рак смертельно опасен, поскольку раковые клетки, в отличие от нормальных, бессмертны — способны делиться неограниченное количество раз, заполонить собой весь организм и нарушить его работу. Но в руках биотехнолога раковые клетки именно благодаря своей способности делиться становятся незаменимым инструментом — ведь их культуру можно поддерживать практически бесконечно. В нашем случае мы используем не простые клетки миеломы, а особенные, имеющие небольшой генетический дефект — у них нет гена гипоксантин-гуанинфосфорибозилтрансферазы (ГГФТ). Зачем это нужно, скоро станет понятно.
В-лимфоциты и клетки миеломы сливают друг с другом, разрушив их мембраны с помощью специального агента. Получаются клетки-гибриды, которые, во-первых, производят нужные нам антитела, а во-вторых, бессмертны (от слова «гибрид» и название — гибридомная технология). Эти клетки станут для нас неисчерпаемым ресурсом антител, но сначала надо произвести селекцию.
Дело в том, что когда мы, смешав две культуры клеток, сливали их между собой, то помимо нужных гибридов — «В-лимфоцит + клетка миеломы» — получились и ненужные: «В-лимфоцит + В-лимфоцит» и «клетка миеломы+клетка миеломы». А некоторые клетки остались и вовсе неслитыми. Чтобы избавиться от ненужных клеток, мы прибегнем к селекции. - Селекция. Помните, мы использовали не просто миелому, а миелому с генетическим дефектом? Пришло время пустить этот дефект в ход: мы пересадим клетки на такую среду, на которой клетки без ГГФТ просто не могут выжить. В результате погибнут все гибриды «клетка миеломы+клетка миеломы». При этом неслившиеся В-лимфоциты тоже гибнут, просто потому, что они — не бессмертные клетки, и сами по себе долго не проживут.
- И снова селекция. Но это еще не все. Дело в том, что на каждый антиген вырабатывается целое сонмище разных антител — как уже говорилось, такие антитела называются поликлональными. Если нам нужно какое-то конкретное, четко определенное антитело, то придется селектировать клетки еще раз. Для этого клетки рассеивают в пластиковые планшеты и культивируют несколько дней. Затем специальными методами содержимое каждой лунки проверяют на присутствие антител нужной специфичности. После этого клетки, содержащие нужные антитела, клонируют (то есть повторно рассеивают клетки в планшет из расчета строго одна клетка на лунку), вновь культивируют и проверяют на присутствие нужных антител. Процедуру повторяют 1–2 раза. Таким образом, отбирают только те клоны, которые продуцируют антитела одной нужной специфичности — моноклональные антитела.
Биотехнологическое производство в эукариотических рекомбинантных системах
Этот метод постепенно оттесняет гибридому в деле производства промышленных количеств антител. «Биотехнологическое производство белков», как уже говорилось в соответствующей главе статьи «Методы в картинках: клеточные технологии» [21], это производство белков в «неродной» клетке с помощью специальных генетических инструментов — векторов со вставленными в них участками с генами необходимых антител (о том, как получают эти участки, рассказано ниже, в разделе «Фаговый дисплей»).
Антитела — чрезвычайно капризный материал для биотехнологического производства. Во-первых, они состоят из двух типов цепей, а, во-вторых, содержат в своей структуре несколько дисульфидных связей, которые могут быть построены только специальными ферментами. Поэтому производство полноразмерных антител — дело не из легких, и с ним справится далеко не каждая система экспрессии рекомбинантных белков [22].
95% применяемых в клинике антител производится в клеточных линиях млекопитающих. Это дорого и долго, но другого выхода нет — только клетка млекопитающего хорошо понимает, как именно провести посттрансляционную модификацию полноценного антитела. Есть несколько клеточных линий, которые могут продуцировать антитела. Самые известные из них — клетки яичника китайского хомячка (chinese hamster ovary, CHO) и линия человеческой эмбриональной почки (human embryonic kidney, HEK293). Они пригодны как для получения линии, стабильно экспрессирующей нужное антитело, так и для производящей продукт лишь некоторое время (транзиентная экспрессия).
При этом фрагменты антител (Fab, scFv и так далее) вполне можно производить и в других биотехнологических системах, прежде всего, бактериальных: эти фрагменты достаточно маленькие, чтобы их ген влез в бактериальную плазмиду, и к тому же их не надо посттрансляционно модифицировать — бактерии этого делать просто не умеют. Помимо бактерий, производить фрагменты антител могут дрожжи, нитчатые грибы и линии клеток насекомых.
Для получения антител можно использовать и целые организмы — так называемые трансгенные растения и животные. Растения немного отличаются от животных по паттернам гликозилирования, поэтому для того, чтобы синтезированные растительной клеткой белки тяжелой и легкой цепи антитела правильно соединились между собой, ученым приходится применять множество сложных уловок. Тем не менее использование трансгенных растений существенно снижает себестоимость получения антител, и хотя сейчас на рынок еще не вышло ни одно антитело, произведенное таким образом, несколько из них уже проходят клинические испытания.
Еще одна заманчивая перспектива для производства антител — использование трансгенных животных, ведь в этом случае нужные нам белки можно будет получать, например, в молоке мышей, кроликов, коров и овец или даже в яйцах кур. В настоящее время такой способ получения антител активно исследуется, однако пока он далек от реального использования в медицине [23], [24].
Фаговый дисплей
Фаговый дисплей (рис. 14) — это, строго говоря, не метод наработки антител, а лишь подготовительная методика для их промышленной наработки, а именно, получения векторных вставок для последующего биотехнологического производства (о котором мы только что рассказали).
Метод основан на работе бактериальных вирусов — бактериофагов. Суть метода заключается в следующем факте: если в ген, который отвечает за синтез оболочки бактериофага, встроить ген какого-либо другого белка, то фаг будет «отображать» (display) этот другой белок на своей поверхности. Если фагов с разными генами много, мы получаем фаговую библиотеку. Фаговая библиотека антител представляет собой популяцию бактериофагов, каждый из которых несет на себе либо Fab-фрагмент антитела, либо sdAb. Существует несколько типов фаговых библиотек. Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Сфокусированные библиотеки создают из клеток иммунизированного животного. В этом случае происходит увеличение числа вариантов антител к антигену, которым иммунизируют животных. Синтетические библиотеки состоят из генов, синтезированных искусственно [25].
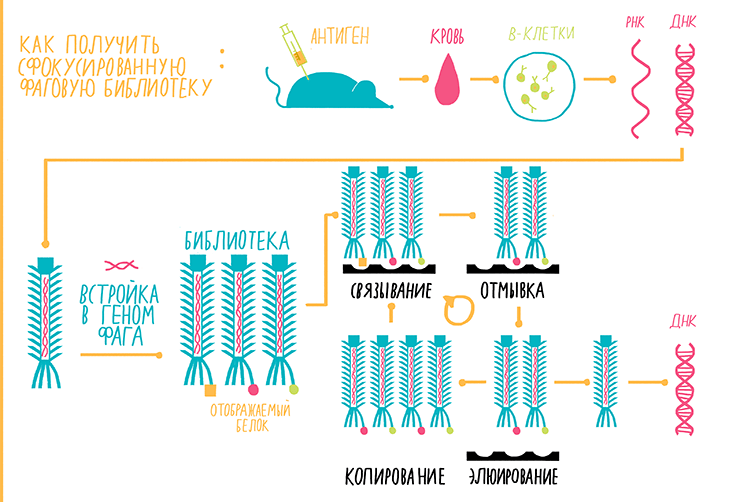
Рисунок 14. Схема фагового дисплея (на примере сфокусированной библиотеки). Пояснения — в тексте.
рисунок Ольги Пташник
Разберем схему фагового дисплея на примере сфокусированной библиотеки (рис. 14).
- Иммунизируем животное тем антигеном, к которому хотим получить антитела.
- Отбираем у животного кровь и выделяем из нее B-лимфоциты.
- Из этих клеток клонируем последовательность всех генов антител, для чего выделяем из них РНК и на ее основе синтезируем комплементарную ДНК.
- Встраиваем полученную последовательность комплементарной ДНК в геном фага.
Библиотека получена, но в ней находится очень много фагов. Многие из них несут антитела к неспецифическим мишеням, которые не представляют интереса для исследователя — ситуация такая же, как и в вышеописанном методе гибридом. Исследователь получает сонмище антител, из которых ему нужно выделить те, которые узнают целевой антиген. И здесь снова потребуются селекции. - Чтобы вытащить из библиотеки только те бактериофаги, которые несут на своей поверхности специфический белок, их инкубируют с антигеном — если на фаге есть нужное антитело, то он окажется крепко связанным с антигеном.
- Несвязавшиеся фаги легко смываются...
- ...а оставшиеся отделяют от антигена...
- ...и заражают ими бактерии.
Бактерии активно делятся, и, соответственно, в них также увеличивается и количество необходимых вирусов. В новой фаговой библиотеке неспецифических молекул будет еще меньше, и, повторяя селекцию несколько раз, можно избавиться от них практически полностью. В результате останутся только те фаги, которые несут на своей поверхности нужные фрагменты белков. - Из этих оставшихся фагов извлекают ДНК, определяют нуклеотидную последовательность, и клонируют ее в бактериальный или иной вектор для последующих получения и наработки антител, о чем рассказано в разделе «Биотехнологическое производство в эукариотических рекомбинантных системах».
Заключение
Иммунные методы — это незаменимая в современном мире группа методик, которая позволяет «поймать» практически любую сложную молекулу, определить ее количество, местоположение в клетке или ткани и даже иногда «поймать» те молекулы, с которыми наша молекула связывается. Кроме того, эти методики очень широко представлены в повседневной жизни: от анализа крови на антитела до теста на беременность.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет ноябрь.
Литература
- A. H. Coons, H. J. Creech, R. N. Jones. (1941). Immunological Properties of an Antibody Containing a Fluorescent Group.. Experimental Biology and Medicine. 47, 200-202;
- R. Wicker, S. Avrameas. (1969). Localization of Virus Antigens by Enzyme-labelled Antibodies. Journal of General Virology. 4, 465-471;
- Eva Engvall, Peter Perlmann. (1971). Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry. 8, 871-874;
- B.K. Van Weemen, A.H.W.M. Schuurs. (1971). Immunoassay using antigen-enzyme conjugates. Unknown journal title.. 15, 232-236;
- Towbin H., Staehelin T., Gordon J. (1979). Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. USA. 76, 4350–4354;
- G. Smith. (1985). Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science. 228, 1315-1317;
- Yuval Blat, Nancy Kleckner. (1999). Cohesins Bind to Preferential Sites along Yeast Chromosome III, with Differential Regulation along Arms versus the Centric Region. Cell. 98, 249-259;
- Gordon Robertson, Martin Hirst, Matthew Bainbridge, Misha Bilenky, Yongjun Zhao, et. al.. (2007). Genome-wide profiles of STAT1 DNA association using chromatin immunoprecipitation and massively parallel sequencing. Nat Meth. 4, 651-657;
- Альтшулер Е.П., Серебряная Д.В., Катруха А.Г. (2010). Получение рекомбинантных антител и способы увеличения их афинности. Успехи биологической химии. 50, 203–258;
- Моноклональные антитела;
- Флуоресцентные репортеры и их молекулярные репортажи;
- 12 методов в картинках: микроскопия;
- В Москве прошла научная школа «Применение SPR-биосенсоров Biacore в разработках лекарств»;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Muhammad Sajid, Abdel-Nasser Kawde, Muhammad Daud. (2015). Designs, formats and applications of lateral flow assay: A literature review. Journal of Saudi Chemical Society. 19, 689-705;
- Karunakaran Kaliyappan, Murugesan Palanisamy, Jeyapradha Duraiyan, Rajeshwar Govindarajan. (2012). Applications of immunohistochemistry. J Pharm Bioall Sci. 4, 307;
- D. S. Johnson, A. Mortazavi, R. M. Myers, B. Wold. (2007). Genome-Wide Mapping of in Vivo Protein-DNA Interactions. Science. 316, 1497-1502;
- 12 методов в картинках: полимеразная цепная реакция;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 12 методов в картинках: клеточные технологии;
- André Frenzel, Michael Hust, Thomas Schirrmann. (2013). Expression of Recombinant Antibodies. Front. Immunol.. 4;
- Marianne Brüggemann, Michael J. Osborn, Biao Ma, Jasvinder Hayre, Suzanne Avis, et. al.. (2015). Human Antibody Production in Transgenic Animals. Arch. Immunol. Ther. Exp.. 63, 101-108;
- M. J. Osborn, B. Ma, S. Avis, A. Binnie, J. Dilley, et. al.. (2013). High-Affinity IgG Antibodies Develop Naturally in Ig-Knockout Rats Carrying Germline Human IgH/Ig /Ig Loci Bearing the Rat CH Region. The Journal of Immunology. 190, 1481-1490;
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека;
- Karin M. (1990). Too many transcription factors: positive and negative interactions. New Biol. 2, 126–131;
- Ivan Yevshin, Ruslan Sharipov, Tagir Valeev, Alexander Kel, Fedor Kolpakov. (2017). GTRD: a database of transcription factor binding sites identified by ChIP-seq experiments. Nucleic Acids Res. 45, D61-D67;
- C Tuerk, L Gold. (1990). Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510;
- Andrew D. Ellington, Jack W. Szostak. (1990). In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822;
- Yetrib Hathout, Edward Brody, Paula R. Clemens, Linda Cripe, Robert Kirk DeLisle, et. al.. (2015). Large-scale serum protein biomarker discovery in Duchenne muscular dystrophy. Proc Natl Acad Sci USA. 112, 7153-7158.