Альцгеймеровский нейротоксин: ядовиты не только фибриллы
07 декабря 2007
Альцгеймеровский нейротоксин: ядовиты не только фибриллы
- 2235
- 0
- 6
Один из интегральных белков мембраны нейронов — предшественник токсичного пептида, вызывающего болезнь Альцгеймера, — играет определённую роль в росте и дифференциации нервных клеток. Однако фрагмент Aβ этого белка (β-амилоидный пептид, показан зелёным), отщепляясь, приобретает способность к полимеризации и разрушает нервные клетки, что и приводит к возникновению болезни Альцгеймера.
-
Автор
-
Редакторы
Заболевания амилоидной природы — группа в основном неизлечимых прогрессирующих нейродегенеративных расстройств, включающая болезни Альцгеймера, Паркинсона и прионные заболевания. Молекулярный механизм этих болезней связывают со спонтанной пространственной перестройкой определённого белка (специфичного для каждого заболевания), придающей ему способность к полимеризации и образованию макромолекулярных фибрилл, токсичных для нервных клеток. Учёным из Чикаго удалось показать, что патогенным действием в болезни Альцгеймера обладают не только сами внутриклеточные фибриллы, но и предшествующие им сферические агрегаты, молекулы β-амилоидного пептида (Aβ) в которых имеют весьма схожую упаковку с фибрилло-образующими формами. β-структурные элементы, обнаруженные в этих молекулах, могут оказаться определяющим фактором для приобретения пептидом токсического действия.
Болезнь Альцгеймера (возникает преимущественно в старческом возрасте) — дегенеративное заболевание центральной нервной системы, характеризующееся прогрессирующим снижением интеллекта, расстройством памяти и изменением поведения. Это заболевание связано с отложением в нервных клетках мозга амилоидного пептида (в виде нерастворимых «фибрилл» молекулярной массой миллионы дальтон), вызывающего дегенерацию нейронов и нарушение холинэргической синаптической передачи.
Механизм болезни Альцгеймера, как и других нейродегенеративных заболеваних амилоидной природы, принято объяснять конформационной перестройки определённого белка, специфичного для конкретного заболевания. Белок болезни Альцгеймера (Aβ) состоит из примерно 40 аминокислотных остатков и является продуктом расщепления белка-предшественника, расположенного в мембране нервных клеток. Несмотря на существенные различия амилоидных белков из разных организмов и характерных для разных заболеваний, считается, что механизм всех этих болезней примерно одинаков (см. врезку). Многие амилоидные пептиды, безвредные в мономерной форме, становятся токсичными после полимеризации и образования фибрилл. Вследствие этого, нейротоксичность считается прямым следствием фибриллизации белка.
Профессору Ишии (Yoshitaka Ishii) из Иллинойского университета в Чикаго и его коллегам удалось охарактеризовать одну из промежуточных форм, принимаемых альцгеймеровым пептидом (Aβ) в процессе полимеризации. Ещё до образования амилоидных фибрилл, агрегаты Aβ принимают форму сфер с диаметром около 20 нм, уже обладающих токсическим эффектом. Что интересно, патогенное действие этих форм примерно в десять раз выше, чем у фибрилл. Этот факт опровергает гипотезу, что токсический эффект фибрилл вызван исключительно их геометрией и размером, поскольку «пойманные» на промежуточной стадии агрегаты по размеру намного меньше фибриллярных форм.
С помощью метода твердотельного ядерного магнитного резонанса учёным удалось установить, что в структуре этой формы Aβ присутствует большое число β-тяжей, характерных и для «фибриллярной» формы этого пептида. Хотя детальная структура промежуточной формы не была установлена (учёные рассчитывают получить её в ходе дальнейших исследований), исследователи выдвинули гипотезу, что именно β-структуры, присутствующие в амилоидном пептиде, являются главной детерминантой нейроксичности (рис. 1).
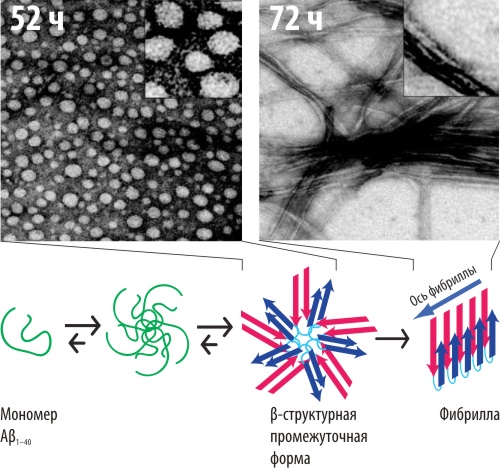
Рисунок 1. Промежуточные стадии формирования амилоидной фибриллы. Вверху: Морфологические свойства амилоидных образований, наблюдаемых через различное время инкубации мономерной формы Aβ (трансмиссионная электронная микрофотография). Промежуточные стадии характеризуются сферическими агломератами, конечная — образованием протяжённых фибрилл. Внизу: предложенный учёными механизм формирования фибриллы. Мономерная форма Aβ, не содержащая в своей структуре β-тяжей, ассоциирует в частицы сферической формы (~10 нм), в составе которых молекулы альцгеймеровского пептида меняют конформацию (возникающие β-структуры показаны стрелками), что приводит к укрупнению частиц до ~20 нм. Эти частицы (формирующиеся через 52 часа после начала инкубации) уже обладают токсическим действием и через некоторое время полимеризуются с образованием фибрилл.
«Наша методика позволила охарактеризовать структуру нестабильной промежуточной формы Aβ, — говорит Ишии. — Насколько нам известно, это первое описание структуры токсического интермедиата амилоидных белков. Наши эксперименты показали, что структура этой формы очень схожа с конечной (фибрилло-образующей) формой, чего мы никак не ожидали» [2]. Структурные исследования пептида Aβ, по заявлению профессора, в будущем могут быть использованы фармацевтическими компаниями для разработки соединений, предотвращающих фибриллизацию и взаимодействие токсичных форм амилоидных белков с нейронами.
«Среди наших интересов — применение аналогичного подхода для изучения процесса формирования пептидных нано-ансамблей», — конкретизирует Ишии свои будущие планы.
Литература
- Sandra Chimon, Medhat A Shaibat, Christopher R Jones, Diana C Calero, Buzulagu Aizezi, Yoshitaka Ishii. (2007). Evidence of fibril-like β-sheet structures in a neurotoxic amyloid intermediate of Alzheimer's β-amyloid. Nat Struct Mol Biol. 14, 1157-1164;
- Chemists characterize Alzheimer's neurotoxin structure. (2007). ScienceDaily.