Аммонийный датчик анаммокс-бактерии
07 мая 2018
Аммонийный датчик анаммокс-бактерии
- 1189
- 0
- 4
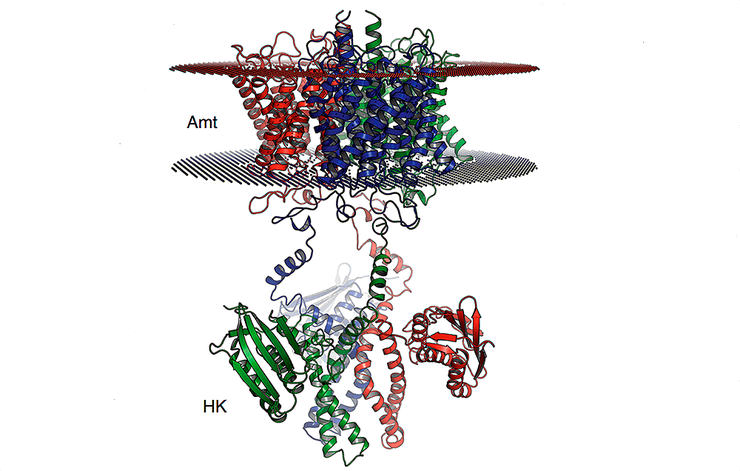
Модель белка Ks-Amt5 состоит из двух частей: одна (Amt) пронизывает мембрану клетки насквозь и выполняет функции рецептора, вторая (HK) находится внутри клетки и передает сигнал в клетку.
-
Авторы
-
Редакторы
Темы
Ученым из Института математических проблем биологии РАН совместно с коллегами из Германии и Нидерландов удалось установить структуру необычной сигнальной системы недавно открытых анаммокс-бактерий. Результаты исследования опубликованы в журнале Nature Communications [1].
Анаммокс-бактерии открыли в самом конце XX века [2]. Их отнесли к типу Planctomycetes, то есть к грамотрицательным бактериям со специфической системой замкнутых внутренних мембран. Название же «анаммокс» добавили потому, что они осуществляют анаэробное окисление аммония [3]. Для этого микроорганизмам не требуется молекулярный кислород, а самого аммония в среде может быть совсем немного.
Анаммокс-бактерии — это группа микроорганизмов с уникальными морфологическими, физиологическими и биохимическими свойствами. Большинство известных планктомицетов аэробны, однако анаммокс-бактерии — анаэробы, и получают энергию за счет окисления аммония в условиях отсутствия кислорода. Что интересно, промежуточным продуктом является гидразин — вещество ракетного топлива, ядовитое для большинства организмов. В качестве источника углерода для роста эти бактерии используют диоксид углерода СО2 и являются, таким образом, автотрофными микроорганизмами, растущими исключительно на неорганике [4]. В их клетках всегда содержится единственная аннамоксосома — окруженный мембраной компартмент, в котором и происходит процесс анаммокса. Кроме того, в состав их мембран входят особые ладдерановые липиды, обнаруженные лишь у этих организмов. До 30% всех белков в клетках, осуществляющих анаммокс, — это белки типа цитохрома с. К их числу относятся и ферменты ключевых катаболических реакций анаммокса. Они придают клеткам характерный красный цвет (рис. 1).

Рисунок 1. Культура анаммокс-бактерий, открытых в XX веке. Красный цвет клеткам придают ферменты, принимающие участие в процесса анаммокса — анаэробного окисления аммония.
сайт mutag.de
Так, анаммокс-бактерия вырабатывает метаболическую энергию, сочетая восстановление нитрита (NO2−) и окисление аммония (NH4+). Конечными продуктами являются вода и молекулярный азот [5]:
NH4+ + NO2− → N2 + 2H2O.
Раньше считалось, что планктомицеты имеют ограниченное экологическое значение. Но сейчас молекулярная микробная экология доказала, что эти бактерии распространены повсеместно и составляют значительную часть естественной популяции бактерий [6]. Очень важным следствием открытия процесса анаммокса и его последующего изучения является создание новых технологий очищения сточных вод c высоким содержанием аммония и почти без органики.
Где у анаммокс-бактерии нос?
Международная группа ученых, в которую входили биоинформатики из Института математических проблем биологии РАН, задалась вопросом: как же бактерия находит аммоний в окружающей среде? Ранее анализ генома микроорганизма Candidatus Kuenenia stuttgartiensis привел к обнаружению необычной молекулы из семейства аммиачных белков Amt/Rh, которая получила название Ks-Amt5 [7]. Последовательность аминокислот этого белка содержала необычную комбинацию двух доменов. Первая часть была похожа на мембранные белки, осуществляющие транспорт ионов аммония внутрь клетки. Вторая часть напоминала белки гистидинкиназы, часто присутствующие в системах передачи сигнала из наружной среды в клетку. Слияния транспортных белков с другими доменами обнаруживали и ранее, но их роль в клетке оставалась невыясненной. Высокая конформационная подвижность этих модульных белков создавала серьезное препятствие для определения пространственной структуры.
Исследователи предположили, что в Ks-Amt5 два строительных блока, уже существующих в природе, соединены для обеспечения совершенно новой функциональности — обнаружения аммония в окружающей среде и последующей передачи этой информации внутрь клетки. Ученые из Института математических проблем биологии РАН с коллегами из Университета Фрайбурга (Германия), Европейской молекулярно-биологической лаборатории в Гамбурге (Германия) и Университета Неймегена (Нидерланды) определили пространственную структуру белка Ks-Amt5 и установили его роль в жизнедеятельности клетки, подтвердив предположение (рис. 2) [1].
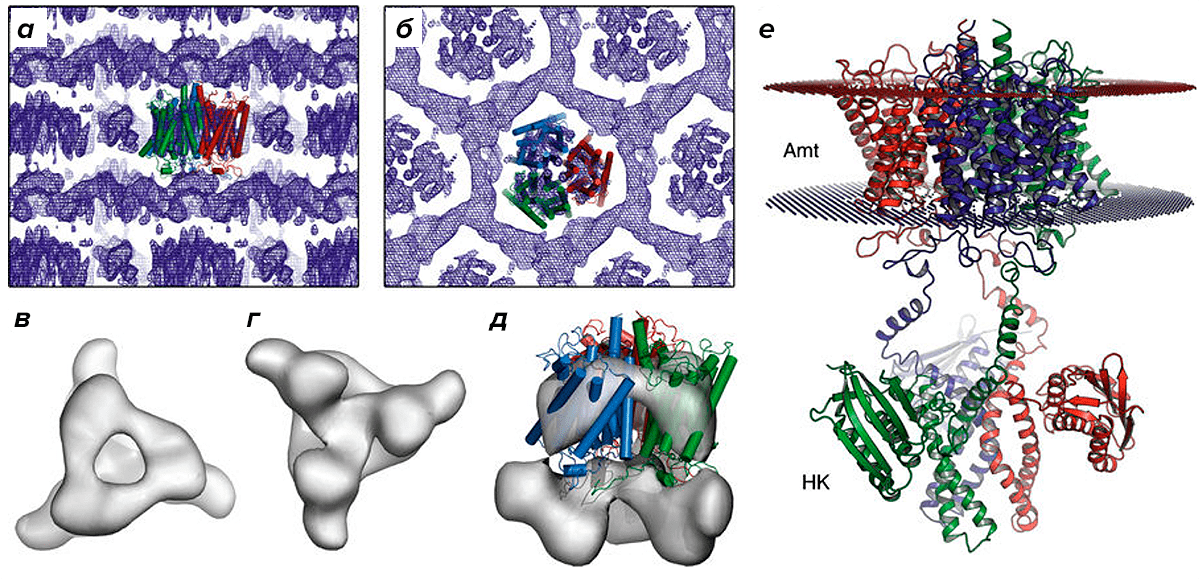
Рисунок 2. Структура белка Ks-Amt5. а — Карта электронной плотности, показывающая слои кристаллов типа I, с высокоразрешающей структурой домена Аmt. б — Вид сверху. Карта плотности электронов лучше разрешена для домена Аmt, который определяет упаковку кристалла, тогда как гистидинкиназный домен выглядит беспорядочно и находится между соседними доменами Аmt. в — Вид сверху полноразмерного Ks-Amt5 в синтезе взвешенной электронной плотности при разрешении 8 Å, очерченном на уровне 1σ. г — Вид снизу на домен HK. д — Синтез электронной плотности Ks-Amt5 с низким разрешением, наложенный на трехмерную структуру высокого разрешения домена Amt. е — Гипотетическая, расширенная компоновка датчика-преобразователя в мембране, показывающая структуру домена Amt, связанного с моделью гомологии для HK-домена в произвольной расширенной конформации. Домены HK структурно гибки в цитоплазме, а их конформация в растворе не идентична той, которая наблюдается в кристаллической решетке.
Оказалось, что, несмотря на схожесть с транспортными белками, трансмембранная часть Ks-Amt5 не способна транспортировать ионы аммония, но имеет центры их связывания. Связывание поступившего из внешней среды иона в таком центре вызывает конформационные изменения трансмембранной части белка, передающиеся на внутриклеточную гистидинкиназную часть и способствующие фосфорилированию гистидина. Это и является сигналом о присутствии аммония во внешней среде. Данный механизм позволяет транслировать внеклеточные стимулы внутрь клетки. Далее они переводятся в адекватный клеточный ответ и быструю адаптацию к изменениям окружающей среды [8]. Также исследователи установили, что присутствие вне клетки аммония даже в очень небольших концентрациях повышает скорость фосфорилирования, которая, однако, снижается при чрезмерном увеличении количества аммония вне клетки. Результаты исследования опубликованы в журнале Nature Communications [1].
Математический подход
«Для изучения структуры была проведена кристаллизация белка. Но полученные кристаллы не позволили определить положение и структуру киназной части системы стандартными методами биологической кристаллографии, — рассказывает Владимир Лунин, руководитель лаборатории кристаллографии макромолекул ИМПБ РАН. — Проблему удалось решить, применив разработанные в нашей лаборатории математические подходы к работе с недостаточно упорядоченными кристаллами».
Пространственную структуру белка можно определить, изучая рассеяние рентгеновских лучей молекулами исследуемого белка. О сути методик структурной биологии мы уже рассказывали в статье «12 методов в картинках: структурная биология» [9]. Интенсивность рассеянных волн очень мала, и их трудно зарегистрировать. Однако если уложить молекулы в кристаллическую решетку, то интенсивность изначально слабых рассеянных лучей резко увеличивается. Чем больше волн, рассеянных в разных направлениях, удалось зарегистрировать, тем более тонкие детали структуры можно определить. Количество экспериментальных данных и детальность определения структуры характеризуется разрешением — размером минимальных различаемых деталей структуры.
Получение кристаллов исследуемого белка — центральная проблема в применении этого метода исследования. Особенно большие сложности возникают при попытке кристаллизации систем, состоящих из нескольких гибко сочлененных частей, как, например, у анаммокс-бактерии. В таком случае отдельные экземпляры молекулы могут оказаться в кристалле в разных конформациях, что выливается в «размывание» картины на картах электронной плотности. На полученных методом молекулярного замещения картах электронной плотности разрешения около 2 Å отчетливо проявилась трансмембранная часть белка, в то время как киназная часть была невидима.
Для стабилизации белка предприняли попытку кристаллизации его комплекса с ингибитором Ro протеинкиназы С. Это привело к частичному успеху: качество кристаллов позволяло получить лишь набор экспериментальных данных, ограниченный разрешением 8 Å. Столь низкое разрешение не позволило локализовать киназную часть структуры стандартными кристаллографическими подходами. Проблему удалось решить, применив специальные подходы, разработанные в Институте математических проблем биологии РАН для работы с наборами экспериментальных данных низкого разрешения.
Карту распределения электронной плотности в белке можно рассчитать как сумму синусоидальных волн (гармоник Фурье). При этом амплитуды волн могут быть измерены в эксперименте, а фазовые сдвиги остаются неизвестными. Определение значений фаз является центральной проблемой при расшифровке структуры. Обычно, для решения этой проблемы используют либо дополнительные эксперименты с другими длинами волн рентгеновского излучения (многоволновое аномальное рассеяние) или модифицированными белками (метод изоморфного замещения), либо используют информацию об известной структуре гомологичных белков (метод молекулярного замещения). Эти подходы позволили определить структуры многих тысяч белков, но иногда они дают сбой, если набор экспериментальных данных слишком мал (не обладает достаточным разрешением). Для таких случаев в ИМПБ РАН разработаны так называемые ab initio подходы, не требующие дополнительных экспериментов или наличия гомолога. Они пока не позволяют получить столь же детальные карты электронной плотности, как стандартные методы, однако дают возможность определить локализацию и внешние очертания исследуемых объектов, используя лишь данные низкого разрешения (рис. 3).
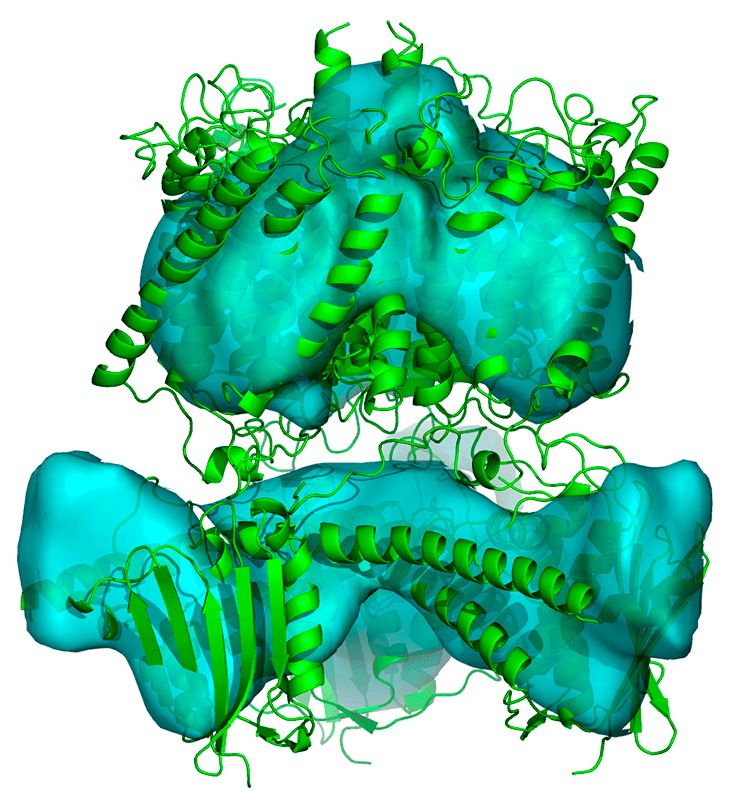
Рисунок 3. Ab initio определенная карта распределения электронной плотности разрешения 8 Å для ингибированного белка Ks-Amt5 c вписанной моделью белка
В примененном подходе для исследования ингибированного белка Ks-Amt5 сначала с помощью суперкомпьютеров рассчитываются миллионы гипотетических распределений электронной плотности, построенных с использованием экспериментально измеренных амплитуд волн и случайно выбранных значений фаз. Полученные распределения анализируются компьютером, и из всего множества отбирается сравнительно небольшое количество карт, похожих на настоящие карты электронной плотности в белках. Центральная проблема метода — выбор критериев «похожести» случайных карт на те, которые встречаются в белках в реальности. В проведенном исследовании в качестве такого критерия применялись свойства связности областей высокой электронной плотности в реальных структурах белков. Использование критерия связности дает возможность отобрать среди сгенерированных карт те, при расчете которых использовались значения фаз, близкие к правильным. Выравнивание и усреднение отобранных карт позволяет получить более четкое изображение объекта, нежели на отдельных отобранных картах.
Что же дальше?
Азот является основным компонентом земной атмосферы, и анаммокс — один из ключевых микробных процессов в его круговороте. Его считают основным фактором, способствующим очистке окружающей среды от реактивного азота, а это просто необходимо при чрезмерном использовании азотных удобрений в промышленном сельском хозяйстве. Теперь, зная работу сигнальной системы анаммокс-бактерий, ее можно лучше использовать в экологических целях: более эффективно регулировать переработку аммония, например, при промышленной очистке сточных вод от азотных загрязнений.
Литература
- Tobias Pflüger, Camila F. Hernández, Philipp Lewe, Fabian Frank, Haydyn Mertens, et. al.. (2018). Signaling ammonium across membranes through an ammonium sensor histidine kinase. Nat Commun. 9;
- Van de Graaf A.A., Mulder A., Slijkhuis H., Robertson L.A., Kuenen J.G. (1990). Anoxic ammonium oxidation. 5th European Congress on Biotechnology, Copenhagen. 1, 388–391;
- J. Gijs Kuenen. (2008). Anammox bacteria: from discovery to application. Nat Rev Micro. 6, 320-326;
- А. Ю. Каллистова, А. Г. Дорофеев, Ю. А. Николаев, М. Н. Козлов, М. В. Кевбрина, et. al.. (2016). Роль анаммокс-бактерий в очистке сточных вод от соединений азота. Микробиология. 85, 126-144;
- Mike S. M. Jetten, Laura van Niftrik, Marc Strous, Boran Kartal, Jan T. Keltjens, Huub J. M. Op den Camp. (2009). Biochemistry and molecular biology of anammox bacteria. Critical Reviews in Biochemistry and Molecular Biology. 44, 65-84;
- Marc Strous, John A. Fuerst, Evelien H. M. Kramer, Susanne Logemann, Gerard Muyzer, et. al.. (1999). Missing lithotroph identified as new planctomycete. Nature. 400, 446-449;
- Boran Kartal, Wouter J. Maalcke, Naomi M. de Almeida, Irina Cirpus, Jolein Gloerich, et. al.. (2011). Molecular mechanism of anaerobic ammonium oxidation. Nature. 479, 127-130;
- Ann M. Stock, Victoria L. Robinson, Paul N. Goudreau. (2000). Two-Component Signal Transduction. Annu. Rev. Biochem.. 69, 183-215;
- 12 методов в картинках: структурная биология.