
Анти-CRISPR: ответ вирусов
06 декабря 2017
Анти-CRISPR: ответ вирусов
- 1774
- 1
- 15
-
Автор
-
Редактор
Системы CRISPR/Cas, обеспечивающие адаптивный иммунитет к вирусам и мобильным генетическим элементам у прокариот, обнаружены примерно у 50% бактерий и 90% архей. Однако некоторые бактериофаги могут нарушать работу системы CRISPR/Cas при помощи особых белков, получивших в совокупности название «анти-CRISPR» (англ. anti-CRISPR). На данный момент описано 22 семейства белков анти-CRISPR, которые действуют против систем CRISPR/Cas I и II типов. Предполагается, однако, что способность избегать действия систем CRISPR/Cas широко распространена среди фагов и других мобильных генетических элементов, так как, согласно новейшим данным, системы CRISPR/Cas минимально препятствуют горизонтальному переносу генов. Данная статья посвящена истории открытия, механизмам действия, а также эволюционному и биотехнологическому значениям известных на сегодняшний момент анти-CRISPR-белков.
Кратко о системах CRISPR/Cas
В процессе эволюции бактерии приобрели несколько приспособлений, направленных на борьбу с бактериофагами: системы рестрикции-модификации, которые уничтожают чужеродную ДНК, разрезая ее на кусочки, системы токсин-антитоксин, которые вызывают прерывание инфекционного цикла, и системы CRISPR/Cas. Первые две защитные системы можно сравнить с врожденным иммунитетом животных: их действие неспецифично и никак не изменяется в ходе жизни организма. Действие систем CRISPR/Cas специфично к нуклеотидным последовательностям чужеродных нуклеиновых кислот и может изменяться в процессе жизни микроорганизма, поэтому системы CRISPR/Cas можно сравнить с приобретенным иммунитетом млекопитающих. Действие этих систем основано на разрушении генетического материала вторгшегося вируса при помощи комплекса белков-нуклеаз, носящих название Cas, который связывается с вирусной ДНК за счет комплементарной ей направляющей РНК.
Но откуда в геноме микроорганизма берутся последовательности, комплементарные вирусной ДНК? Оказывается, при первом вторжении чужеродной ДНК в клетках многих бактерий и архей от нее отрезается небольшой кусочек, который вставляется в геном микроорганизма, а именно — в специальный локус, получивший название CRISPR (от англ. clustered regularly interspaced short palindromic repeats). При повторном заражении тем же вирусом с этой вставки транскрибируется короткая молекула РНК, которая в комплексе с белками-нуклеазами, разрушающими ДНК, связывается с чужеродной ДНК, и нуклеазы разрезают ее на кусочки . На данный момент известно шесть типов систем CRISPR/Cas, которые отличаются механизмами действия. В системах типов I, III и IV с направляющей РНК связывается комплекс из нескольких белков, а в системах II, V и VI и за связывание с направляющей РНК, и за разрушение чужеродной ДНК отвечает один белок. Белки анти-CRISPR обнаружили только для систем I и II типов.
Более подробно работа систем CRISPR/Cas рассматривается в статье «Просто о сложном: CRISPR/Cas» [1], а история изучения этих систем — в статье «CRISPR-эпопея и ее герои» [2].
Изучение анти-CRISPR
До открытия анти-CRISPR был известен только один способ, с помощью которого фагам удается ускользнуть от CRISPR/Cas, — приобретение точечных мутаций. Они практически не сказываются на жизнеспособности фага, зато нарушают комплементарность спаривания фаговой ДНК с направляющей РНК, из-за чего система CRISPR/Cas не может распознать вирусный генетический материал. Однако микроорганизмы быстро наносят ответный удар, вставляя в свой геном новые фрагменты чужеродной ДНК.
Первые белки анти-CRISPR открыли в 2013 году у нескольких родственных фагов, поражающих бактерию Pseudomonas aeruginosa [3]. Теоретически если фаг встроится в геном бактерии, имеющей активную систему CRISPR/Cas, то бактерия погибнет, поскольку разрежет собственный геном. Однако встраивание некоторых фагов в геном бактерий с активной CRISPR/Cas не приводило к гибели клеток. При сравнении геномов фагов, вызывающих гибель бактериальных клеток, и фагов, которые не приводят к смерти клеток, оказалось, что у последних имеется особый локус, содержащий десять совершенно различных и очень коротких генов (длиной 150–450 нуклеотидов). Выяснилось, что белковые продукты пяти из них (acrF1–acrF5) нарушают работу системы CRISPR/Cas типа I-F у P. aeruginosa, а еще четыре (acrE1–acrE4) блокируют систему типа I-E у той же бактерии. Гены анти-CRISPR были выявлены не только у фагов P. aeruginosa, но также в плазмидах и конъюгативных островках этой бактерии [3].
Последовательности белков анти-CRISPR сильно различаются и не имеют какого-то общего мотива, который бы помог идентифицировать аналогичные гены в геномах других бактериофагов при помощи стандартных методов биоинформатики. Однако оказалось, что окружение генов анти-CRISPR очень похоже: у всех них после собственно генов анти-CRISPR находится ген, кодирующий транскрипционный фактор под названием Aca1 (от англ. anti-CRISPR associated 1) [3]. Фаги, не имеющие генов анти-CRISPR, не имеют и гена aca1. Более того, гены анти-CRISPR и ген aca1 образуют единый оперон, а белок Aca1, по-видимому, регулирует экспрессию анти-CRISPR сообразно стадии инфекционного цикла фага. Белок Aca1 имеет структурный мотив «спираль—поворот—спираль», часто встречающийся среди транскрипционных факторов. Чтобы установить, кодирует ли исследуемый участок генома бактериофага белки анти-CRISPR, ученые проверяли наличие сразу за ним гена, кодирующего белок с мотивом «спираль—поворот—спираль». С помощью такого подхода белки анти-CRISPR, действующие против систем I типа, открыли у бактериофагов разнообразных протеобактерий. Тот же подход привел к открытию анти-CRISPR, нарушающих работу систем II типа [3], [4].
Недавно создали базу данных белков анти-CRISPR — antiCRISPRdb, — в которой любой желающий может найти известную информацию об интересующем белке анти-CRISPR [5].
Механизм действия анти-CRISPR
Сегодня известно 22 семейства белков анти-CRISPR. Их объединяет лишь малый размер (от 50 до 150 аминокислотных остатков), они не имеют какого-либо общего мотива и ни один из них не похож на какой-либо белок с известной функцией. Поэтому предположить механизм действия анти-CRISPR с помощью биоинформатики оказалось невозможным. Пока удалось установить механизм действия шести белков анти-CRISPR с использованием генетического, биохимического и структурного подходов (рис. 1).
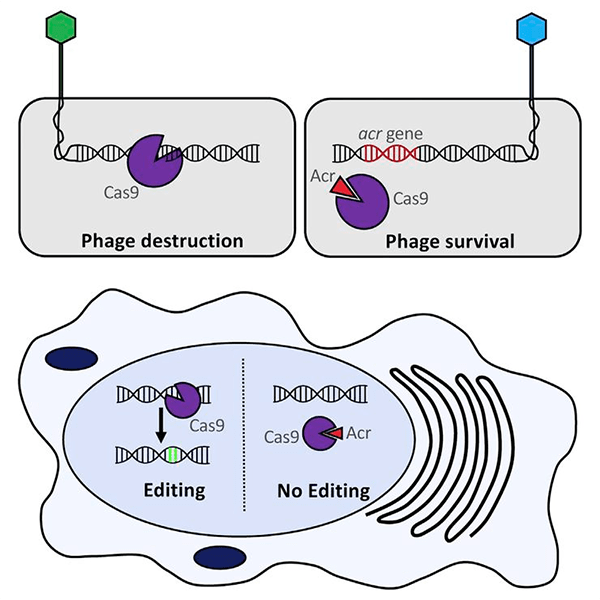
Рисунок 1. Белки группы анти-CRISPR могут связываться с элементами ключевой молекулярной машины системы CRISPR/Cas (например белком Cas9) и блокировать его работу. Это может происходить не только в бактериальных клетках (сверху), но и в клетках млекопитающих, геном которых редактируется с помощью системы CRISPR/Cas (снизу).
Теоретически, белки анти-CRISPR могут влиять на работу CRISPR/Cas на нескольких этапах. Они могут:
- препятствовать вставке новых фрагментов чужеродной ДНК в геном микроорганизма;
- нарушать синтез белков Cas;
- блокировать образование направляющей РНК;
- препятствовать сборке активного комплекса белков Cas с РНК;
- мешать связыванию комплекса с чужеродной ДНК;
- блокировать способность комплекса к разрезанию ДНК-мишени.
На данный момент описано действие белков анти-CRISPR по двум последним сценариям. Например, белки AcrF1 и AcrF2 присоединяются к комплексу белков Cas и РНК, не давая ему связываться с чужеродной ДНК. Белок AcrF3 взаимодействует с белком Cas3 (рис. 2), обладающим хеликазной и нуклеазной активностями, и не дает ему присоединиться к комплексу других белков Cas и РНК, уже связавшему ДНК-мишень. AcrIIC1 связывается с нуклеазным доменом белка Cas9 (единственного белка Cas в системах II типа), не давая ему разрезать ДНК [3].
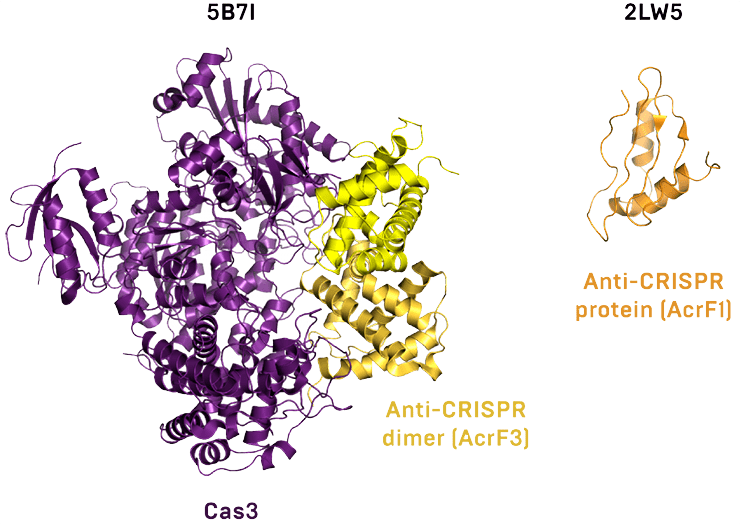
Рисунок 2. Пространственные структуры белка Cas3, связанного с димером AcrF3 (слева), и белка AcrF1 (справа).
Некоторые белки анти-CRISPR активны против нескольких систем CRISPR/Cas. Например, белки анти-CRISPR, действующие против систем типа II-A, подавляют работу гомологичных белков Cas9, аминокислотные последовательности которых схожи лишь на 53% [3], [4].
Эволюционное значение анти-CRISPR
Недавние исследования показали, что одних только точечных мутаций бактериофагам недостаточно, чтобы избежать действия CRISPR/Cas. Фагу необходимо иметь, по крайней мере, один ген анти-CRISPR, чтобы избежать полного уничтожения при совместном культивировании с бактериями с активными системами CRISPR/Cas. По-видимому, столь сильный отбор вносит свой вклад в разнообразие аминокислотных последовательностей и механизмов действия анти-CRISPR.
Белки анти-CRISPR служат важными факторами эволюции микроорганизмов. Так, встраивание мобильных генетических элементов с генами таких белков в геном бактерии приводит к постоянной инактивации систем CRISPR/Cas из-за стабильной экспрессии анти-CRISPR. Находящаяся в таком состоянии клетка не может сопротивляться проникновению других мобильных генетических элементов и, следовательно, горизонтальному переносу генов. При долговременной инактивации CRISPR/Cas бактерия может совсем потерять гены cas или накопить мутации, делающие их нефункциональными. Биоинформатический анализ систем CRISPR/Cas различных бактерий показал, что около 12% из них нефункциональны из-за утраты генов cas или вредных мутаций в них. Экспериментально продемонстрировали, что в условиях, когда приобретение чужеродной ДНК выгодно, бактерии могут вообще целиком терять систему CRISPR/Cas [4].
Биотехнологическое значение белков анти-CRISPR
На данный момент известны белки анти-CRISPR, подавляющие работу Cas9 бактерии Streptococcus pyogenes (именно этот фермент чаще всего используют для редактирования геномов с помощью систем CRISPR/Cas). Более того, два из них делают это в клетках человека, блокируя редактирование генома. Поэтому с помощью белков анти-CRISPR можно регулировать редактирование генома посредством CRISPR/Cas, например, оставляя систему активной только в некоторых тканях и органах, только на определенных этапах эмбрионального развития или только в определенные моменты клеточного цикла. Кроме того, применение анти-CRISPR поможет уменьшить частоту внеплановых мутаций, вносимых Cas9. Обычно Cas9 активен до тех пор, пока клетка не разрушит или фермент, или направляющую РНК, и слишком длительный период активности Cas9 часто приводит к мутациям вне гена-мишени [3].
Многие бактериальные патогены человека имеют активные системы CRISPR/Cas, и применение белков анти-CRISPR может значительно повысить эффективность фаговой терапии [3].
Таким образом, в будущем белки анти-CRISPR могут найти широкое применение в биотехнологии, генной инженерии и медицине.
Литература
- Просто о сложном: CRISPR/Cas;
- CRISPR-эпопея и ее герои;
- Karen L. Maxwell. (2017). The Anti-CRISPR Story: A Battle for Survival. Molecular Cell. 68, 8-14;
- April Pawluk, Alan R. Davidson, Karen L. Maxwell. (2017). Anti-CRISPR: discovery, mechanism and function. Nat Rev Micro;
- Chuan Dong, Ge-Fei Hao, Hong-Li Hua, Shuo Liu, Abraham Alemayehu Labena, et. al.. (2017). Anti-CRISPRdb: a comprehensive online resource for anti-CRISPR proteins. Nucleic Acids Research.





