
Археи-бунтари, или как заставить стоп-кодон кодировать пирролизин
06 февраля 2026
Археи-бунтари, или как заставить стоп-кодон кодировать пирролизин
- 166
- 0
- 5
Три стоп-кодона в стандартном генетическом коде: TAG, TAA и TGA.
Рисунок в полном размере.
-
Автор
-
Редакторы
Авторы недавней работы, опубликованной в Science, обнаружили, что некоторые археи используют уникальный генетический код: стоп-кодон TAG у них начал кодировать необычную аминокислоту пирролизин. О том, насколько распространена новая версия генетического кода и зачем археям специальный кодон для пирролизина, читайте в этой статье.
Генетический код, то есть совокупность правил сопоставления триплетов нуклеотидов и аминокислот, универсален, хотя для него известно и немало исключений [1].
Подробнее об эволюции генетического кода читайте в статьях «Биомолекулы»: «Эволюция генетического кода» [2], «У истоков генетического кода: родственные души» [3].
Считается, что самыми «законопослушными» живыми организмами, строго следующими правилам универсального генетического кода, являются археи. Однако оказалось, что это не совсем так: у некоторых архей есть гены, в которых стоп-кодон TAG, на котором в стандартном варианте завершается трансляция, кодирует протеиногенную (то есть входящую в состав белков) аминокислоту пирролизин [4]. Как же устроен альтернативный генетический код архей? Давайте разбираться.
Пирролизин — это нестандартная протеиногенная аминокислота, которая химически представляет собой производное лизина с пирролиновым кольцом (рис. 1).
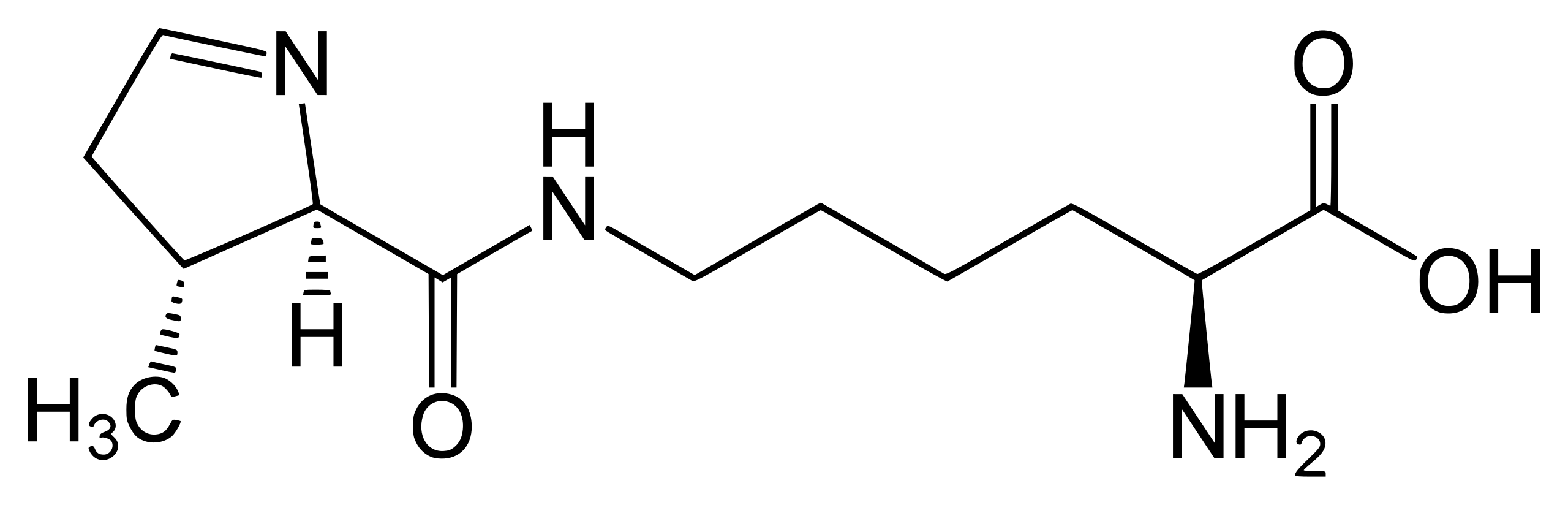
Рисунок 1. Структурная формула пирролизина.
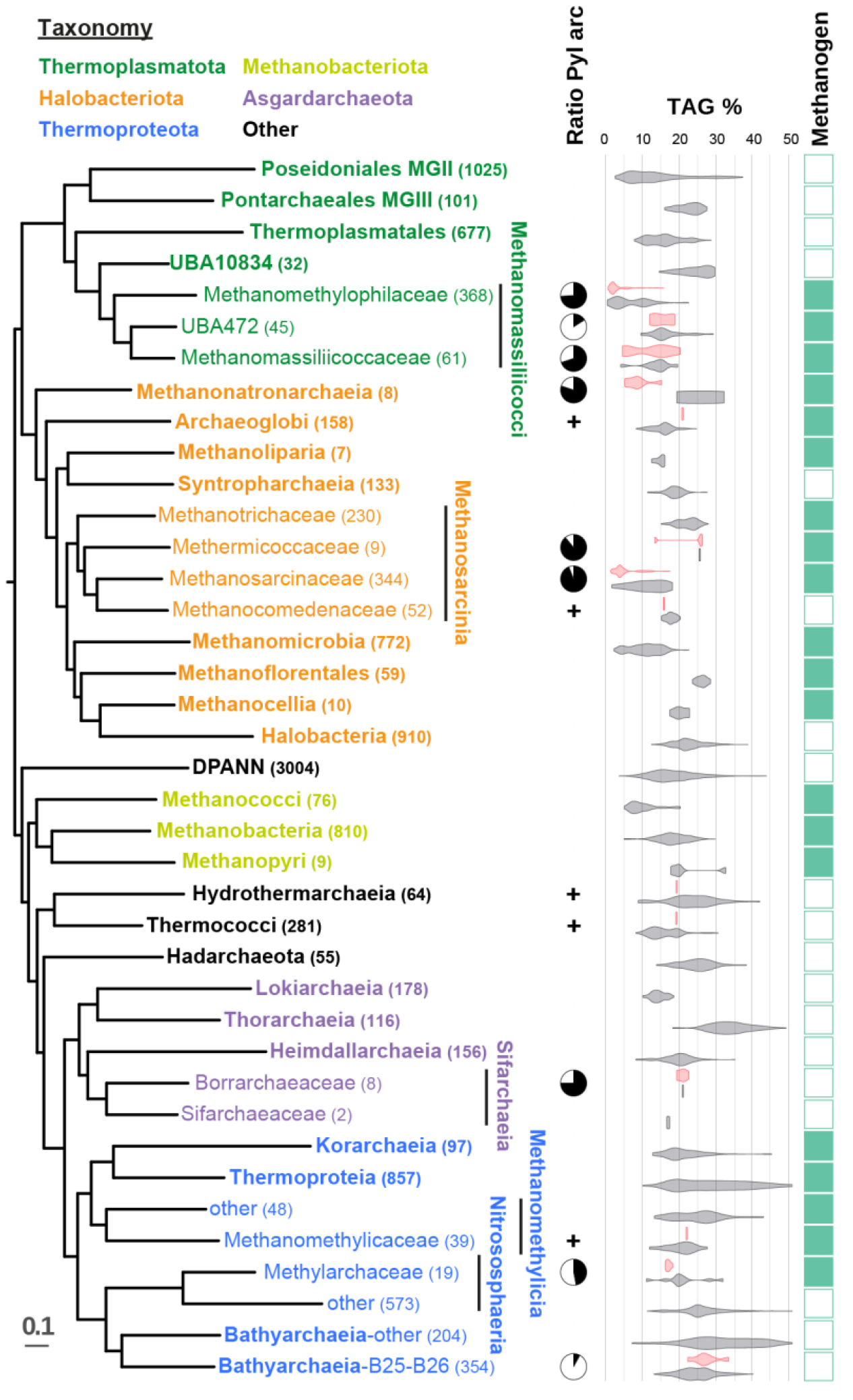
Рисунок 2. Распространение пирролизиновой машинерии среди архей. В скобках указано количество представителей группы, попавших в анализ.
Предыдущие исследования показали, что пирролизин кодируется стоп-кодоном TAG и встречается в белках архей из 11 типов. Считается, что у всех архей, лишенных пирролизина, TAG служит стоп-кодоном, а у архей, у которых есть пирролизин-содержащие белки, TAG тоже выступает стоп-кодоном за исключением генов, кодирующих пирролизин. Есть у них и «пирролизиновая машинерия» — пирролизил-тРНК-синтетаза (PylRS) и пирролизиновая тРНК (тРНКPyl). Но действительно ли пирролизин-содержащие археи используют альтернативный генетический код? Обо всем по порядку.
Для того, чтобы исследовать филогенетическое распространение пирролизина, авторы воспользовались геномными данными по всем семействам, в которых встречается пирролизин, а также по пирролизиновой машинерии. Оказалось, что распределение пирролизиновой машинерии прерывисто даже на уровне родов, и ее распределение оказалось парафилетическим, то есть она встречалась только у части потомков одного общего предка. Ученые не исключают, что между некоторыми группами архей имел место горизонтальный перенос пирролизиновой машинерии (рис. 2).
Итак, мы выяснили, что пирролизин встречается в белках многих групп архей. Но что с кодирующим его кодоном TAG (который, напоминаем, в стандартном генетическом коде является стоп-кодоном)? Если представить себе ситуацию, в которой TAG может быть и стоп-кодоном, и кодирующим пирролизин, то в клетке может начаться настоящий хаос: когда стоп-кодон TAG действительно стоп-кодон, а когда он кодирует аминокислоту? На данный момент нет свидетельств тому, как клетка археи может различать эти две ситуации. Ранее было показано, что у архей, которые кодируют пирролизин, очень редко встречается кодон TAG [5]. Однако авторы обсуждаемой работы показали, что это не так: в геномах архей с пирролизиновой машинерией доля кодонов TAG неизменно высока и достигает более чем 15%. Значит, археи борются с двусмысленной ситуацией не за счет снижения частоты неоднозначного кодона... Ученые предположили, что все дело в локализации пирролизиновых кодонов и функциях соответствующих белков.
Как вообще археи используют TAG? Чтобы ответить на этот вопрос, ученые провели масштабный биоинформатический анализ геномов бактерий и архей и предсказали в них гены, а затем выделили случаи, когда TAG выступал в роли смыслового кодона, то есть кодировал пирролизин. Выявленные гены разбили на четыре категории в зависимости от того, в какой области белка находятся кодоны TAG. Всего же было предсказано 1903 пирролизин-содержащих белков, причем больше всего таких белков оказалось у некультивируемой археи JDFR-19. Что касается белков, в состав которых входит пирролизин, то в составе всех геномов с «пирролизиновым» генетическим кодом закодированы одна или несколько метиламинметилтрансфераз. Эти ферменты — единственное, что сближает всех без исключения архей с «пирролизиновым кодом». В других белках пирролизин встречается редко, и авторы исследования предположили, что необходимость в метаболизме метиламина сама по себе могла стать драйвером эволюции «пирролизинового кода».
Чтобы определить, как вообще «пирролизиновый код» влияет на протеом археи, авторы работы взяли два изолята из разных местообитаний и разного таксономического положения, которых сближает функционирование TAG как смыслового кодона. Этими изолятами стали Methanococcoides burtonii, психрофильная (то есть экстремофильная и любящая низкие температуры) галобактерия из Антарктического озера, и Methanomethylophilus alvi, которая обитает в кишечнике человека. Протеомные данные по обеим археям подтвердили, что они используют TAG как смысловой кодон. Примечательно, что пирролизин удалось выявить в 54 белках, в которых раньше его не находили.
Протеомный анализ этих архей позволил существенно расширить список белков, в состав которых входит пирролизин. Так, у M. burtonii к их числу отнесли ДНК-хеликазу, гистидин-тРНК-синтетазу, изоцитратдегидрогеназу и многие другие белки. Более того, авторы исследования смогли найти пирролизин-содержащие белки в системах CRISPR-Cas, а также РНК-направляемых нуклеазах, которые в предыдущих работах не были должным образом аннотированы. Подводя итог протеомному анализу, ученые заключают, что археи M. burtonii и M. alvi используют нестандартный генетический код, где 62 кодона кодируют 21 аминокислоту, и только два кодона являются стоп-кодонами.
А что будет, если PylRS и тРНКPyl внедрить в кишечную палочку? Приобретет ли она расширенный «пирролизиновый» код? Чтобы разрешить эту загадку, ученые, помимо вставки генов, кодирующих PylRS и тРНКPyl, воспользовались двумя аналогами пирролизина — α-аминокислотой Boc-лизином и α-гидроксикислотой HO-Boc-лизином (рис. 3). Авторы работы исследовали, вставятся ли они в модельный белок, производное GFP — sfGFP, в котором в рамке считывания находится кодон TAG. Как оказалось, в обоих случаях происходила вставка пирролизина в белок.
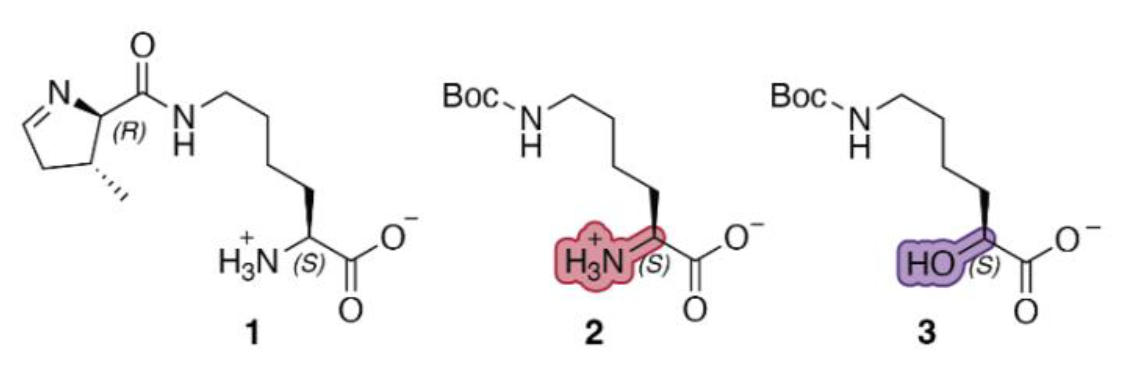
Рисунок 3. Структурная формула субстратов PylRS: пирролизина, Boc-лизина и Boc-лизина-OH.
Полученные результаты позволили авторам исследования выделить основные этапы эволюции «пирролизинового кода», который подразделили на коды A, B и C. В случае кодов группы А пирролизин входит в состав только метиламинметилтрансфераз, причем кодон TAG встречается столь же часто, что и у архей с обычным кодом. Промежуточная стадия эволюции пирролизинового кода, стадия B, включала постепенное сокращение кодонов TAG, а обладающие ею археи живут в местах, богатых метиламином, и являются метаногенами или облигатными метилотрофами. Наконец, на стадии C кодон TAG стал уже полностью смысловым. Обладатели такого кода тоже любят, когда в среде много метиламина, и являются метаногенами.
По оценкам авторов работы, «пирролизиновый» код мог возникнуть по меньшей мере пять раз, вероятно, по описанному выше сценарию, причем его возникновение тесно связано с метаболизмом метиламина. По этой причине «пирролизиновый» код отсутствует у бактерий: они не являются ни метаногенами, ни метилотрофами, то есть их метаболизм не связан с метиламином. Похоже, археи никогда не перестанут нас удивлять.
Литература
- Самые нестандартные генетические коды;
- Эволюция генетического кода;
- У истоков генетического кода: родственные души;
- Veronika Kivenson, Samantha L. Peters, Guillaume Borrel, Aleksandr Kivenson, Leah T. Roe, et. al.. (2025). An archaeal genetic code with all TAG codons as pyrrolysine. Science. 390;
- Yan Zhang, Pavel V. Baranov, John F. Atkins, Vadim N. Gladyshev. (2005). Pyrrolysine and Selenocysteine Use Dissimilar Decoding Strategies. Journal of Biological Chemistry. 280, 20740-20751.





