
Биологическая машина репарации ДНК
01 февраля 2021
Биологическая машина репарации ДНК
- 1876
- 4
- 5
Команда ферментов репарации позволяет сохранить структуру ДНК
-
Автор
-
Редакторы
Комикс на конкурс «Био/Мол/Текст»: В наш век биоинформатики, компьютерных технологий и инноваций словом «мутация» никого не удивишь. Но мало кто осознает, что человек может сам являться причиной собственных генетических заболеваний. Между тем, биологическая машина репарации ДНК человеческого организма трудится ежеминутно и неустанно, чтобы не допустить непоправимых мутаций жизненно важных участков генома человека.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Представленная работа посвящена репарации — одной из самых важных функций биологической клетки, позволяющей ликвидировать фантастическим образом практически любые повреждения молекулы ДНК. Нарушение механизмов репарации ДНК может привести к увеличению риска онкологических заболеваний, возникающих в организме, нестабильности генома и преждевременному старению. Именно к тем проблемам, с которыми борется человечество.
Несмотря на устойчивость, ДНК представляет собой сложную молекулу и подвержена самопроизвольным изменениям до 1000 раз в день даже при нормальных условиях, не говоря уже о воздействии высокой температуры, излучениях различной природы, нарушениях обмена веществ [1]. Такие самопроизвольные изменения в животной клетке носят кратковременный характер, поскольку практически мгновенно исправляются механизмом, поддерживающим генетическую стабильность и включающим набор процессов, в совокупности названных репарацией [2], [3]. Благодаря эффективности службы репарации лишь малая доля изменений в ДНК приводит к постоянным мутациям. Показателем важности репарации является большой процент кодирующего объема ДНК, который отведен на функции репарации, у бактерий и дрожжей [2]. Также исследователи недавно установили, что феноменально длительная продолжительность жизни грызуна под названием «голый землекоп», возможно, связана с высокой активностью системы репарации ДНК зверька [4], .
О том, как голые землекопы борются с развитием у себя опухолей, читайте в статье «Голый землекоп и рак: кто кого» [14]. — Ред.
Разные типы повреждений ДНК происходят по разным причинам. Азотистые основания ДНК часто повреждаются в результате реакции дезаминирования (отщепления аминогруппы от азотистого основания в ДНК с образованием нового вещества) при столкновении с реакционными продуктами обмена веществ в клетке, такими как активные формы кислорода, или под воздействием химических соединений из окружающей среды — дезаминирующих агентов, например азотистой кислоты [3]. Также часто в процессе реакции депуринизации происходит потеря пуриновых оснований (аденина и гуанина) по причине гидролиза N-гликозидной связи между основанием и пентозой. С пиримидиновыми основаниями (цитозином и тимином) данная реакция гидролиза происходит реже. В результате данной реакции образуется брешь — AP-сайт (пентозо-фосфатные группы без оснований [2]).
Подробнее о структуре ДНК можно узнать, прочитав комикс «Структура ДНК» [15]. — Ред.
Другие реакции повреждения обусловловлены УФ-излучением Солнца, высокоэнергетическим ионизирующим излучением, и вызывают образование циклобутановых пиримидиновых димеров (образование ковалентной связи между двумя смежными пиримидиновыми основаниями) и другие химические изменения в клетках нашей кожи: раскрытие цикла и фрагментацию азотистого основания, образование поперечных связей между основаниями двух параллельных нитей и между ДНК и белковыми молекулами, например гистонами [3].
Алкилирующие агенты также способны изменять определенные основания ДНК, например, метилировать их [5–7]. Но всё же самым главным источником мутаций служит окислительное повреждение ДНК. Активные формы кислорода повреждают ДНК, вступая в различные реакции — от окисления дезоксирибозы и оснований до одиночных и двухнитевых разрывов цепи ДНК.
Как и разновидностей спонтанных повреждений ДНК, так и механизмов репарации структуры ДНК существует несколько типов. В зависимости от разновидности спонтанного изменения в молекуле ДНК активируется нужный механизм репарации.- Реактивация, или прямая репарация преимущественно служит для устранения пиримидиновых димеров, некоторых типов однонитевых разрывов ДНК, образования AP-сайтов [1].
- Репарации, связанные с рекомбинацией (гомологичная и негомологичная) участков цепей ДНК, ликвидирует двухнитевые разрывы ДНК, межцепочечные сшивки [1], [6].
- Репарация неканонических пар оснований (англ. mismatch repair), ликвидирующая неправильно спаренные основания ДНК [8]. Этот тип репарации предотвращает возникновение мутаций, связанных с ошибками репликации и устраняет некоторые типы повреждений.
- Эксцизионная репарация оснований и эксцизионная репарация нуклеотидов подразумевают восстановление структуры молекулы ДНК посредством вырезания поврежденных участков из цепи ДНК, таких как изменения азотистых оснований, димеры, AP-сайты, одноцепочечные разрывы [1–3].
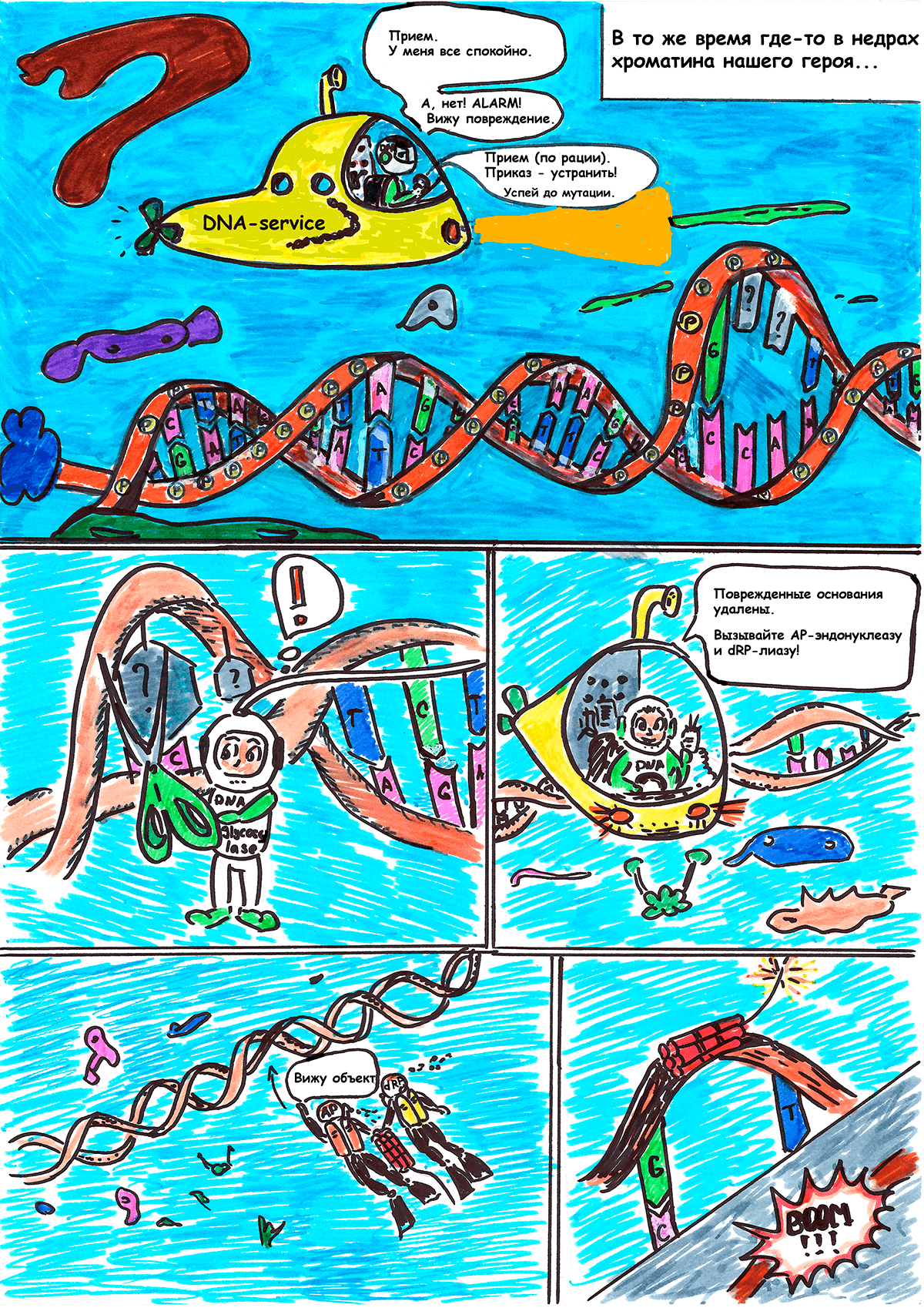
В ниже представленном комиксе описывается эксцизионная репарация модифицированных азотистых оснований ДНК. Согласно механизму этого типа репарации, вначале поврежденное основание распознается специфичным ферментом ДНК-гликозилазой, которая гидролизирует N-гликозидную связь между поврежденным основанием и сахарофосфатным остовом с образованием АР-сайта и свободного основания [1–3]. Далее участок сахарофосфата, лишенный основания, вырезается под действием ферментов AP-эндонуклеазы [10] и dRP-лиазы в присутствии лиазной активности (короткозаплаточная эксцизионная репарация; в отсутствии же dRP-лиазной активности происходит длиннозаплаточная эксцизионная репарация [11–13]). Брешь единственного нуклеотида заделывается ДНК-полимеразой и ДНК-лигазой [1–3].
Недавно проведенные исследования по выяснению последствий снижения способности животного организма к репарации ДНК позволили установить связь многих болезней человека именно с этой проблемой [2]. К подобным наследственным заболеваниям, связанным с нарушениями в системе репарации ДНК, относятся:
- пигментная ксеродерма (ХР): типы A–G — рак кожи, повышенная чувствительность к УФ-лучам, неврологические расстройства; XP-вариант — повышенная чувствительность к УФ-лучам, рак кожи;
- синдром Вернера — преждевременное старение, склонность к злокачественным новообразованиям, нестабильность генома и прочие заболевания;
- Синдром Блума — склонность к злокачественным новообразованиям, задержка роста, нестабильность генома.
К сожалению, выше приведенный список заболеваний не окончателен и растет ежегодно по мере открытий в области генетики, связанных с накоплением мутаций в геноме человека. По этой причине герои ниже представленного комикса спешат напомнить читателю о важности здорового образа жизни и рассказать, к чему приводят повреждения ДНК, какие запускаются процессы и какие ферменты являются в них участниками. Приятного прочтения!
Весь комикс целиком доступен в формате pdf.


Литература
- Friedberg E.C., Walker G.C., Siede W., Wood R.D., Schultz R.A., Ellenberger T. DNA Repair and Mutagenesis. Washington, D.C.: ASM Press, 2006. — 1118 p.;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки: в 3-х томах (т. I). Москва—Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — 808 с.;
- Основы биохимии Ленинджера / под ред. Д. Нельсона, М. Кокса. М.: «Бином. Лаборатория знаний», 2014. — 640 с.;
- Alexei Evdokimov, Mikhail Kutuzov, Irina Petruseva, Natalia Lukjanchikova, Elena Kashina, et. al.. (2018). Naked mole rat cells display more efficient excision repair than mouse cells. Aging. 10, 1454-1473;
- M. Olsson, T. Lindahl. (1980). Repair of alkylated DNA in Escherichia coli. Methyl group transfer from O6-methylguanine to a protein cysteine residue.. Journal of Biological Chemistry. 255, 10569-10571;
- Anthony E. Pegg, Timothy L. Byers. (1992). Repair of DNA containing O 6 ‐alkylguanine. FASEB j.. 6, 2302-2310;
- Anthony E. Pegg, M. Eileen Dolan, Robert C. Moschel. (1995). Structure, Function, and Inhibition of O6-Alkylguanine-DNA Alkyltransferase. Progress in Nucleic Acid Research and Molecular Biology. 167-223;
- Paul Modrich. (1991). Mechanisms and Biological Effects of Mismatch Repair. Annu. Rev. Genet.. 25, 229-253;
- Jan H.J. Hoeijmakers. (1993). Nucleotide excision repair I: from E. coli to yeast. Trends in Genetics. 9, 173-177;
- B Demple, L Harrison. (1994). Repair of Oxidative Damage to DNA: Enzymology and Biology. Annu. Rev. Biochem.. 63, 915-948;
- Samuel E. Bennett, Jung-Suk Sung, Dale W. Mosbaugh. (2001). Fidelity of Uracil-initiated Base Excision DNA Repair in DNA Polymerase β-Proficient and -Deficient Mouse Embryonic Fibroblast Cell Extracts. Journal of Biological Chemistry. 276, 42588-42600;
- Francoise Dantzer, Magnar Bjørås, Luisa Luna, Arne Klungland, Erling Seeberg. (2003). Comparative analysis of 8-oxoG:C, 8-oxoG:A, A:C and C:C DNA repair in extracts from wild type or 8-oxoG DNA glycosylase deficient mammalian and bacterial cells. DNA Repair. 2, 707-718;
- P FORTINI, E DOGLIOTTI. (2007). Base damage and single-strand break repair: Mechanisms and functional significance of short- and long-patch repair subpathways. DNA Repair. 6, 398-409;
- Голый землекоп и рак: кто кого?;
- Структура ДНК.







