
Голый землекоп и рак: кто кого?
18 июля 2016
Голый землекоп и рак: кто кого?
- 3333
- 0
- 10
Землекопы не сдаются. Ну да, ничто человеческое иному землекопу не чуждо — даже рак. Но нокаутировать землекопа не так-то просто — даже раку. Голый снаружи, внутри он скрывает слоистую противораковую броню.
рисунок Ольги Пташник
-
Автор
-
Редакторы
-
Иллюстратор
Первая половина 2016 года принесла две интересных новости о голых землекопах — как водится, плохую и хорошую. Выяснилось, что злокачественные новообразования изредка, но всё же поражают этих грызунов-долгожителей. Что, однако, не опровергает факта их феноменальной устойчивости к раку. В объяснении механизмов этой устойчивости как раз и преуспели ученые. Оказалось, что индуцированные плюрипотентные стволовые клетки землекопов, в отличие от мышиных и человеческих, не провоцируют рост опухолей. И всего из-за двух генетических особенностей. Манипуляции с парой «враждующих» генов — подавляющим и, наоборот, стимулирующим онкогенез — подвели биологов к открытию специфичного для землекопов механизма клеточного старения и к возможности преодоления главной проблемы клеточной терапии человека.
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».

В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
Небольшой африканский эусоциальный зверек со смешным названием голый землекоп (англ. naked mole-rat, лат. Heterocephalus glaber) прославился благодаря беспрецедентной для грызунов продолжительности жизни, невосприимчивости к раку и ряду уникальных физиологических и биохимических особенностей. О возможных причинах жизнестойкости этих подземных зверьков и их почти таких же удачливых родственников «биомолекула» подробно рассказывала [1]. До 2016 года не наблюдали ни одного случая развития злокачественных новообразований у землекопов. Но время и дотошность биологов сделали свое дело.
Онкопатология у голого землекопа: первые истории болезни
В февральском номере Veterinary Pathology появилось сообщение о двух подтвержденных случаях рака у землекопов из американских зоопарков — Брукфилдского (штат Иллинойс) и Национального (Смитсоновского) (г. Вашингтон) [2]. Опухоли разной природы обнаружили у пожилых (старше 20 лет) самцов-рабочих.
В первом случае бессимптомное подвижное 1,5-сантиметровое новообразование извлекли из подмышечной впадины. На основе цитологических, гистохимических, иммуногистохимических и ультраструктурных характеристик опухоль классифицировали как недифференцированную аденокарциному неясного происхождения — из эпителиальных клеток то ли молочных, то ли слюнных желез, хотя вариант метастаза иной опухоли тоже не исключили. Количество митозов в образцах в основном не превышало 0–1 в поле зрения (при 400-кратном увеличении) и лишь местами достигало 4. Локальную инвазию оценить не удалось, поскольку зона трансформации доходила до границ извлеченной ткани. Однако через три месяца после операции в подмышечной впадине зверька наблюдалось лишь нормальное рубцевание — никаких признаков рецидива. Оценить влияние опухоли на самочувствие и продолжительность жизни землекопа не довелось: что до, что после операции его здоровье и социальная адаптация не страдали.
А вот второй случай вряд ли можно назвать бессимптомным, хотя рак выявили уже посмертно: зверька пришлось усыпить из-за неизлечимого тяжелого дерматита и прогрессирующей потери веса. Не исключено, что обнаруженная при вскрытии желудка нейроэндокринная карцинома (устаревшее название — карциноид) могла спровоцировать подобную симптоматику. Происходит такая опухоль из энтерохромаффиноподобных_клеток, секретирующих гистамин. У усыпленного землекопа раковые клетки проникли в слизистую и подслизистую оболочки стенки желудка, местами — в мышечный слой и даже в прилегающие тонкостенные сосуды (видимо, лимфатические), однако отличались низкой митотической активностью и метастазов не сформировали.
Ранее в той же колонии землекопов Брукфилдского зоопарка уже четыре раза фиксировали гиперпластические изменения. Все находки были случайными: разрастания тканей обнаруживали при вскрытии усыпленных по иным причинам особей (эти зверьки, например, могут серьезно травмироваться в семейных стычках). В отличие от тех, судя по всему, доброкачественных образований, два новых случая неоплазии не оставили сомнений в том, что у голых землекопов может развиваться рак. Другой вопрос, что происходит это феноменально редко. И было бы странным, если бы многолетние и целенаправленные наблюдения никогда не выявили бы рака у этого вида — это же не гидры какие-нибудь, а самые настоящие млекопитающие. Нельзя исключить и особую предрасположенность конкретных колоний к неоплазии: ведь в размножении участвуют единичные особи, и вполне вероятно закрепление в популяции каких-то редких мутаций.
Авторы статьи [2] обращают внимание читателей на то, что выявленные случаи никак не опровергают факта выдающейся невосприимчивости голых землекопов к раку. Зато тщательный анализ этих случаев необходим для разработки критериев диагностики доброкачественных и злокачественных опухолей и предраковых состояний у этого вида животных, который всё чаще используют в качестве модельного биогеронтологи и онкологи. И используют, между прочим, успешно.
Полезные «настройки» землекопа: стволовые клетки с сюрпризом
Ранее группа исследователей из США показала, что к противораковой защите землекопов может иметь отношение специфичная для этого вида экстремально высокомолекулярная гиалуроновая кислота, да не просто она, а особенности «гиалуронового» сигналинга, и в частности конечного его этапа — индукции генетического локуса INK4. Этот локус кодирует у ряда животных (и человека тоже) опухолевые супрессоры p15Ink4b, Arf и p16Ink4a, а у голого землекопа еще и уникальный дополнительный продукт — гибрид p15Ink4b и p16Ink4a [1], [3], названный pALTInk4a/b. Синтез последнего индуцируется при разных стрессовых воздействиях и в процессе раннего контактного торможения клеточного деления, потому-то фибробласты землекопа в культуре осторожничают, прекращая деление при малейшем контакте с соседями и предотвращая тем самым опухолеобразование. Не удивительно, что локус INK4 (он же — CDKN2A) очень часто мутирует при раке у людей, а кроме того, участвует в развитии некоторых типов старения [1].
И вот, этот локус вновь привлек внимание биологов, но уже японских. Главным фигурантом нового дела стал другой его продукт, Arf (alternate reading frame protein), вышли на который довольно неожиданным путем — при манипуляциях с индуцированными плюрипотентными стволовыми клетками (ИПСК) землекопа [4].
Как неоднократно рассказывала «биомолекула», производство таких клеток, то есть перепрограммирование соматических клеток в дедифференцированные, напоминающие эмбриональные стволовые клетки, может быть крайне полезным и для терапии множества патологий, и для исследовательских целей [5–7]. Однако такое перепрограммирование требует временной экспрессии «онкогенного коктейля» — генов Oct3/4, Sox2, Klf4 и c-Myc (OSKM), кодирующих транскрипционные факторы. Их активность сближает процесс создания ИПСК с онкогенезом: в клетках синонимично меняется экспрессия генов, эпигенетический профиль и метаболизм. Подобно эмбриональным стволовым клеткам, ИПСК, даже кратковременно экспрессирующие этот «коктейль» in vivo, могут провоцировать формирование опухолей, чаще всего тератом [8]. Причем процесс опухолевой трансформации даже не требует каких-то мутаций, достаточно изменения профиля метилирования ДНК [9]. Риск развития опухолей препятствует введению клеточной терапии в клиническую практику, потому способы снижения этого риска ищут в совершенно разных направлениях: и в модификации состава перепрограммирующих факторов, и в принуждении к гибели неспособных к полной дифференцировке ИПСК, и во внутренних резервах этих клеток [10].
Японские исследователи решили проверить, способны ли к перепрограммированию и образованию опухолей клетки животных, устойчивых к раку. Кожные фибробласты голого землекопа подошли как нельзя лучше. Оказалось, что получить ИПСК из них вполне возможно с помощью ретровирусных векторов, временно экспрессирующих мышиный OSKM-коктейль. Однако, как ни странно, эти ИПСК, в отличие от мышиных и человеческих, после пересадки в яички иммунодефицитных мышей не формировали тератом (рис. 1).
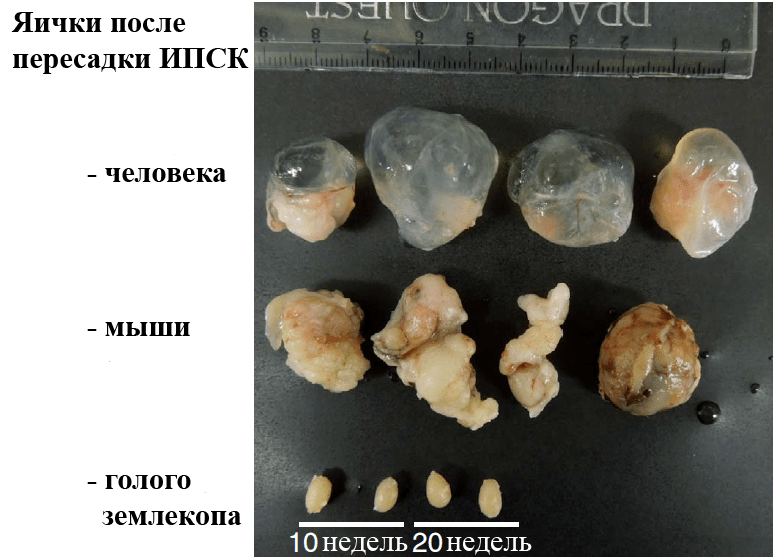
Рисунок 1. Яички иммунодефицитных мышей или их опухоли после трансплантации ИПСК разного происхождения. Сверху вниз: человека (через 10 недель), мыши (через 4 недели) и голого землекопа (через 10 и 20 недель).
Чтобы выяснить, какие факторы отвечают за онкогенность стволовых клеток, а какие препятствуют этому у ИПСК землекопа, ученые проанализировали транскрипционный профиль клеток (используя секвенирование РНК [11] и количественную ПЦР в реальном времени). В итоге выявили две существенных особенности ИПСК землекопа.
- Активный продолжительный синтез одного из продуктов локуса INK4 — Arf (он же — p19Arf у мышей и p14Arf у людей), способствующего предотвращению избыточного клеточного деления: он стабилизирует контролера клеточного цикла p53, блокируя уничтожающий его фермент Mdm2. Как известно, p53 действует через активацию синтеза p21 (этот белок участвует в дифференцировке клеток и способен ингибировать их деление даже без «приказа» p53) — и словно в подтверждение, ИПСК землекопа показали необычную активность его гена. В человеческих же и мышиных клетках синтез продуктов локуса INK4 прекращался уже на ранних стадиях перепрограммирования. Боле того, в другом исследовании было показано, что белки Arf и p16Ink4a у землекопа короче, чем у людей и мышей, и они надежно блокируют клеточный цикл фибробластов в ответ на стрессы [12].
- «Молчание» гена ERas, фактора онкогенности мышиных стволовых клеток, действующего через активацию пути PI3K/AKT и принадлежащего к печально известному Ras-семейству. Как выяснилось, это молчание связано не с какими-то регуляторными моментами, а с банальной мутацией, привнесшей в ген ERas землекопа преждевременный стоп-кодон, а значит, определившей синтез неполноценного «белка-вредителя».
Интересно, что обе особенности имеют прямое отношение к сигнальным путям, выбранным в качестве возможных мишеней для продляющей жизнь терапии [13] .
В статье [13] представлена схема, где описанные сигнальные дорожки встречаются с известным ферментом mTOR, активная работа которого, по современным представлениям, сокращает жизнь.
Но чтобы подтвердить причастность обеих находок к потрясающей онкорезистентности ИПСК землекопа, пришлось заставить замолчать их ген Arf и компенсировать дефектный ERas рабочим, мышиным. Это привело к подавлению синтеза p21 и индукции AKT-пути соответственно [4]. Специальный тест на рост в мягком агаре и пересадка таких модифицированных ИПСК в яички мышей показали, что выключение Arf стимулирует онкогенез сильнее, чем активация ERas, а совместно эти изменения приводят к формированию крупных тератом.
С другой стороны, стабильная экспрессия трансгена Arf в мышиных ИПСК заметно защищала их от опухолевой трансформации, однако в сформировавшихся таки тератомах работа этого гена подавлялась.
Ну а самое интересное произошло, когда исследователи изучали реакцию фибробластов землекопа на выключение Arf в ходе производства ИПСК. У мышей такая манипуляция повышала эффективность перепрограммирования — подобно нокдауну последовательности Ink4a, кодирующей p16. А вот фибробласты землекопа не то что делиться и омолаживаться отказались, а приобрели все признаки сенесцентного статуса. Старение наблюдали и при отключении Arf у стрессированных фибробластов, в которых этот ген дерепрессировался в ответ на активацию онкогена c-Myc либо серийные клеточные пассажи. Дерепрессия Arf и Ink4a — нормальная реакция фибробластов многих млекопитающих на стрессы: перепрограммирование, активацию онкогенов, репликативный стресс. Стрессированные клетки стареют — и это их первая линия защиты от онкогенеза. У землекопа же, судя по всему, сформировалась дополнительная линия, срабатывающая в случае подавления синтеза Arf в стрессированных клетках (рис. 2). Этот феномен исследователи назвали старением, индуцированным супрессией Arf (ARF suppression-induced senescence, ASIS).
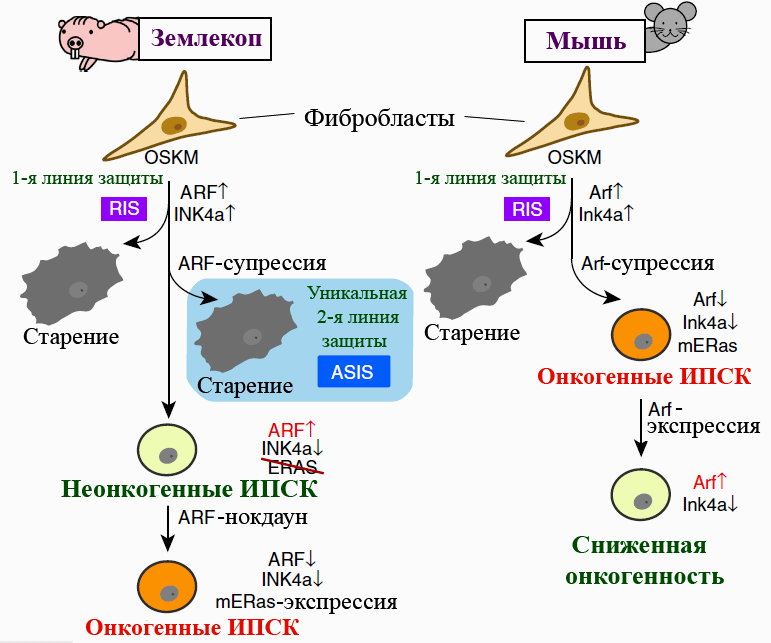
Рисунок 2. Перепрограммирование фибробластов голого землекопа и мыши. Особенности работы гена Arf и мутация гена ERas (обозначена перечеркиванием) «отключают» онкогенный потенциал ИПСК землекопа. Гены землекопа обозначены прописными буквами. OSKM — «генетический коктейль» для перепрограммирования (Oct4, Sox2, Klf4, c-Myc). Под старением подразумевается сенесценция клеток. mERas — мышиный, то есть полноценный, вариант гена. RIS — старение, индуцированное перепрограммированием. ASIS — старение, индуцированное супрессией Arf.
[4], рисунок адаптирован
Японским биологам удалось слегка проникнуть в таинство работы этого уникального механизма. Они изучили в фибробластах землекопа деятельность ряда ингибиторов клеточного цикла, обычно регулирующих старение клеток. Ранее было показано, что старение мышиных фибробластов индуцировалось гипофосфорилированием белка Rb (только фосфорилированный Rb позволяет клетке готовиться к делению) и фосфорилированием АКТ. Гипофосфорилирование Rb — ключевого, как и p53, контролера клеточной пролиферации — обычно обусловлено работой таких ингибиторов цикла, как p27, p21 и p16. Однако в фибробластах землекопа при ASIS в гипофосфорилирование Rb эти ингибиторы не были вовлечены. Фосфорилирование же АКТ происходило совместно с активацией пролиферативного ERK-пути.
Таким образом, устойчивость ИПСК голого землекопа к онкогенезу, по мнению авторов работы [4], обусловлена специфической регуляцией гена Arf и повреждением гена ERas. Дальнейшее изучение феномена ASIS поможет до конца понять причины онкорезистентности этого зверька и, вероятно, поспособствует повышению безопасности человеческих ИПСК.
Литература
- Преодолевшие старение. Часть II. Дети подземелья;
- Delaney M.A., Ward J.M., Walsh T.F., Chinnadurai S.K., Kerns K., Kinsel M.J., Treuting P.M. (2016). Initial case reports of cancer in naked mole-rats (Heterocephalus glaber). Vet. Pathol. 53 (3), 691–696;
- Tian X., Azpurua J., Ke Z., Augereau A., Zhang Z.D., Vijg J. et al. (2015). INK4 locus of the tumor-resistant rodent, the naked mole rat, expresses a functional p15/p16 hybrid isoform. PNAS. 112 (4), 1053–1058;
- Miyawaki S., Kawamura Y., Oiwa Y., Shimizu A., Hachiya T., Bono H. et al. (2016). Tumour resistance in induced pluripotent stem cells derived from naked mole-rats. Nat. Commun. 7, 11471;
- Была клетка простая, стала стволовая;
- Снежный ком проблем с плюрипотентностью;
- Предохранитель ИПСК;
- Ben-David U., Benvenisty N. (2011). The tumorigenicity of human embryonic and induced pluripotent stem cells. Nat. Rev. Cancer. 11 (4), 268–277;
- Ohnishi K., Semi K., Yamamoto T., Shimizu M., Tanaka A., Mitsunaga K. et al. (2014). Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation. Cell. 156 (4), 663–677;
- Dannenmann B., Lehle S., Essmann F., Schulze-Osthoff K. (2015). Genome surveillance in pluripotent stem cells: Low apoptosis threshold and efficient antioxidant defense. Mol. Cell Oncol. 3 (2), e1052183;
- Малая РНК большого значения;
- Miyawaki S., Kawamura Y., Hachiya T., Shimizu A., Miura K. (2015). Molecular cloning and characterization of the INK4a and ARF genes in naked mole-rat. Inflamm. Regen. 35, 42–50;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить.







