Болезнь Паркинсона: что изучать? как изучать?
26 октября 2017
Болезнь Паркинсона: что изучать? как изучать?
- 3312
- 0
- 11
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Болезнь Паркинсона — второе по распространенности в мире нейродегенеративное заболевание. Протекание патологии ассоциировано с нарушениями аутофагии — способности клетки удалять поврежденные органеллы и белки. Статья расскажет читателю о связи аутофагии и митофагии с патогенезом паркинсонизма и о том, как применение индуцированных плюрипотентных стволовых клеток (ИПСК) помогает ученым исследовать клеточные аспекты заболевания.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Болезнь Паркинсона (БП) — это медленно прогрессирующее нейродегенеративное заболевание, характеризующееся потерей дофаминергических нейронов в черной субстанции. Характерными симптомами являются тремор и брадикинезия (замедление активных движений, сопровождаемое мышечной ригидностью) (рис.1) [1].
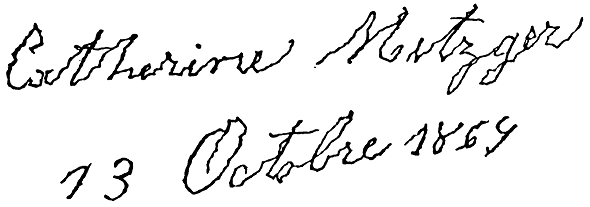
Рисунок 1. Микрография — аномально малый почерк, характерный для пациентов с болезнью Паркинсона. На иллюстрации — пример почерка одной из пациенток психиатра 19 века Жана Мертена Шарко.
Клетки нашего организма содержат специальные компоненты — органеллы, которые необходимы для реализации множества процессов: например, шероховатый эндоплазматический ретикулум важен для синтеза белков, с помощью аппарата Гольджи белки могут сортироваться и транспортироваться к нужным клеточным регионам, а митохондрии являются энергетическими станциями наших клеток. Поскольку обнаружили, что митохондрии могут повреждаться при патогенезе паркинсонизма, рассмотрим подробнее эти органеллы.
Митохондрии вносят огромный вклад в энергетические ресурсы нашего организма за счет синтеза АТФ. Этому процессу предшествует восстановление кислорода до воды путем поэтапного переноса электронов между сложными молекулярными комплексами, встроенными во внутреннюю мембрану митохондрий. Можно сравнить электрон с футбольным мячом, который в результате 4 пасов должен попасть в ворота — кислород. При этом есть вероятность образования радикалов — активных форм кислорода с неспаренными электронами (например, это может произойти, если один из нормальных интермедиатов этого процесса — радикал убихинона — из-за медленного протекания процесса переноса электронов просуществует в мембране митохондрий достаточно долго для того, чтобы прореагировать с молекулярным кислородом) [2], [3].
На «Биомолекуле» есть интересная статья о том, почему активные формы кислорода могут оказаться важными для нашего организма: «Активный кислород: друг или враг, или о пользе и вреде антиоксидантов» [4].
Радикалы — это мутагенные вещества, оказывающие на клетку губительное влияние по причине их высокой реакционной способности. Для них характерны цепные реакции, в ходе которых радикал «отбирает» электрон у другой молекулы, тем самым делая радикалом «обворованную» молекулу. Не зря их накопление (а также повреждение митохондрий) выдвигается рядом ученых как одна из причин старения [3], [5]. Поэтому утилизация поврежденных митохондрий необходима для поддержания нормальной жизнедеятельности клетки.
Закономерен вопрос: есть ли у клетки программа самозащиты от поврежденных органелл и неправильно собранных белков?
Внимание исследователей болезни Паркинсона направлено на множество молекулярных аспектов жизни клетки, один из которых — аутофагия (рис. 2). Можно сказать, что клетка — это «умный дом», следящий за собственной чистотой. Такая программа самоочищения — аутофагия — заключается в утилизации внутриклеточных органелл и макромолекул путем слияния аутофагосом (цитоплазматических включений, окруженных двойной мембраной, в которых расположены субстраты аутофагии) с лизосомами [6]. Выделяют несколько вариантов аутофагии — рисунок 2 [7].
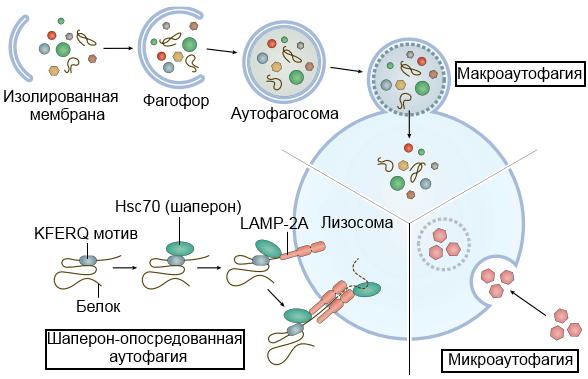
Рисунок 2. Варианты аутофагии: макроаутофагия, микроаутофагия и шаперон-опосредованная аутофагия. При микроаутофагии субстрат попадает в лизосому через ее мембрану. При макроаутофагии субстрат сначала окружается собственной двойной мембраной — образуется аутофагосома, которая в дальнейшем сольется с мембраной лизосомы и высвободит свое содержимое внутрь. При шаперон-опосредованной аутофагии субстрат (белок, в составе которого есть определенная последовательность аминокислот — так называемый KFERQ-мотив) будет доставлен в лизосому при помощи шаперона. Роль шаперона сводится к тому, что он «подведет» белок к поре в мембране лизосомы — LAMP-2A — и пропустит его внутрь.
antibodycenter.co.kr, рисунок адаптирован
Как изучать патологии на клеточном уровне?
Существует множество методов для изучения того, как протекает жизнь клетки. Каждый из подходов обладает своими недостатками и своими преимуществами, как следствие — своей применимостью к изучению той или иной проблемы. Ниже будет рассмотрен один из подходов, который активно используют для изучения патогенеза болезни Паркинсона в настоящее время.
Индуцированные плюрипотентные стволовые клетки (ИПСК) — стволовые клетки, полученные из дифференцированных клеток путем перепрограммирования. Перепрограммирование осуществляют введением в клетку определенного набора транскрипционных факторов (то есть белков, контролирующих транскрипцию — синтез РНК на матрице ДНК — с конкретных генов) и поддержанием клеток в специфической среде [8], [9].
ИПСК позволяют моделировать процессы, происходящие внутри клетки в норме и при патологиях (рис. 3). Безусловным преимуществом использования ИПСК является возможность более быстро и дешево получать необходимый тип клеток для исследований: например, благодаря легкости добывания фибробластов (клеток соединительной ткани) этот тип клеток часто используют для перепрограммирования. ИПСК позволяют избежать этических дилемм («правомерно ли использование клеток эмбриона для исследований?») и возлагать надежды на пациент-ориентированную терапию (например, после гибели клеток сердца перепрограммировать другой тип клеток пациента в кардиомиоциты и в дальнейшем пересадить их в орган) [7], [10]. Таким образом, с помощью ИПСК исследователи могут получать нейроны , которые можно использовать для изучения болезни Паркинсона.
Узнать подробнее о том, как сделать нейрон из фибробласта, можно в одноименной статье на «Биомолекуле» — «Как сделать нейрон из фибробласта?» [11].
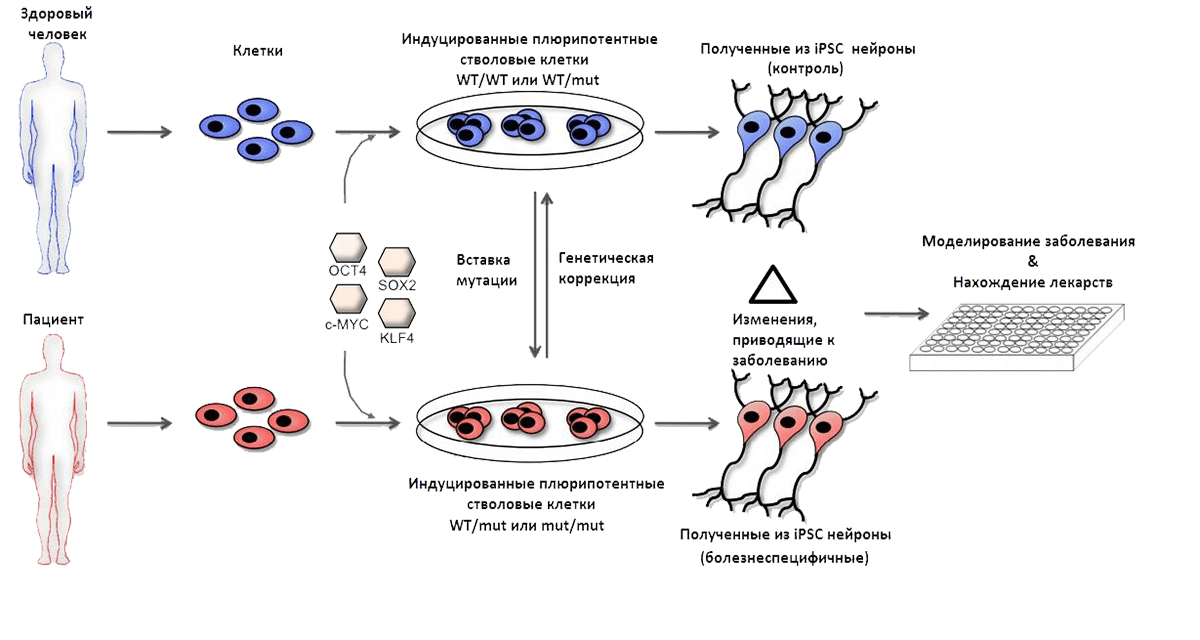
Рисунок 3. Схема получения и использования ИПСК (iPSC) в биомедицине. В клетки (например, фибробласты), полученные как от больного, так и от здорового доноров, встраивают специальные конструкции, благодаря которым клетки начинают производить белки Oct4, Sox2, a-Myc, Klf4. Присутствие этих белков переводит клетку в плюрипотентное состояние. После этого над клетками совершают генетические манипуляции (например, вставляют мутацию или, наоборот, редактируют повреждения в каком-либо гене) и создают условия для того, чтобы клетка дифференцировалась — например, стала нейроном. На полученных нейронах могут изучать действие лекарственных препаратов и протекание заболевания.
Чтобы увидеть рисунок в полном размере, нажмите на него.
[7], рисунок адаптирован
В этой статье опишем несколько примеров того, как технология ИПСК и знания об аутофагии позволили исследователям приблизиться к пониманию процессов, происходящих при болезни Паркинсона.
Кто виноват? Что делать?
Прежде чем составлять сложные гипотезы о протекании патогенеза болезни и приступать к фармакологическим исследованиям, нужно найти «мишени», по которым следует бить. Мишени в данном случае — это какие-либо мутации и нарушения метаболизма клетки, ассоциированные с изучаемой болезнью. Ниже рассмотрим список потенциальных мишеней паркинсонизма, среди которых есть белки, связанные с функционированием митохондрий, — вовлеченность этих органелл в патогенез обсуждалась ранее.
LRRK2 (leucine-rich repeat kinase 2) — мультидоменный фермент, 90% которого представлены в цитоплазме, а оставшиеся 10% — ассоциированы с внешней мембраной митохондрий. Мутации LRRK2 часто обнаруживают у пациентов с паркинсонизмом, при этом наиболее распространенные мутации расположены в доменах, отвечающих за киназную (фосфорилирующую) и ГТФазную (гидролизующую ГТФ) активности. Одна из наиболее часто встречаемых мутаций — G2019S — обсуждается ниже [7].
LC3-II (light chain 3 — II) — белок, расположенный на внутренней и внешней частях мембраны аутофагосом. После того, как мембрана аутофагосомы замыкается сама на себе, образуя внутриклеточный пузырек, чье содержимое подлежит уничтожению, LC3-II удаляется с внешней (то есть смотрящей в цитоплазму) мембраны. При этом «внутренний» LC3-II сохраняется и после слияния аутофагосомы с лизосомой деградирует (рис.4) [7].
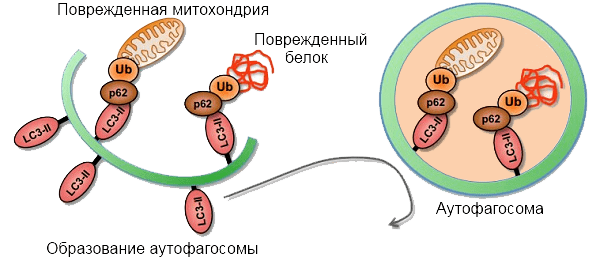
Рисунок 4. После образовании аутофагосомы LC3-II удаляется с внешней стороны ее мембраны.
[7], рисунок адаптирован
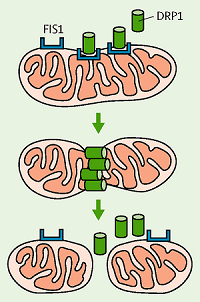
Рисунок 5. Схема фрагментации митохондрий.
В одном из исследований рассматривали ИПСК, полученные от доноров с паркинсонизмом (в одной линии присутствовала мутация G2019S, в другой — нет) и от здоровых доноров. После дифференцировки ИПСК в дофаминергические нейроны выяснилось, что уровень LC3-II повышен в образцах с БП. При этом электронная микроскопия показала, что в «здоровых» нейронах преобладают аутофаголизосомы (то есть аутофагосомы, мембрана которых слилась с лизосомой), в то время как в нейронах с фенотипом БП большинство аутофагосом не слилось с лизосомальной мембраной. Исследователи предполагают, что полученный результат позволяет сделать вывод о нарушении слияния аутофагосомы с лизосомой [12].
Drp1 — находящийся в цитоплазме белок, фосфорилируемый киназным доменом LRRK2. Фосфорилирование активирует Drp1, и протеин, подойдя к митохондриям, взаимодействует с адапторами на внешней мембране органеллы (например, Fis1). В результате митохондрия фрагментируется, высвобождая при этом активные формы кислорода и факторы клеточной смерти (апоптоза) (рис.5) [13], [14].
Фрагментация митохондрий — важный процесс: во-первых, путем деления получаются новые митохондрии; во-вторых, митохондрии способны сливаться, и фрагментирование поврежденной митохондрии предотвращает ее слияние с нормально функционирующей органеллой.
Известно, что при мутации G2019S активность киназной функции LRRK2 повышена и, как и ожидалось, концентрация Drp1 на внешней мембране митохондрий также увеличена. Группа ученых разработала селективный ингибитор Drp1 — P110, препятствующий избыточному делению митохондрий. P110 подавляет фосфорилирование Drp1, не давая ему перейти в активную форму. Возможный механизм этого ингибитора — конформационное изменение Drp1 и, как следствие, недоступность сайта фосфорилирования Drp1 для киназного домена LRRK2.
Для того чтобы проверить действие разработанного ингибитора, исследователи получили ИПСК LRRK2 G2019S из фибробластов пациентов, больных паркинсонизмом, и ИПСК с немутантной LRRK2 из фибробластов здоровых людей. В дальнейшем клеточные линии перепрограммировали в дофаминергические нейроны. В нейронах, несущих мутацию, митохондрии были меньше по размеру и присутствовали в бóльшем количестве, чем в нейронах с нормальным LRRK2, что указывало на повышенную фрагментацию. Последствия применения P110 выражались в увеличении размера митохондрий и сокращении расстояния между ними [15].
Важно акцентировать внимание на том, что на примере этой работы мы можем увидеть, каким образом ИПСК могут использоваться для тестирования потенциальных лекарственных препаратов.
С чего начинается митофагия? С заветного PINK1
Для того чтобы подробнее познакомиться с протеканием митофагии (уничтожения митохондрий путем аутофагии), мы рассмотрим этот процесс в хронологическом порядке. Повреждения митохондрий приводят к деполяризации мембраны этих органелл, и PINK1 — первый обсуждаемый нами белок — принимается за дело.
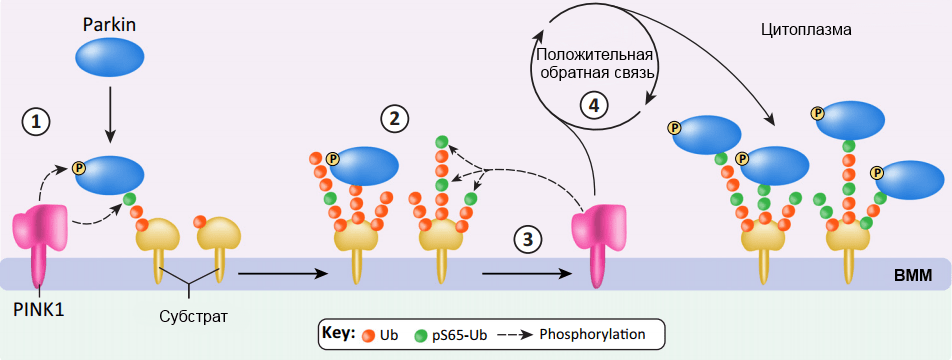
PINK1 — киназный белок, встроенный в мембрану митохондрий и выполняющий роль датчика повреждений этих органелл. Деполяризация митохондриальной мембраны сообщает PINK1 о нарушении работы митохондрий — в ответ на это PINK1 фосфорилирует расположенный неподалеку убиквитин, предварительно «навешанный» на белок внешней мембраны митохондрий (убиквитин — это белок, который, как правило, играет роль универсального «пропуска» на процедуру уничтожения каких-либо клеточных компонентов).
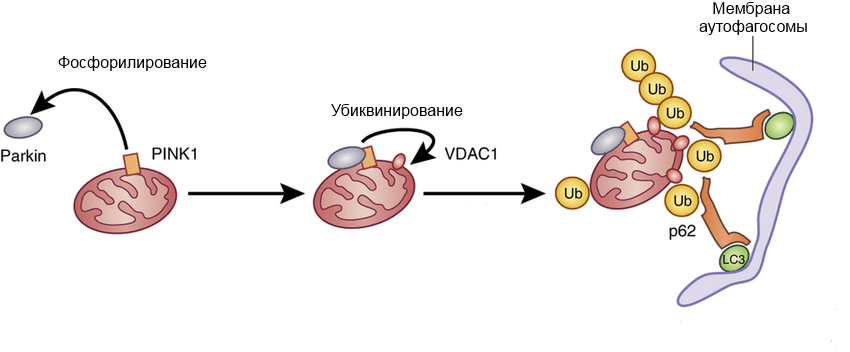
Фосфорилирование запускает каскадный процесс, именуемый «положительной обратной связью». С фосфорилированным убиквитином контактирует белок Parkin (назовем его «новобранец»), у которого в результате контакта изменяется взаимное расположение доменов. Это, во-первых, обеспечивает фосфорилирование «новобранца», и в ответ на это с ним контактирует «следующий новобранец», который в дальнейшем будет фосфорилирован. Во-вторых, фосфорилирование дает зеленый свет убиквитинлигазной функции белка Parkin — это означает, что на другие белки митохондриальной мембраны будет «пришит» убиквитин (рис. 6а). С убиквитированными белками (например, с VDAC1) контактируют рецепторы аутофагии p62, которые, в свою очередь, связываются с LC3-II — компонентом мембраны аутофагосомы, которая «запаковывает» в себя поврежденную митохондрию и в дальнейшем сливается с лизосомой (рис. 6б) [16], [17].
Таким образом, митофагия является сложным многокомпонентным процессом, который начинается с активации PINK1 в ответ на повреждения в митохондрии.
Чтобы лучше представить себе эту цепочку молекулярных превращений, предлагаю такую аналогию.
Представьте, что во время школьной перемены учитель (PINK1), отчаявшийся собрать своих детей (множество белков Parkin), дает одному из них шарик с надписью «2А» (добавление фосфорной группы). К ученику с шариком подбегает его одноклассник, который тоже жутко хочет шарик, и наш учитель достаточно запаслив, чтобы его не обделить! В итоге рядом с педагогом толпится его класс, и какой-нибудь сторонний куратор (p62) теперь может направить ребят в кабинет математики (надеюсь, это достаточно этичная аналогия аутофагосомы).
Мутации как в гене PINK1, так и в гене Parkin ассоциированы с БП. Исследователи получили ИПСК от больных паркинсонизмом (с мутантным вариантом PINK1) и от здоровых доноров. Дифференцировав полученные ИПСК в дофаминергические нейроны, ученые обнаружили нарушения в подходе белка Parkin к митохондриальной мембране в нейронах с фенотипом БП. Затем в клетки с мутантным вариантом PINK1 доставили ретровирус, содержащий ген PINK1 WT (wild type, или дикий тип, — вариант гена, который чаще всего встречается в природе и который мы бы назвали «нормальным»). В результате экспрессии нормального варианта PINK1 проблема привлечения Parkin к поврежденным митохондриям была устранена [18].
Митофагия — сложно организованный процесс, и его роль в развитии болезни Паркинсона, а также его взаимосвязь с другими клеточными патологиями при паркинсонизме требуют дальнейшего изучения.
Помогут ли шапероны?
В рассмотрении нуждается еще один вариант аутофагии — шаперон-опосредованная аутофагия (ШОА). В данный тип аутофагии вовлечены шапероны — специальные белки, которые обычно функционируют как помощники других белков, способствуя их правильной сборке (фолдингу).
При шаперон-опосредованной аутофагии (ШОА) шаперон HSC70 распознает последовательность из пяти аминокислот в белке (KFERQ-мотив) и, при необходимости, доставляет поврежденный белок к LAMP-2A — поре в мембране лизосомы (рис. 2). Одним из субстратов ШОА является упомянутый ранее белок LRRK2. Примечателен факт того, что другие субстраты ШОА (белки, содержащие KFERQ-мотив), которые обычно конкурируют друг с другом за право связаться с LAMP-2A, только усиливают связь LRRK2 с этой лизосомальной порой и обеспечивают скорейшую деградацию LRRK2. Представьте, что вас пропустили вперед себя в очереди к врачу 10 человек, а вы даже не произнесли магические слова «Мне только спросить»! Удивительно, не правда ли? Однако аномальная форма LRRK2 G2019S сильно связывается с LAMP-2A, но не может пройти внутрь лизосомы и поэтому медленно деградирует, «засоряя» мембрану лизосомы, из-за чего на ее поверхности начинают скапливаться другие субстраты для ШОА. Как если бы вы вместо того, чтобы зайти к врачу, начали копаться в сумке в поисках полиса, а люди бы все прибывали, проклиная вашу нерасторопность [19].
Обсудим один из субстратов ШОА, вовлеченный в протекание болезни Паркинсона — белок альфа-синуклеин:
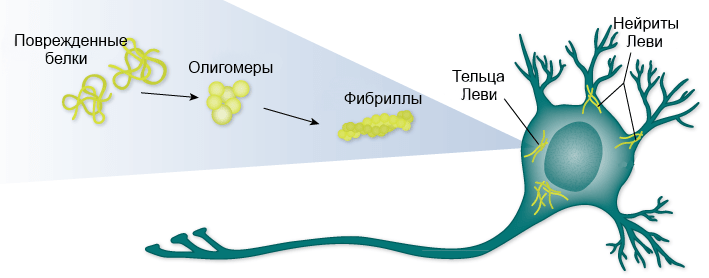
Альфа-синуклеин (α-синуклеин) — белок семейства синуклеинов, присутствующий в нервной ткани и некоторых видах опухолей. Альфа-синуклеин может изменять свою конформацию и агрегировать в фибриллы, которые затем формируют тельца Леви — амилоидоподобные образования, встречающиеся в теле нейрона и в нейритах (рис. 7а и 7б).
В дофаминергических нейронах, дифференцированных из ИПСК LRRK2 G2019S доноров с БП, по сравнению с контрольными ИПСК-производными нейронами, была усилена локализация α-синуклеина с лизосомальной мембраной. Исследователи также проверили, влияет ли мутация G2019S на увеличение телец Леви. Выяснилось, что при немутантном LRRK2 тельца Леви образуются при условии, что в гене альфа-синуклеина есть мутация. Однако, если LRRK2 содержит мутацию G2019S, тельца Леви образуются даже в том случае, если ген α-синуклеина мутации не содержит [19].
Шаперон-опосредованная аутофагия — еще один вариант аутофагии, связанный с развитием болезни Паркинсона. На примере этого варианта мы видим, как изменения в субстратах ШОА (например, мутантная форма LRRK2) могут влиять на развитие заболевания: при этом белки, вовлеченные в аутофагию (шаперон Hsc70 и пора LAMP-2A), никак не повреждены.
Связь с болезнью Гоше?
В последнее время активно изучают связь мутаций гена β-глюкоцереброзидазы (GBA) с заболеванием Паркинсона. Глюкоцереброзидаза — один из лизосомальных ферментов, гидролизующий связь между углеводом глюкозой и жиром церамидом (рис. 8) [20]. Гомозиготная мутация (которая затрагивает оба аллеля) в гене приводит к болезни Гоше (БГ) — у людей с этим заболеванием повышен риск развития паркинсонизма в 20 раз. Для носителей гетерозиготной мутации (которая затрагивает один из двух аллелей) риск заболеть БП повышен в 5 раз.
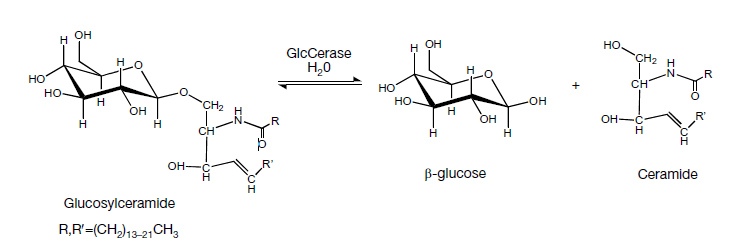
Рисунок 8. У пациентов с болезнью Гоше активность β-глюкоцереброзидазы понижена: по этой причине в клетках накапливается глюкоцереброзид, избыток которого токсичен. Болезни, характеризующиеся накоплением какого-либо вещества из-за нарушений работы лизосом, называют «лизосомальными болезнями накопления».
Глюкоцереброзиды — это вещества липидной природы, встроенные в мембрану. Известно, что α-синуклеин преимущественно расположен в пресинаптической терминали (участке мембраны нейрона перед синапсом — щелевым контактом между двумя нейронами, в полость которого высвобождаются пузырьки с нейромедиаторами). Возможно, что изменение состава мембраны (что происходит при мутации в гене GBA) влияет на нарушения метаболизма α-синуклеина. [21]
Исследователи с помощью технологии ИПСК получили клеточные линии с мутацией в гене GBA с фенотипом паркинсонизма и мутантные линии с фенотипом болезни Гоше, а также линию с генетически скорректированной мутацией от доноров с БП и линию контроля. В нейронах с фенотипами БП и БГ наблюдали повышенное накопление глюкоцереброзидов и α-синуклеина. Также в нейронах, несущих мутацию, наблюдали повышенный уровень одного из маркеров аутофагии — LC3-II (см. выше) [21].
Болезнь Паркинсона может быть взаимосвязана с протеканием других нейродегенеративных заболеваний: этот факт требует дальнейшего изучения тех молекулярных путей, на которых «пересекаются» течения паркинсонизма и другого заболевания.
Подведение итогов
Сегодня накоплено множество сведений о нарушении клеточного метаболизма при патогенезе болезни Паркинсона. Исследователи обращают много внимания на протекание разных вариантов аутофагии, и науке предстоит найти взаимосвязь между этими процессами, а фармакологии — научиться селективно воздействовать на «мишени» паркинсонизма, исправляя неполадки во внутренней жизни клетки.
Одна из передовых технологий для дальнейшего изучения болезни Паркинсона (как, впрочем, и множества других нейроденегеративных заболеваний — например, болезни Альцгеймера и амиотрофического латерального склероза) — это ИПСК. Как, возможно, убедился читатель, ИПСК позволяют исследовать существующие фенотипы паркинсонизма, связанные с аутофагией, проверять гипотезы о том, каким образом определенная мутация влияет на внутриклеточные процессы, а также тестировать препараты, способные минимизировать патологические эффекты.
Литература
- J Jankovic. (2008). Parkinson's disease: clinical features and diagnosis. Journal of Neurology, Neurosurgery & Psychiatry. 79, 368-376;
- Нельсон Д. и Кокс М. Основы биохимии Ленинджера. Том 2: биоэнергетика и метаболизм. М: БИНОМ, Лаборатория знаний, 2014. — 636 с;
- Фомченко Н.Е., Воропаев Е.В., Скачков А.В., Затора Н.Ю. (2015). Биологическая роль митохондрий в старении организма. Проблемы здоровья и экологии. 4, 8–13;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Болезни и изменения клеточного метаболизма;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Johannes Jungverdorben, Andreas Till, Oliver Brüstle. (2017). Induced pluripotent stem cell-based modeling of neurodegenerative diseases: a focus on autophagy. J Mol Med. 95, 705-718;
- Была клетка простая, стала стволовая;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Yoshinori Yoshida, Shinya Yamanaka. (2017). Induced Pluripotent Stem Cells 10 Years Later. Circ Res. 120, 1958-1968;
- Как сделать нейрон из фибробласта?;
- Adriana Sánchez-Danés, Yvonne Richaud-Patin, Iria Carballo-Carbajal, Senda Jiménez-Delgado, Carles Caig, et. al.. (2012). Disease-specific phenotypes in dopamine neurons from human iPS-based models of genetic and sporadic Parkinson's disease. EMBO Mol Med. 4, 380-395;
- Zhenzhen Zhang, Lei Liu, Shengnan Wu, Da Xing. (2016). Drp1, Mff, Fis1, and MiD51 are coordinated to mediate mitochondrial fission during UV irradiation–induced apoptosis. FASEB J. 30, 466-476;
- Henrik Hagberg, Carina Mallard, Catherine I Rousset, Claire Thornton. (2014). Mitochondria: hub of injury responses in the developing brain. The Lancet Neurology. 13, 217-232;
- Yu-Chin Su, Xin Qi. (2013). Inhibition of excessive mitochondrial fission reduced aberrant autophagy and neuronal damage caused by LRRK2 G2019S mutation. Unknown journal title.. 22, 4545-4561;
- Thanh N. Nguyen, Benjamin S. Padman, Michael Lazarou. (2016). Deciphering the Molecular Signals of PINK1/Parkin Mitophagy. Trends in Cell Biology. 26, 733-744;
- Doris Popovic, Domagoj Vucic, Ivan Dikic. (2014). Ubiquitination in disease pathogenesis and treatment. Nat Med. 20, 1242-1253;
- P. Seibler, J. Graziotto, H. Jeong, F. Simunovic, C. Klein, D. Krainc. (2011). Mitochondrial Parkin Recruitment Is Impaired in Neurons Derived from Mutant PINK1 Induced Pluripotent Stem Cells. Journal of Neuroscience. 31, 5970-5976;
- Samantha J Orenstein, Sheng-Han Kuo, Inmaculada Tasset, Esperanza Arias, Hiroshi Koga, et. al.. (2013). Interplay of LRRK2 with chaperone-mediated autophagy. Nat Neurosci. 16, 394-406;
- Hay Dvir, Michal Harel, Andrew A. McCarthy, Lilly Toker, Israel Silman, et. al.. (2003). X-ray structure of human acid-β-glucosidase, the defective enzyme in Gaucher disease. EMBO Rep. 4, 704-709;
- David C. Schöndorf, Massimo Aureli, Fiona E. McAllister, Christopher J. Hindley, Florian Mayer, et. al.. (2014). iPSC-derived neurons from GBA1-associated Parkinson’s disease patients show autophagic defects and impaired calcium homeostasis. Nat Comms. 5.