Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
15 февраля 2021
Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
- 8501
- 0
- 9
Ученые из Калифорнийского университета в Сан-Диего показали успешную трансформацию астроцитов в нейроны in situ для лечения болезни Паркинсона. Поможет ли эта работа приблизиться к созданию успешной терапии?
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Болезнь Паркинсона до сих пор остается неизлечимой. Однако в июне 2020 года в журнале Nature вышла статья, способная произвести революцию в терапии этого недуга. В этой работе мы рассмотрим, какие предыдущие исследования привели к такому результату и как это может повлиять на будущее всей нейробиологии.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Болезнь Паркинсона является вторым по распространенности нейродегенеративным расстройством. Она характеризуется отмиранием нейронов в черной субстанции мозга. Существующая терапия направлена на ограниченное сдерживание заболевания. Эффективного лекарства до сих пор не существует. Недавнее исследование может в корне изменить плачевную ситуацию. Хао Цянь из Калифорнийского университета в Сан-Диего (США) вместе с коллегами из Пекинского университета (Китай) продемонстрировал успешное превращение астроцитов в нейроны in situ на мышиной модели болезни Паркинсона. Однако начнем с общей характеристики этого заболевания.
Болезнь Паркинсона: история и молекулярный патогенез
В 1817 году английский врач Джеймс Паркинсон [1] опубликовал работу «Эссе о дрожательном параличе», в которой дал описание неврологического недуга, а также провел анализ и выявил общие закономерности. В названии отражено необычное сочетание основных симптомов — тремор, скованность мышц и неспособность удерживать равновесие [2].
Долгое время медицина не понимала причины этого расстройства. Прорыв в изучении болезни Паркинсона произошел уже в XX веке .
Кстати, одним из ученых, который помог разгадать тайны патогенеза болезни Паркинсона, стал русский невропатолог Константин Николаевич Третьяков, занимавший в 1916–1923 годах должность заведующего лабораторией мозга имени Шарко кафедры нервных болезней Парижского университета (Франция). Он предложил нигральную теорию патогенеза болезни Паркинсона, согласно которой, проявления заболевания были связаны с утратой черной субстанции головного мозга.
Сегодня известно, что болезнь Паркинсона развивается вследствие дегенерации дофаминергических нейронов в черной субстанции, что приводит к снижению уровня вырабатываемого дофамина — нейромедиатора, ответственного за чувство удовлетворения и привязанности. Клинические проявления связаны с нейротоксическим эффектом: по мере прогрессирования заболевания в клетках накапливается белок альфа-синуклеин [3]. Альфа-синуклеин в норме задействован в механизме транспорта и высвобождения везикул с нейротрансмиттерами. Однако у пациентов с болезнью Паркинсона наблюдается фосфорилирование и аномальное свертывание этого белка с образованием агрегатов — телец Леви (рис. 1). В 2018 году группа ученых из научно-исследовательского института Скриппса (США) обнаружила, что фосфорилированная форма альфа-синуклеина локализуется в митохондриях, вызывая их фрагментацию [4].
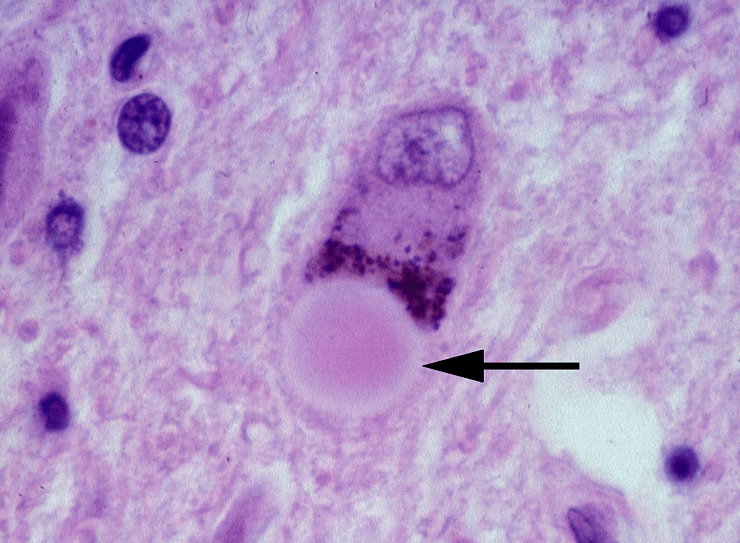
Рисунок 1. Тельце Леви в нейроне черной субстанции головного мозга
Возможности сегодняшней терапии
Сейчас существует только симптоматическое лечение, направленное на облегчение имеющихся проявлений заболевания. Одним из наиболее эффективных и широко применяемых лекарств является леводопа, или 3-гидрокси-L-тирозин [5]. Леводопа — биологический предшественник дофамина. Помимо леводопы, иногда используется ряд других лекарственных средств. Агонисты дофаминовых рецепторов имеют химическую структуру, похожую на дофамин, и за счет этого могут стимулировать его рецепторы [6]. Ингибиторы моноаминоксидазы B способны блокировать высвободившийся дофамин и продлевать время его действия. Ингибиторы катехол-О-метилтрансферазы подавляют распад принятой леводопы и удлиняют время ее действия в организме.
Также для терапии болезни Паркинсона применяют так называемые нейротрофические факторы — регуляторные белки, которые поддерживают жизнеспособность и функционирование нейронов. Хотя было проведено множество исследований по использованию нейротрофических факторов в клинической практике, у них есть ряд недостатков. Во-первых, они нуждаются в точной доставке к месту назначения. Для этого используют специальные катетеры. Во-вторых, нейротрофические факторы целесообразно использовать только в том случае, если у пациента еще не повреждены аксоны дофаминергических нейронов. Если же транспортная система в черной субстанции нарушена или уничтожена, то такое лечение не даст никаких положительных эффектов [7].
Часть из вышеперечисленных способов борьбы с болезнью широко используется, однако ничего из этого не поможет вернуть человеку его утраченные нейроны. Поэтому были попытки разработать терапию, направленную на восстановление популяции дофаминергических нейронов. В 2018 году группа ученых из японского Университета Киото [8] пересадила в мозг пациента индуцированные плюрипотентные стволовые клетки (ИПСК) [9], способные превращаться в любую клетку организма. Перед тем как применять ИПСК для лечения болезни Паркинсона у человека, были проведены исследования эффективности и безопасности этой терапии на приматах [10]. У семи людей изъяли ИПСК для их последующего превращения в клетки нейронного ряда. Для трансформации использовали двойное подавление сигнального пути SMAD, участвующего в процессах клеточного роста, дифференциации и смерти. За специализацию дофаминергических нейронов в черной субстанции отвечает сигнальный путь Sonic hedgehog (Shh). Подавление SMAD и активация Shh привели к дифференцировке ИПСК в клетки-предшественники дофаминергических нейронов, которые начали синтезировать нейронные маркеры [11]. Однако трансплантация стволовых клеток для лечения болезни Паркинсона у человека не применяется из-за сложности и недостаточных данных об эффективности.
Астроциты — возможное лекарство?
В последнее время было опубликовано несколько научных работ по превращению различных клеток в дофаминергические нейроны. В основном, исследователи останавливали свой выбор на астроцитах — клетках, поддерживающих жизнедеятельность нейронов. Свое название они получили за характерную звездчатую форму (рис. 2). В обязанности этих клеток входит обеспечение метаболических потребностей нейронов, участие в своевременном высвобождении нейротрансмиттеров из нервных окончаний, запас питательных веществ и регуляция активности нейронов.
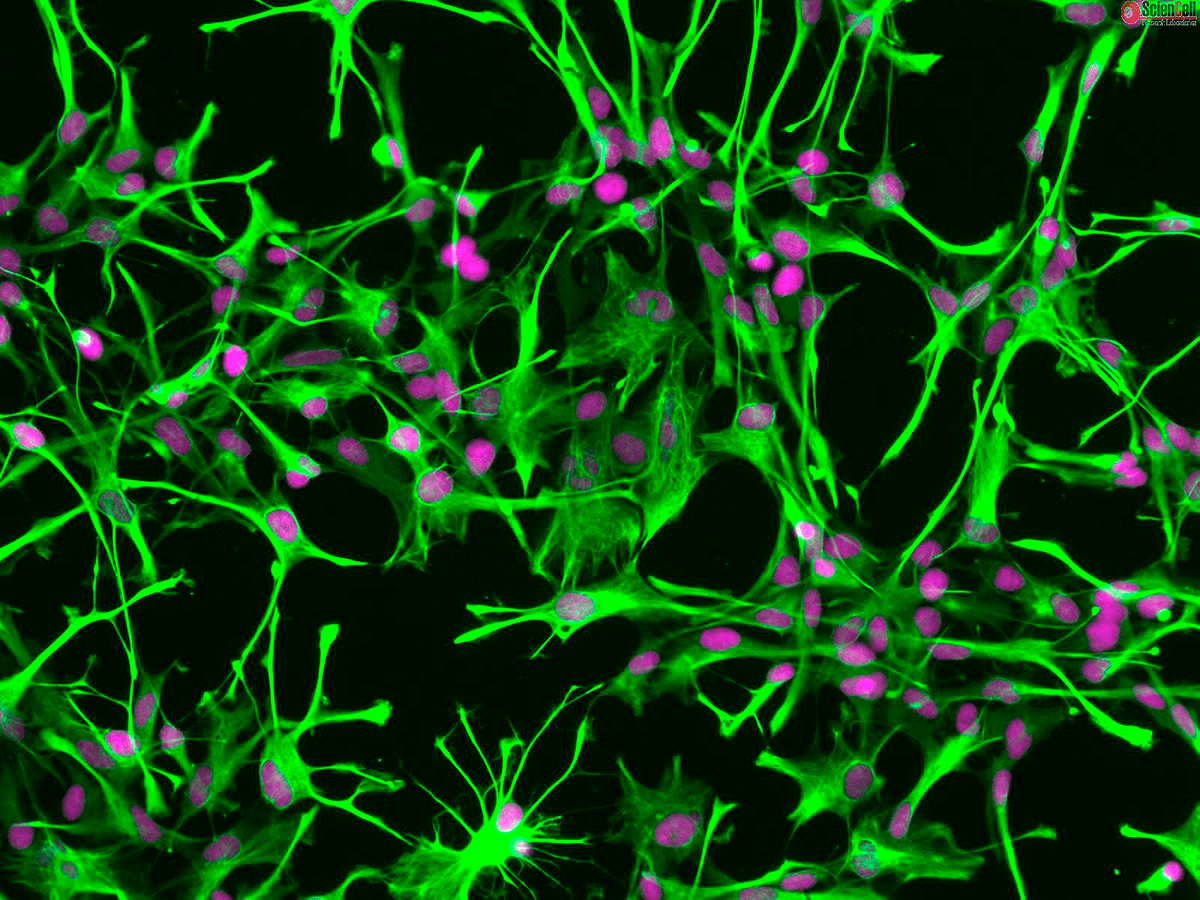
Рисунок 2. Вспомогательные клетки нервной системы — астроциты. В норме они обеспечивают жизнедеятельность нейронов, но воздействуя на молекулярные процессы, протекающие в астроцитах, можно добиться их «превращения» в нейроны любого типа.
Но больше всего ученых интересует их репаративная функция. В 2014 году группа ученых из Лундского университета и Каролинского института обнаружила, что при повреждении нервной ткани после инсульта астроциты способны замещать погибшие нейроны [12]. При этом у них «выключается» сигнальный путь Notch1, имеющий ключевое значение в процессах пролиферации и дифференцировки клеток. В здоровом головном мозге этот путь активен и блокирует превращение астроцитов в нейроны. Однако после инсульта этот механизм подавляется, и астроциты могут начать трансформироваться в нейроны.
Идея для исследования, проведенного группой из Калифорнийского университета, не нова. Еще в 2017 году группа шведских ученых с помощью вирусных векторов превратила человеческие астроциты в нейроны in vitro. После этого трансформировали и мышиные астроциты, но уже in vivo. Для репрограммирования они использовали три транскрипционных фактора (NEUROD1, ASCL1 и LMX1A) и микроРНК miR218 [13]. Трансформация астроцитов in vitro была улучшена с помощью молекул, способных провоцировать перестройку хроматина и активировать несколько сигнальных путей.
Однако в исследовании 2020 года предлагается куда более простой метод перепрограммирования астроцитов: достаточно просто заблокировать производство одного-единственного белка.
Механизм трансформации астроцитов
В качестве мишени для репрограммирования астроцитов Цянь и коллеги выбрали РНК-связывающий белок PTB1 [14]. Этот белок синтезируется в астроцитах и ингибирует дифференцировку в нейроны. Снижение производства PTB1 вызывает продукцию его нейронного варианта nPTB1.
Сначала ученые провели трансформацию астроцитов in vitro. Астроциты выделили из среднего мозга и коры мыши и из коры человека. Исследователи использовали РНК-шпильку к гену Ptbp1, который кодирует белок PTB1. РНК-шпильки работают по принципу РНК-интерференции: они взаимодействуют с информационной РНК конкретного гена и вызывают ее деградацию, что приводит к неспособности клетки произвести белок. Уровень PTB1 в астроцитах упал, что привело к трансформации астроцитов в нейроны.
Затем исследователи перешли к экспериментам in vivo: они истощали запасы белка PTB1 в мозге мыши. Симптомы болезни Паркинсона у мышей были вызваны с помощью токсичного аналога дофамина, 6-OHDA, вызывающего гибель дофаминергических нейронов. Цянь и коллеги использовали трансгенных мышей, продуцирующих cre-рекомбиназу. Это позволяло нацелить вирусный вектор непосредственно на астроциты. Чтобы убедиться, что вирус достиг своей цели, в него встроили ген красного флуоресцентного белка. В составе вирусного вектора была маленькая РНК-шпилька (shPTB), которая блокировала ген Ptbp1. Такая стратегия также привела к преобразованию астроцитов в нейронные клетки и восстановлению двигательной активности (рис. 3).
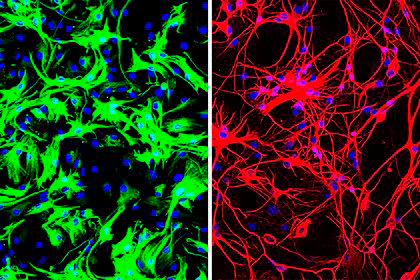
Рисунок 3. Слева: астроциты мыши. Справа: нейроны, полученные в ходе репрограммирования астроцитов.
Результаты
Цянь и коллеги обнаружили, что истощение запасов PTB1 в астроцитах стимулирует их трансформацию в нейроны. Результат такой трансформации зависит от области мозга, в которой находятся целевые астроциты. Обнаружено, что астроциты в среднем мозге синтезируют низкие уровни факторов транскрипции Lmx1a и Foxa2. Эти факторы являются маркерами предшественников дофаминергических нейронов во время развития среднего мозга. Однако истощение белка PTB1 усиливало продукцию этих факторов транскрипции в астроцитах среднего мозга. С другой стороны, воздействие на корковые астроциты приводило к увеличению синтеза факторов транскрипции, характерных для корковых нейронов.
Спустя 4 недели после воздействия на астроциты in vitro 50–80% клеток стали морфологически похожи на нейроны и дали положительный результат на нейронные маркеры TUJ1 и MAP2.
При экспериментах in vivo спустя 3 недели после введения shPTB около 20% клеток, получивших красный флуоресцентный белок, синтезировали маркер нейронов NeuN. После 10 недель было уже около 80% клеток с NeuN. При этом клетки переставали продуцировать GFAP — белок, присутствующий в астроцитах.
Спустя 12 недель 30–35% этих клеток трансформировались в дофаминергические нейроны. Другими словами, перепрограммирование астроцитов помогло восстановить более 600 погибших дофаминергических нейронов (рис. 4).
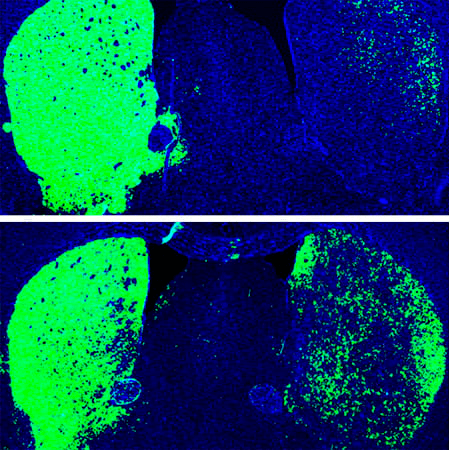
Рисунок 4. Мозг мыши с «односторонней» болезнью Паркинсона. Сверху — до репрограммирования с помощью shPTB. Снизу — после. Зеленым показаны дофаминергические нейроны.
Более того, новоиспеченные нейроны стали активно производить дофамин. Воздействие 6-OHDA привело к снижению уровня нейромедиатора до 25% от нормальных показателей. После терапии концентрация дофамина поднялась до 65% нормального уровня.
Будет ли создана новая терапия болезни Паркинсона?
Пока что слишком рано говорить о перспективах использования метода репрограммирования астроцитов для лечения болезни Паркинсона у реальных пациентов. Однако уже сейчас можно сказать, что это исследование помогло понять, как лучше подступиться к созданию новых направлений терапии этого недуга. Хотя эта многообещающая терапевтическая стратегия в будущем может быть применима и для лечения других нейродегенеративных заболеваний, сами авторы указывают, что «применение нашего подхода к людям потребует преодоления многих препятствий, включая возрастные ограничения перепрограммирования и потенциальные побочные эффекты». Вдобавок, в дальнейших экспериментах необходимо определить, сохранят ли перепрограммированные клетки свою функциональную активность в течение длительных промежутков времени.
Литература
- James Parkinson. (2002). An Essay on the Shaking Palsy. JNP. 14, 223-236;
- Дофаминовые болезни;
- L. Stefanis. (2012). -Synuclein in Parkinson's Disease. Cold Spring Harbor Perspectives in Medicine. 2, a009399-a009399;
- Diego Grassi, Natalia Diaz-Perez, Laura A. Volpicelli-Daley, Corinne Ida Lasmézas. (2019). Pα-syn* mitotoxicity is linked to MAPK activation and involves tau phosphorylation and aggregation at the mitochondria. Neurobiology of Disease. 124, 248-262;
- National Collaborating Centre for Chronic Conditions (UK). (2006). Parkinson's disease: National clinical guideline for diagnosis and management in primary and secondary care. Royal College of Physicians (UK);
- Ghoshal M. (2019). Understanding dopamine agonists. Healthline Media;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Jun Takahashi. (2019). Preparing for first human trial of induced pluripotent stem cell-derived cells for Parkinson's disease: an interview with Jun Takahashi. Regenerative Medicine. 14, 93-95;
- Такие разные стволовые клетки;
- Tetsuhiro Kikuchi, Asuka Morizane, Daisuke Doi, Hiroaki Magotani, Hirotaka Onoe, et. al.. (2017). Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model. Nature. 548, 592-596;
- Болезнь Паркинсона: что изучать? как изучать?;
- J. P. Magnusson, C. Goritz, J. Tatarishvili, D. O. Dias, E. M. K. Smith, et. al.. (2014). A latent neurogenic program in astrocytes regulated by Notch signaling in the mouse. Science. 346, 237-241;
- Pia Rivetti di Val Cervo, Roman A Romanov, Giada Spigolon, Débora Masini, Elisa Martín-Montañez, et. al.. (2017). Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nat Biotechnol. 35, 444-452;
- Hao Qian, Xinjiang Kang, Jing Hu, Dongyang Zhang, Zhengyu Liang, et. al.. (2020). Reversing a model of Parkinson’s disease with in situ converted nigral neurons. Nature. 582, 550-556;
- Laura Dunn, Patrick A. Lewis. (2008). The Shaking Palsy - Advances in Our Understanding of Parkinson's Disease. OPT;
- От астроцита до нейрона: история одного превращения в живом мозге.