
Что расскажут о белках алмазы
30 апреля 2015
Что расскажут о белках алмазы
- 445
- 0
- 1
Особый дефект в алмазе (NV-центр) может служить сенсором при анализе динамики единственной молекулы.
Рисунок в полном размере.
-
Автор
-
Редакторы
В мире всё состоит из молекул, а белки — ключевые молекулы живого мира. Пока что мы не можем посмотреть напрямую, как они работают в клетках, но с каждым днем возможностей для анализа становится все больше. Ученые из Китая и Германии предложили экспериментальный подход к изучению динамики единичных белков.
Во всём мире во множестве лабораторий биологи изучают функции белков, пытаясь понять механизмы их работы в норме и при патологии. Белки — это кирпичики жизни, но не какие-то одинаковые кубики, а молекулы самой разнообразной формы. Понимание их функций неотделимо от знания структуры. Часто форма белка может изменяться в зависимости от его взаимодействий с другими молекулами или просто так — случайно. Крайним случаем являются неструктурированные белки или их части (домены), которые не принимают постоянной формы вообще [1], [2].
Существуют различные методы изучения структуры белков — и экспериментальные, и теоретические [3]. Наиболее достоверная информация — полученная в эксперименте — требует обобщения данных, поступающих от множества одинаковых белков. Как ведет себя каждая молекула в отдельности — вот что неизвестно, а значит, интересно. Ученые из Китая и Германии смогли получить данные о динамике одной-единственной молекулы белка [4]. А работа их началась с испорченных алмазов.
И на солнце бывают пятна, и на алмазах — азото-замещенные вакансии...
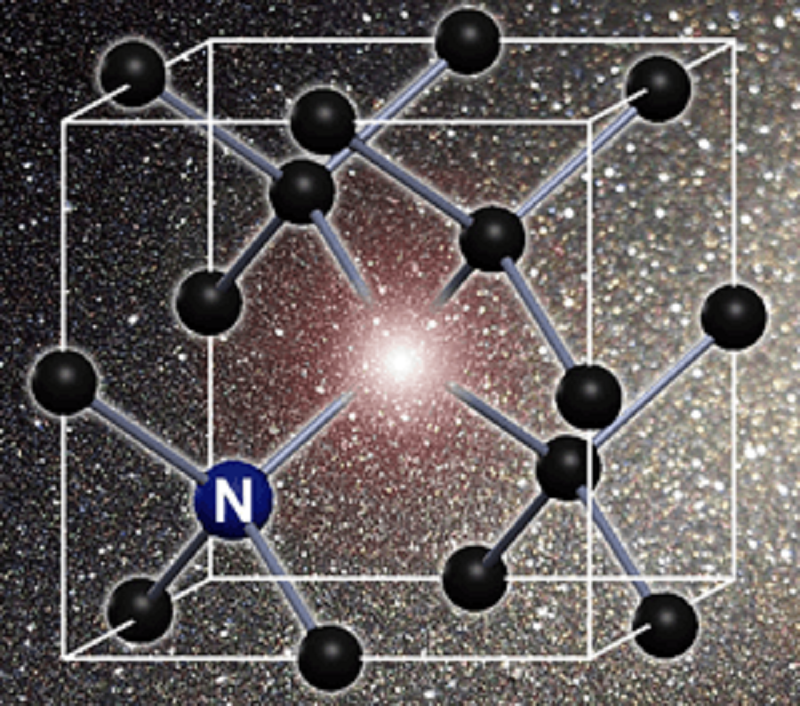
Рисунок 1. Кристаллическая решетка алмаза с азото-замещенной вакансией.
рисунок с сайта scitechdaily.com
Как известно, алмаз состоит из атомов углерода, образующих специфическую кристаллическую решетку. Если два атома углерода покинут соседние узлы решетки, а место одного из них займет азот, образуется NV-центр (nitrogen-vacancy center, азото-замещенная вакансия), содержащий неспаренные электроны. Такой дефект (рис. 1) обладает замечательным свойством: при воздействии света, испускаемого лазерами, в нем возбуждается резонансная красная фотолюминесценция, которую легко детектировать, а параметры ее — измерить. Спинами электронов NV-центра можно управлять, так как они очень чувствительны не только к свету, но и к разным полям, которые могут наводить спиновую поляризацию, и эту информацию центр будет сохранять продолжительное миллисекундное время (в данном случае это и правда долго — ведь обсуждается не квантовый компьютер).
Увидеть с помощью оптики наноразмерные объекты невозможно из-за дифракционного предела (ближнепольная оптическая микроскопия, правда, зашла дальше). Потому структуру таких объектов изучают, фиксируя «проявления» их атомов — электронные облака, слабые магнитные поля, силы взаимодействия со сканирующим зондом и т.п. Такой способ познания напоминает технику чтения, разработанную для незрячих. С помощью NV-дефекта, облучаемого светом, можно измерять параметры магнитного поля различных объектов (даже ничтожного размера), детектируя и анализируя поток красного света, испускаемый дефектом алмаза при приближении этих объектов. Это свойство и легло в основу технологий применения искусственных наноалмазов с целенаправленно вносимыми дефектами в качестве биомедицинских сенсоров (ультрачувствительное определение уровня металлопротеинов в крови) [5], «насадок» на зонды атомно-силовых микроскопов (сканирующая алмазная магнитометрия) (рис. 2) [6].
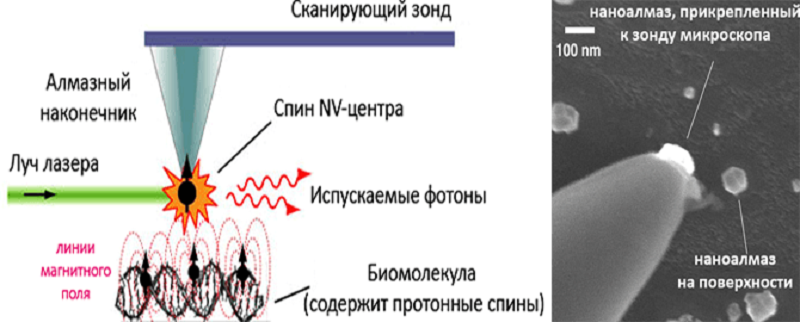
Рисунок 2. Сканирующая алмазная магнитометрия (иногда — сканирующая квантовая микроскопия). Слева — схема метода; справа — зонд микроскопа. Объектив атомно-силового микроскопа возбуждает и детектирует фотолюминесценцию NV-центра. Рядом находится источник поля — магнит (метод объединяет магнитно-резонансную спектроскопию с оптической микроскопией) и обычно генератор микроволн (для манипулирования NV-спином). Модификации метода разрабатываются разными научными коллективами. Разрешающая способность — на уровне полей единичных электронных спинов (наномасштаб), достигается при обычных условиях (!), в отличие от магнитно-резонансной силовой микроскопии (низкие температуры и вакуум ограничивают ее применение в анализе биообъектов). Можно «видеть» монослои органических материалов.
рисунки с сайта web.mit.edu, адаптированный
Алмазы могут работать лучше, если им подставляют дружеские спины
Ученые приближались к возможности анализировать отдельные молекулы постепенно. Сейчас рутинно используются довольно чувствительные методы рентгеновской кристаллографии, просвечивающей электронной микроскопии (ПЭМ), ядерного магнитного резонанса (ЯМР), однако они не способны охарактеризовать отдельную молекулу, да еще в ее естественной среде.
Изначально NV-центр «чувствовал» только ядра атомов в кристаллической решетке самогό алмаза. Прошли годы, прежде чем с помощью дефектного алмаза научились регистрировать «чужие» спины, однако разрешения не хватало для изучения белковых молекул (и конкретно их активных центров): оно должно достигать уровня единичного атомного ядра, тогда же фиксировались спины лишь их групп. В прошлом году опубликовали работу, которая продемонстрировала приближение разрешения к «почти-одноатомному» — исследовали четыре кремниевых ядра, на специальной подложке помещенные на алмаз, — и принципиальную возможность преодоления магнитного «шума» от неспаренных электронов у поверхности сенсора (из-за этих «помех» раньше вообще сомневались в возможности достижения одноядерного разрешения с помощью NV-центра) [7].
В 2015 году сообщили о возможности фиксировать не только спины единичных ядер в сложных биомолекулах, прикрепленных к поверхности алмаза, а считывать целые фрагменты белковой пространственной структуры, что просто необходимо в моделировании, например, взаимодействия лекарств с рецепторами и т.п. Авторы усилили способность системы «запоминать» спиновую поляризацию дефекта: квантовая память обеспечивалась комплексом NV-центра с ядерным 15N-спином. В итоге сами объекты исследования — единичные ядерные спины — тоже поляризовались и служили зондами для локального окружения, передавая затем сигнал обратно, на NV-центр, где «показания» считывались оптикой [8]. Всё происходило при комнатной температуре, не требовалась кристаллизация белков (для мембранных она и вовсе невозможна). Однако предложенный метод позволяет исследовать лишь фрагменты поверхности, но не целые молекулы, потому должен сочетаться с перечисленными выше «неалмазными» техниками. Кстати, какие-то аминокислоты можно пометить изотопом 13C, чтобы сфокусировать эксперимент на спинах нужного участка.
Но всё же требовалось дистанцироваться от поверхности кристалла — смастерить метку-«засланца» (репортера), которая передавала бы сигналы о конформационных перестройках конкретного фрагмента белка (в предыдущей работе подобием репортерной системы была кросс-поляризация поверхностных частиц). Важно отметить, что по большей части белки не обладают парамагнитными свойствами, а потому не могут «загружать информацию» в NV-центр. Но знание о структуре и динамике биомолекулы удастся получить, если внести в нее спиновую метку, которая будет выступать зондом для получения спектров электронного парамагнитного (спинового) резонанса. То есть можно искусственно придать объекту изучения парамагнитные свойства.
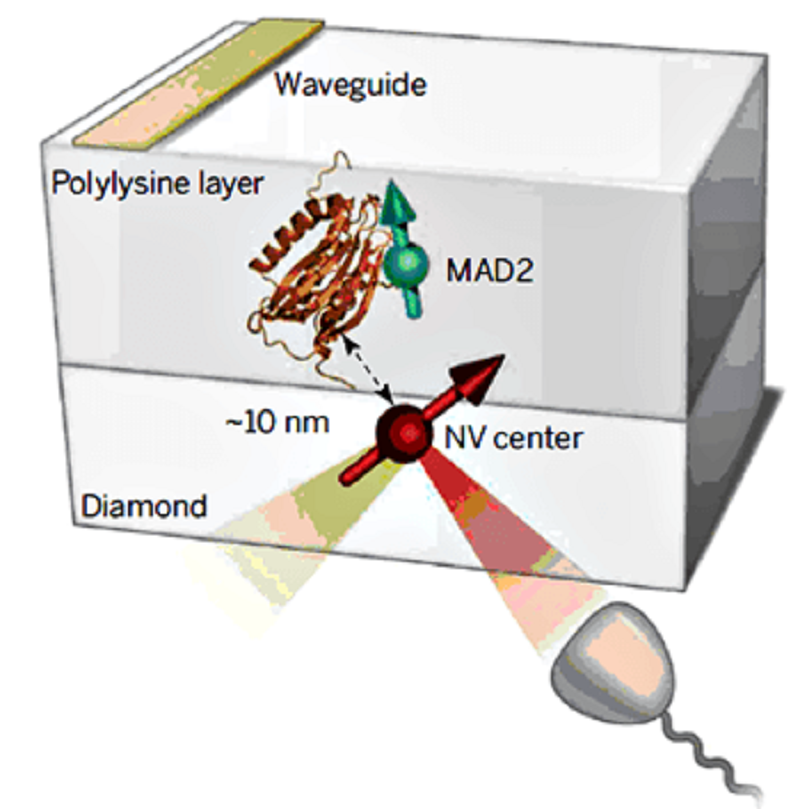
Рисунок 3. Схема регистрации ядерного спина с помощью NV-центра в алмазе и репортерного спина, прикрепленного к белку MAD2.
Авторы работы [4] использовали NV-центр уже как сенсор спиновой метки в белке (рис. 3). Он может реагировать на спин единственного (!) электрона, находящегося на расстоянии свыше 30 нм. Дистанция между репортерной меткой и NV-дефектом около 10 нм (5 нм от поверхности кристалла) оказалась достаточной, чтобы «прочувствовать» даже удаленные участки молекулы.
В качестве спиновой метки использовали традиционный нитроксид (нитроксильный радикал). Каждый нитроксид имеет один неспаренный электрон, позволяющий обнаруживать ядра близлежащих атомов в процессе, известном как сверхтонкое взаимодействие (грубо — взаимодействие магнитных моментов электрона и ядра, энергия же взаимодействия зависит от возможных взаимных ориентаций их спинов). Для контроля поляризации NV-центра и синхронного возбуждения метки ученые импульсно воздействовали микро- и радиоволнами, и внешнее магнитное поле, конечно, тоже создавали.
Для исследования выбрали белок MAD2 (mitotic arrest deficient 2), участвующий в регуляции деления клетки, точнее — в контроле правильного расхождения хромосом при переходе митоза из метафазы в анафазу. Его предпочли в данном случае не из-за какой-то исключительной важности, а в первую очередь потому, что его легко пометить спиновой меткой именно в том месте, где очень хотелось исследователям. Мало того, MAD2 удалось надежно закрепить на поверхности алмаза. Таким образом обеспечили магнитное дипольное взаимодействие между спином NV и спиновой меткой в белке. Эти взаимодействия регистрировали, описывали и анализировали, что позволило ученым обнаружить перестройки в структуре белка: движения молекулы отражались на динамике спина метки, менялся спектр парамагнитного резонанса.
Особенности фиксации белка на алмазе — внедрение в полилизиновый матрикс — понизили его подвижность и, следовательно, подвижность спиновой метки. Однако «замороженной» их динамику считать было нельзя. Структурные изменения в белке происходят в миллисекундном временнόм диапазоне, поэтому их удалось зафиксировать. Оказалось, что преимуществом спектров односпинового электронного резонанса является возможность точного определения анизотропии сверхтонкого взаимодействия. Такой спектр позволяет утверждать, что одна молекула MAD2 имеет несколько разных структурных состояний.
Интересно также то, что взаимодействие между спиновой меткой и соседними ядрами атомов может дать информацию о структуре и динамике частей белка, находящихся за пределами чувствительности сенсора (алмазного дефекта): ученые смогли локализовать не только репортерный спин, но и ядерный спин рядом. Так удалось еще на один шаг приблизиться к исследовательскому идеалу — наблюдению за жизнью отдельных молекул в реальном времени и в живых клетках. Только для этого еще предстоит подобрать фотостабильные репортерные метки с большей квантовой памятью и совместить их не с обычными, а наноалмазами. Мы еще очень мало знаем, о том, как ведут себя единичные белки, поэтому остается только догадываться, какие открытия будут сделаны с помощью подобных технологий.
Литература
- Недоупорядоченные белки;
- За пределами порядка;
- Новые успехи в предсказании пространственной структуры белков;
- Fazhan Shi, Qi Zhang, Pengfei Wang, Hongbin Sun, Jiarong Wang, et. al.. (2015). Single-protein spin resonance spectroscopy under ambient conditions. Science. 347, 1135-1138;
- A. Ermakova, G. Pramanik, J.-M. Cai, G. Algara-Siller, U. Kaiser, et. al.. (2013). Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Lett.. 13, 3305-3309;
- P. Maletinsky, S. Hong, M. S. Grinolds, B. Hausmann, M. D. Lukin, et. al.. (2012). A robust scanning diamond sensor for nanoscale imaging with single nitrogen-vacancy centres. Nature Nanotech. 7, 320-324;
- Philip Hemmer, Carmen Gomes. (2015). Single proteins under a diamond spotlight. Science. 347, 1072-1073;
- A. Ajoy, U. Bissbort, M. D. Lukin, R. L. Walsworth, P. Cappellaro. (2015). Atomic-Scale Nuclear Spin Imaging Using Quantum-Assisted Sensors in Diamond. Phys. Rev. X. 5.






