Динитрозильные комплексы железа: изобретение природы — лекарство будущего для здоровых сосудов
01 ноября 2017
Динитрозильные комплексы железа: изобретение природы — лекарство будущего для здоровых сосудов
- 2381
- 0
- 5
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Многим хорошо знаком препарат нитроглицерин. Его применяют для профилактики и лечения приступов стенокардии. Сосудорасширяющее действие нитроглицерина связано с оксидом азота (NO), образующимся при его восстановлении в организме. Нитроглицерин можно заменить более эффективным веществом — динитрозильными комплексами железа с глутатионовыми лигандами (ДНКЖ) [(GS)2Fe(NO)2]. Эти комплексы открыли 50 лет назад и только сейчас на их основе создали фармакологический препарат «Оксаком». ДНКЖ имитируют регуляторное действие NO и являются формой запасания и транспорта NO. В экспериментах ДНКЖ показали мощное и длительное сосудорасширяющее действие. Это их свойство в сочетании с низкими эффективными дозами делает ДНКЖ уникальными донорами NO. К тому же ДНКЖ с глутатионовыми лигандами являются природным веществом, абсолютно естественным для нашего организма. О том, как были обнаружены данные комплексы, как они устроены и как работают, можно узнать, прочитав нашу статью.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
История проблемы
Какой ученый биолог или медик не знает о существовании молекулы оксида азота (NO)? Оксид азота — бесцветный газ, плохо растворимый в воде. Несмотря на свою простоту, эта молекула играет огромную роль в жизнедеятельности различных организмов. Для жизни этот газ так же важен, как и кислород. Только если о необходимости последнего для жизни знают все (кислород необходим нам для дыхания, то есть для наиболее полного извлечения энергии из потребляемых с пищей химических веществ), то о полезных свойствах NO слышали немногие. Часто бывает, что, пользуясь плодами прогресса, мы не задаемся вопросом о том, как это работает, какие физико-химические процессы лежат в основе той или иной конструкции, того или иного вещества. Так получилось и с молекулой NO. Так, нитроглицерин давно применяют в медицинской практике для купирования приступов стенокардии и гипертонии. Только действующим веществом является не сам нитроглицерин, а продукт его восстановления в организме — оксид азота. Именно оксид азота вызывает расширение сосудов. Несмотря на длительную историю использования нитроглицерина как лекарственного средства (с 1876 года) долгое время принцип работы этого препарата был не известен. Понадобилось целое столетие для расшифровки механизма действия нитроглицерина. За выяснение механизма действия оксида азота на гладкую мускулатуру сосудов в 1998 году Роберт Ферчготт, Луис Игнарро и Ферид Мурад получили Нобелевскую премию по физиологии и медицине.
Биологические функции оксида азота не исчерпываются его сосудорасширяющими свойствами. Эта молекула является универсальным регуляторным и сигнальным веществом в организмах разного уровня сложности, от бактерий до человека. С момента объявления оксида азота молекулой года (1992 г.) начался настоящий бум в исследовании роли NO в процессах жизнедеятельности. Мало кто из ученых-биологов не добавлял химические доноры NO к объекту исследования, чтобы посмотреть, а что из этого получится.
Получилось очень многое. Оказалось, что все базовые аспекты поведения клетки (рост, деление, приобретение специализированных структур и функций, запрограммированная гибель, адаптация) регулируются молекулой NO [1]. Природа нашла применение и токсическим свойствам NO, связанным с образованием сильного окислителя пероксинитрита (ONOO−) в реакциях с супероксидом (O2•−). Оказалось, что макрофаги специально в больших количествах синтезируют NO, чтобы затем использовать его токсичные метаболиты в качестве «химического оружия» против внедрившихся в организм бактерий, доброкачественных и злокачественных опухолей.
Как открытие генетического кода разделило биологическую науку на догеномную и постгеномную эры, так и открытие биологического действия NO разделило науку на «до и после». Появилось целое научное направление — биология NO. В последующие годы установили, что и другие малые газообразные молекулы — монооксид углерода (CO) и сероводород (H2S) в организме действуют во многом аналогично NO. NO, CO и H2S составляют группу газомедиаторов. Газомедиаторы образуются в организме либо целенаправленно, в реакциях, катализируемых ферментами, либо спонтанно, как побочные продукты ферментативных реакций. У этих веществ много общих мишеней: клеточные рецепторы, ферменты, регуляторы активности генов и др. Все три соединения являются химически активными веществами и родоначальниками так называемых «активных форм»: активных форм азота, активных форм серы и активных карбонильных соединений. Именно с образованием «активных форм» связано токсичное действие указанных молекул на организм. В организме в норме концентрации NO, CO и H2S регулируются, так что токсичных «активных форм» образуются очень мало. Увеличение базового уровня «активных форм» можно рассматривать как сигнал неблагополучия, нарушения в метаболических путях.
Остановимся подробнее на молекуле NO. Молекула оксида азота имеет один неспаренный электрон на внешней орбитали, то есть на языке химии является свободным радикалом. Благодаря этому электрону NO легко реагирует с другими биологическими молекулами. Поэтому время жизни NO крайне мало. В неизменном виде оксид азота не способен преодолевать большие расстояния. Конечно, в нужное время и в нужном месте можно запустить синтез NO, активируя специализированные ферменты — NO-синтазы. Однако на этом пути есть несколько проблем. Не все клетки содержат постоянно действующие NO-синтазы (только клетки эндотелия, нейроны и эритроциты). Большинство клеток имеют ген этого фермента, поэтому для того, чтобы получить порцию NO, необходимо сначала активировать ген, синтезировать белок (NO-синтазу), который затем должен превратить аминокислоту L-аргинин в цитруллин с выделением NO. Поскольку такой способ получения NO требует времени, в организме предусмотрены системы быстрого реагирования, позволяющие получить NO из его хранилищ (депо) или доноров. Основной формой хранения NO в организме являются динитрозильные комплексы железа. Включение NO в состав таких комплексов не только стабилизирует молекулу, предотвращая образование активных форм азота, но и делает возможным ее транспорт от места образования к месту действия. Как эти комплексы устроены, как образуются, как работают и могут ли быть полезны нам?
От мечты к открытию
Счастливый случай благоприятствует подготовленному уму.
Луи Пастер
Началось все с простого исследования свободнорадикальных центров в пекарских дрожжах Sacharomices cerevisia, проводимого аспирантами МГУ А.Ф. Ваниным и Р.М. Налбандяном в далеком 1963 году. В ходе этих исследований в дрожжах был зарегистрирован пик сигнала электронного парамагнитного резонанса (ЭПР) при g-факторе 2,03. Этот пик на спектрах ЭПР мог остаться не замеченным, тем более что он не соответствовал сигналу ЭПР свободных радикалов. Но молодые исследователи обратили внимание на необычный сигнал. Тогда никто не мог и подумать, что случайное открытие парамагнитных центров с g-фактором 2,03 будет иметь огромные последствия для биологии и медицинской химии, ведь для биофизики того времени открытие нового сигнала ЭПР было обычным событием. С этого времени началось изучение природы ответственных за этот сигнал парамагнитных центров, которыми могли оказаться железо-серные комплексы. Первые публикации появились в 1964 и 1965 гг. [2].
Справедливости ради следует отметить, что в то же самое время в авторитетном журнале Nature вышли работы английских [3] и американских исследователей [4], в которых сообщалось об обнаружении сигнала 2,03 в печени крыс.
Когда открыли комплексы 2,03, никто не мог и предположить, что в их состав входит оксид азота. В 60-х годах прошлого столетия о биологических функциях NO ничего не было известно. Пытаясь разгадать природу центров 2,03, вначале предположили, что за этот сигнал ответственны радикалы серы, входящей в состав железосерных кластеров белков. Помог случай. Группа российских исследователей после введения крысам нитрита натрия зарегистрировала в митохондриях их печени сигнал 2,03. Стало ясно, что нитриты участвуют в формировании «комплекса 2,03». Этот факт помог Ванину сделать предположение, что увиденный в митохондриях сигнал 2,03 обусловлен нитрозильными комплексами железосерных белков. Нитрозильные лиганды (NO) в эти комплексы могли поступать из нитрита при его восстановлении метаболическими системами. И снова помог случай. Оказалось, что нитрозильные комплексы негемового железа с тиолсодержащими лигандами к этому времени (1965 г.) уже синтезировали и описали американские химики. Не оставалось никаких сомнений, что за сигнал 2,03 ответственны парамагнитные центры, представляющие собой динитрозильные комплексы железа (ДНКЖ) с двумя тиолсодержащими лигандами ([(RS–)2Fe(NO)2]). Свою догадку Ванин проверил в экспериментах на дрожжевых клетках, обработанных оксидом азота. Ответ на поставленный вопрос был получен, природа загадочного сигнала ЭПР выяснена. А что дальше? Может ли добытый научный факт быть кому-нибудь полезен? В предисловии к своей книге Ванин пишет: «С 70-х до 80-х годов наша группа занималась изучением происхождения и биологической активности обнаруженных нами ДНКЖ в полном одиночестве, что дало повод моим знакомым говорить о „блестящем тупике“, в котором я оказался» (с. 5) [5]. Только после того, как стало известно, что в клетках и тканях животных имеются специальные ферменты для образования NO, стало понятно, что этот собственный NO может включаться в ДНКЖ. Многие исследователи экспериментально подтвердили такую возможность. Образование в живых системах ДНКЖ с тиолсодержащими лигандами стало общепризнанным фактом. Таким образом, открытие функциональной роли NO вывело Ванина, по его словам, из «блестящего тупика».
История открытия ДНКЖ показывает, как настойчивость, логика, интуиция и случай могут незначительный побочный экспериментальный факт превратить в открытие общебиологического значения.
К настоящему времени ДНКЖ обнаружены в клетках и тканях животных, в растениях и бактериях. Продемонстрирована способность ДНКЖ оказывать на биологические объекты действие, подобное NO. Стало ясно, что данные комплексы могут выступать в биологических системах в качестве основной «рабочей» формы оксида азота.
ДНКЖ-невидимки
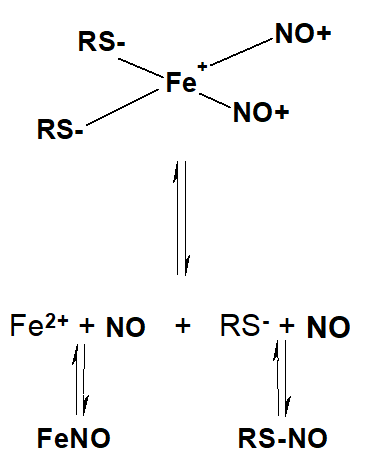
Рисунок 1. Структура тиолсодержащих ДНКЖ (равновесие между ДНКЖ, оксидом азота, S-нитрозотиолоами и тиолами)
ДНКЖ представляют собой нестабильный координационный комплекс двухвалентного железа, оксида азота и лигандов (веществ, связывающих железо):
(GS−)2–Fe+–(NO+)2 ↔ Fe2+ + NO + GSNO + GS−
(равновесная система ДНКЖ с глутатионом).
Этот комплекс находится в динамическом равновесии со всеми компонентами (рис. 1). Иначе говоря, извлечь ДНКЖ из биологического объекта в виде самостоятельного вещества невозможно. В чистом виде получить данные комплексы нельзя даже химическим синтезом, препарат ДНКЖ всегда будет содержать примесь лигандов. Измерить концентрацию ДНКЖ можно только с помощью ЭПР-спектроскопии, да и то не всегда. ДНКЖ существуют в двух формах: моноядерной [(RS)2Fe(NO)2], которая может переходить в другую — димерную биядерную форму [(RS)2Fe(NO)4]. Парамагнитными свойствами обладает только моноядерная форма комплекса, биядерная попросту «невидима» для ЭПР (диамагнитная форма). В тканях животных ДНКЖ находятся в биядерной форме. В культуре клеток животных ДНКЖ предпочитают находиться в моноядерной форме. Общепринятого объяснений этому феномену нет. В следующем разделе мы высказываем некоторые свои догадки по этому вопросу.
Как работают ДНКЖ
В качестве лигандов ДНКЖ могут выступать различные природные вещества: глутатион, цистеин, гистидин, липоевая кислота, карнозин, эрготионеин, фосфатные ионы, персульфидные ионы. Если лигандами являются перечисленные вещества, образуются низкомолекулярные ДНКЖ, если остатки аминокислот (чаще всего цистеина), входящие в состав белка, образуются высокомолекулярные (белковые) ДНКЖ. От природы лиганда зависит стабильность комплексов. В порядке уменьшения стабильности ДНКЖ можно расположить в следующем ряду: белковые > глутатионовые > цистеиновые > ДНКЖ. Характерной особенностью моноядерных ДНКЖ является их нестабильность (лабильность), то есть эти комплексы легко собираются и легко разбираются, а также могут переходить с одних лигандов на другие, например, фосфатные ДНКЖ переходят в глутатионовые, а глутатионовые — в более стабильные белковые. При такой трансформации переносится не молекула NO, а фрагмент [Fe(NO)2]. Такой механизм переноса предотвращает утечку NO и, следовательно, минимизирует образование токсичных активных форм азота.
Молекулярный механизм действия NO связан с образованием комплексов NO с железом. Как правило, NO образует координационную связь с железом гемовой группы белка. Образование нитрозильных комплексов гемового железа (гем-FeNO) вызывают изменения структуры связанного с гемом белка и, как следствие, меняется функция белка в сторону усиления (активация) или снижения (инактивация). Подобные изменения в структуре белка происходят в молекуле гемоглобина при связывании железом молекулы кислорода. Еще одной молекулярной мишенью действия NO являются железосерные центры в белках. Низкомолекулярные ДНКЖ могут разрушать [2Fe–2S]-кластеры. При этом образуются связанные с белком ДНКЖ. Когда такая трансформация обратима, реакцию [2Fe–2S]-кластеров с низкомолекулярными ДНКЖ можно рассматривать как один из способов регуляции активности железосерных белков. По такому механизму регулируется работа бактериального фактора транскрипции SoxR (рис. 2) [6]. Оксид азота также может воздействовать на белки, S-нитрозилируя входящие в их состав SH-группы (R–SNO).
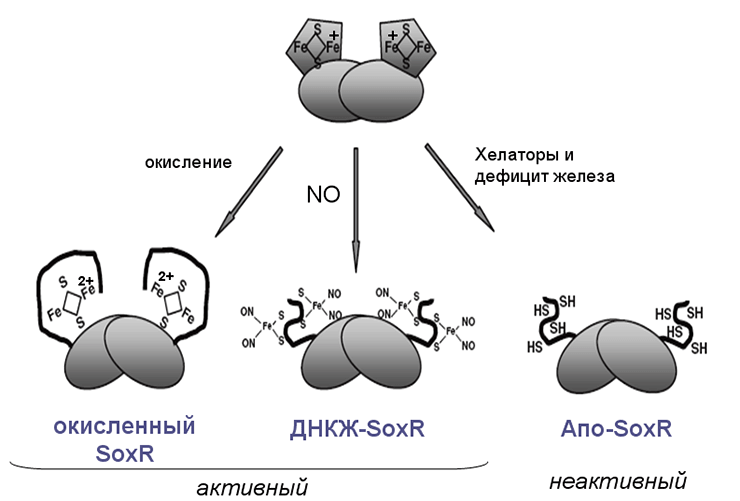
Рисунок 2. Регуляция динитрозильными комплексами железа бактериального транскрипционного фактора SoxR.
[6], рисунок модифицирован
С участием гем-FeNO, R–[Fe(NO)2] и R–SNO возможен внутри- и межмолекулярный перенос молекулы NO. Такой способ передачи NO «из рук в руки» позволяет доставить NO прицельно на мишень, препятствуя появлению его в свободной форме, в которой NO очень быстро вступает в реакцию с супероксидом с образованием токсичного пероксинитрита.
Можно предложить еще один механизм влияния ДНКЖ на активность белков. Включение SH-групп белков в состав биядерных ДНКЖ препятствует их участию в биохимических реакциях. При изменении окислительно-восстановительных условий в клетке эти комплексы могут распадаться с высвобождением SH-групп или переходить в менее стабильную моноядерную форму. Формирование биядерных ДНКЖ можно рассматривать как механизм регулирования реакционной способности белков в зависимости от условий среды.
Фантазируя на эту тему, мы высказали гипотезу, что один из механизмов действия моноядерных ДНКЖ на биологические системы может заключаться в регуляции активности белковых SH-групп. Включение SH-групп в ДНКЖ снижает их химическую активность, при распаде комплексов SH-группы высвобождаются в виде тиолят-аниона (R-S−), которые на порядок реакционноспособнее SH-групп. Получается, что ДНКЖ могут быть блокаторами и сенсибилизаторами (усилителями) активности SH-групп. Знак биологического эффекта, оказываемого ДНКЖ, зависит от разных факторов: рН, концентрации глутатиона (GSH), активных форм кислорода и концентрации самих комплексов. Благодаря своей нестабильности ДНКЖ являются чувствительными датчиками внутриклеточных условий, они могут легко собираться и также легко распадаться при смене условий. Сейчас наша группа ведет экспериментальные работы в этом направлении.
Подводя итог вышесказанному, можно заключить, что действие ДНКЖ на метаболические процессы обусловлено следующими их характеристиками:
- Существенное ослабление токсического действия железа и NO путем включения их в комплекс.
- Источник NO и Fe-NO групп.
- Антиоксидантные и антирадикальные свойства.
- Стабилизация и сенсибилизация SH-групп белков.
Что могут ДНКЖ
За тридцатилетнюю историю активного изучения ДНКЖ стало ясно, что эти комплексы могут очень многое. Ниже мы перечим основные результаты. Ссылки на научные работы, в которых они подробно описаны, содержатся в книге А.Ф. Ванина [5].
- Мощное сосудорасширяющее и гипотензивное действие.
- Подавление агрегации тромбоцитов.
- Противогипоксическое действие на миокард.
- Повышение эластичности эритроцитов.
- Ускорение заживления кожных ран.
- Повышение выживаемости животных при геморрагии.
- Снижение размеров некротической зоны при инфаркте миокарда.
- Подавление программируемой гибели нормальных клеток.
- Активация/подавление активности некоторых генов.
- Подавление роста опухолей на ранней стадии развития.
- Эректильное действие.
В растениях ДНКЖ также регулируют многие физиологические процессы [7]. Данная статья не имеет цель дать полную сводку данных о ДНКЖ, поэтому остановимся только на некоторых функциях.
Гипотензивная активность
Из всех выявленных для ДНКЖ положительных воздействий на организм наиболее изучен гипотензивный эффект [8]. На экспериментальном предприятии медико-биологических препаратов ФГБУ «РКНКП» МЗ РФ создан препарат, получивший название «Оксаком» (сокращения названия «оксида азота комплекс»). Активным веществом «Оксакома» являются ДНКЖ с глутатионом, стабилизированные декстраном. Это новый препарат с мощным гипотензивным действием для купирования гипертонического криза. Доклинические исследования «Оксакома» на крысах, кроликах и обезьянах не выявили у него отрицательных качеств. Гипотензивное действие препарата было испытано на здоровых добровольцах. При одноразовом внутривенном введении он вызывал уже через 3–4 мин снижение артериального давления с последующим медленным восстановлением через 8–10 ч [9]. В отличие от других образуемых в организме доноров NO, S-нитрозоглутатиона и нитрита, ДНКЖ оказывали длительное гипотензивное действие в концентрациях, существенно более низких (примерно в 50–100 раз) [5]. Объясняется это свойством низкомолекулярных комплексов переходить на белки с образованием стабильных комплексов, которые постепенно высвобождают NO. Сейчас препарат «Оксаком» находится на стадии массовых клинических испытаний, проводимых несколькими медицинскими учреждениями.
Противоопухолевая активность
ДНКЖ имитирует не только регуляторное, но и токсическое действие NO, направленное на подавление роста опухолей. ДНКЖ с тиолсодержащими лигандами способны избирательно подавлять развитие опухолей. Эта избирательность обусловлена быстрым разрушением ДНКЖ в активно делящихся клетках и высвобождением больших количеств NO. В качестве примера приведем следующие данные. Показана противоопухолевая активность биядерной формы ДНКЖ с глутатионом на модели карциномы Льюиса при внутрибрюшинном и подкожном введении препарата. Торможение роста опухоли достигало примерно 40% [10]. Губительное действие комплексов на клетки можно объяснить двумя свойствами этих соединений. Первое — образование пероксинитрита из NO, высвобождающегося из ДНКЖ. Второе — способность ДНКЖ разрушать железосерные активные центры в белках, в том числе и тех, которые участвуют в дыхании клетки.
Антиоксидантное действие
ДНКЖ с тиольными лигандами являются уникальной группой соединений, способных быть донорами NO и в то же время способных реагировать с широким спектром активных форм кислорода, азота и углерода. Изучение ДНКЖ в искусственных системах и в культуре клеток показало, что комплексы могут оказывать антиоксидантное и антирадикальное действие, то есть в их присутствии снижается концентрация «активных форм». На первый взгляд такое свойство ДНКЖ кажется парадоксальным. Ведь в их состав входит железо, легко высвобождающееся из этих комплексов. А железо, как известно, может запускать реакцию Фентона (Fe2+ + H2O2 → Fe3+ + OH• + OH−), в которой образуется токсичный для клеток агент — гидроксильный радикал (OH•), представитель активных форм кислорода. Однако эксперименты показали, что включение железа в данные комплексы препятствует его участию в реакции Фентона. На белковых ДНКЖ показано, что NO в составе комплексов реагирует с супероксидом гораздо медленнее по сравнению с реакцией свободного NO с супероксидом (константы скорости отличаются на три порядка) [11]. Глутатионовые ДНКЖ препятствуют образованию оксоферрильной формы миоглобина — сильного окислителя [12], перехватывают свободные радикалы и предотвращают окислительную модификацию гемоглобина [13].
Конечно, нельзя полностью отвергать токсические свойства железа. В некоторых ситуациях высвобождение ионов железа при разрушении ДНКЖ все же может приводить к нежелательному образованию активных форм кислорода. Мы считаем, что результат действия ДНКЖ в стрессовых условиях, будут ли они защищать клетку или, наоборот, поспособствуют ее гибели, зависит от равновесия между различными формами ДНКЖ (низкомолекулярные и белковые, моно- и биядерные) и другими метаболитами NO.
ДНКЖ: наследие предбиологических систем
Горячие воды архейского океана, насыщенные двухвалентным железом, фосфатами и простой неорганикой (CO, CO2, HCN, H2S, NH3 и др.), благоприятствовали образованию каталитических железо-серных минералов. Впоследствии минеральные катализаторы могли эволюционировать, меняя лигандное окружение, в связи с чем изменялись и их каталитические свойства [14]. Включение [2Fe–2S]-кластеров в состав белков позволило получить прототипы современных железосерных центров ферментов. Наличие железосерных каталитических центров в ферментах современных организмов является отголоском абиогенного эволюционного прошлого живых систем. Еще одним таким отголоском являются ДНКЖ, которые могли спонтанно собираться с участием веществ-лигандов, вероятно, имевшихся в достаточном количестве в добиологический период.
ДНКЖ могли сформироваться на основе железосерных кластеров. Современным аналогом таких комплексов являются ДНКЖ с тиолсодержащими лигандами. Лигандами для Fe2+ могли служить продукты взаимодействия простых альдегидов с аминосоединениями. Впервые ДНКЖ с продуктами аминокарбонильной реакции (реакции Майяра) [15] были получены в наших исследованиях с помощью химического синтеза [16]. ДНКЖ также могли собираться на полимерах меланоидинового типа (конечные продукты конденсации альдегидов с аминосоединениями), которые способны связывать ионы переходных металлов [17]. Ранними метаболическими системами ДНКЖ могли эксплуатироваться как кофакторы в окислительно-восстановительных реакциях. Наиболее вероятным представляется функционирование ДНКЖ совместно с железосерными кластерами. Как мы уже упоминали, низкомолекулярные ДНКЖ могут разрушать [2Fe–2S]-кластеры и образовывать связанные с белком ДНКЖ.
Необходимо отметить, что ДНКЖ возникли в анаэробной атмосфере Земли. В отсутствие кислорода данные комплексы не обладали токсичным действием и были более стабильными. Поэтому с наступлением кислородной эпохи в биологических системах функции ДНКЖ, так же, как железосерных кластеров, были переориентированы на детекцию уровня кислорода, окислительно-восстановительного состояния и антиоксидантную защиту [14].
Физико-химические свойства ДНКЖ сочетают химические активности железа, серы и оксида азота. Известно, что железо, сера и азот образуют геохимические циклы, которые предшествовали появлению биохимических циклов. Посредством ДНКЖ, образующих равновесную систему с Fe2+, NO и RS−, становится возможным сопряжение абиогенных циклов азота, серы и железа в единую динамическую систему — гиперцикл (рис. 3).
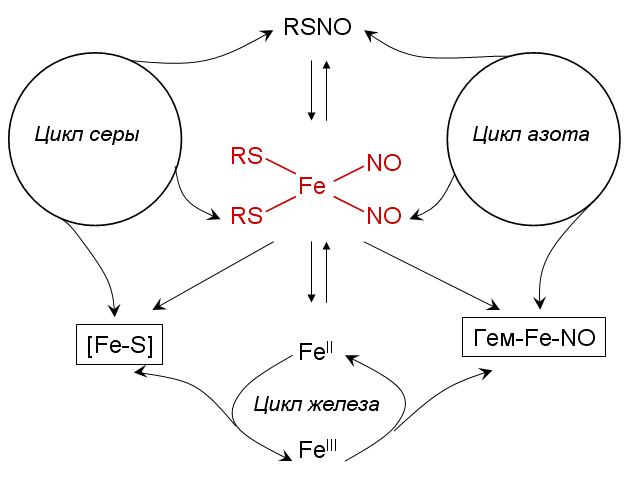
Рисунок 3. ДНКЖ — сопрягающее звено циклов азота, серы и железа. Датчики кислорода: [Fe–S], гем-Fe–NO, ДНКЖ.
схема предложена авторами статьи
Проблемы, гипотезы и перспективы
Основными проблемами при создании новых лекарственных препаратов являются наличие у них побочных токсичных эффектов и сложность синтеза. Первое — препятствие для применения препарата в медицинской практике, второе сильно повышает стоимость препарата, что ограничивает его массовое использование. Как любое биологически активное вещество, ДНКЖ может проявлять токсичное действие, но у препарата на основе ДНКЖ токсичное действие существенно ниже, чем у других доноров NO. Вспомним слова Парацельса: «Всё есть яд и всё есть лекарство. Доза делает лекарство ядом и яд лекарством». Только у препаратов на основе ДНКЖ диапазон доз, соответствующих биологической активности (0,4 мг/кг веса), сильно удален от диапазона доз, при которых проявляется токсическое действие (4,6 мг/кг веса).
Алгоритм синтеза ДНКЖ с глутатионом очень прост. Получить комплексы может практически любой исследователь, даже не сильно подкованный в химии, смешав в нужных пропорциях и в нужной последовательности в дистиллированной воде глутатион, соль двухвалентного железа и нитрит натрия.
Главная проблема в использовании данных комплексов — это их низкая стабильность. В растворе при комнатной температуре ДНКЖ с глутатионом распадаются в течение 2–3 ч. В замороженном состоянии процесс распада идет медленнее. Например, у себя в лаборатории мы храним синтезированные препараты ДНКЖ при температуре −70 °С. Промышленный препарат «Оксаком», о котором речь шла в предыдущем разделе, представляет собой порошок (лиофильно высушенный раствор ДНКЖ), запаянный в ампулы. В таком виде препарат может храниться долго. Казалось бы, проблема решена. Однако в такой форме препарат не удобен для использования, содержимое ампулы нужно растворить в воде и сделать укол. Куда проще принять таблетку! Остается проблема создания мягких лекарственных форм — мазей, кремов, гелей, которые предназначены для местного применения. Ведь одно из побочных действий ДНКЖ, как, впрочем, и других экзогенных доноров оксида азота, связано с системным действием NO, выделяющегося в кровоток при распаде комплексов. ДНКЖ в виде мази расширили бы спектр применения этого препарата. Например, можно было бы нанести мазь на область ожога, ну или на какое-нибудь другое место. Такую мазь можно было бы использовать в качестве средства для повышения эректильной функции [18]. ДНКЖ могли бы составить конкуренцию дорогой «Виагре». Возможно, проблема будет решена с помощью использования более стабильной биядерной формы ДНКЖ. Но пока это только идеи, область для проявления исследовательских способностей!
На пути использования ДНКЖ есть еще один камень преткновения. Существуют опасения, что железо, легко высвобождающееся из этих нестабильных комплексов, может запускать реакцию Фентона. Мы попытались разрешить эти сомнения в разделе «Что могут ДНКЖ». Еще раз отметим, что токсичным вещество делает доза. ДНКЖ настолько эффективное соединение, что заметного результата можно достичь при очень низких дозах. В таких количествах комплексы не токсичны.
Настоящую статью мы посвятили наиболее изученным ДНКЖ с глутатионом. Хотя в формировании ДНКЖ могут участвовать и другие природные вещества. Мы синтезировали ДНКЖ с дипептидом карнозином [19]. Поскольку сам по себе карнозин используется как биологически активная добавка, ДНКЖ с карнозином можно рассматривать как новый класс фармакологических препаратов с комплексным терапевтическим действием. Получен еще один интересный тип комплексов с липоевой кислотой. Благодаря жирорастворимым свойствам липоевой кислоты, такие ДНКЖ могут проходить через липидную мембрану внутрь клетки. Получены ДНКЖ, лигандами которых являются продукты взаимодействия цистеина и лизина с метилглиоксалем [16]. Такие ДНКЖ в плазме крови функционируют как доноры FeNO группы. Эти новые типы ДНКЖ сейчас исследуют в нашей лаборатории (ФИЦ биотехнологии РАН) и в лабораториях Российского кардиологического научно-производственного комплекса.
Может быть, у некоторых читателей возникнет вопрос, не являются ли ДНКЖ тем новым, что есть хорошо забытое старое. Существует ведь препарат нитроглицерин — дешевое, проверенное временем средство для снятия гипертонических приступов. Кстати, испытания ДНКЖ проводили именно в сравнении с ним. У препаратов ДНКЖ есть несколько свойств, выгодно отличающих его от старого доброго нитроглицерина.
- В отличие от нитроглицерина, ДНКЖ с глутатионом является природным соединением, образующимся в клетках и тканях организма. Данный комплекс легко интегрируется в метаболические пути.
- ДНКЖ действуют напрямую, высвобождая в кровоток NO или FeNO,в то время как нитроглицерин должен сначала восстановиться до глицерина и NO.
- Терапевтические дозы ДНКЖ существенно ниже доз нитропрепаратов.
- Как мы уже отмечали, специфика молекулярного действия ДНКЖ минимизирует выход свободного NO в раствор.
- Время действия ДНКЖ длительное, а нитроглицерин оказывает кратковременный сосудорасширяющий эффект.
Мы вовсе не предлагаем отказаться от нитроглицерина. У каждого препарата есть своя ниша использования. ДНКЖ эффективны при купировании гипертонических кризов, когда другие фармакологические препараты малоэффективны или вовсе бессильны.
Мы описали историю одного открытия, в конце которой не решаемся поставить точку. Каждый из нас, соавторов этой статьи, в той или иной степени причастен к изучению ДНКЖ. Мы искреннее верим в благополучный исход нашего дела. Надеемся, препарат «Оксаком» преодолеет все сложности клинических испытаний и появится на аптечных полках.
Совторы статьи
Космачевская Ольга Владимировна, кандидат биологических наук, старший научный сотрудник ФИЦ биотехнологии РАН, Москва.
Шумаев Константин Борисович, доктор биологических наук, старший научный сотрудник ФИЦ биотехнологии РАН, Москва.
Тимошин Александр Анатольевич, доктор биологических наук, ведущий научный сотрудник Российского кардиологического научно-производственного комплекса, Москва.
Литература
- Шумаев К.Б., Космачевская О.В., Топунов А.Ф. (2008). Оксид азота – с гемоглобином и не только. Химия и жизнь. 4, 22–25;
- Ванин А.Ф. и Налбандян Р.М. (1965). Свободные радикалы нового типа в дрожжевых клетках. Биофизика. 10, 167–168;
- J. R. MALLARD, M. KENT. (1964). Differences observed between Electron Spin Resonance Signals from Surviving Tumour Tissues and from their Corresponding Normal Tissues. Nature. 204, 1192-1192;
- ANTONY J. VITHAYATHIL, JESSIE L. TERNBERG, BARRY COMMONER. (1965). Changes in Electron Spin Resonance Signals of Rat Liver During Chemical Carcinogenesis. Nature. 207, 1246-1249;
- Ванин А.Ф. Динитрозильные комплексы железа с тиолсодержащими лигнадами. М.-Ижевск: Институт компьютерных исследований, 2015. — 220 с.;
- Ding H. and Demple B. (2000). Direct nitric signal transduction via nitrosylation of iron-sulfur centers in the SoxR transcription activation. Proc. Natl. Acad. Sci. USA. 97, 5146–5150;
- Shumaev K.B., Kosmachevskaya O.V., Chumikina L.V., Topunov A.F. (2016). Dinitrosyl iron complexes and other physiological metabolites of nitric oxide: Multifarious role in plants. Natural Product Communications. 8, 1189–1192;
- Vladimir L. Lakomkin, Anatoly F. Vanin, Alexander A. Timoshin, Valery I. Kapelko, Evgeny I. Chazov. (2007). Long-lasting hypotensive action of stable preparations of dinitrosyl-iron complexes with thiol-containing ligands in conscious normotensive and hypertensive rats. Nitric Oxide. 16, 413-418;
- Чазов Е.И., Родненков О.В., Зорин А.В., Лакомкин В.Л., Грамович В.В., Выборов О.Н. и др. (2011). Испытание гипотензивного действия препарата оксаком, содержащего динитрозильный комплекс железа с глутатионом, на здоровых добровольцах. Кардиология. 11, 28–37;
- Ванин А.Ф., Островская Л.А., Корман Д.Б., Кубрина Л.Н., Бородулин Р.Р., Фомина М.М. и др. (2015). Противоопухолевая активность препаратов динитрозильного комплекса железа с глутатионом и S-нитрозоглутатиона: сравнительное изучение. Биофизика. 6, 1157–1165;
- Konstantin B. Shumaev, Andrey A. Gubkin, Vladimir A. Serezhenkov, Irina I. Lobysheva, Olga V. Kosmachevskaya, et. al.. (2008). Interaction of reactive oxygen and nitrogen species with albumin- and methemoglobin-bound dinitrosyl-iron complexes. Nitric Oxide. 18, 37-46;
- Шумаев К.Б, Петрова Н.Э., Заббарова И.В., Ванин А.Ф., Топунов А.Ф., Ланкин В.З., Рууге Э.К. (2004). Взаимодействие оксоферрилмиоглобина и динитрозильных комплексов железа. Биохимия. 5, 699–705;
- Shumaev K.B., Kosmachevskaya O.V., Timoshin A.A., Vanin A.F., Topunov A.F. (2008). Globins and other nitric oxide-reactive proteins. Dinitrosyl iron complexes bound with haemoglobin as markers of oxidative stress. Methods in Enzymology. 436, 445-461;
- Nunziata Maio, Tracey A. Rouault. (2015). Iron –sulfur cluster biogenesis in mammalian cells: New insights into the molecular mechanisms of cluster delivery. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1853, 1493-1512;
- Космачевская О.В. (2012). Вездесущая реакция Майара. Химия и жизнь. 2, 23–27;
- K. B. Shumaev, S. A. Gubkina, A. F. Vanin, D. Sh. Burbaev, V. P. Mokh, et. al.. (2013). Formation of a new type of dinitrosyl iron complexes bound to cysteine modified with methylglyoxal. BIOPHYSICS. 58, 172-177;
- Zhonghe Wang, Jun Wang, Shoujun Guo, Xiaoli Xue, Shujuan Yu. (2013). Iron-Chelating Properties of Melanoidins and Inducing Effect of Pulsed Electric Field. J Food Process Eng. 36, 786-792;
- Alexander А. Andreyev-Andriyevsky, Vasak D. Mikoyan, Vladimir А. Serezhenkov, Anatoly F. Vanin. (2011). Penile erectile activity of dinitrosyl iron complexes with thiol-containing ligands. Nitric Oxide. 24, 217-223;
- Konstantin B. Shumaev, Olga V. Kosmachevskaya, Elvira I. Nasybullina, Sergey V. Gromov, Alexander A. Novikov, Alexey F. Topunov. (2017). New dinitrosyl iron complexes bound with physiologically active dipeptide carnosine. J Biol Inorg Chem. 22, 153-160.