Дисфункция аутофагических путей в нейронах и ее значение для прогрессирования болезни Альцгеймера
18 марта 2025
Дисфункция аутофагических путей в нейронах и ее значение для прогрессирования болезни Альцгеймера
- 293
- 0
- 5
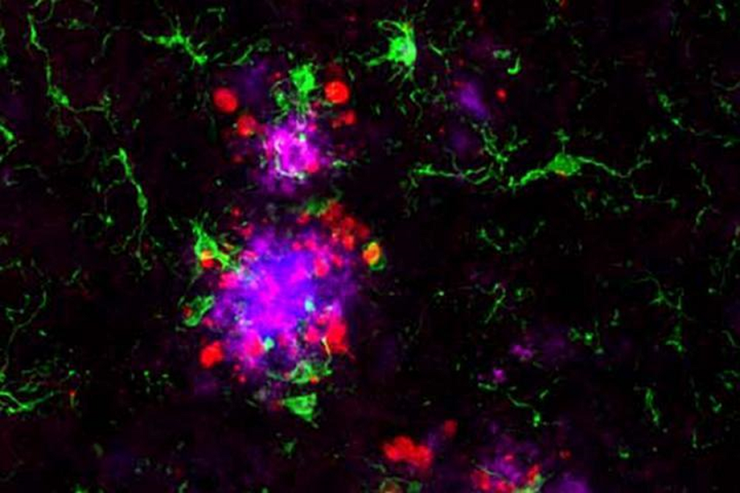
Амилоидный белок (пурпурный) виден в амилоидных бляшках (синий), окруженных иммунными клетками микроглии (зеленый) и белком тау (красный). Исследователи из Медицинской школы Вашингтонского университета в Сент-Луисе обнаружили, что нестабильная микроглия может быть связующим звеном между амилоидом и тау — двумя разрушительными белками болезни Альцгеймера. Полученные данные могут привести к новому подходу к разработке терапии болезни Альцгеймера.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Эта статья посвящена старению мозга и причинам развития таких заболеваний, как болезнь Альцгеймера. Это недуг, который затрагивает не только пожилых людей, но и тех, кто находится в самом расцвете сил. Я расскажу про молекулярные механизмы, лежащие в основе болезни: накопление токсичных белков, нарушение клеточных процессов и воспаление в мозге. Все это приводит к когнитивным расстройствам и потере памяти, которые сильно влияют на качество жизни.
Также я затрону новые методы диагностики, такие как ПЭТ-сканирование и исследование новых терапевтических подходов, направленных на стимуляцию аутофагии и замедления прогрессирования болезни. Они позволяют заглянуть в мозг и понять, что происходит на ранних стадиях болезни.
Но нельзя забывать о тревожной статистике. Болезнь Альцгеймера — это не только медицинская, но и социально-экономическая проблема. Заболеваемость и смертность растут, а уход за больными деменцией становится огромной нагрузкой для их близких. Это затрагивает миллионы семей по всему миру.
Я верю, что разработка эффективных методов лечения может изменить ситуацию. Мы сможем значительно улучшить качество жизни пациентов и облегчить бремя, которое ложится на их родных и близких. Эта статья — мой маленький вклад в понимание и осознание проблемы, которая требует внимания каждого из нас.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Каждый человек хоть раз в жизни задумывался о приближающейся старости. С годами мы замечаем, как седеют волосы наших родителей, как сильнее проступают морщины на лице наших бабушек и дедушек, как меняемся и мы с вами.
Но сегодня я не буду говорить о классическом понимании старения, а предлагаю вам погрузиться в таинственную и от этого более интересную тему — «старение» нашего мозга и почему же так происходит.
Говоря о сохранении здоровья организма, мы часто беспокоимся о таких органах, как сердце, почки, печень или легкие, которые первыми приходят на ум. Однако мозг — главный управляющий всех процессов — нередко остается вне внимания. Мы обращаемся к молодому поколению с советами: «Не курите, правильно питайтесь, занимайтесь спортом», и, хотя эти рекомендации тоже важны для здоровья мозга, есть и другие специфические действия, которые следует предпринимать для его поддержания.
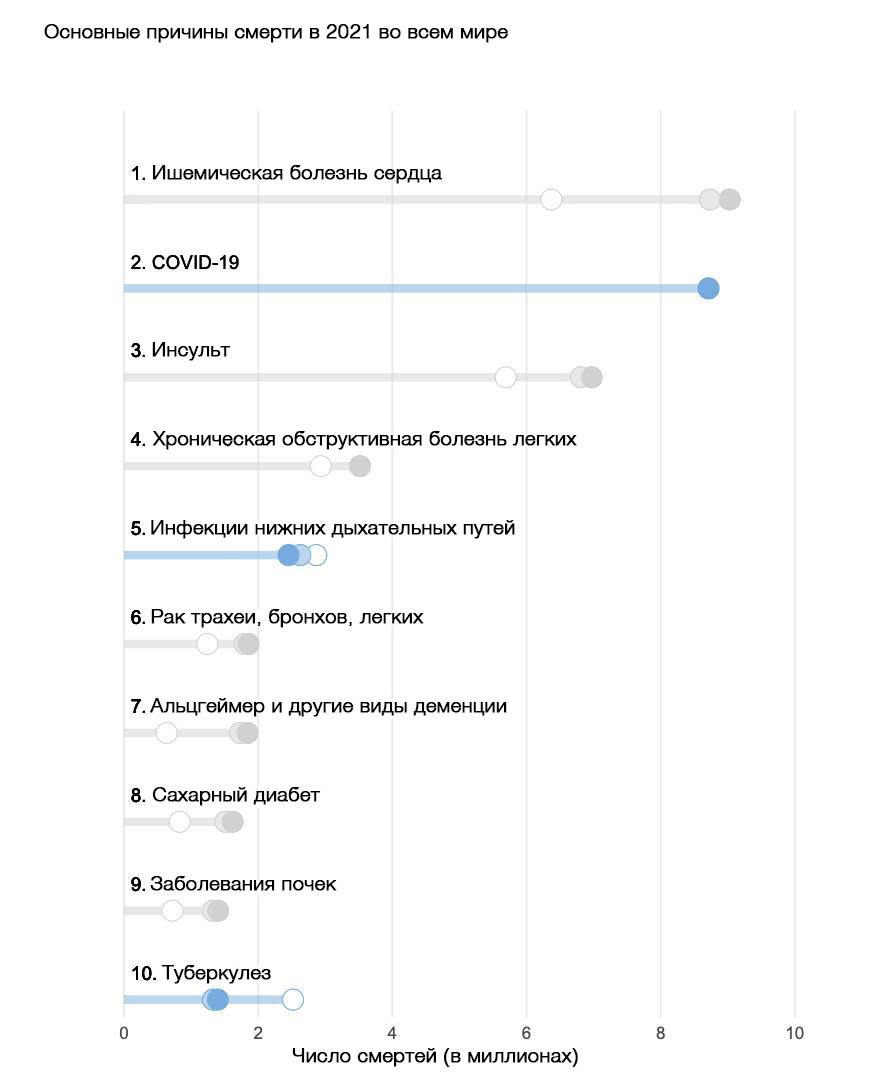
Согласно статистическим данным за 2021 год, дегенеративные заболевания, включая болезнь Альцгеймера (БА), занимают седьмое место среди основных причин смертности в мире.
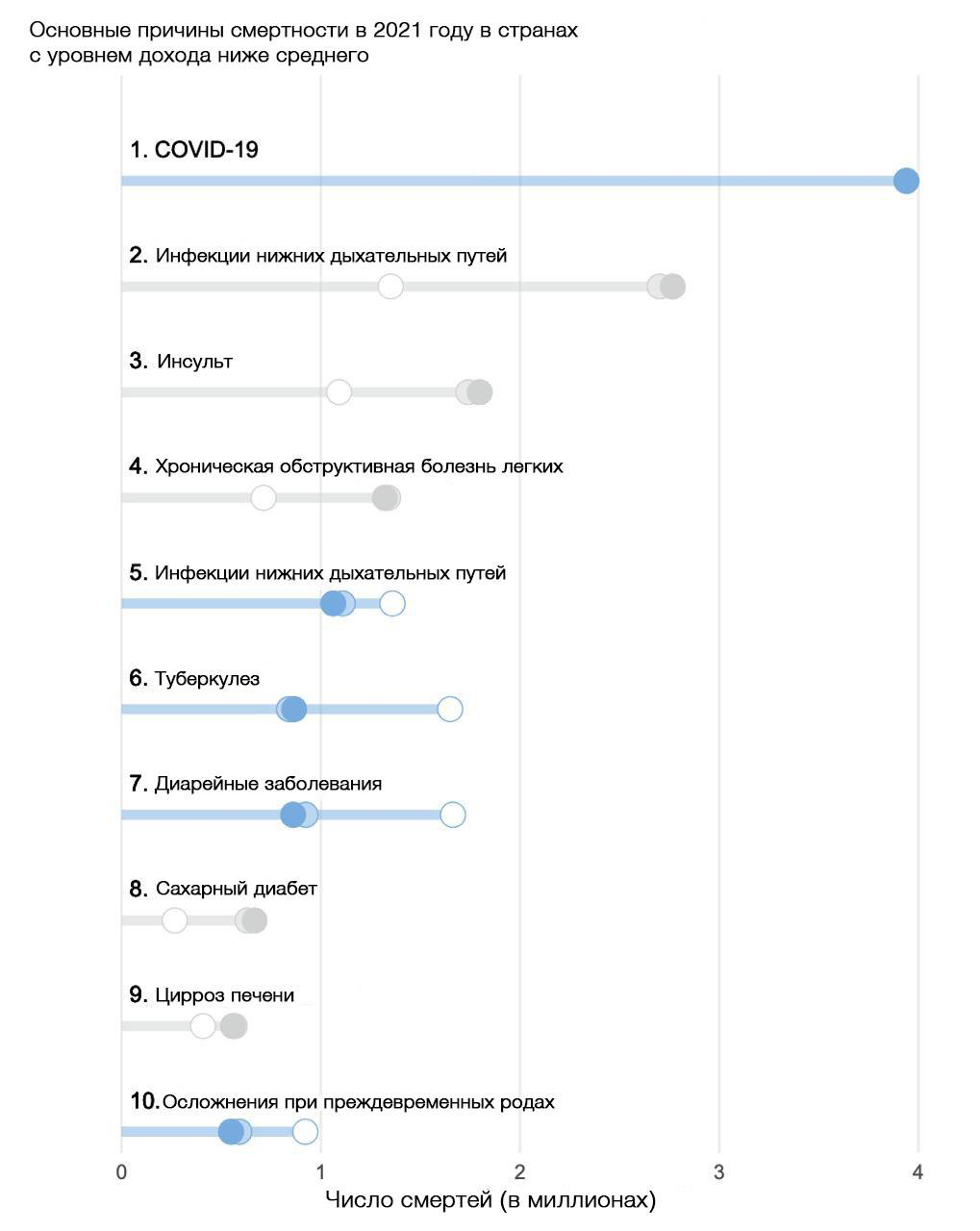
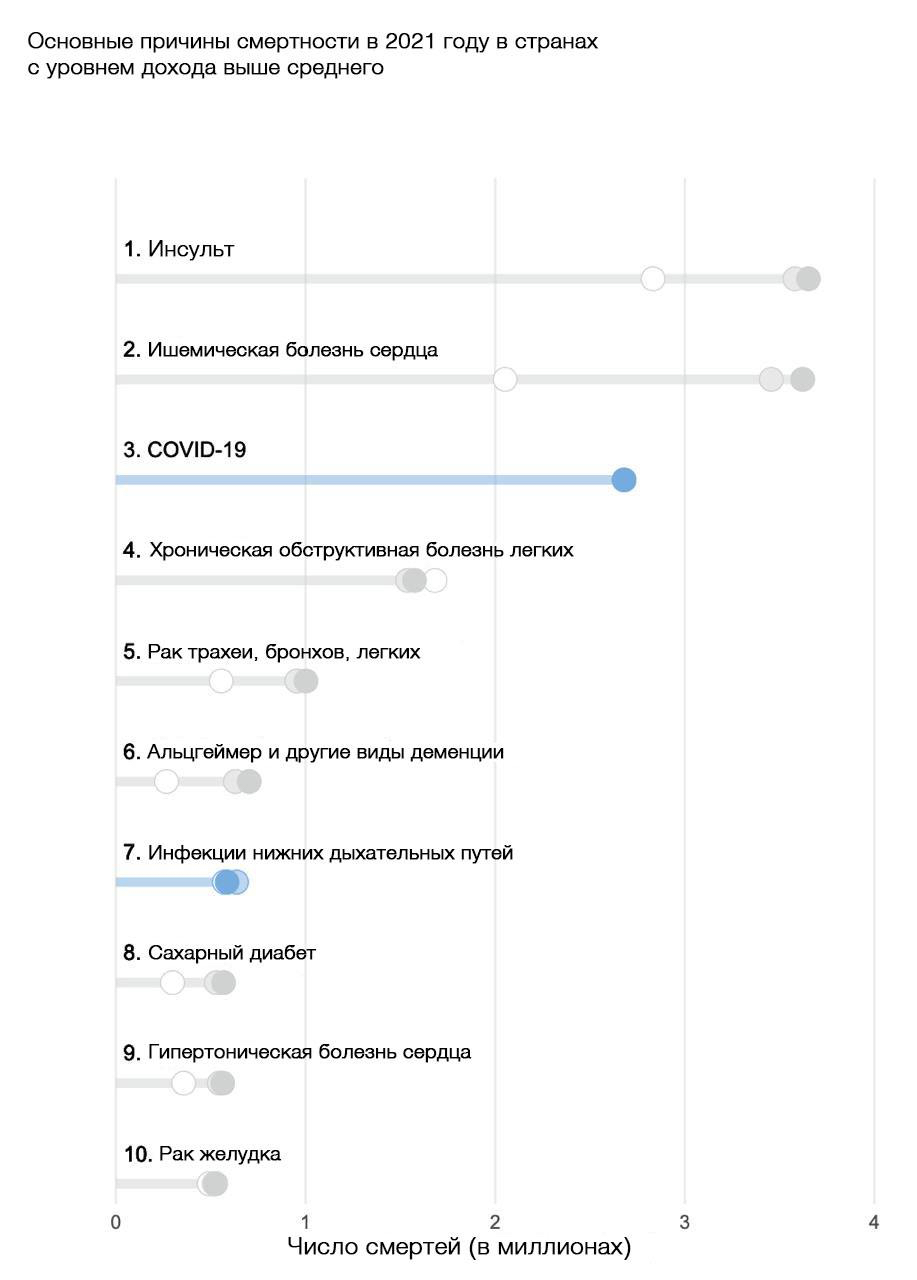
Интересно, что болезнь Альцгеймера и другие формы деменции входят в десятку ведущих причин смертности преимущественно в странах с высоким и средним уровнем дохода. В регионах с низким доходом более распространены такие заболевания, как хроническая обструктивная болезнь легких, туберкулез, цирроз печени, осложнения преждевременных родов и диабет, тогда как деменция отсутствует среди основных причин смертности. Это связано с тем, что средняя продолжительность жизни в этих регионах значительно ниже. Таким образом, люди часто не доживают до возраста, в котором развивается болезнь Альцгеймера.
«Какие молекулярные и клеточные процессы вызывают развитие болезни Альцгеймера? Как с этим связана аутофагия, и какие современные методы исследования помогают ученым разобраться в ее механизмах, чтобы найти способы лечения?»
В этой статье я постараюсь ответить на эти и другие вопросы, которые волнуют миллионы людей по всему миру, касающиеся одной из самых актуальных и тревожных проблем современной медицины.
Каждый день начинается с чистого листа
«Болезнь Альцгеймера — это долгая, печальная прощальная речь» — так выразилась Нэнси Рейган, супруга президента США Рональда Рейгана, страдавшего этим заболеванием. Ее слова показывают психологическую боль, с которой сталкиваются семьи пациентов, наблюдая, как их близкие постепенно теряют память, личность и способность к самостоятельной жизни.
Болезнь Альцгеймера — это хроническое нейродегенеративное заболевание головного мозга, которое характеризуется накоплением токсичных белковых агрегатов, таких как β-амилоид (Aβ) и аномально фосфорилированный белок Тау. Эти процессы приводят к повреждению синапсов, гибели нейронов и хроническому нейровоспалению. Это заболевание является самой распространенной формой деменции у пожилых людей. Симптомы включают в себя прогрессирующее ухудшение когнитивных способностей, таких как память, рассуждения и способность к аналитическому мышлению, а также утрату поведенческих навыков. Постепенно эти нарушения становятся настолько выраженными, что они значительно осложняют повседневную жизнь пациента, требуя постоянного ухода. Подробнее о патогенезе болезни Альцгеймера можно прочесть на «Биомолекуле» в статье «Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен» [1].
Деменция же не самостоятельная болезнь, а всего лишь синдром, который является результатом различных заболеваний. К таким можно отнести инсульты, нейродегенеративные заболевания, черепно-мозговые травмы, опухоли центральной нервной системы, нейроинфекции (в том числе ВИЧ в стадии СПИДа) и другие.
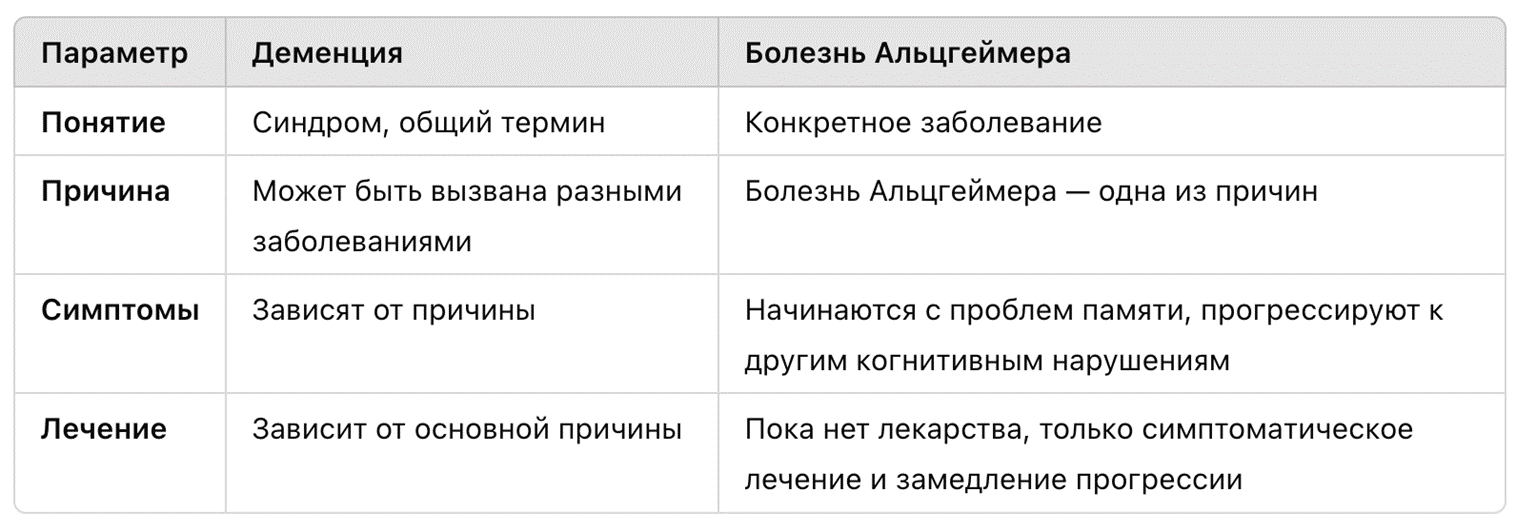
Рисунок 2. Различия между деменцией и БА.
рисунок автора
Только ли пожилым людям стоит бояться БА и кого это может коснуться
Долгое время деменцию рассматривали как проблему, связанную исключительно с пожилым возрастом. Однако в последние годы всё больше фиксируется случаев раннего начала болезни у молодых людей. Около 5% всех случаев болезни Альцгеймера относятся к ее ранней форме, которая обычно развивается у пациентов в возрасте 30–50 лет. Ее развитие связано с мутациями в генах APP, PSEN1 или PSEN2, вызывающими накопление токсичных белков в мозге, что приводит к гибели нейронов и разрушению тканей. Пациенты с такими мутациями страдают семейной формой болезни Альцгеймера (FAD), затрагивающей обычно нескольких членов семьи.
Лобно-височная деменция (ЛВД), составляя около 10% всех случаев деменции, представляет собой редкое нейродегенеративное расстройство, поражающее преимущественно лобные и височные доли мозга. Эти зоны отвечают за когнитивные функции, такие как эмоции, мотивация, речь и решение сложных задач. Поэтому ранние симптомы ЛВД включают изменения личности и поведения, а не ухудшение памяти, как при болезни Альцгеймера. Заболевание чаще всего поражает людей в возрасте 40–50 лет, также выделяясь среди других форм деменции.
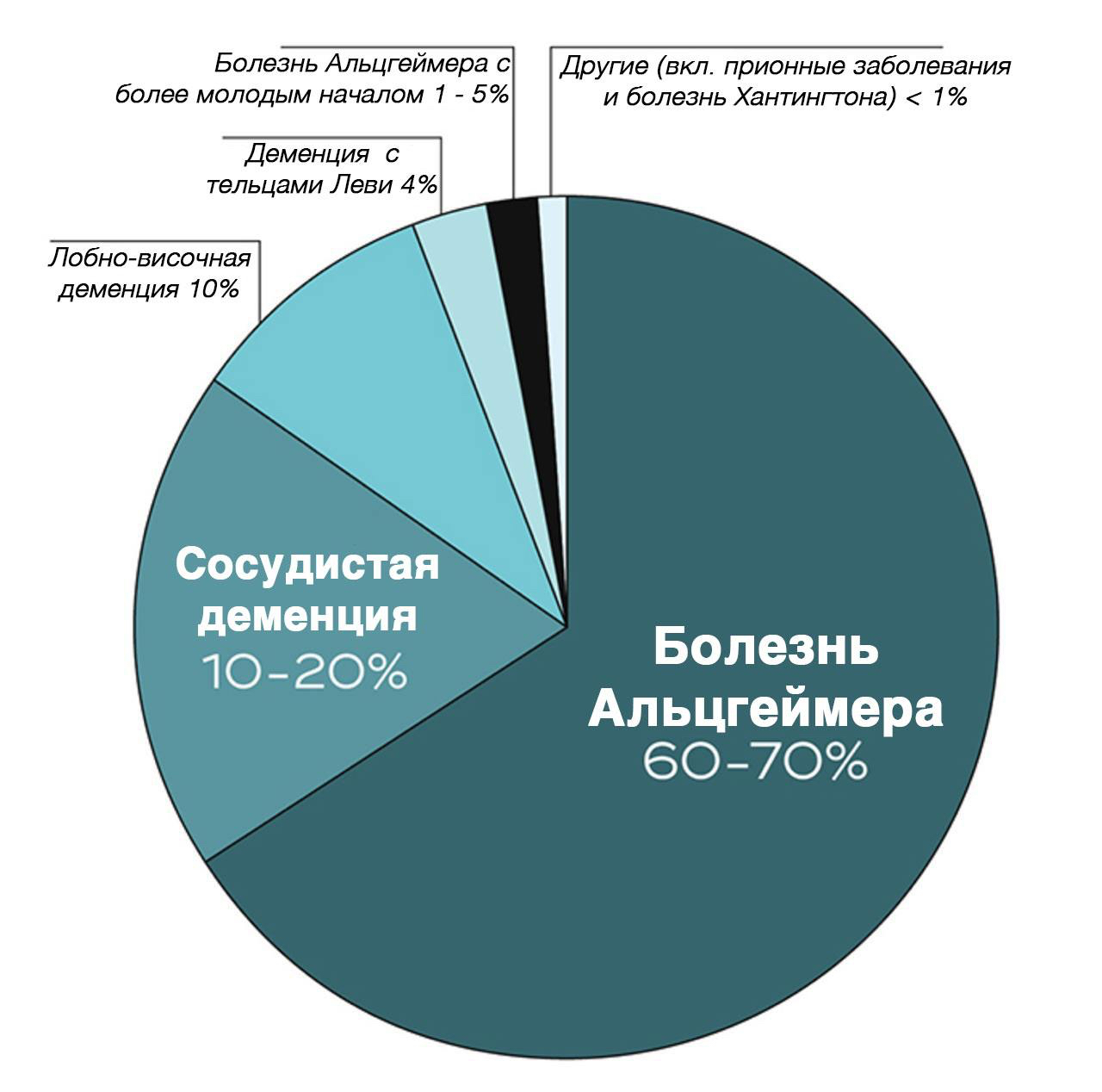
Рисунок 3. Типы деменции.
Погружаясь в мир клеток и нейронов
Одной из причин развития болезни Альцгеймера является нарушение механизмов аутофагии, которые играют ключевую роль в поддержании клеточного гомеостаза. Аутофагия — это процесс, при котором клетка очищает себя от поврежденных компонентов, включая белковые агрегаты и поврежденные органеллы [2]. Этот процесс не только предотвращает накопление токсичных молекул, таких как амилоид-бета (Aβ) и аномально фосфорилированный тау-белок (tau), но и помогает поддерживать внутреннюю стабильность клетки [3]. Однако при болезни Альцгеймера аутофагия нарушается, что ведет к накоплению этих молекул в клетках и усиливает повреждения нейронов. Аномальное накопление амилоида может начинаться еще за десятилетия до появления симптомов заболевания. Таким образом, отследить болезнь очень тяжело. Забыв один раз ключи от дома, мы не подумаем, что проблема в нашем мозге. Однако, если это повторяется и прогрессирует, стоит обратиться к врачу для диагностики.
Важная роль микроглии
Микроглия — иммунные клетки центральной нервной системы — играет критически важную роль в центральной нервной системе, выполняя несколько ключевых функций, которые поддерживают здоровье мозга [4]. Она служит первичной линией защиты мозга от патогенов и повреждений, выполняя функцию иммунного надзора, фагоцитоза и регуляции нейротрофической активности. В нормальных условиях микроглия помогает поддерживать баланс клеток и нейротрансмиттеров, а также способствует нейропластичности, то есть способности нейронов восстанавливаться и адаптироваться [5]. Подробнее про роль микроглии можно прочесть на «Биомолекуле» в статье «Микроглия: роль „иммунных“ клеток центральной нервной системы в здоровом мозге и при нейродегенеративных заболеваниях» [6].
Однако, как мы видим, на фоне болезни Альцгеймера роль микроглии становится более сложной. Когда начинают накапливаться токсичные молекулы, такие как амилоид-бета (Aβ) и аномально фосфорилированный тау-белок, микроглия активируется [7]. Это приводит к усиленной активности фагоцитарных процессов, в попытке удалить эти патологические молекулы. Однако чрезмерная или неправильная активация микроглии может привести к хроническому нейровоспалению, которое, в свою очередь, может усугубить повреждения нейронов и ускорить прогрессирование заболевания [8].
Микроглия и ее взаимодействие с нарушенной аутофагией
Кроме того, важно отметить, что нарушение аутофагии также влияет на эффективность работы микроглии. Если аутофагия нарушена, то микроглия не в состоянии эффективно справляться с накоплением амилоид-бета и других токсичных молекул, что только усугубляет воспалительные процессы и ускоряет развитие болезни. Вместо того, чтобы обеспечивать разрушение и удаление этих молекул, микроглия может содействовать их накоплению, что ведет к ухудшению мозговой функции. Это особенно важно, поскольку микроглия при нарушении аутофагии начинает не просто очищать, а может способствовать накоплению токсичных молекул, что усиливает воспаление и нейрональные повреждения.
Таким образом, микроглия не только служит защитником мозга, но и может стать катализатором патологических процессов, если её механизмы взаимодействия с аутофагией нарушаются. Этот двойственный процесс делает ее участником как защиты, так и ускоренного развития болезни Альцгеймера.
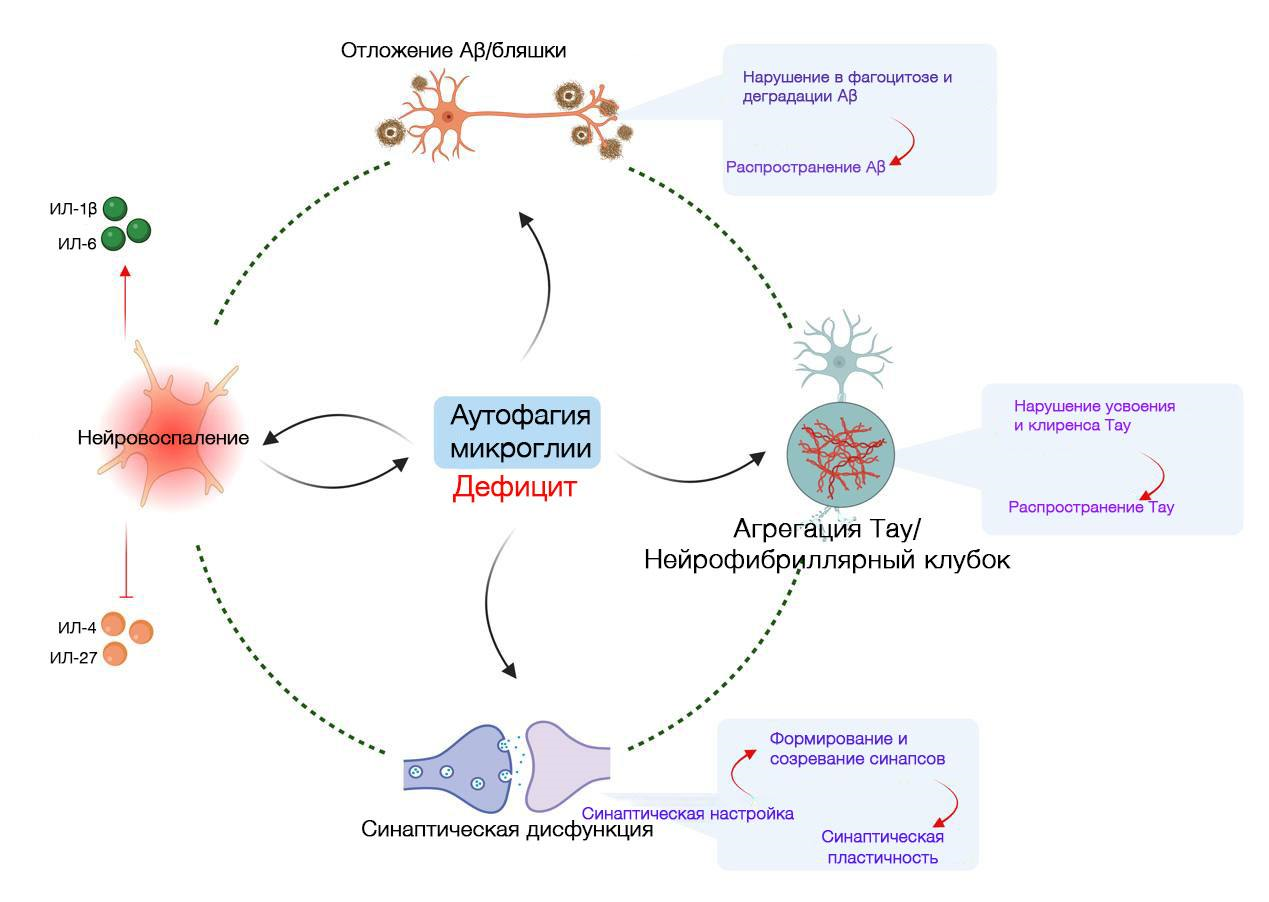
Рисунок 4. Взаимосвязь между микроглиальной аутофагией и патогенезом БА. Нарушенная микроглиальная аутофагия вносит свой вклад в различные аспекты патогенеза БА, включая нейровоспаление, отложение Aβ в бляшках, агрегацию Тау/НФТ и синаптическую дисфункцию. Существует взаимосвязь между микроглиальной аутофагией и нейровоспалением при БА. Дефект микроглиальной аутофагии приводит к накоплению патологических агрегатов белков, ассоциированных с БА (Aβ и Tau), в результате нарушения фагоцитоза и деградации Aβ, распространения Aβ, нарушения поглощения и клиренса Tau, а также распространения Tau. Наконец, микроглиальная аутофагия играет решающую роль в модуляции синаптической обрезки и синаптической пластичности при БА.
Процессы аутофагии
Важнейшим элементом в работе микроглии является аутофагия, которая регулирует ее способность справляться с накоплением токсичных молекул. Однако, как мы видели, нарушение этого процесса может привести к ухудшению работы микроглии и, следовательно, к усугублению нейродегенеративных изменений. Аутофагия играет ключевую роль в деградации амилоид-бета (Aβ) и тау-белков, молекул, которые при накоплении становятся токсичными для нейронов. Когда аутофагия функционирует должным образом, она помогает очищать клетку от этих поврежденных молекул, поддерживая нейрональную стабильность и предотвращая развитие нейродегенеративных заболеваний.
Этот процесс приводит к образованию нового подтипа микроглии, ассоциированного с болезнью Альцгеймера (DAM, Disease-Associated Microglia) [9], который активно участвует в очищении мозга от патологических белков. Однако нарушение аутофагии в микроглии может лишь усугубить процесс. Эксперименты с животными моделями показали, что при дефиците аутофагии в микроглии (например, при нокауте гена Atg7) наблюдается снижение способности к фагоцитозу Aβ, что ведет к его накоплению и ухудшению нейронной функции [10].
Кроме того, микроглиальная аутофагия регулирует распространение патологического тау-белка, и ее дефект может способствовать его прогрессированию. Эти молекулы регуляции аутофагии не только контролируют ее запуск в клетках, но и играют важную роль в ответе микроглии на клеточный стресс, такой как накопление амилоидных бета-белков и тау, что важно для прогрессирования болезни Альцгеймера. Молекулярные механизмы аутофагии в клетках регулируются сложной сетью сигнальных путей. Один из главных регуляторов — это комплекс mTORC1 (мишень рапамицина млекопитающих 1), который ингибирует процесс аутофагии. Когда аутофагия не нужна, mTORC1 предотвращает ее запуск. В ответ на клеточный стресс, например, повреждения или нарушение гомеостаза, активируется AMPK (аденозинмонофосфат-активируемая протеинкиназа), который, наоборот, стимулирует аутофагию.
Эти два пути взаимодействуют с ULK1 — киназой, которая инициирует сам процесс аутофагии. Также p38 MAPK (p38 митоген-активируемая протеинкиназа) регулирует как аутофагию, так и воспалительные реакции в клетках микроглии, что подчеркивает важность координации этих процессов для нормальной работы клеток, особенно при нейродегенеративных заболеваниях [11].
Роль рецептора TREM2 в патогенезе болезни Альцгеймера
Особое внимание стоит уделить рецептору TREM2 (триггерный рецептор, экспрессируемый на миелоидных клетках 2), который играет важную роль в патогенезе болезни Альцгеймера. Этот рецептор экспрессируется на микроглии — клетках иммунной системы мозга, и активирует аутофагию [12]. TREM2 взаимодействует с белком DAP12, который запускает сигнальный путь PI3K-Akt-mTOR. Этот путь активирует mTORC1, что, в свою очередь, может подавить аутофагию. Это подчеркивает двойственную роль микроглии: с одной стороны, она может очищать мозг от токсичных молекул, а с другой — дефекты в ее аутофагической функции могут усугублять прогрессирование заболевания. Дополнительно следует отметить, что мутации в TREM2 связаны с повышенным риском развития болезни Альцгеймера, что подтверждает его критическую роль в патогенезе заболевания.
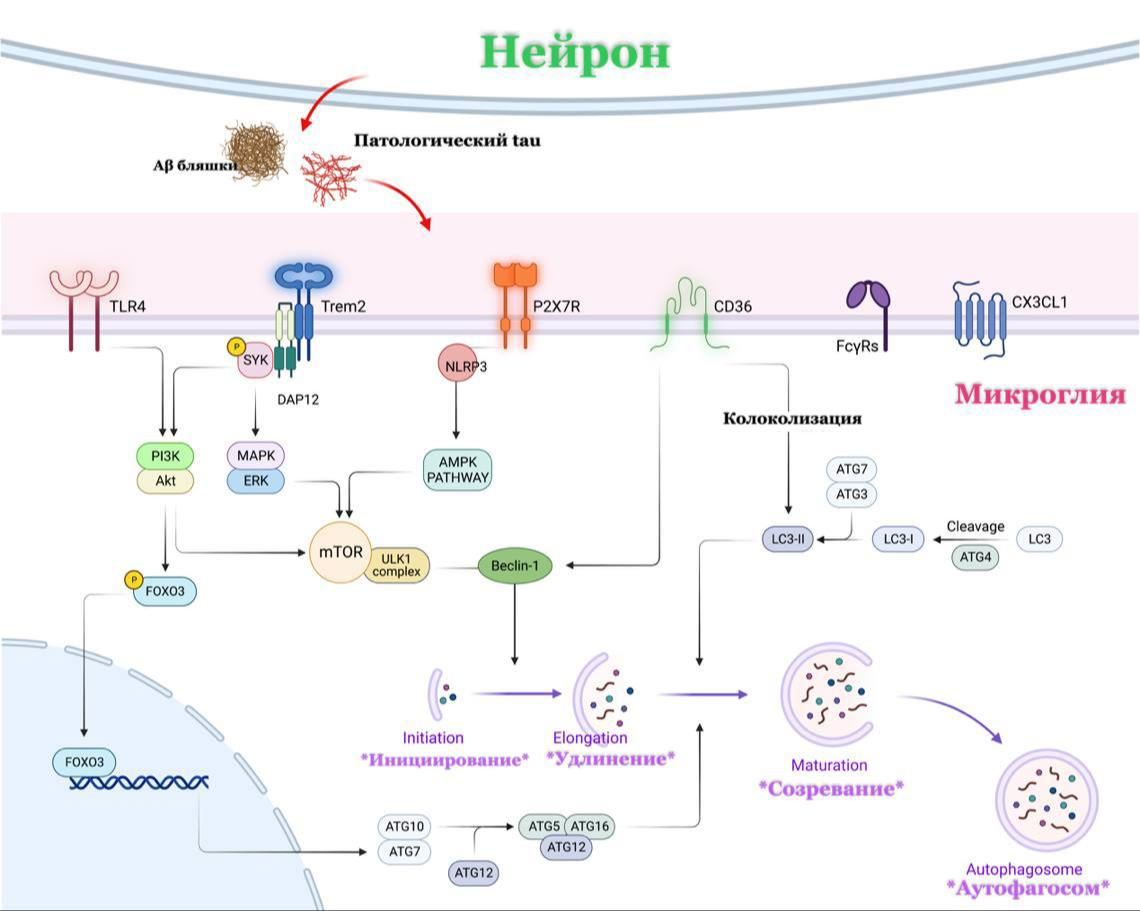
Рисунок 5. Модель аутофагии, опосредованной микроглиальными рецепторами. На аутофагию влияют несколько рецепторов микроглии, связанных с АД, в частности, TLR4, TREM2, P2X7R и CD36. Активация TLR4 снижает аутофагический поток и экспрессию генов Atg в микроглии за счет ингибирования PI3K-Akt и нижележащих путей FOXO3 и mTOR. TREM2 связывает DAP12, после чего происходит рекрутирование SYK, приводящее к активации PI3K и MAPK, тем самым запуская mTOR-сигнализацию. P2X7R регулирует микроглиальную аутофагию через AMPK-mTOR-сигнализацию. CD36 колокализуется с мембранным белком аутофагосомы MAP1LC3/LC3 и влияет на функцию беклина-1, регулируя тем самым аутофагию.
Диагностика болезни Альцгеймера: ПЭТ и МРТ
Для диагностики болезни Альцгеймера существуют различные методы, включая нейропсихологическое тестирование, магнитно-резонансную томографию (МРТ) и ПЭТ-сканирование. В последнее время одним из самых эффективных способов раннего выявления заболевания стало позитронно-эмиссионное томографическое сканирование (ПЭТ). Особенно значимым является использование амилоидных маркеров в ПЭТ-сканировании, которое позволяет не только выявить наличие амилоидных бляшек в мозге, но и отслеживать прогрессирование болезни на ранних стадиях. Это помогает диагностировать болезнь на более ранней стадии, когда клинические симптомы еще не выражены, а также оценивать эффективность проводимой терапии. ПЭТ-сканирование с амилоидными маркерами демонстрирует высокую чувствительность в обнаружении амилоидных отложений, что делает его важным инструментом в клинической практике и исследованиях. Значительный прогресс в изучении болезни Альцгеймера был достигнут благодаря исследованиям с использованием технологий, таких как МРТ и ПЭТ-сканирование, которые позволяют точно отслеживать накопление амилоид-бета и других биомаркеров в мозге. Это помогает не только диагностировать заболевание на ранних стадиях, но и наблюдать за эффективностью различных терапевтических стратегий.
Перспективы терапии: рапамицин, сиртуины и метформин
Совсем недавно активно начали исследоваться молекулы, способные модулировать аутофагию и улучшать иммунные реакции мозга, открывая перспективы для разработки новых терапевтических стратегий в борьбе с болезнью Альцгеймера. Одним из таких препаратов является рапамицин, который, подавляя mTORC1, активирует аутофагию и помогает замедлить развитие болезни. В одном из клинических исследований II фазы, проводимых в Университете Техаса, оценивается безопасность и эффективность рапамицина у пациентов с легкими когнитивными нарушениями и ранней стадией болезни Альцгеймера. Это исследование включает в себя анализ когнитивных функций, структуры мозга с использованием МРТ и ПЭТ-сканирования, а также следит за метаболизмом пациента в течение одного года. Ранние результаты показывают обнадеживающие перспективы, подтверждая, что рапамицин может замедлить прогрессирование заболевания, но требует дальнейших исследований. Другим перспективным направлением является использование сиртуина 1 (SIRT1), белка, регулирующего метаболизм и аутофагию, что может помочь в борьбе с нейродегенеративными заболеваниями [13]. Существуют данные, что некоторые молекулы, активирующие SIRT1, могут оказывать положительное влияние на аутофагию, что делает их перспективными для терапии болезни Альцгеймера [14]. Также метформин, широко известный как препарат для лечения диабета, продемонстрировал свой потенциал в модуляции аутофагии, что открывает новые возможности для разработки терапевтических средств для пациентов с болезнью Альцгеймера [15]. Однако его роль в лечении или профилактике заболевания требует дополнительных клинических испытаний, чтобы подтвердить его эффективность. В Вашингтонском университете активно проводятся исследования, направленные на разработку новых терапевтических подходов для лечения болезни Альцгеймера, в том числе на основе инновационных технологий, таких как ПЭТ-сканирование с амилоидными маркерами и улучшение аутофагии. Недавние исследования выявили новые пути для стимуляции аутофагии и оптимизации иммунных реакций мозга. В частности, ученые университета активно исследуют роль микроглии и ее аутофагической активности при нейродегенеративных заболеваниях, что открывает перспективы для разработки новых молекул, способных модулировать эти процессы. В сотрудничестве с фармацевтическими компаниями, университет также разрабатывает препараты, направленные на уменьшение накопления амилоидных бляшек и улучшение нейрональной функции. Эти усилия демонстрируют значительный прогресс в области исследований болезни Альцгеймера и открывают новые возможности для эффективной терапии и ранней диагностики, что может существенно повлиять на лечение и профилактику этого разрушительного заболевания.
Немного сухих подсчетов
В 2010 году в мире насчитывалось 35,6 миллионов человек с деменцией, а к 2050 году это число может достигнуть 115,4 миллионов, удваиваясь каждые 20 лет [16]. По оценкам, в 2010 году Россия с населением около 145 миллионов человек вошла в число девяти стран с наибольшим количеством людей с деменцией [17]. Около 12% ее населения старше 65 лет, что делает эту группу особенно уязвимой.
Рост случаев деменции связан со старением населения. Кроме того, 22,3% случаев объясняются модифицируемыми факторами риска, такими как гипертония, ожирение и низкая физическая активность [18].
Если взглянуть на глобальные цифры сейчас, более 55 миллионов человек по всему миру страдают различными формами деменции, и около 60–70 % из них имеют именно болезнь Альцгеймера [19]. Этот факт демонстрирует масштабы проблемы. И что примечательно, если в последние десятилетия смертность от заболеваний, таких как инсульт, болезни сердца и ВИЧ, снизилась, то число смертей от болезни Альцгеймера увеличилось более чем на 140%. Такая тенденция подчеркивает острую необходимость в решении этой проблемы [20].
В 2023 году уход за больными Альцгеймером и деменцией стал настоящим испытанием для многих семей: около 11 миллионов человек посвятили 18,4 миллиарда часов заботе о своих близких. Экономическая стоимость такой заботы оценивается в 346,6 миллиарда долларов — сумма, которая делает эту проблему важной не только с медицинской, но и с экономической точки зрения. При этом, несмотря на рост числа часов ухода, общее количество ухаживающих сократилось, что означает, что нагрузка на каждого из оставшихся ухаживающих значительно возросла. Эти данные подтверждают необходимость разработки эффективных методов лечения и поддержки, которые помогли бы как пациентам, так и их семьям.
Женщины и болезнь Альцгеймера: почему они болеют чаще?
Болезнь Альцгеймера гораздо чаще поражает женщин, чем мужчин, и за этим стоит несколько интересных факторов. Прежде всего, стоит учесть, что женщины в целом живут дольше мужчин, и болезнь Альцгеймера развивается в основном в пожилом возрасте. Однако, несмотря на это, разница в числе заболевших всё же гораздо больше, чем просто продолжительность жизни.
Одной из ключевых причин является влияние гормонов. После менопаузы, когда уровень эстрогена значительно снижается, женщины теряют гормональную защиту, которая помогает поддерживать нейронную функцию. Эстроген играет роль в поддержании нейропластичности мозга, и его дефицит может ускорить развитие болезней, таких как Альцгеймер. Интересно, что женщины, которые переживают раннюю менопаузу, имеют более высокий риск заболевания.
Кроме того, генетика также может играть свою роль. Одним из важных факторов является аполипопротеин E (APOE) — ген, который ассоциируется с повышенным риском развития болезни Альцгеймера [21]. У женщин этот ген оказывает более выраженное влияние, и они более подвержены развитию болезни, даже если они имеют схожие генетические маркеры с мужчинами.
Эти особенности подчеркивают, насколько важны дальнейшие исследования, направленные на разработку более эффективных методов профилактики и лечения, которые будут учитывать половые различия в развитии болезни.
Сможем ли мы получить волшебную таблетку?
Наука уже сегодня подбирается к тому, чтобы создать что-то, что можно назвать «волшебной таблеткой» для предотвращения и лечения болезни Альцгеймера. Аутофагия микроглии — сложный и элегантный процесс, регулирующий баланс между защитой мозга и его разрушением, — становится центральной точкой для таких разработок.
Микроглия, как «уборщик» мозга, избавляется от поврежденных клеток и белковых агрегатов. Но если она выходит из-под контроля, то запускает воспалительные процессы, которые, в свою очередь, повреждают нейроны. Аутофагия помогает микроглии поддерживать этот баланс, словно дирижер, задающий ритм клеточным процессам. Исследования показывают, что ее нарушение ускоряет прогрессирование болезни Альцгеймера, позволяя накапливаться токсичным белкам, таким как бета-амилоид и тау-протеины.
Однако наиболее вдохновляющее открытие — это то, что аутофагию можно модифицировать. Ученые работают над методами «перенастройки» этого механизма. Потенциально такие вмешательства позволят замедлить развитие когнитивных нарушений или даже полностью их предотвратить.
Итак, волшебная таблетка? Пока ее нет, но мы движемся к пониманию того, как ее создать. Это будет не просто лекарство, а инструмент для управления сложными процессами нашего мозга. Впереди еще много открытий, но ключ к ясному разуму в старости, кажется, всё ближе.
Литература
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Danielle Glick, Sandra Barth, Kay F. Macleod. (2010). Autophagy: cellular and molecular mechanisms. The Journal of Pathology. 221, 3-12;
- Yin Xu, Nicholas E. Propson, Shuqi Du, Wen Xiong, Hui Zheng. (2021). Autophagy deficiency modulates microglial lipid homeostasis and aggravates tau pathology and spreading. Proc. Natl. Acad. Sci. U.S.A.. 118;
- Alexandria B. Marciante, Arash Tadjalli, Maria Nikodemova, Kayla A. Burrowes, Jose Oberto, et. al.. (2024). Microglia regulate motor neuron plasticity via reciprocal fractalkine and adenosine signaling. Nat Commun. 15;
- C. Y. Daniel Lee, Gary E. Landreth. (2010). The role of microglia in amyloid clearance from the AD brain. J Neural Transm. 117, 949-960;
- Микроглия: роль «иммунных» клеток центральной нервной системы в здоровом мозге и при нейродегенеративных заболеваниях;
- Kanchan Bisht, Kaushik Sharma, Marie-Ève Tremblay. (2018). Chronic stress as a risk factor for Alzheimer's disease: Roles of microglia-mediated synaptic remodeling, inflammation, and oxidative stress. Neurobiology of Stress. 9, 9-21;
- Pei Ou-Yang, Zhi-Yu Cai, Zhong-Hao Zhang. (2023). Molecular Regulation Mechanism of Microglial Autophagy in the Pathology of Alzheimer's Disease. Aging and disease. 0;
- Chao Gao, Jingwen Jiang, Yuyan Tan, Shengdi Chen. (2023). Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets. Sig Transduct Target Ther. 8;
- Beth Levine, Guido Kroemer. (2019). Biological Functions of Autophagy Genes: A Disease Perspective. Cell. 176, 11-42;
- Yingli He, Hua She, Ting Zhang, Haidong Xu, Lihong Cheng, et. al.. (2018). p38 MAPK inhibits autophagy and promotes microglial inflammatory responses by phosphorylating ULK1. Journal of Cell Biology. 217, 315-328;
- Yaming Wang, Marina Cella, Kaitlin Mallinson, Jason D. Ulrich, Katherine L. Young, et. al.. (2015). TREM2 Lipid Sensing Sustains the Microglial Response in an Alzheimer’s Disease Model. Cell. 160, 1061-1071;
- Mehrane Mehramiz, Tenielle Porter, Eleanor K. O’Brien, Stephanie R. Rainey-Smith, Simon M. Laws. (2023). A Potential Role for Sirtuin-1 in Alzheimer’s Disease: Reviewing the Biological and Environmental Evidence. Journal of Alzheimer's Disease Reports. 7, 823-843;
- Ana Quintas, Alain J. de Solís, F. Javier Díez-Guerra, José M. Carrascosa, Elena Bogónez. (2012). Age-associated decrease of SIRT1 expression in rat hippocampus. Experimental Gerontology. 47, 198-201;
- M. Tahmi, José A. Luchsinger. (2023). Metformin in the Prevention of Alzheimer's Disease and Alzheimer's Disease Related Dementias. The Journal of Prevention of Alzheimer's Disease. 10, 706-717;
- Martin Prince, Renata Bryce, Emiliano Albanese, Anders Wimo, Wagner Ribeiro, Cleusa P. Ferri. (2013). The global prevalence of dementia: A systematic review and metaanalysis. Alzheimer's & Dementia. 9, 63;
- Karel Kostev, Galina Osina. (2020). Treatment Patterns of Patients with All-Cause Dementia in Russia. Journal of Alzheimer's Disease Reports. 4, 9-14;
- Valery L Feigin, Emma Nichols, Tahiya Alam, Marlena S Bannick, Ettore Beghi, et. al.. (2019). Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology. 18, 459-480;
- Huong Q. Nguyen, Soo Borson, Peter Khang, Annette Langer‐Gould, Susan E. Wang, et. al.. (2022). Dementia diagnosis and utilization patterns in a racially diverse population within an integrated health care delivery system. A&D Transl Res & Clin Interv. 8;
- . (2024). 2024 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 20, 3708-3821;
- Qi Qin, Zhaoqian Teng, Changmei Liu, Qian Li, Yunsi Yin, Yi Tang. (2021). TREM2, microglia, and Alzheimer’s disease. Mechanisms of Ageing and Development. 195, 111438.