
Дивный новый мир психоделической терапии
18 февраля 2021
Дивный новый мир психоделической терапии
- 5728
- 1
- 6
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: После пятидесятилетнего забвения возродился интерес к использованию психоделиков для лечения психических расстройств. Исследования последних лет позволили лучше разобраться в механизмах, лежащих в основе эффектов этих веществ, вселив в исследователей оптимистичный взгляд на перспективы терапии, основанной на использовании психоделиков. О том, приблизился ли переворот в психиатрии и что об этом может сказать современная нейрофармакология, пойдёт речь в данной статье.
Конкурс «Био/Мол/Текст»-2020/2021
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
К чему весь тарарам, прими-ка сомы грамм!
Олдос Хаксли. Дивный новый мир.
Введение
Эпиграф к статье выбран неслучайно. Во-первых, Олдос Хаксли был большим любителем «расширить» своё сознание при помощи различных галлюциногенных веществ. Собственно, и название синтетического наркотика «сома» из бессмертного романа Хаксли отсылает к загадочной, но часто упоминаемой в ведических текстах «соме», имевшей, судя по всему, выраженные галлюциногенные свойства. Во-вторых, именно в письме к Олдосу Хаксли, написанному в 1956 году психиатром Хамфри Осмондом, впервые прозвучал термин «психоделик». Это слово происходит от древнегреческих слов психэ́ — «душа», «разум» и дэ́лёс — «раскрывающий», «проявляющий», и переводится как «раскрывающий разум» или «освобождающий душу». Ни Осмонду, ни Хаксли не нравился термин «галлюциноген» из-за негативных коннотаций, и они решили придумать что-нибудь получше. Новый термин многим пришёлся «по вкусу» .
Со временем и термин «психоделик» показался некоторым исследователям слишком негативным. Так, в 1979 году Карл Рук с коллегами предложил новое определение — «энтеоген» (entheogen) [1]. Из названия (греч. э́нтхэос — «вдохновлённый божеством, находящийся в экстазе» и гэнэ́стхай — «становиться») следует, что эти вещества пробуждают в человеке нечто божественное. Это определение не обрело популярности в научной среде. В PubMed можно найти всего 43 упоминания слова «энтеогены» (против более 27 000 упоминаний «психоделиков»), да и то львиная доля этих определений приходится на последнее десятилетие, период возрождения интереса к психоделикам. Сейчас под энтеогенами подразумевают «сборную солянку» из растительных веществ, способных вызывать изменённые состояния сознания и применяемых в различных мистических ритуалах.
Для начала нам нужно внести некоторую ясность и познакомиться с основными «действующими лицами», которые будут встречаться по ходу статьи. В современном представлении психоделики — это не любые галлюциногены, а только те, что связываются в мозге с серотониновыми рецепторами 2А подтипа (5-НТ2А) [2]. «Классические» психоделики относятся к трём классам химических веществ. Первый класс — индоламины природного происхождения: N,N-диметилтриптамин (DMT), 5-метокси-DMT (5-MeO-DMT), псилоцибин и 4-гидрокси-DMT (псилоцин, активный метаболит псилоцибина). Ко второму классу относятся фенилалкиламины, включая мескалин (получаемый из кактуса пейота) и синтетические «амфетамины», такие как 2,5-диметокси-4-йодоамфетамин (DOI) и 2,5-диметокси-4-бромамфетамин (DOB). Третья группа — это полусинтетические эрголины, такие как знаменитый LSD.
Тут хотелось написать «растительного», но не будем допускать ошибок, которые иногда делают даже уважаемые авторы в уважаемых изданиях. Диметилтриптамин действительно получают из растений, а вот псилоцибин был выделен из грибов, которые растениями не являются (возблагодарим курс ботаники за 6 класс).
На сегодняшний день в большинстве стран психоделики относятся к запрещённым наркотическим веществам. «Соседство» с кокаином и героином в ограничительных списках сильно подпортило репутацию психоделиков, впрочем, и оказались они среди «отбросов» неслучайно. К середине 1960-х годов психоделики свободно курсировали в обществе. Отдохнуть и расслабиться с помощью галлюциногенов (отсюда выражение «рекреационные наркотики») позволяли себе не только молодые люди из контркультурной среды, но и вполне респектабельные персоны. Бесконтрольное «экспериментирование» с дозами и комбинациями веществ предсказуемо привело ко множеству сообщений о тяжёлых побочных эффектах вроде психоза, продолжительных панических атак, длительного расстройства восприятия, опасного поведения, иногда и с трагическим исходом. Естественно, это очень быстро привлекло внимание общественности. Новоявленные психонавты вроде Тимоти Лири и сами подбрасывали дров в разгорающуюся «топку» общественного негодования, открыто пропагандируя употребление психоделиков (рис. 1). Результаты не заставили долго ждать — к 1972 году психоделики оказались в списке 1 «Единой Конвенции о наркотических средствах» ООН.

Рисунок 1. Дело Тимоти Лири. После того, как в 1969 году Диана Линклеттер, дочь известного радиоведущего Арта Линклеттера, покончила с собой после передозировки LSD, тот во всём обвинил Тимоти Лири и спровоцировал общественный резонанс. В 1970 году Лири был приговорён к 38 годам заключения за хранение наркотиков. Совершив дерзкий побег и скитаясь по свету два года, он был-таки схвачен, но досрочно выпущен в 1976 году. Тем не менее, участь психоделиков уже была предрешена.
адаптировано на основе материалов сайтов Berkeley Historical Plaque Project и The Pop History Dig
Однако если вы думаете, что годы свободного применения психоделиков не дали нам ничего кроме культуры хиппи, то вы ошибаетесь. В период 1950-х и 1960-х годов было опубликовано более 1000 работ, в которых изучались эффекты психоделиков в психотерапии, лечении психических расстройств и зависимостей у более чем 40 000 субъектов. К сожалению, большинство этих исследований было выполнено, выражаясь официально, на низком методологическом уровне. В большинстве работ не было статистической обработки результатов. Совсем. Выводы делали на основе субъективных сообщений пациентов, вроде «Доктор, кажется, мне полегчало». Никакой унифицированной шкалы оценки состояния пациентов, скрупулёзного подбора групп, точных критериев диагностики заболеваний, анализа побочных эффектов . По нынешним меркам дикость какая-то. Тем не менее, в последние годы было предпринято несколько попыток экстрагировать и проанализировать данные из более-менее надёжных старых исследований. В одной работе внимание сконцентрировали на пациентах с большим депрессивным расстройством [3]. 335 индивидов из 423 (почти 80%) в 19 исследованиях продемонстрировали значительное улучшение после приёма психоделиков. Своеобразная переоценка наследия психоделической терапии — важная составная часть нового ренессанса и переосмысления роли психоделиков в современной психофармакологии. С одной стороны, за полвека технологии и методы ушли далеко вперёд и позволяют проводить исследования на уровне, недоступном в 1960-е годы, и если работы тех лет, при всём их несовершенстве, действительно сообщают нечто интересное, эти крупицы ценного знания нужно всесторонне проанализировать. С другой стороны, времена уже другие. Перед клиницистами в полный рост встала проблема резистентности к лечению антидепрессантами. Лишь 30% пациентов отвечают на такое лечение, что при одновременном росте заболеваемости депрессивными расстройствами не может не беспокоить. Отчаянные времена, как известно, требуют отчаянных мер. Так началось возрождение интереса к психоделикам.
Последнее особенно удивляет. Тут стоит привести один наглядный пример. В 1960 году Сидни Коэн озадачился вопросом побочных эффектов и разослал специальный опросник 62 исследователям, применявшим LSD и мескалин. 44 из них откликнулись и предоставили информацию о 5 000 пациентов. Выяснилось, что очень незначительное количество пациентов после приёма препаратов пытались совершить суицид (0,12%), успешно его совершали (0,04%) или впадал в состояние психоза (0,18%), и уж тем более никто не пристрастился к LSD и мескалину [4]. Всё бы хорошо, но врачи-респонденты опирались не на строгие данные клинических исследований, а на свои субъективные воспоминания. Думаю, вы согласитесь, что свидетельства вроде «Мне кажется, с этим парнем всё было в порядке» весят не больше, чем «Доктор, кажется, мне полегчало».
В «Биомолекуле» ранее уже публиковали статью, авторы которой в довольно позитивном ключе рассказывали о возрождении интереса к психоделикам в качестве средства лечения психических расстройств [5]. В этой статье мы более подробно рассмотрим проблему и попытаемся понять, насколько обоснован оптимизм в отношении психоделической терапии.
Плоды второго Ренессанса
В конце 2018 года влиятельная FDA (Food and Drug Administration) назвала псилоцибин «прорывной терапией» для лечения терапевтически резистентной депрессии . Что ж, давайте посмотрим, на каких исследованиях основано мнение этой организации. В пионерском исследовании Робина Кархарта-Харриса (Robin Carhart-Harris) 12 пациентам, не поддающихся лечению обычными антидепрессантами, дали две дозы псилоцибина (10 и 25 мг) с разницей в одну неделю [6]. Симптомы депрессии у пациентов через неделю существенно уменьшились и оставались на таком же уровне даже через 3 месяца. Те же исследователи увеличили выборку до 20 пациентов и посмотрели, что будет через полгода после приёма псилоцибина. И вновь наблюдалось стабильное улучшение [7]. Когда приём псилоцибина сопровождался психотерапией, пациенты становились более открытыми (говоря психологическими терминами, повышалась экстраверсия), у них исчезала ангедония (нежелание и неспособность получать удовольствие), что совпадало с лучшим распознаванием эмоций на лицах [8], [9]. В одном аналогичном исследовании у пациентов даже оценивали выраженность чувства единения с природой и политические взгляды (либеральные/авторитарные). У принимавших псилоцибин, помимо улучшения депрессивных симптомов, любовь к природе становилась сильнее, а политические взгляды — либеральнее [10].
Кстати, эра современных клинических испытаний психоделиков началась тоже с псилоцибина. В 2006 году Франсиско Морено опубликовал результаты исследования, в котором девяти пациентам с обсессивно-компульсивным расстройством давали псилоцибин в разных дозах (25, 100, 200 и 300 мкг/кг) [11]. В совокупности каждым пациентом было принято 29 доз с разницей в одну неделю. Вне зависимости от дозировки наблюдалось выраженное улучшение симптомов заболевания.
Псилоцибин применялся и в нескольких плацебо-контролируемых исследованиях. Их целью была оценка качеств этого психоделика при снижении признаков тревожности и депрессии у пациентов, смертельно больных онкологическими заболеваниями. В одном из исследований в качестве плацебо использовался ниацин — никотиновая кислота — что в высокой дозе (250 мг) вызывает некоторые физиологические эффекты, напоминающие таковые у психоделиков, а псилоцибин давали в низкой дозе (0,2 мг/кг) [12]. Лечение сопровождалось психологической поддержкой пациентов (а всего их было 12), и было ослеплённым .
Имеется в виду слепой метод, когда пациента не посвящают в детали процедуры. При двойном слепом методе в детали не посвящаются ещё и врачи, которые проводят процедуры.
По этическим соображениям пациенты были контролем для самих себя (состояние до лечения рассматривалось в качестве точки отсчёта). Статистически значимого улучшения в этом исследовании не обнаружили. Зато в другом плацебо-контролируемом исследовании с участием 51 пациента с тяжёлыми онкологическими заболеваниями наблюдались заметные улучшения через пять недель после приёма псилоцибина [13]. В качестве плацебо использовалась небольшая доза псилоцибина (1 или 3 мг), которую сравнивали с высокой дозой (22 или 30 мг). Интересно, что через пять недель проводили «рокировку» — пациентов с низкой дозы переводили на высокую, и наоборот (в клинических испытаниях это называется crossover design). Положительный эффект от высокой дозы при этом не исчезал. Эффект от низкой дозы был значительно слабее и долго не продержался, даже если испытуемых переводили на высокую дозу.
Третье исследование, также с участием смертельно больных пациентов, вобрало в себя что-то от двух уже упомянутых. В качестве плацебо выступал ниацин, доза псилоцибина была низкой (0,3 мг) и применялся «кроссовер» [14]. Как отмечают исследователи, после приёма псилоцибина наблюдался незамедлительный, существенный и устойчивый эффект, который сохранялся и через 8 месяцев после приёма психоделика. Те пациенты, которые начали с приёма ниацина и лишь позже были переведены на псилоцибин, наоборот, показывали стабильное ухудшение клинического эффекта, который в итоге не продержался и 7 недель. Через 4,5 года после завершения испытаний тех пациентов, которые оставались в живых (не будем забывать про их серьёзные диагнозы) снова проверили на соответствие клиническим критериям антидепрессантного и антитревожного эффектов. 60–80% испытуемых соответствовали этим критериям [15]. Исследователи подчеркнули, что подавляющее большинство участников приписывали положительные жизненные изменения опыту терапии с применением псилоцибина и оценивали его как одно из наиболее духовно значимых событий в своей жизни.
Не только псилоцибин оказался в фокусе исследователей. В Бразилии было проведено два испытания, в одном из которых однократную дозу напитка аяуаска (одним из действующих компонентов которого является DMT) давали шести пациентам с рекуррентной депрессией [16]. Второе, аналогичное, проводилось на семнадцати пациентах [17]. В обоих случаях улучшение наблюдалось уже на первый день и сохранялось, по меньшей мере, в течение трёх недель. Недавно в Бразилии было проведено и плацебо-контролируемое двойное слепое исследование, в котором участвовало 29 пациентов с терапевтически-резистентной депрессией [18]. Половине давали плацебо, которое выглядело и на вкус было как отвар аяуаски; остальным давали настоящий напиток (с 0,36 мг DMT). Оценка состояния пациентов показала значимое улучшение уже на первый день после приёма аяуаски, которое сохранялось минимум неделю.
LSD тоже «засветился» в одном клиническом испытании (ослеплённом и рандомизированном) на пациентах с клиническими случаями тревожности. Правда, как и в испытаниях с псилоцибином, эта тревожность была ассоциирована с тяжёлым онкологическим заболеванием. Одной группе пациентов дали две дозы по 200 мкг LSD, другой группе — контрольной — давали по 20 мкг LSD. Высокая доза оказалась эффективнее [19]. Признаки тревожности были снижены не только через два месяца, но и через год после приёма LSD [20].
Результаты вышеописанных клинических испытаний действительно впечатляют, поэтому нам стоит поподробнее остановиться на тех механизмах, что обусловливают чудодейственные эффекты психоделиков.
Как это работает?
Рассмотрим более-менее устоявшуюся точку зрения на механизмы действия психоделиков. Мы уже знаем, что истинные психоделики связываются с 5-НТ2A рецепторами. Они действуют как полные или частичные агонисты. Это означает, что соединение (в нашем случае психоделик) своей структурой и оказываемыми эффектами имитирует «родной» лиганд рецептора (в нашем случае серотонин) (рис. 2). Но будем честны — психоделики имеют сродство и к другим серотониновым (и не только) рецепторам. Разница лишь в степени сродства (селективности) — для одних рецепторов выше, для других ниже (на этом моменте мы подробнее остановимся в следующей главе).
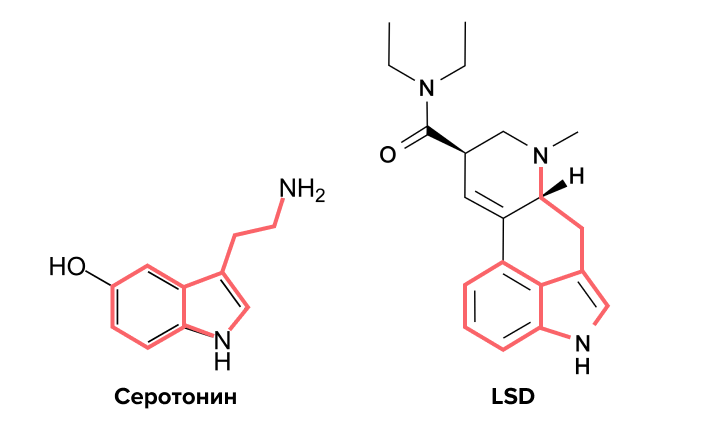
Рисунок 2. Сравнение химической структуры серотонина и LSD.
адаптировано из «Википедии»
Однако 5-НТ2A рецепторы не случайно выбраны в качестве основных «мишеней». Считается, что активация именно этих рецепторов в коре головного мозга и в подкорковых структурах является общим для животных и человека механизмом, через который психоделики изменяют поведение и психологию [21]. У грызунов, которые чаще всего используются в различных фармакологических экспериментах, аналогом психоделического эффекта у человека является head twitch response [22]. С точки зрения наблюдателя, мышь через несколько минут после укола психоделика начинает совершать резкие встряхивания головой — head twitch — будто бы её одолевает надоедливое насекомое. Точка зрения мыши нам неизвестна. Непонятно видит ли мышь какие-либо галлюцинации в нашем, человеческом, понимании, но из различных исследований следует, что у животных нарушается зрительное восприятие, необходимое при пространственном обучении [23]. О том, что в эффектах психоделиков замешаны именно 5-НТ2А рецепторы, стало известно благодаря их блокаде селективным антагонистом кетансерином, после чего любой психоделик уже не мог вызвать встряхивания головой [22]. Я думаю, вы не удивитесь, если узнаете, что и у людей кетансерин практически полностью устраняет любые субъективные эффекты психоделиков, например, LSD [24–26]. С помощью позитронно-эмисионной томографии исследователям из Копенгагена удалось показать, что связывание 5-НТ2A рецепторов с лигандом в префронтальной коре испытуемых положительно коррелирует с дозой и эффектом псилоцибина [27]. Они же показали, что при приёме уже 3 мг псилоцибина в коре связывается 43% рецепторов.
Как и агонист, антагонист имитирует естественный лиганд, но не активирует рецептор, а наоборот, «выключает» его, блокируя активный центр.
Ну связался психоделик с рецептором, а что дальше? Откуда всё многообразие эффектов? Давайте разберёмся. 5-НТ2A рецепторы интересны тем, что широко распространены в мозге. Одна из самых «насыщенных» этими рецепторами областей — кора головного мозга (особенно префронтальная часть), а ещё точнее — пятый слой коры, заполненный пирамидальными нейронами (они обладают возбуждающей активностью). Нервные пути (афференты) из таламуса в кору тоже имеют на своих окончаниях 5-НТ2A рецепторы. Таламус получает огромное количество сенсорной и когнитивной информации из окружающей среды и отправляет её в кору. Пирамидальные нейроны в данном случае играют роль связного, соединяющего информационные потоки от нижележащих нейрональных петель из таламуса с вышележащими петлями в коре (рис. 3). Но и это не всё. Ингибирующие (ГАМК ) нейроны в коре и подкорковых структурах тоже богато «усеяны» 5-НТ2A рецепторами (но ещё и 5-НТ1A рецепторами).
ГАМК (гамма-аминомасляная кислота) — это основной нейромедиатор, секретируемый данными нейронами. ГАМК обладает ингибирующими свойствами и угнетает активность других нейронов.
Когда крысам вкололи психоделик DOI и с помощью имплантированных электродов измерили среднее число потенциалов действия в пирамидальных нейронах (что отражает степень их возбуждения), то оказалось, что возбуждение выросло на 481% [28]. Причём это наблюдалось при невысокой дозе DOI. Однако, если дозу существенно повысить, начнётся ингибирование нейронов [29]. Очевидно, что расположение рецепторов и то, на каких нейронах они «сидят», имеет большое значение в эффектах психоделиков. Вполне возможно, что стоит лишь переборщить с дозой вещества, чтобы активировались тормозные ГАМК нейроны, подобно стоп-крану в поезде [30]. Продолжая аналогию, хочется отметить, что срыв стоп-крана не гарантирует быстрой остановки разогнавшегося состава; то же можно сказать и про мозг.
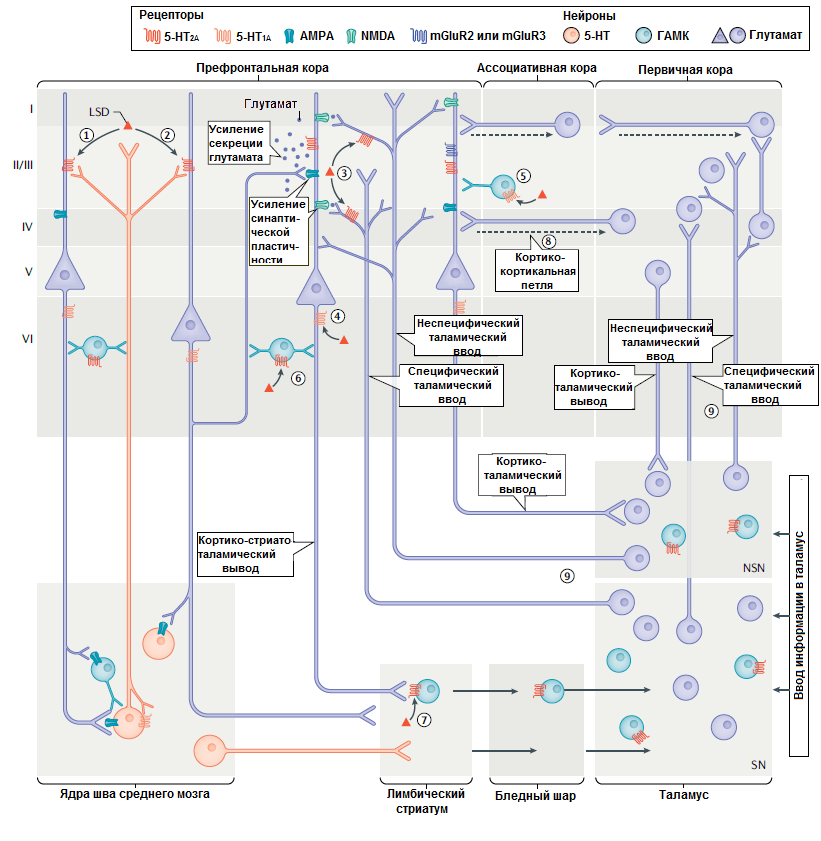
Рисунок 3. Схема эффекта психоделиков на внутрикортикальные и кортикоталамические цепи. Эти данные получены с применением LSD и DOI в основном на животных. Сначала LSD активирует 5-НТ2A рецепторы на отростках пирамидальных нейронов пятого (1) и шестого (2) слоёв коры. Также эти рецепторы активируются на специфических и неспецифических афферентах из таламуса в кору (3). Также LSD активирует 5-НТ1A рецепторы на отростках пирамидальных нейронов (4) и на ГАМК нейронах (5). Это приводит как к ингибированию, так и к активации пирамидальных нейронов. 5-НТ2A рецепторы на ГАМК нейронах в коре (6) и стриатуме (7) тоже активируются. Хотя это и приводит к частичному ингибированию, в целом LSD вызывает выброс глутамата из глутаматергических нейронов в пятом и четвёртом слоях коры, что возбуждает всю нервную сеть и через NMDA и АМРА рецепторы стимулирует синаптическую пластичность. Глутаматные нейроны коры влияют на поток информации в кортико-кортикальных (8) и таламокортикальных петлях (9).
mGluR2 — метаботропные рецепторы к глутамату (не являются ионными каналами). NSN — неспецифические таламические ядра. SN — специфические таламические ядра.
адаптировано из [30]
NMDA и AMPA рецепторы связывают глутамат. Оба рецептора представляют собой ионные каналы, только АМРА рецепторы пропускают внутрь клетки ионы натрия, а NMDA пропускает ионы натрия и кальция. Когда глутамат активирует АМРА рецепторы, они начинают пропускать внутрь ионы натрия, что приводит к деполяризации клеточной мембраны (т.е. она меняет свой заряд с отрицательного на положительный). Из-за этого «разблокируются» NMDA рецепторы, которые начинают пропускать в клетку кальций. Зависимые от кальция киназы фосфорилируются сами и фосфорилируют субъединицы АМРА рецепторов, благодаря чему они встраиваются в мембрану клетки; число рецепторов растёт. Этот цикл повторяется снова и снова, благодаря чему нейрон может генерировать возбуждающие потенциалы действия.
Распространена точка зрения, что введение психоделиков нарушает кортикоталамическую связь. Таламус, в котором нарушается фильтрация сенсорной информации, при этом «перегружает» этой информацией кору, в которой тоже нарушается перераспределение нейрональной активности (рис. 4). Отсюда вытекают изменения перцепции, чувство расщеплённого «Я», галлюцинации [31]. Любопытно, но подобные пертурбации в кортико-таламической связи можно найти и у больных шизофренией [32]. На то, что происходит с нервными связями под действием психоделиков, есть и иной взгляд. Этот взгляд связан с понятием энтропии мозга — то есть количества состояний нейронов, которые мозг способен достичь. Приём психоделиков приводит к повышению энтропии. Это выражается в виде значительного снижения альфа-осциляций при магнито- и электроэнцефалографии у пациентов [33]. Это должно приводить к ослаблению (или, если хотите, расслаблению) прогностических функций коры, что приводит к снижению потока информации «сверху-вниз» и усилению потока «снизу-вверх». Из-за этого, в частности, под действием психоделиков замедляется реакция на неожиданные стимулы. В соответствии с такой гипотезой, психоделики не нарушают кортико-таламические связи, а изменяют их. Однако в одних работах энтропические эффекты подтверждаются, в других нет. Вопрос, очевидно, требует дальнейшего исследования.
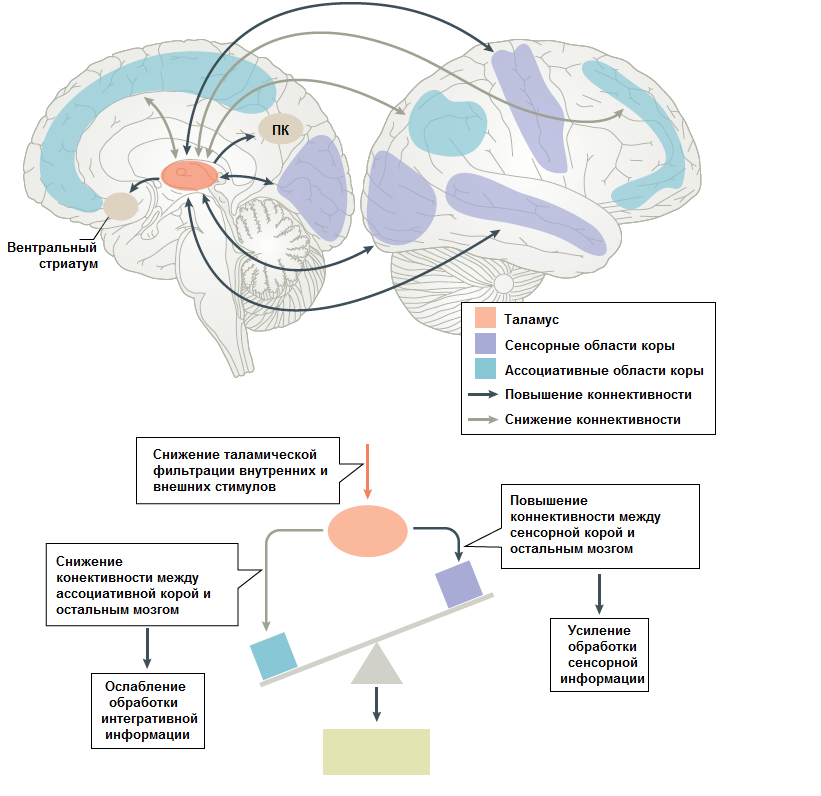
Рисунок 4. Схема, иллюстрирующая рабочую гипотезу изменений в коннективности мозга, вызванной приёмом психоделиков.
адаптировано из [30]
Для долгосрочных эффектов терапии недостаточно просто «разогнать» нервные сети до высоких скоростей, нужно ещё и закрепить этот успех. Как следует из клинических испытаний, после даже одной или пары доз психоделиков эффекты сохраняются длительное время (как минимум, несколько недель). Объяснить это могут сопутствующие нейропластические изменения в мозге. Как сейчас известно из экспериментов на клеточных культурах, психоделики способны менять морфологию нервных клеток — растут новые дендриты, ветвятся старые, удлиняются шипики (места синаптических контактов между дендритами) (рис. 5) [34]. Как считают исследователи, чем выше сродство психоделиков к 5-НТ2A рецепторам, тем сильнее меняется морфология нейронов. Связаны все эти эффекты с нейротрофическими факторами , в первую очередь с BDNF и его рецептором TrkB. Именно им приписывают ведущую роль в усложнении нейрональных отростков и поддержании устойчивых синаптических контактов. Также BDNF немало способствует поддержанию высокого уровня АМРА и NMDA рецепторов, связывающих глутамат. Кроме морфологии, это также является важным условием долговременных изменений в активности нервных клеток. Ещё в ранних исследованиях было показано, что активация 5-НТ2A рецепторов провоцирует усиление экспрессии BDNF в коре мозга крыс [35].
Как следует из названия, это пептиды, которые обеспечивают рост и выживание нервных клеток.
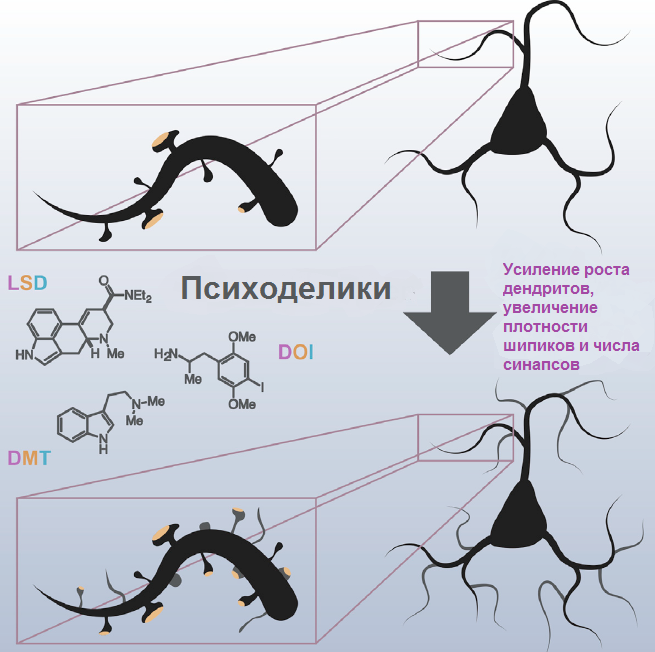
Рисунок 5. Психоделические вещества изменяют морфологию нейронов.
адаптировано из [34]
Приём психоделиков сопровождается рядом психологических изменений, которые можно расценивать как положительные, особенно в контексте депрессии или тревожности. Во многих исследованиях на здоровых добровольцах и в клинических испытаниях отмечается эмоциональное возбуждение, повышенная чувствительность, раскрепощение, причём восприимчивость к негативным эмоциональным стимулам снижается. У здоровых испытуемых LSD и псилоцибин улучшают распознавание положительных эмоций на лицах и наоборот, затрудняют распознавание негативных [36], [37]. Нечто схожее наблюдается и у пациентов с депрессией. Изменения в обработке эмоциональной информации могут быть связаны с миндалевидным комплексом. В норме этот комплекс фиксирует информацию о негативном опыте и всегда готов её воспроизвести при необходимости. По сути, это защитный механизм, который, как сейчас известно, выходит из-под контроля при депрессии и посттравматическом стрессовом расстройстве. Тогда негативные воспоминания прокручиваются снова и снова, как заевшая пластинка, а также усиливаются восприятие и обработка негативных эмоций. Оказалось, что после приёма психоделиков ослабляется связь между миндалевидным комплексом и корой [38], [39]. Отсюда и сдвиг в сторону положительных эмоций. Причём у пациентов с депрессией такие изменения сохраняются значительно дольше, чем у здоровых добровольцев. Такие ощущения, как расщепление «Я», снятие самоограничений и появление чувства единения со всем и со всеми, часто наблюдаемые при приёме психоделиков, уже труднее описать с точки зрения какого-то одного нервного пути. В самых разных исследованиях показано, что в мозге наблюдаются масштабные изменения самых разных нервных сетей внутри коры и между корой и лимбическими структурами [30]. Иными словами, усиливается коннективность. Изменения в восприятии себя влекут за собой и изменения в общении с другими людьми. Частым эффектом приёма психоделиков является усиление эмпатии и социального взаимодействия — что с психотерапевтом, что с другими людьми; усиливается альтруистическое поведение. Стоит ли повторять, что данный эффект тоже длительный?
«Проклятье победителей»
Итак, мы узнали результаты клинических испытаний психоделиков, узнали биологические основы их действия, теперрь самое время чокнуться бокалами за скорую победу над депрессией... Но не будем спешить открывать бутылку с шампанским. Многие многообещающие препараты, показывавшие фантастические результаты в доклинических и пилотных клинических исследованиях, в итоге потерпели фиаско в масштабных испытаниях. Это и получило название winner’s curse (проклятье победителей).
На самом деле, испытания психоделиков ушли от тех старых, ненадёжных исследований полувековой давности всего лишь на шаг вперёд. Но не на десять шагов. Этому есть веские причины. Маленькие размеры выборок в исследованиях мы обсуждать не будем; это, что называется, «лежит на поверхности», поэтому сконцентрируемся на более важных моментах. Итак, серьёзная причина № 1 — отсутствие адекватного плацебо. Особенность психоделиков, как мы уже знаем, в специфических эффектах, которые трудно чем-либо замаскировать. Конечно, попытки предпринимаются. Как мы видели, применяют ниацин, или просто подкрашенную водичку (в случае с аяуаской), однажды применили и бенадрил , [40]. В исследованиях, где применяли «кроссовер», эффект ослепления мигом исчезал, когда пациентов с плацебо переводили на психоделик, и наоборот — настолько заметной была разница от приёма двух веществ [13], [14]. Особенно неудачным здесь является использование в качестве плацебо низких доз [13]. Для пациента низкая доза, может, и будет субъективно незаметной, но произведёт позитивный эффект на симптомы депрессии, пусть и более краткосрочный. Это ни в коем разе нельзя назвать плацебо!
Это лекарство от аллергии. В состав бенадрила входит дифенгидрамин (он же димедрол), который в больших дозах может вызывать бред и галлюцинации.
Причина № 2 — отсутствие внятного представления об оптимальной дозировке препаратов. Сколько нужно психоделиков, чтобы оказать максимальный эффект на состояние пациентов, но избежать побочных реакций? Анализируя данные клинических испытаний, складывается впечатление, что психоделики эффективны в любой дозе. Установлено, что минимальная доза псилоцибина, которая не окажет вообще какого-либо эффекта — ничтожные 0,028 мг/кг [27]. Поскольку в нескольких испытаниях небольшие дозы психоделиков, выбранные как плацебо, неожиданно хорошо себя зарекомендовали, сразу же активизировался интерес к использованию именно маленьких доз — микродозингу [41], [42]. Однако анализ тех же самых клинических испытаний показывает, что чем выше доза, тем эффект, вроде бы, лучше. Некоторые даже отметили, что мистический опыт, испытанный пациентами, положительно коррелирует со снижением тревожности и депрессивных симптомов [13]. То есть двадцать миллиграммов псилоцибина лучше одного. Но один миллиграмм не вызывает галлюцинаций, а продолжительность эффектов можно увеличить путём повторных приёмов. Разрешить эту дилемму можно только в сравнительном исследовании. Но для этого к высокой дозе психоделика тоже должен быть плацебо-контроль, и мы возвращаемся к причине № 1. При клинических испытаниях большинства препаратов ко второй фазе испытаний уже, как правило, сформировано представление о необходимых дозировках. В случае с психоделиками такого нет.
Серьёзная причина № 3 — подбор испытуемых. Очень часто участники испытаний имели в прошлом опыт применения психоделиков. Поскольку нередко рекрутирование происходит через интернет-сайты, где сообщества психонавтов обсуждают персональный опыт употребления рекреационных наркотиков, закрадывается подозрение, что некоторые добровольцы с готовностью соглашаются на испытания, чтобы легально получить новую дозу незабываемых ощущений. Не хочу быть голословным. Например, в упоминаемом ранее двойном слепом испытании псилоцибина на пациентах со смертельным онкологическим заболеванием 55% испытуемых уже имели ранее опыт употребления психоделических веществ [14]. В пионерских испытаниях Кархарта-Харриса на пациентах с терапевтически резистентной депрессией пятеро из двадцати испытуемых в период наблюдения и оценки длительности эффектов после приёма последней дозы нашли и употребили псилоцибин (дизайн исследования действительно был open-label и очень даже uncontrolled) [7]. Беда не только в том, что испытуемые с опытом употребления психоделиков прекрасно знают, чего от них ожидать, поэтому «портят» своими ожиданиями объективность исследования. Те, кто имел негативный опыт употребления, будут попросту избегать таких испытаний. Кроме того, выборки очень гомогенны. Как правило, это образованные европейцы среднего возраста. Многие из них имеют положительный опыт употребления психоделических веществ. И многим после краткого курса псилоцибина, аяуаски или LSD становится хорошо. Удивительное совпадение...
Причина № 4, которая тоже заслуживает обсуждения — присутствие в дизайне всех испытаний психотерапии. Этот компонент сам по себе может вносить очень большой вклад в результаты и запутывать исследователей. В недавнем метаанализе шести рандомизированных испытаний было показано, что когнитивно-поведенческая психотерапия, широко распространённая при лечении депрессии, эффективно снижает выраженность симптомов и позволяет достичь ремиссии [43]. Эффект психотерапии сохраняется по меньшей мере шесть месяцев или даже год. Интересно, но эффект психоделиков часто наблюдается в аналогичном временном интервале. Стоит сказать, что приём психоделиков сильно зависит от контекста и требует соблюдения кучи условий. Отсюда и сопровождение со стороны психотерапевтов. Хорошо известно, что при плохом эмоциональном настрое и тревожной обстановке пациент легко может получить от психоделика так называемый бэд-трип.
А как насчёт биологических основ действия психоделиков? Здесь-то вроде устоявшийся консенсус? Боюсь, и в этом «уравнении» всё ещё есть неизвестные переменные. Помните, мы говорили про то, что психоделики с разной селективностью связываются со всеми серотониновыми рецепторами? Показателем селективности является константа ингибирования (Ki). В применении к рецепторам, чем меньше значение Ki, тем выше сила связывания, а значит, меньше вещества нужно, чтобы активизировать рецептор (если мы говорим об агонисте). Так вот, для 5-НТ2A рецептора Ki псилоцибина равняется 107,2 нМ (наномоль), а для 5-НТ7 рецептора — всего 3,5 нМ. То есть нужно всего три наномоля псилоцибина, чтобы «включить» эти рецепторы. Очень низка Ki для 5-НТ2B рецептора (4,5 нМ), что создаёт ненулевой риск побочных эффектов на сердечно-сосудистую систему, в работе которой этот рецептор играет важную роль. Рецепторы, разумеется, очень разные по своей локализации и внутриклеточным сигнальным каскадам. Однако никто не выстраивается в очередь, чтобы посмотреть с помощью ПЭТ, как приём псилоцибина изменяет плотность 5-НТ7 рецепторов в мозге пациентов. Да, здесь есть определённые методологические проблемы, ведь нужны эффективные радиоактивно меченые лиганды, которые должны свободно проникать через гематоэнцефалический барьер (это относится ко многим рецепторам). Но это не значит, что саму проблему потенциального «удара мимо мишени» (off-target) нужно старательно обходить стороной. В литературе, посвящённой психоделикам, этой проблеме уделено очень мало внимания, что несколько тревожит. Тем более что в настоящее время накоплено достаточно свидетельств тесной связи между разными подтипами рецепторов [44]. «Тесной» в прямом смысле — рецепторы формируют функциональные гетеродимеры, то есть физически связываются в пару на мембране клетки. В таких парах один рецептор может «перетягивать одеяло на себя» и, активируясь лигандом, погружаться внутрь клетки, утягивая с собой второй рецептор. Так, к примеру, происходит в «связке» между 5-НТ2A и 5-НТ1A рецептором [45]. К сожалению, нам пока ещё мало известно о том, как комплексы рецепторов распространены в мозге и как в глобальном масштабе это может влиять на развитие или лечение депрессии. Однако новая информация совершенно точно заставляет пересматривать устоявшиеся представления о депрессивных расстройствах. Спектр этих психических заболеваний имеет сложную природу. Факторы среды и генетическая предрасположенность переплетаются и порождают чудовище, разрушающее разум. Очень вероятно, что нарушение баланса разных рецепторов является существенным фактором, запускающим патологический процесс. Психофармакология здесь уже превращается в настоящее искусство по созданию действенных «коктейлей» агонистов и антагонистов — с помощью одних препаратов уровень одного рецепторов нужно снизить, другого увеличить и т.д. Психоделики в этом контексте выглядят поразительно архаично. Вообще, терапия психоделиками противоречит накопленному опыту психофармакологии депрессии. Считается, что не активация, а как раз блокада 5-НТ2A рецепторов является эффективной стратегией борьбы с депрессией [46].
Хочется ещё вспомнить про эффект психоделиков на BDNF. С этим всё далеко не так однозначно. Если в коре мозга активация 5-НТ2A рецепторов увеличивает уровень мРНК BDNF, то в гиппокампе... снижает. Причём известно это стало всё в тех же первых работах [35]. Здесь могу вставить свои «пять копеек». Недавно мы с коллегами опубликовали статью, в которой показали, что в мозге мышей активация 5-НТ2A рецепторов селективными агонистами приводит к неожиданным изменениям со стороны BDNF и его рецепторов [47]. Дело в том, что раньше все разговоры велись, основываясь лишь на уровне мРНК BDNF, а мы исследовали и уровень белка. Оказалось, что рост уровня мРНК сопровождался ростом уровня proBDNF, но не BDNF. Надо сказать, что proBDNF — это белок-предшественник, который, в отличие от зрелой формы, выполняет прямо противоположные функции — уменьшает число дендритов и синапсов, снижает число NMDA и AMPA рецепторов, а иногда и убивает нейроны. А ещё мы обнаружили существенное снижение уровня белка TrkB рецептора в мышином мозге. Конечно, мы не использовали псилоцибин, который «широкого спектра действия», мы «били» более прицельно, но полученные результаты всё равно заставляют задуматься. 5-HT2A рецепторы действуют на BDNF и его рецепторы не так как предполагалось раньше. Значит, и в этом вопросе сторонники психоделиков преждевременно поставили точку.
Заключение
Вы скажете, зачем надо было в течение двух глав так старательно выстраивать «здание» психоделической терапии, чтобы в конце взять кувалду и разнести его на кусочки? Отвечу — ничего я не разнёс, а лишь указал на то, что у «здания» фундамент в трещинах и кладка неровная. Не скрою, я не разделяю особого оптимизма относительно психоделиков. Да, у психоделических веществ действительно есть какой-то потенциал, но существующих данных явно недостаточно для того, чтобы психоделики были декриминализованы и широко вошли в лечебную практику. Многие сторонники психоделической терапии считают законодательные ограничения главным тормозом на пути прогресса. Но даже при всех ограничениях исследования психоделиков всё равно проводили и проводят. Заинтересованным исследователям нужно приложить все усилия, чтобы получаемые результаты стали надёжнее. Не эмоции и не завышенные ожидания «волшебной пули», а только кропотливая научная работа позволит ответить на вопрос: «Психоделики — это суперэффективные антидепрессанты или мощное плацебо?».
Литература
- Carl A. P. Ruck, Jeremy Bigwood, Danny Staples, Jonathan Ott, R. Gordon Wasson. (1979). Entheogens. Journal of Psychedelic Drugs. 11, 145-146;
- David E. Nichols. (2016). Psychedelics. Pharmacol Rev. 68, 264-355;
- James JH Rucker, Luke A Jelen, Sarah Flynn, Kyle D Frowde, Allan H Young. (2016). Psychedelics in the treatment of unipolar mood disorders: a systematic review. J Psychopharmacol. 30, 1220-1229;
- James J.H. Rucker, Jonathan Iliff, David J. Nutt. (2018). Psychiatry & the psychedelic drugs. Past, present & future. Neuropharmacology. 142, 200-218;
- Новая жизнь психоделиков;
- Robin L Carhart-Harris, Mark Bolstridge, James Rucker, Camilla M J Day, David Erritzoe, et. al.. (2016). Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. The Lancet Psychiatry. 3, 619-627;
- R. L. Carhart-Harris, M. Bolstridge, C. M. J. Day, J. Rucker, R. Watts, et. al.. (2018). Psilocybin with psychological support for treatment-resistant depression: six-month follow-up. Psychopharmacology. 235, 399-408;
- D. Erritzoe, L. Roseman, M. M. Nour, K. MacLean, M. Kaelen, et. al.. (2018). Effects of psilocybin therapy on personality structure. Acta Psychiatr Scand. 138, 368-378;
- J. B. Stroud, T. P. Freeman, R. Leech, C. Hindocha, W. Lawn, et. al.. (2018). Psilocybin with psychological support improves emotional face recognition in treatment-resistant depression. Psychopharmacology. 235, 459-466;
- Taylor Lyons, Robin L Carhart-Harris. (2018). Increased nature relatedness and decreased authoritarian political views after psilocybin for treatment-resistant depression. J Psychopharmacol. 32, 811-819;
- Francisco A. Moreno, Christopher B. Wiegand, E. Keolani Taitano, Pedro L. Delgado. (2006). Safety, Tolerability, and Efficacy of Psilocybin in 9 Patients With Obsessive-Compulsive Disorder. J. Clin. Psychiatry. 67, 1735-1740;
- Charles S. Grob, Alicia L. Danforth, Gurpreet S. Chopra, Marycie Hagerty, Charles R. McKay, et. al.. (2011). Pilot Study of Psilocybin Treatment for Anxiety in Patients With Advanced-Stage Cancer. Arch Gen Psychiatry. 68, 71;
- Roland R Griffiths, Matthew W Johnson, Michael A Carducci, Annie Umbricht, William A Richards, et. al.. (2016). Psilocybin produces substantial and sustained decreases in depression and anxiety in patients with life-threatening cancer: A randomized double-blind trial. J Psychopharmacol. 30, 1181-1197;
- Stephen Ross, Anthony Bossis, Jeffrey Guss, Gabrielle Agin-Liebes, Tara Malone, et. al.. (2016). Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol. 30, 1165-1180;
- Gabrielle I Agin-Liebes, Tara Malone, Matthew M Yalch, Sarah E Mennenga, K Linnae Ponté, et. al.. (2020). Long-term follow-up of psilocybin-assisted psychotherapy for psychiatric and existential distress in patients with life-threatening cancer. J Psychopharmacol. 34, 155-166;
- Flávia de L. Osório, Rafael F. Sanches, Ligia R. Macedo, Rafael G. dos Santos, João P. Maia-de-Oliveira, et. al.. (2015). Antidepressant effects of a single dose of ayahuasca in patients with recurrent depression: a preliminary report. Rev. Bras. Psiquiatr.. 37, 13-20;
- Rafael Faria Sanches, Flávia de Lima Osório, Rafael G. dos Santos, Ligia R.H. Macedo, João Paulo Maia-de-Oliveira, et. al.. (2016). Antidepressant Effects of a Single Dose of Ayahuasca in Patients With Recurrent Depression. Journal of Clinical Psychopharmacology. 36, 77-81;
- Fernanda Palhano-Fontes, Dayanna Barreto, Heloisa Onias, Katia C. Andrade, Morgana M. Novaes, et. al.. (2019). Rapid antidepressant effects of the psychedelic ayahuasca in treatment-resistant depression: a randomized placebo-controlled trial. Psychol. Med.. 49, 655-663;
- Peter Gasser, Dominique Holstein, Yvonne Michel, Rick Doblin, Berra Yazar-Klosinski, et. al.. (2014). Safety and Efficacy of Lysergic Acid Diethylamide-Assisted Psychotherapy for Anxiety Associated With Life-threatening Diseases. The Journal of Nervous and Mental Disease. 202, 513-520;
- Peter Gasser, Katharina Kirchner, Torsten Passie. (2015). LSD-assisted psychotherapy for anxiety associated with a life-threatening disease: A qualitative study of acute and sustained subjective effects. J Psychopharmacol. 29, 57-68;
- Adam L. Halberstadt, Muhammad Chatha, Adam K. Klein, Jason Wallach, Simon D. Brandt. (2020). Correlation between the potency of hallucinogens in the mouse head-twitch response assay and their behavioral and subjective effects in other species. Neuropharmacology. 167, 107933;
- Adam L. Halberstadt. (2015). Recent advances in the neuropsychopharmacology of serotonergic hallucinogens. Behavioural Brain Research. 277, 99-120;
- Gongliang Zhang, Robert W. Stackman. (2015). The role of serotonin 5-HT2A receptors in memory and cognition. Front. Pharmacol.. 6;
- Katrin H. Preller, Marcus Herdener, Thomas Pokorny, Amanda Planzer, Rainer Kraehenmann, et. al.. (2017). The Fabric of Meaning and Subjective Effects in LSD-Induced States Depend on Serotonin 2A Receptor Activation. Current Biology. 27, 451-457;
- Rainer Kraehenmann, Dan Pokorny, Helena Aicher, Katrin H. Preller, Thomas Pokorny, et. al.. (2017). LSD Increases Primary Process Thinking via Serotonin 2A Receptor Activation. Front. Pharmacol.. 8;
- Katrin H. Preller, Leonhard Schilbach, Thomas Pokorny, Jan Flemming, Erich Seifritz, Franz X. Vollenweider. (2018). Role of the 5-HT2A Receptor in Self- and Other-Initiated Social Interaction in Lysergic Acid Diethylamide-Induced States: A Pharmacological fMRI Study. J. Neurosci.. 38, 3603-3611;
- Martin K. Madsen, Patrick M. Fisher, Daniel Burmester, Agnete Dyssegaard, Dea S. Stenbæk, et. al.. (2019). Psychedelic effects of psilocybin correlate with serotonin 2A receptor occupancy and plasma psilocin levels. Neuropsychopharmacol.. 44, 1328-1334;
- M. V. Puig. (2003). In Vivo Modulation of the Activity of Pyramidal Neurons in the Rat Medial Prefrontal Cortex by 5-HT2A Receptors: Relationship to Thalamocortical Afferents. Cerebral Cortex. 13, 870-882;
- J. Wood, Y. Kim, B. Moghaddam. (2012). Disruption of Prefrontal Cortex Large Scale Neuronal Activity by Different Classes of Psychotomimetic Drugs. Journal of Neuroscience. 32, 3022-3031;
- Franz X. Vollenweider, Katrin H. Preller. (2020). Psychedelic drugs: neurobiology and potential for treatment of psychiatric disorders. Nat Rev Neurosci. 21, 611-624;
- M GEYER, F VOLLENWEIDER. (2008). Serotonin research: contributions to understanding psychoses. Trends in Pharmacological Sciences. 29, 445-453;
- Alan Anticevic, Kristen Haut, John D. Murray, Grega Repovs, Genevieve J. Yang, et. al.. (2015). Association of Thalamic Dysconnectivity and Conversion to Psychosis in Youth and Young Adults at Elevated Clinical Risk. JAMA Psychiatry. 72, 882;
- Robin L. Carhart-Harris. (2018). The entropic brain - revisited. Neuropharmacology. 142, 167-178;
- Calvin Ly, Alexandra C. Greb, Lindsay P. Cameron, Jonathan M. Wong, Eden V. Barragan, et. al.. (2018). Psychedelics Promote Structural and Functional Neural Plasticity. Cell Reports. 23, 3170-3182;
- Vidita A. Vaidya, Gerard J. Marek, George K. Aghajanian, Ronald S. Duman. (1997). 5-HT2AReceptor-Mediated Regulation of Brain-Derived Neurotrophic Factor mRNA in the Hippocampus and the Neocortex. J. Neurosci.. 17, 2785-2795;
- Michael Kometer, André Schmidt, Rosilla Bachmann, Erich Studerus, Erich Seifritz, Franz X. Vollenweider. (2012). Psilocybin Biases Facial Recognition, Goal-Directed Behavior, and Mood State Toward Positive Relative to Negative Emotions Through Different Serotonergic Subreceptors. Biological Psychiatry. 72, 898-906;
- Patrick C Dolder, Yasmin Schmid, Felix Müller, Stefan Borgwardt, Matthias E Liechti. (2016). LSD Acutely Impairs Fear Recognition and Enhances Emotional Empathy and Sociality. Neuropsychopharmacol. 41, 2638-2646;
- Rainer Kraehenmann, Katrin H. Preller, Milan Scheidegger, Thomas Pokorny, Oliver G. Bosch, et. al.. (2015). Psilocybin-Induced Decrease in Amygdala Reactivity Correlates with Enhanced Positive Mood in Healthy Volunteers. Biological Psychiatry. 78, 572-581;
- F Mueller, C Lenz, P C Dolder, S Harder, Y Schmid, et. al.. (2017). Acute effects of LSD on amygdala activity during processing of fearful stimuli in healthy subjects. Transl Psychiatry. 7, e1084-e1084;
- Michael P. Bogenschutz, Samantha K. Podrebarac, Jessie H. Duane, Sean S. Amegadzie, Tara C. Malone, et. al.. (2018). Clinical Interpretations of Patient Experience in a Trial of Psilocybin-Assisted Psychotherapy for Alcohol Use Disorder. Front. Pharmacol.. 9;
- Kim PC Kuypers, Livia Ng, David Erritzoe, Gitte M Knudsen, Charles D Nichols, et. al.. (2019). Microdosing psychedelics: More questions than answers? An overview and suggestions for future research. J Psychopharmacol. 33, 1039-1057;
- Kim P.C. Kuypers. (2020). The therapeutic potential of microdosing psychedelics in depression. Therapeutic Advances in Psychopharmacology. 10, 204512532095056;
- Jia-Mei Li, Yi Zhang, Wen-Jun Su, Lin-Lin Liu, Hong Gong, et. al.. (2018). Cognitive behavioral therapy for treatment-resistant depression: A systematic review and meta-analysis. Psychiatry Research. 268, 243-250;
- Luc Maroteaux, Catherine Béchade, Anne Roumier. (2019). Dimers of serotonin receptors: Impact on ligand affinity and signaling. Biochimie. 161, 23-33;
- Dasiel O. Borroto-Escuela, Xiang Li, Alexander O. Tarakanov, David Savelli, Manuel Narváez, et. al.. (2017). Existence of Brain 5-HT1A–5-HT2A Isoreceptor Complexes with Antagonistic Allosteric Receptor–Receptor Interactions Regulating 5-HT1A Receptor Recognition. ACS Omega. 2, 4779-4789;
- Tiago A Mestre, Mateusz Zurowski, Susan H Fox. (2013). 5-Hydroxytryptamine 2A receptor antagonists as potential treatment for psychiatric disorders. Expert Opinion on Investigational Drugs. 22, 411-421;
- Anton S. Tsybko, Tatiana V. Ilchibaeva, Elena A. Filimonova, Dmitry V. Eremin, Nina K. Popova, Vladimir S. Naumenko. (2020). The Chronic Treatment With 5-HT2A Receptor Agonists Affects the Behavior and the BDNF System in Mice. Neurochem Res. 45, 3059-3075.






