
ДНК-наноробот: кто он такой и как поможет нам?
22 октября 2018
ДНК-наноробот: кто он такой и как поможет нам?
- 2547
- 4
- 3
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: В последнее время образовалось много новых научных направлений на стыке двух, а иногда и более фундаментальных наук. Именно такие объединенные науки внесли огромный вклад в развитие современной медицины. В этой статье описаны исследования в области нанонаук, генетики и биохимии, которые объединились и представляют большой научный кластер бионанотехнологий. Я расскажу вам о «маленьких помощниках» (то, что это ДНК-нанороботы, вы, конечно же, уже знаете из названия), сконструированных из молекул ДНК, с помощью которых многие исследователи решают такие проблемы, как адресная доставка веществ и специфическое распознавание молекул!
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вы задумывались хоть раз, как быстро развивается наука? Или как много уже разработано технологий? Или сколько человек в мире в эту секунду бьётся над решением масштабных проблем, например, лечение организма от различных заболеваний или создание искусственного интеллекта?
Но самое важное — это тенденция делать всё максимально компактным. Вспомните огромные телефоны с проводами и циферблатом — а какие они теперь? Да, теперь телефон можно поместить в руку, и нет никаких проводов, стесняющих его использование. Или же еще пример — открытие молекул, а затем атомов, а затем фотонов и кварков...
Многое мы стремимся уменьшить (процессоры, чипы, носители информации) и да, нам это удается!
И тут конечно же не обошлось без роботов. В этой статье я хочу рассказать о самых маленьких, но таких важных и перспективных нано... ДНК-нанороботах!
Применение наноконструктов поможет многим исследователям решать большие и важные проблемы. Благодаря соединению нанобиотехнологии и генетики ученые создают структуры, которые в будущем будут способны функционировать в организме, контролировать процессы в клетках и лечить наш организм.
Биомедицина и генная инженерия с приставкой «нано-»
Теперь давайте попробуем представить, насколько мало это слово «нано». Если представить размер одной пылинки, то по сравнению с наночастицами она размером с планету! Или еще пример: представьте, что ваш мизинец размером с комнату, в которой вы сидите. Теперь засыпем эту комнату рисом. Одно зернышко — одна клетка кончика вашего мизинца. Теперь увеличим одно зернышко (оно же клетка) до размера комнаты, и засыпем опять комнату рисом. Одно зернышко — это теперь размер белка. А теперь засыпем пространство между рисовыми зернышками мелким песком. Несколько частичек песка и есть размер самых малых наночастиц. Все еще сложно представить? Не переживайте, так бывает, когда речь идет о том, что нам не видно сразу...
Именно с такими размерами и связана наука будущего. Да, она проходит бóльшей частью в пробирках и электрофорезных камерах, и только в самых мощных электронных микроскопах видны плоды работы с микромиром! Но потенциала в этих маленьких частицах столько, что его увидеть можно и невооруженным глазом!
«Молекулярный конструктор»: начало
Впервые о конструировании из ДНК всерьез заговорил американский ученый Нэд Симэн (Ned Seeman) в начале 1980-х гг. Для достижения целей нужно было понять принцип того, как молекулы ДНК по собственному желанию собирать в отдельные структуры. Спустя годы Нэд Симэн представил нанометровый куб, ребра которого состояли из молекул ДНК [2]. Вот это и было началом ДНК-нанотехнологий!
Результат работы Симэна послужил основой для дальнейших открытий. Настоящие плоские фигуры, построенные из молекул ДНК, получил американец Пол Ротемунд. В 2006 году он опубликовал статью в научном издании Nature [3]. Полученные им фигуры впечатляли своей оригинальностью (рис. 1).
Далее последовала череда экспериментов по созданию 3D-структур. И несмотря на всю сложность процессов сборки объемных структур, исследователей было не остановить, ведь собрав объемную структуру можно было бы начать конструировать по-настоящему сложные модели. Такие перспективы любого исследователя мотивируют!
Первой объемной моделью стал куб с крышкой и замком, который открывался только при специфичном связывании с «ДНК-ключом». И тут уже сборка блоков и двигающихся конструкций началась полным ходом !
Подробнее о конструировании ДНК-фигур можно прочитать в статьях «ДНК-оригами: путь от гравюры до нанороботов длиной в 30 лет» [4] и «Биоинженеры научились получать ДНК-структуры, сборкой и разборкой которых можно управлять» [5].
ДНК-нанороботы — «роботы-курьеры»
Механизмы адресной доставки изучаются довольно давно. Поэтому для ученых найти точного курьера — это как желанный философский камень для алхимиков.
Кто же этот курьер? Это своеобразная капсула, которая сможет специфически распознать целевую ткань или группу клеток. Главным является то, что только при контакте с мишенью (клеткой или группой клеток) капсула высвобождает лекарственное вещество.
Почему именно ДНК-нанороботы? Для этого нужно понимать, что такое аптамер. Это собранная из небольшой цепи ДНК структура, которой можно задать форму любого рецептора. А значит, такой рецептор будет узнавать только свою мишень по принципу «ключ—замок».
Поэтому если наноробот имеет такой специфический рецептор, он становится точным курьером.
Я хотела бы рассказать о статье 2015 года с интересным курьером, которого там описывают. Команда исследователей из Колумбии (США) опубликовала свои результаты использования ДНК-нанороботов как поставщиков лекарств [6].
Исследователи сравнивали способность адресной доставки вещества и ДНК-наноробота, нагруженного этим веществом.
Препаратом был даунорубицин — противоопухолевый антибиотик, синтезируемый несколькими видами бактерий. Механизм действия заключается в блокировке синтеза нуклеиновых кислот и белков в клетке. Проникновение вещества в клетку обеспечивается диффузией через мембрану, но антибиотик не может проникнуть в устойчивые к даунорубицину опухолевые клетки в связи с изменением структуры их мембраны.
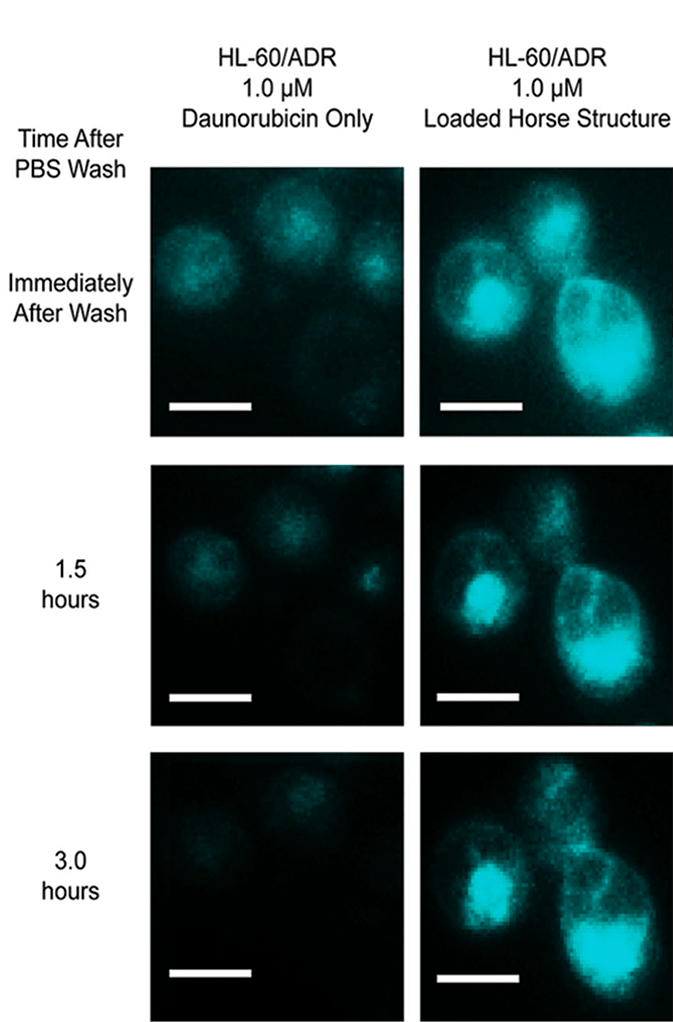
Рисунок 2. Сравнение интенсивности проникновения в клетки HL-60/ADR (устойчивые к даунорубицину) свободного даунорубицина (Daunorubicin Only) и ДНК-нанороботов, нагруженных даунорубицином (Loaded Horse Structure). Снимки получены с интервалом в 1,5 часа.
Ученые спроектировали ДНК-оригами стержневой формы размером 11 нм! Далее готовую конструкцию нагружали даунорубицином. Полученные нанороботы использовали для обхода лекарственной устойчивости к даунорубицину в линиях клеток лейкемии.
Почему же ДНК-нанороботы, нагруженные даунорубицином, проникают в клетки лучше, чем сам даунорубицин? Все дело в путях проникновения через мембрану! Даунорубицин проходит только через специальные клеточные насосы в мембране раковых клеток, но у устойчивых линий клеток лейкемии эти насосы видоизменяются и не пропускают антибиотик, а если он и проникает, то эффективно выводится обратно. ДНК-нанороботы имеют маленький размер, а также вытянутую цилиндрическую форму (размер и форма очень важны!), благодаря чему они проходят через другие мембранные каналы, связанные с процессом эндоцитоза (рис. 2).
Так как ДНК-нанороботы проникают в клетку по эндоцитарному пути, они попадают в лизосомы (органоиды, куда попадают поглощенные клеткой вещества, в том числе и нанороботы), где содержится множество кислот. Под действием этих кислот происходит высвобождение даунорубицина из наноробота. Сам же даунорубицин легко проникает в цитоплазму опухолевых клеток через те же самые насосы в мембране лизосом. Вот так и происходит обман устойчивых опухолевых клеток!
Эксперимент проводили на клеточных линиях миелоидной лейкемии (HL-60 и устойчивой к даунорубицину HL-60/ADR). Результаты опубликованы для нескольких временных промежутков: 3, 9 и 15 часов после добавления роботов в культуру. Просмотр проводили на флуоресцентном микроскопе (фиксирует свечение веществ в темноте). Для того чтобы убедиться, что адресная доставка и распаковка лекарств подействовала, лизосомы клеток окрашивали красителем зеленого цвета, а ДНК-нанороботов, нагруженных препаратом, метили красным цветом. Далее с помощью микроскопа делали серию изображений и смотрели расположение этих цветов на данных временных промежутках. Если ДНК-наноробот достигал лизосом, то такие места в клетке светились желтым цветом (результат наложения красного и зеленого цветов при анализе полученных снимков), а значит, адресная доставка прошла успешно (рис. 3).
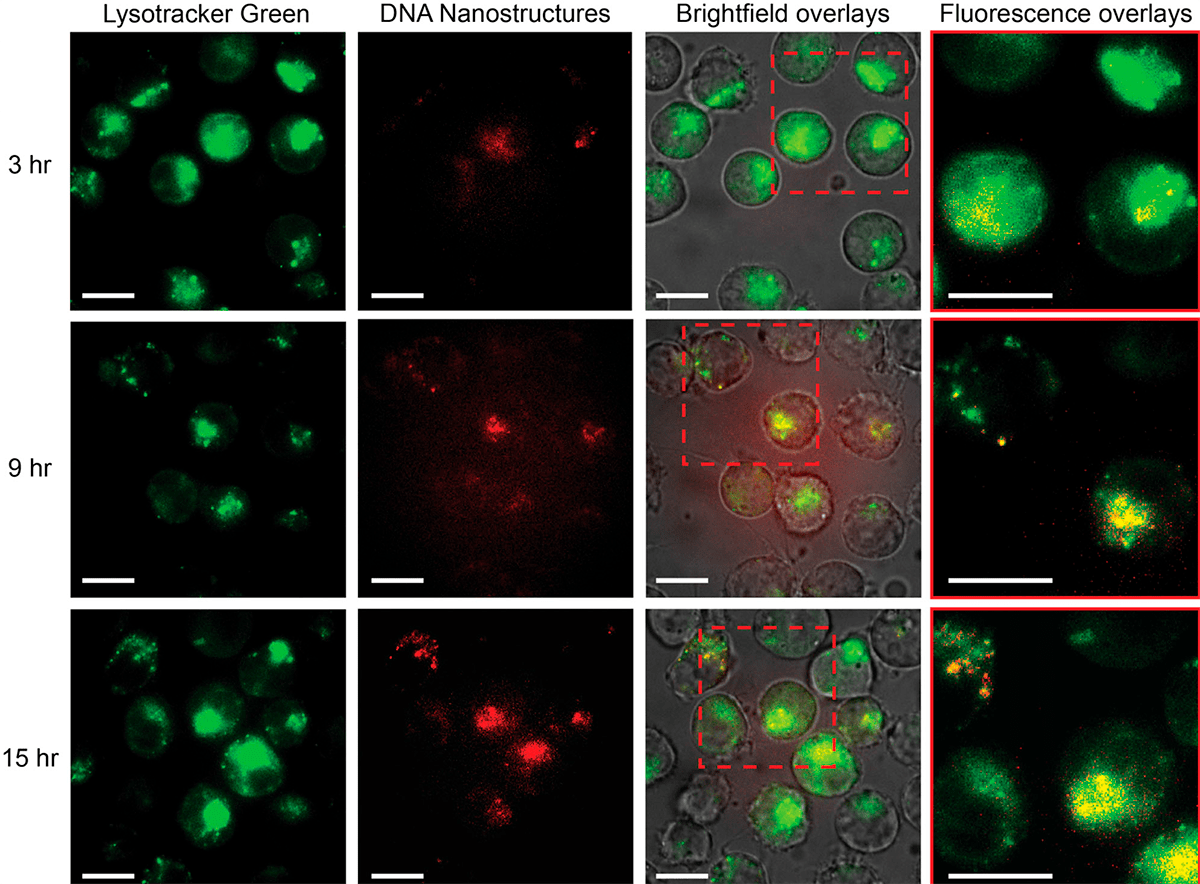
Рисунок 3. Визуализация входа ДНК-наноструктур и локализации лизосомного отсека в клетках HL-60/ADR. Первая колонка — просмотр помеченных лизосомных структур клеток (зеленый цвет). Вторая колонка — помеченные ДНК-наноструктуры, добавленные к опухолевым клеткам (красный цвет). Третья колонка — область дальнейшего просмотра. Четвертая колонка — показаны наложенные области из первой и второй колонок, указаны совпадающие участки (желтый цвет).
Как же ученые убедились, что даунорубицин вышел из лизосомы и подействовал на опухолевые клетки? Если клетки погибали при добавлении ДНК-наноробота, нагруженного препаратом, значит, распаковка даунорубицина происходила успешно. Так и вышло! При проведении эксперимента опухолевые клетки погибали.
По такому же принципу ДНК-нанороботы могут доставлять вещества не только в опухолевые клетки, но и в другие клетки нашего организма, требующие лечения.
ДНК-нанороботы vs опухолевые клетки
В марте 2018 года опубликовали свое исследование ученые из Китая. Они сконструировали ДНК-наноробота, способного распознавать раковые клетки с помощью ДНК-аптамера, комплементарного к нуклеолину (белок, который вырабатывается на поверхностях эндотелиальных раковых клеток) [7].
Складывание ДНК-оригами происходит в несколько стадий (рис. 4). Сначала создают ДНК-лист из молекул ДНК, далее на листе располагают тромбин (держится на основе химических связей). Получившийся наноробот имеет форму трубки с расположенным внутри тромбином.
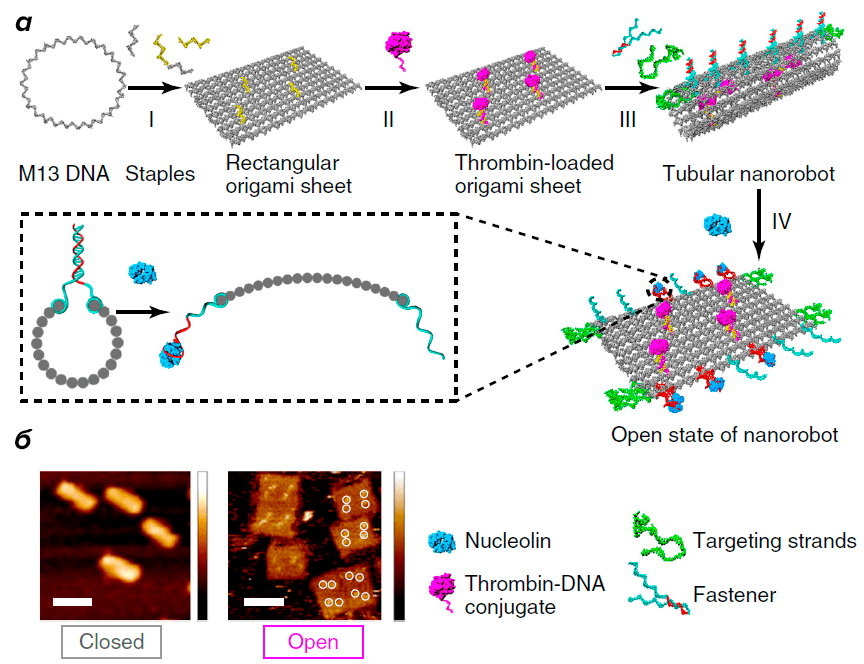
Рисунок 4. Создание и тестирование ДНК-нанороботов. а — Этапы конструирования ДНК-наноробота, функционализированного тромбином. б — Изображения закрытых (слева) и открытых состояний (справа) нанороботов.
И для чего же тромбин? Это белок свертывания крови, который регулирует агрегацию тромбоцитов посредством их активации и превращение циркулирующего в крови фибриногена в фибрин. В конечном итоге это приводит к образованию тромба в сосудах.
При взаимодействии ДНК-наноробота с нуклеолином происходит изменение конформации аптамера, и тромбин высвобождается. Тромбин индуцирует свертывание крови вблизи опухолевых клеток, тем самым перекрывая им доступ к кислороду и питательным веществам. Оставшись без «всех благ» опухолевые клетки замедляют свой рост, а также наступает некроз опухолевых клеток.
Ученые провели эксперимент на мышах, которым ввели клетки рака молочной железы человека (рис. 5). Для выявления терапевтического эффекта взяли группу мышей, которым вводили наноробота, нагруженного тромбином. Также подготовили несколько контрольных групп для введения физиологического раствора; свободного тромбина; пустого наноробота; нанотрубки, нагруженной тромбином, но не распознающей нуклеолин; нанотрубка, не способная высвобождать тромбин.
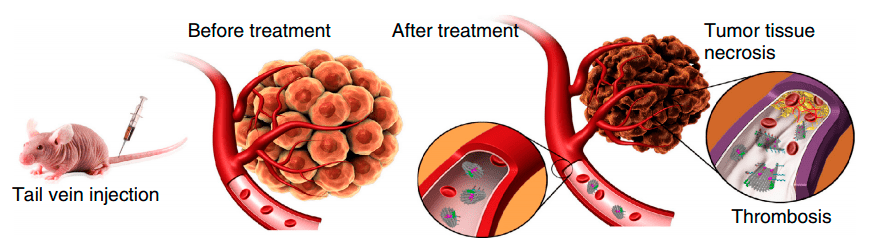
Рисунок 5. Схематическое представление терапевтического механизма работы ДНК-наноробота, нагруженного тромбином, в опухолевых сосудах. Введение мышам клеток рака молочной железы, затем введение наноробота. Далее связывание наноробота с нуклеолином и высвобождение тромбина. В итоге происходит образование тромба и некроз опухоли.
В результате раковые клетки у контрольных групп мышей формировали крупные опухоли. Среднее время выживания животных, которые составляли контрольные группы, составляло 29 дней. Напротив, опухоли росли значительно медленнее у мышей, получивших ДНК-наноробота, нагруженного тромбином, что указывало на терапевтический эффект в ингибировании роста опухоли (рис. 6). Это коррелировало со значительным увеличением выживаемости животных до 39 дней.
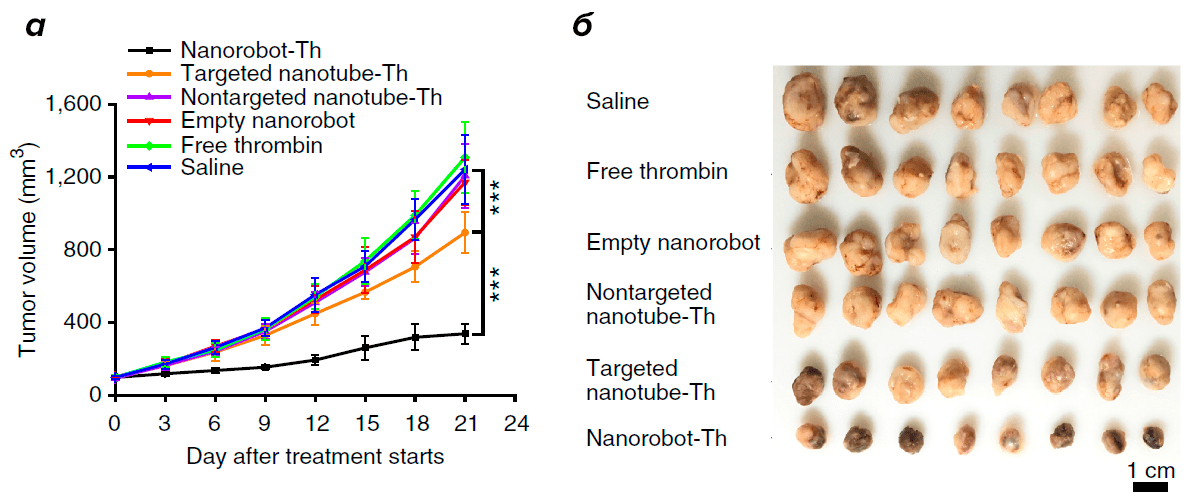
Рисунок 6. Изменение размеров опухоли при обработке ДНК-нанороботом, нагруженным тромбином (nanorobot-Th), и контролями: физиологическим раствором (saline); свободным тромбином (free thrombin); пустым нанороботом (targeted empty nanorobot); нанотрубкой, нагруженной тромбином, но не распознающей нуклеолин (nontargeted nanotube-Th); нанотрубкой, не способной высвобождать тромбин (targeted nanotube-Th). а — график изменения размера опухоли в зависимости от количества дней после начала лечения; б — репрезентативный размер опухоли при обработке различными инъекциями.
Также этой группой ученых описаны и другие эксперименты с использованием нанороботов. С результатами их интересных исследований подробнее можно ознакомиться по ссылке [7].
А что же биосенсоры?
Биосенсоры... слово красивое, но не всем оно понятно. Сенсор — чувствительный элемент, распознающий определенную мишень. Биосенсор — это сенсор, сконструированный сочетанием органических и неорганических материалов.
В статье, опубликованной в январе 2018 года журналом Biosensors and Bioelectronics, ученые описали модель биосенсора, сочетающего в себе ДНК-оригами и оптоволокна [8].
Сконструировали ДНК-наноробота в виде эллипса, где с внешней стороны располагалась дополнительная последовательность — «ручка», которая распознавала целевой зонд (то есть последовательность ДНК, комплементарная зонду). Эту конструкцию закрепляли на оптоволокне двумя последовательностями захвата (тоже из ДНК). Если происходило распознавание целевого зонда «ручкой» ДНК-наноробота, открывался лоскут его оболочки и высвобождал определенный фермент, находящийся внутри конструкции (рис. 7).
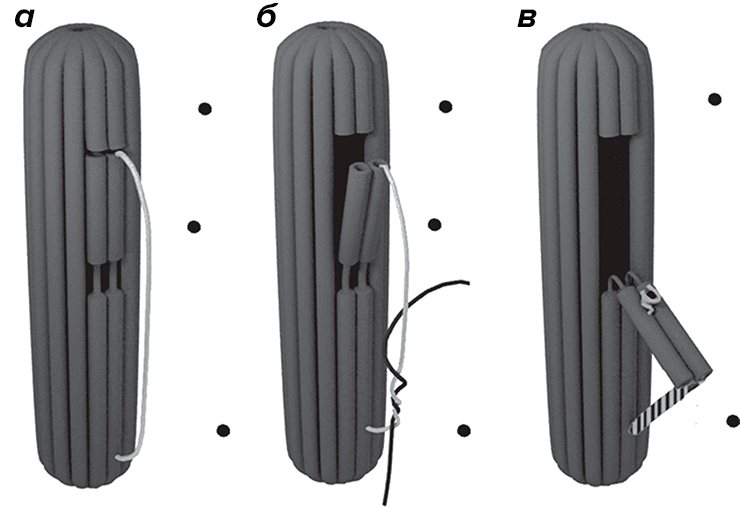
Рисунок 7. Механизм работы ДНК-наноробота. а — Исходное положение наноробота. б — Связывание целевого зонда в «ручкой» наноробота. в — Изменение структуры «ручки» и открытие капсулы.
Реакция на биосенсорах проходит в растворе, содержащем активаторы фермента. Как только ДНК-наноробот высвобождает фермент, тот активируется молекулами в растворе, и в результате реакции получаются хемилюминесцентные сигналы (химическое свечение). Такие сигналы достигают устройства, способного их считывать и усиливать, а далее поступают в компьютер (рис. 8).
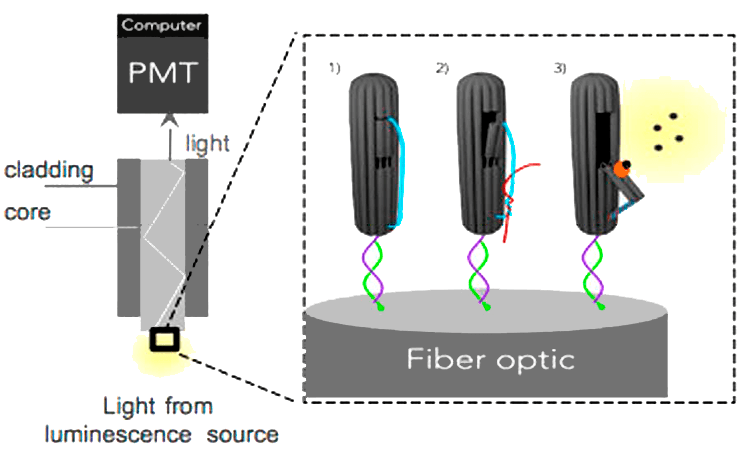
Рисунок 8. Схема биосенсора. Оптоволокно — ядро сенсора. Трехмерный ДНК-наноробот, закрепленный двумя последовательностями захвата (зеленой и фиолетовой). Распознающая последовательность — «ручка» (голубая). Целевой зонд — красный. Фермент, высвобожденный из ДНК-наноробота (оранжевый), и его активаторы (черные). Слева — система сенсорного модуля, фотоумножителя и компьютера.
Таким образом можно с высокой точностью определять содержание исследуемых веществ в различных растворах. В перспективе станет возможным детектировать группы клеток или микроорганизмов, прикрепляя к готовой системе биосенсора (ДНК-наноробота и оптоволокна) только нужную «ручку».
Вместо заключения
Какой станет медицина будущего? Как использование ДНК-нанороботов изменит нас и наше отношение к жизни? Это, конечно же, еще долго не будет ясно. В своей статье я рассмотрела лишь несколько успешных экспериментов. Но есть и провалы, и тупики на многих этапах применения ДНК-нанотехнологий. Еще больше вопросов возникает у самих разработчиков наноструктур.
Все нынешние достижения — это большая гордость для человечества, но, как и все новые открытия — также и большой риск. Ведь множество вопросов еще не решено и вряд ли решится в ближайшие 10 лет.
Я же надеюсь, что такие перспективные технологии дадут человечеству большой толчок в улучшении качества жизни. И да, я думаю, что за исследованиями нанотехнологий и стоит наше будущее!
Литература
- Feynman R.P. (1960). There’s plenty of room at the bottom. Caltech Engineering and Science. 23, 22–36;
- Junghuei Chen, Nadrian C. Seeman. (1991). The electrophoretic properties of a DNA cube and its substructure catenanes. Electrophoresis. 12, 607-611;
- Paul W. K. Rothemund. (2006). Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302;
- ДНК-оригами: путь от гравюры до нанороботов длиной в 30 лет;
- Биоинженеры научились получать ДНК-структуры, сборкой и разборкой которых можно управлять;
- Patrick D. Halley, Christopher R. Lucas, Emily M. McWilliams, Matthew J. Webber, Randy A. Patton, et. al.. (2016). Daunorubicin-Loaded DNA Origami Nanostructures Circumvent Drug-Resistance Mechanisms in a Leukemia Model. Small. 12, 308-320;
- Suping Li, Qiao Jiang, Shaoli Liu, Yinlong Zhang, Yanhua Tian, et. al.. (2018). A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nat Biotechnol;
- Emanuela Torelli, Marisa Manzano, Sachin K. Srivastava, Robert S. Marks. (2018). DNA origami nanorobot fiber optic genosensor to TMV. Biosensors and Bioelectronics. 99, 209-215;
- Emanuela Torelli, Monica Marini, Sabrina Palmano, Luca Piantanida, Cesare Polano, et. al.. (2014). A DNA Origami Nanorobot Controlled by Nucleic Acid Hybridization. Small. 10, 2918-2926.







